5 Ионные реакции осаждения, нейтрализации, гидролиза
| Вид материала | Документы |
- Рекомендации к зачёту, 133.1kb.
- Написать краткие ионные и молекулярные уравнения реакций гидролиза карбоната натрия,, 4.27kb.
- Методический пакет учебного курса, 331.54kb.
- Молекулярно-динамическое моделирование осаждения металлического нанокластера на подложку, 66.11kb.
- Наносимые электрохимическими методами на поверхность детали в результате осаждения, 96.3kb.
- Для подготовки к экзамену по общей химии (2 семестр) Кинетика, 73.49kb.
- Программа коллоквиумов по курсу физической химии, 99.84kb.
- Оглавление, 334.79kb.
- Календарный план занятий по физической химии в весеннем семестре 2008/2009 уч года, 32.67kb.
- Отчет 86 с., 34 рис., 15 табл., 53 источника, 2 приложения. Ключевые слова : структура, 56.56kb.
Зависимость скорости реакции от концентрации реагирующих веществ
Из кристаллогидрата Na2S2O3. 5Н2О и дистиллированной воды приготовьте свежий 1М раствор тиосульфата натрия. На шести стаканах сделайте метки, соответствующие 75 мл. На трех стаканах поставьте номера 1,2,3, на трех других – номера I, II, III. С помощью мерного цилиндра точно отмерьте раствор тиосульфата натрия: в стакан 1 – 10 мл, 2 – 20 мл, 3 – 40 мл, долейте дистиллированной воды до метки. Отмерьте 10, 20 и 40 мл 1М раствора серной кислоты в стаканы I, II, III и долейте до метки в 75 мл дистиллированной воды. Молярные концентрации растворов в стаканах запишите в таблицу.
Быстро слейте растворы (1 и I) в один стакан, перемешайте содержимое стакана стеклянной палочкой и по секундомеру зафиксируйте время появления помутнения. То же самое проделайте с растворами 2 и II, 3 и III. Чтобы легче заметить появление помутнения растворов, за стаканами поставьте черный экран. Температура всех растворов должна быть одинакова. Время появления помутнения заносят в таблицу.
| № | с (Na2S2O3), моль/л | № | с (Н2SO4), моль/л | t, с | 1/t,c-1 |
| 1 | 0,1(3) | I | 0,1(3) | | |
| 2 | 0,2(6) | II | 0,2(6) | | |
| 3 | 0,5(3) | III | 0,5(3) | | |
При сливании растворов происходят реакции:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3 (1)
H2S2O3 = S + H2O + SO2 (2)
Известно, что реакция (1) протекает практически мгновенно. Реакция (2) – медленная. В опыте фактически изучается скорость медленной реакции (2).
Скорость реакции падает с разбавлением раствора тиосульфата натрия. Она обратно пропорциональна времени появления помутнения (V ~ 1/t). Самое низкое значение скорости (1/t) принимают равным единице и вычисляют относительные скорости реакции при разных концентрациях тиосульфата натрия. Строят график зависимости скорости реакции (1/t) от концентрации Na2S2O3 и определяют порядок реакции.
**Химическое равновесие
Для обратимой химической реакции
А + В ⇄ С + D
где СА, СВ, СС и СD равновесные концентрации участников реакции, константа химического равновесия К вычисляется по уравнению:
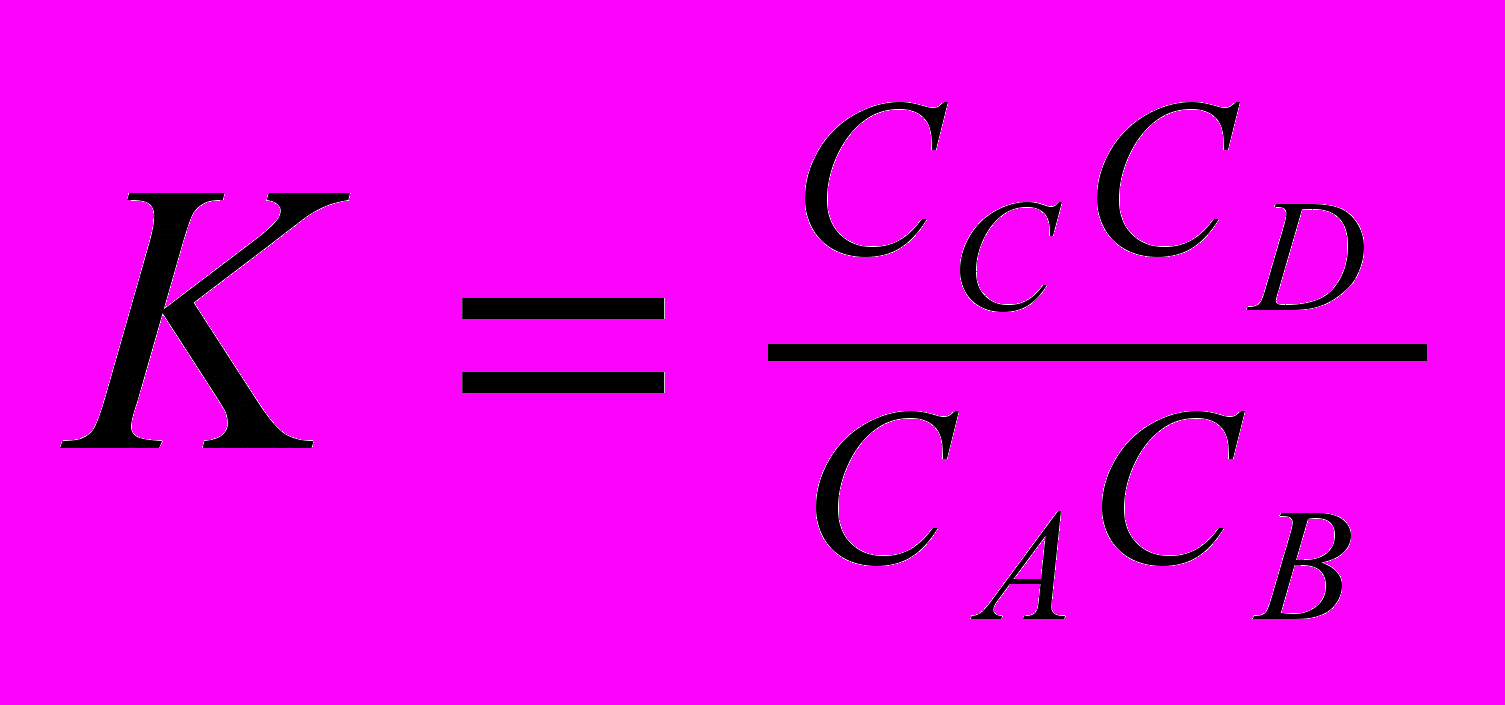
Для гомогенной обратимой химической реакции, идущей в газовой фазе или растворе, в выражении константы химического равновесия записываются концентрации всех участников процесса. Например:
Н2(г) + I2(г) ⇄ 2НI(г)
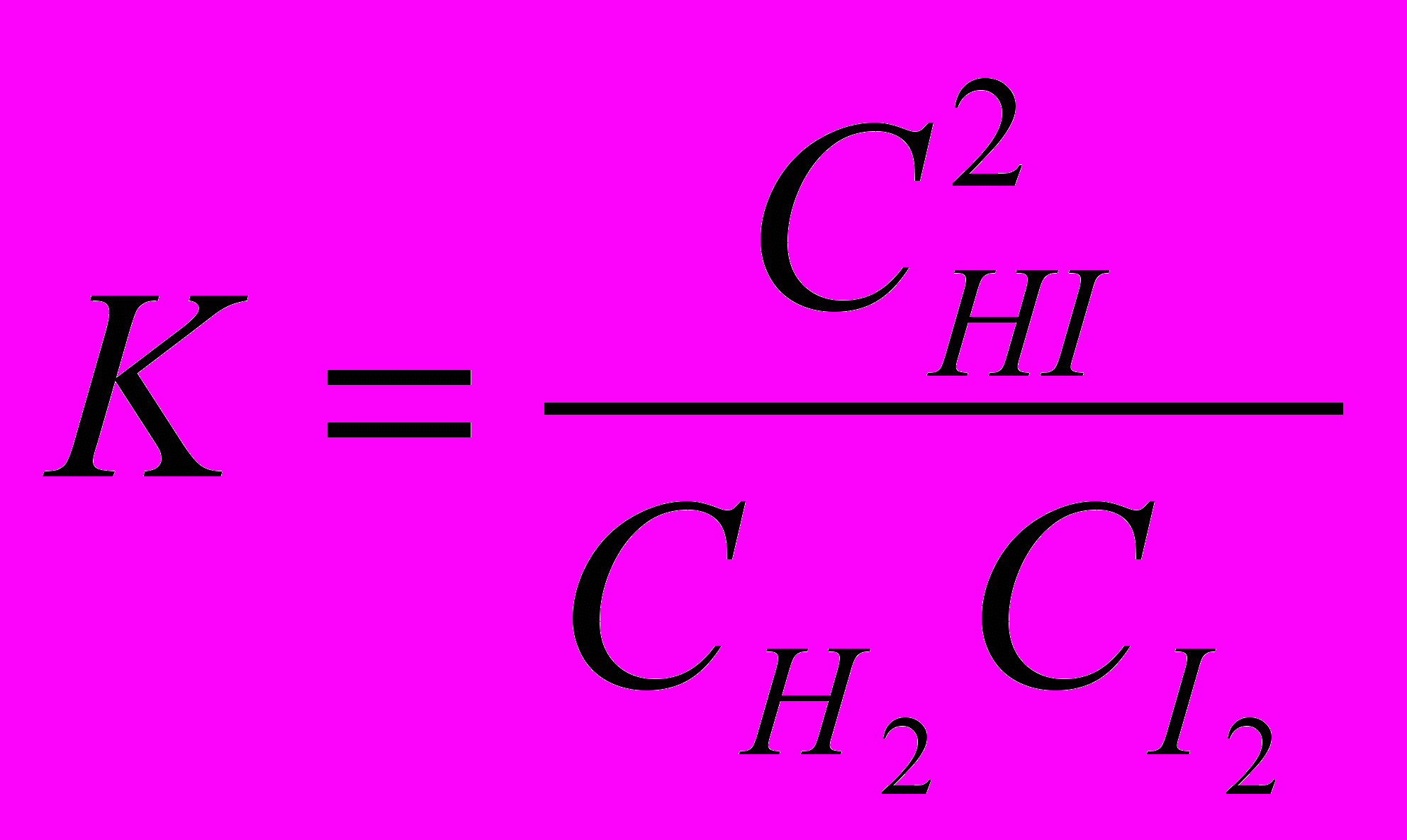
Для гетерогенной химической реакции в выражении константы равновесия записываются концентрации участников реакции в жидкой или газовой фазе. Например:
СаСО3(т) ⇄ СаО(т) + СО2(г),
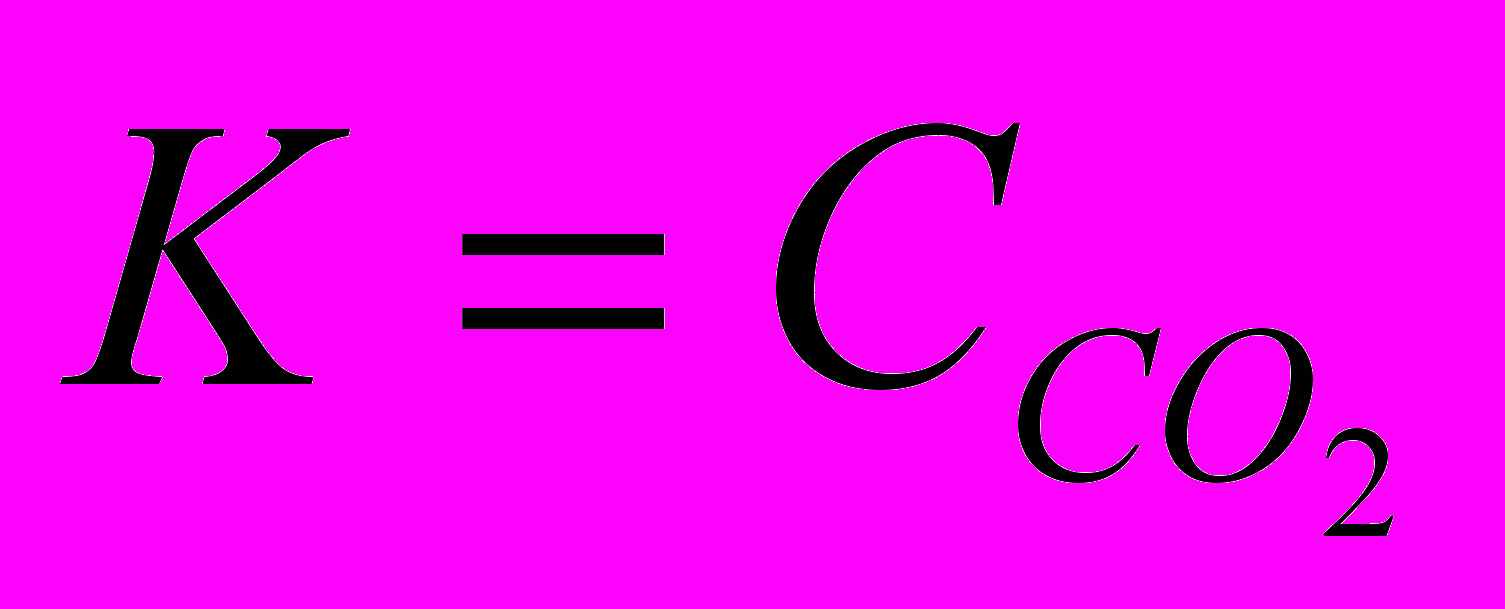
СО2(г) + С(т) ⇄ 2СО(г),
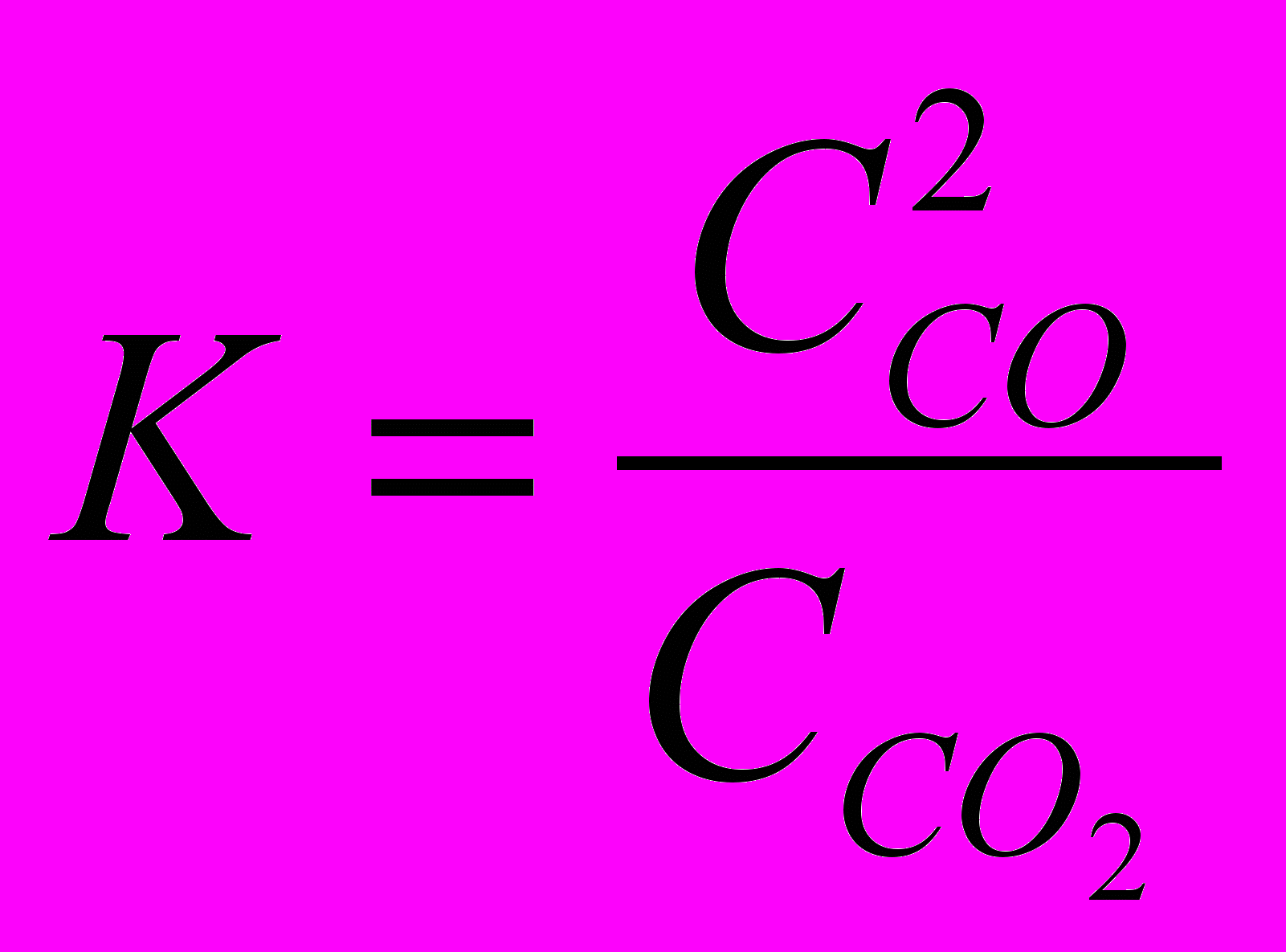
Практическая работа
Химическое равновесие
Опыт 1. В пробирку налейте 2 мл концентрированного раствора хлорида меди (II). В концентрированном растворе образуются комплексные анионы [CuCl4]2–, придающие ему зеленый цвет:
CuCl2 + 2Cl– = [CuCl4]2–
По каплям добавляйте в пробирку воду до появления голубой окраски, обусловленной образованием ионов тетрааквамеди (II):
[CuCl4]2– + 4Н2О ⇄ [Cu(Н2О)4]2+ + 4Cl–
Задание. Добавлением какого реактива можно сместить равновесие данной реакции влево? Как изменится при этом цвет раствора? Напишите выражение для константы равновесия реакции.
Опыт 2. В пробирку налейте 2 мл концентрированного раствора CoCl2 розового цвета, добавьте несколько капель концентрированной соляной кислоты до появления синей окраски:
[Co((Н2О)6]Cl2 + HCl ⇄ H[CoCl3] + 6H2O
Задание. Как сместить равновесие данной реакции влево? Как изменится при этом цвет раствора? Напишите выражение для константы равновесия реакции.
Опыт 3. В пробирку налейте 1 мл раствора I2 в KI, добавьте 1-2 капли крахмала – раствор окрашивается в синий цвет. Добавлением нескольких капель щелочи добейтесь обесцвечивания раствора:
3I2 + 6KOH ⇄ 5KI + KIO3 + 3H2O
Задание. К бесцветному раствору, помешивая его, прилейте несколько капель раствора HCl(1:2). Раствор опять приобретает синюю окраску. Напишите уравнение реакции в ионном виде и объясните, почему смещается равновесие. Напишите выражение для константы равновесия реакции.
Вопросы для проверки знаний
- Что изучает химическая кинетика?
- Какие процессы подразумевают под механизмом химической реакции?
- Что подразумевают под скоростью химической реакции?
- Как формулируется основной закон химической кинетики?
- Какие элементарные реакции называются моно-, би- и тримолекулярными?
- Можно ли по химическому уравнению элементарной реакции определить молекулярность и порядок реакции?
- Какие факторы влияют на скорость химической реакции?
- Какую роль играет катализатор в химической реакции?
- Чем отличаются гомогенные от гетерогенных реакций?
*Упражнения
1. Скорость химической реакции описывается уравнением V k CА CВ. Во сколько раз увеличится скорость реакции, если начальную концентрацию вещества А увеличить в 2 раза, а вещества В в 4 раза?
2. В элементарной мономолекулярной реакции А В 1 грамм А превратился на 50% в В за 10 минут. Сколько времени потребуется, чтобы 1 тонна вещества А превратилась на 50% в продукт В?
*Задачи
- Вычислите константу равновесия гомогенной реакции: СО+Н2О⇄СО2+Н2, если равновесные концентрации оксида углерода (II) равна 0,004 моль/л, воды 0,064 моль/л, оксида углерода (IV) 0,016 моль/л, водорода 0,016моль/л.
- В обратимой реакции А + В ⇄ С + D исходные неравновесные концентрации веществ А, В, С, D равны 1 моль/л. После установления равновесия в смеси обнаружено 1,5 моль вещества С. Вычислите константу равновесия реакции.
- Рассчитайте равновесные концентрации веществ в реакции СО+Н2О⇄СО2+Н2, если исходные неравновесные концентрации оксида углерода (II) 0,1моль/л; воды 0,4моль/л. Константа равновесия К = 1.
- Как следует изменить давление в системе СО2 + С ⇄ 2СО, чтобы повысить выход СО?
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
Тема 7. Естественная и искусственная среда обитания человека
7.1. Среда обитания человека
Естественная среда включает неорганические и органические вещества, кругооборот которых осуществляется по законам природы. Она включает то, что рождается, растет, размножается и может существовать без человека, независимо от человека.
Искусственная среда создана человеком и существует только благодаря естественной среде, из которой она черпает вещества и энергию для поддержания своего существования. Только благодаря усилиям человека искусственная среда (города, сельскохозяйственные районы, дороги, дамбы, плотины, гидроэлектростанции, атомные и тепловые электростанции, парки и другие сооружения) поддерживается в устойчивом состоянии.
Четыреста лет тому назад города и сельскохозяйственные районы практически не оказывали серьезного отрицательного воздействия на окружающую среду. Естественная среда выдерживала антропогенную (человеческую) нагрузку и «перерабатывала» отходы деятельности человека, сохраняя себя в первозданном виде.
В конце восемнадцатого века была запатентована паровая машина (1796 г.), преобразовывавшая тепло в механическую работу. Рост производительности труда в результате использования машинной техники обещал изобилие продуктов и высокий жизненный уровень. В девятнадцатом веке электромагнитная теория как основа современной техники породила уверенность в неограниченных возможностях человека, способного повышать свой жизненный уровень. Двадцатый век принес еще большие успехи в области фундаментальных наук и технических решений. Теория относительности и квантовая механика дали возможность понять законы микромира и открыть невиданный ранее источник энергии – энергию деления и синтеза атомных ядер. С развитием науки и техники, с ростом производительности труда в промышленный оборот вводилось громадное количество природных ресурсов и, соответственно, в окружающую среду выбрасывалось громадное количество отходов производства. Естественная среда уже не могла «перерабатывать» возросшее количество отходов человеческой деятельности. Достаточно сказать, что в 1700 году на всей планете насчитывалось примерно шестьсот миллионов человек. В настоящее время население планеты возросло более чем в 10 раз! Нарастающие противоречия между естественной и искусственной средой достигли опасных масштабов. Искусственная среда в больших масштабах вытесняет и уничтожает естественную среду, хотя нуждается в ней, без неё не может существовать. Все это напоминает действия человека, который рубит сук, на котором сидит.
Что такое качество жизни? Можно назвать многие показатели качества жизни человека. Одни показатели выражают степень социальной защищенности, другие связаны с политическим устройством общества, третьи определяются состоянием окружающей среды.
С позиций химических превращений вещества качество жизни человека определяется состоянием биосферы – части оболочки Земли (верхняя часть земной коры, вся гидросфера, нижняя часть атмосферы), занятой растительными и животными организмами.
Химические процессы в земной коре с участием живых организмов изучает биогеохимия. Биогеохимические процессы привели к созданию среды, переработанной живыми организмами и солнечным излучением до состояния, которое отвечает современной биосфере.
Процессы физико-химического преобразования биосферы идут непрерывно с момента возникновения жизни на Земле, и все большую роль в них играет человеческая деятельность. Антропогенное воздействие на биосферу приобрело масштабы, соизмеримые с масштабами природных явлений. Качество жизни человека зависит от качества воды, которую мы пьем, качества воздуха, которым мы дышим, качества животных и растительных продуктов, которыми мы питаемся.
В условиях высокой концентрации населения в городах возрастает количество транспорта, сжигающего бензин и дизельное топливо, увеличивается потребление электроэнергии, продуктов питания, воды. В городе создается микроклимат, отличающийся загазованностью, соседствующими с городом свалками мусора, плохой питьевой водой. Например, третий по численности населения в России г. Нижний Новгород забирает ежедневно из Волги и Оки около одного миллиона кубических метров пресной воды для бытовых и промышленных нужд и сбрасывает ежедневно вниз по течению в Волгу такой же объем промышленных и бытовых стоков по канализационным трубам. Разумеется, городские стоки очищают, прежде чем сливать их в реку, но они недостаточно чистые, чтобы их можно было снова использовать в качестве питьевой воды. Поэтому городские стоки разбавляются речной водой и проходят естественную очистку при участии микроорганизмов донного ила и кислорода, растворенного в воде. Ниже по течению примерно в 30 километрах находится город Кстово. Процесс водозабора речной воды и сброса городских стоков повторяется. Так происходит на всем протяжении великой реки. Фактически речная вода теряет свои природные качества и примерно на 40% состоит из сточных вод.
7.2. Загрязнители
Загрязнители – это вещества, которые оказались не в то время, не в том месте и, не в том количестве, которое предполагает естественная среда обитания. Практически любое вещество может оказаться загрязнителем, оказавшись в неподходящем месте. Например, в люминесцентной лампе металлическая ртуть Hg содержится в количестве примерно 0,2 г. Она обеспечивает экономную работу осветительных приборов при высоком качестве освещения помещений и улиц. Однако разбитая лампа становится источником опасных для здоровья людей паров ртути. Капля ртути становится загрязнителем, если оказалась в помещении, и может привести к медленному отравлению организма человека.
Минеральные удобрения такие, как фосфат кальция Ca3(PO4)2, уместны на сельскохозяйственных плантациях для сохранения плодородия почвы и поддержания высокой урожайности полей. Вымытые из почвы и попавшие в водоемы удобрения становятся загрязнителями, опасными для живых организмов, обитающих в водоемах, и ухудшающих качество воды.
Существуют нормы содержания в воде, почве и воздухе химических соединений, превышение которых считается опасным для здоровья. Предельно допустимая концентрация – это максимальная концентрация загрязнителя, считающаяся безопасной для здоровья человека. Сокращенно такая концентрация обозначается ПДК и выражаются в миллиграммах загрязнителя на килограмм почвы [мг/кг], на литр воды [мг/л] или на кубический метр воздуха [мг/м3] (табл. 12).
Т а б л и ц а 12
Предельно допустимые концентрации (ПДК) некоторых веществ
в воздухе
| Газ | Среднесуточная ПДК, мг/м3 | Газ | Среднесуточная ПДК, мг/м3 |
| СО Сl2 HCN HCl NH3 NO2 | 3 0,03 0,01 0,2 0,04 0,04 | O3 SO2 Ацетон Пыль Hg Фенол | 0,03 0,05 0,35 0,15 0.0003 0,003 |
Человеческий организм, как и любой другой живой организм, представляет собой открытую, неизолированную от окружающей среды систему. Обмен веществом и энергией с окружающей средой (питание, дыхание) – непременное условие устойчивого существования организма. Зависимость человека от качества окружающей среды очевидна.
«Строительным материалом» живых организмов, включая человека, являются шесть элементов: C, H, O, N, P, S. Они называются макроэлементами, потому что содержаться в организме в количествах от сотен граммов, до десятков килограммов в составе молекул различного строения и состава. К макроэлементам относится еще одна группа химических элементов (Ca, Fe, Mg, K. Na, Cl), входящих в состав скелета и биожидкостей.
Важную группу составляют микроэлементы (Cu, F, I, Mo, Zn и др.), обеспечивающие нормальное функционирование организма в составе ферментов, витаминов, гормонов. Именно ферменты, витамины, гормоны обеспечивают обмен веществ. Поэтому важно понять роль каждого элемента в составе организма.
На рис. 68 показано распределение некоторых химических элементов в тканях человека.
Мозг: Na, Mg, K
Гипофиз: Zn, Br, Mn, Cr
Волосы: Al, As, V
Эмаль зубов: Ca, Mg, F

Глазная жидкость: Na
Сетчатка глаза: Ba
Щитовидная железа: I, Zn, Br
Сердце: Сa, K
Легкие: Li, Na
Поджелудочная железа: Mg
Почки: Li, Se, Ca, Na,
Mg, K, Mo, Cd, Hg
Белки, нуклеиновые кислоты и другие биологически активные соединения: С, H, O, N, S, P
Скелетная мускулатура: Li, Mg, K
Мышцы: Li, Mg, K
Костная ткань: Na, Ca, Mg, K, P
Кровь: Fe, Na, Li, Cs, K
Печень: Li, Se, Mo,
Zn, Ca, Mg, K, Cu
Половые железы: Zn, Br
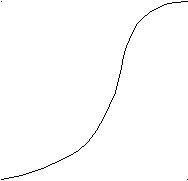
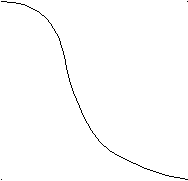
Рис. 68. Распределение некоторых химических элементов в тканях человека
Химические элементы должны находиться в организме в нужном месте и в том количестве, которое обеспечивает его устойчивость и нормальное функционирование. Превышение микроэлементов оказывает токсическое действие, недостаток – нарушение нормального обмена веществ.
Так происходит с любыми живыми организмами (рис. 69). Растение не только гибнет при избытке или недостатке того или иного химического элемента. Даже при благоприятном для растения содержании микроэлементов это количество может оказаться опасным для человека, употребляющего его в пищу. Иллюстрацией может служить драматический случай массового отравления ртутью жителей местечка Минамата (префектура Каямамота, Япония). Веществом, вызывающим неизлечимое нарушение деятельности нервной системы, оказалась метилртуть CH3Hg+, которая попадала в море со сточными водами химического завода. По пищевой цепи водоросли – рыба – человек метилртуть вернулась к человеку.




Скорость роста растения

Оптимум
Стрессовая зона
Стрессовая зона
Предел
устойчивости (гибель)
Предел
устойчивости (гибель)

Концентрация микроэлемента
Рис. 69. Зависимость скорости роста растения от концентрации микроэлементов
Человек в стремлении развивать искусственную среду обитания попал в замкнутый круг. Для удовлетворения потребностей и повышения качества жизни возрастающего по численности населения планеты требуется расширенное производство товаров потребления. Расширенное производство предполагает вовлечение в этот процесс возрастающего количества возобновляемых и невозобновляемых природных ресурсов. Переработка природных ресурсов сопровождается отходами производства, выбрасываемыми в атмосферу, гидросферу и на поверхность земли. То, что произведено в виде пищевых продуктов и товаров, постепенно расходуется и тоже превращается в отходы, которые загрязняют планету. Скапливаются старые покрышки от автомобилей и сами автомобили превращаются со временем в ржавое железо и становятся отходами жизнедеятельности людей. Рассеиваются на громадной территории выбросы электростанций, работающих на газе, мазуте и каменном угле. Происходят изменения микроклимата территорий, заселенных людьми.
Человек не может вернуться к состоянию, которое было на планете несколько сот лет тому назад. Есть только движение вперед. Следовательно, он должен искать пути выхода из замкнутого круга. Но как это сделать? Ответа пока нет.
7.3. Промышленные способы получения вещества
Для поддержания жизнедеятельности людей нужны разнообразные вещества. Химическая промышленность дает необходимые материалы, совершенствуя технологии производства.
Получение и применение водорода
Водород необходим для синтеза аммиака, получения бензина, дизельного топлива, керосина, смазочных масел из тяжелых и густых остатков нефтепереработки, для получения метанола, как ракетное топливо и исходный реагент топливных элементов. Примерно 25% производимого в мире водорода расходуется на производство аммиака. Более 35% водорода расходуется на гидрокрекинг. Остальное количество водорода применяется для гидрогенизации жиров, получения метанола, производства некоторых металлов, в производстве изделий из стекла.
Основным методом промышленного производства водорода является каталитическая конверсия природного газа с водяным паром. На первой стадии осуществляют реакцию при 750–8700С в присутствии катализаторов Ni и Al2O3:
СН4 + Н2О ® СО + 3Н2
На второй стадии полученную газовую смесь подергают более глубокому каталитическому превращению:
СО + 3Н2 + Н2О ® СО2 + 4Н2
Смесь (СО2 и Н2) называется синтез-газом.
Получение метанола Из синтез-газа получают метанол при температуре 200–300 0С и давлении 25–40 МПа на катализаторе, содержащем Cu, Zn, Al, Cr :
СО2 + 3Н2 ⇄ СН3ОН + Н2О
Гидрокрекинг. Водород широко используется в гидрокрекинге. Цель гидрокрекинга состоит в получении из высококипящих нефтяных фракций, имеющих температуру кипения при пониженном давлении 300–5400С более летучих углеводородов: фракций бензина, керосина, дизельного топлива, смазочных масел и газообразных углеводородов. Сущность гидрокрекинга состоит в том, чтобы при высокой температуре в отсутствии кислорода воздуха разрушить (крекинг) высокомолекулярные соединения и превратить непредельные и ароматические углеводороды в алканы и циклоалканы (гидрирование). Таким образом, основными реакциями гидрокрекинга являются гидрогенолиз и гидрирование углеводородов.
В реакции гидрогенолиза освобождаются от кислород-, азот- и серусодержащих органических примесей. Например, разрушают молекулярную структуру эфира в результате реакции:
С6Н5СН2ОR + Н2 ® С6Н5СН3 + ROH
В реакции гидрирования алкенов и ароматических соединений
R2C=CR2 + H2 ® R2 HC-CHR2
С6Н5R + nH2 ® C6H11R
получают алканы и циклоалканы. Эти реакции позволяют получить смесь углеводородов, хорошо горящую в двигателях различного типа. Так после гидрокрекинга нефтяных остатков получают фракцию смеси различных углеводородов, выкипающую в пределах 30–205 0С. Это бензин. Качество бензина оценивается октановым числом. Октановое число – это единица измерения антидетонационных свойств моторного топлива. Чем выше октановое число, тем выше его стойкость к детонации, т.е. эффективнее сгорает топливо и не так интенсивно изнашивается двигатель. При низком октановом числе детонация – горение со взрывом – интенсивно изнашивает двигатель. Для измерения октанового числа используют смесь изооктана С8Н18 (для 100%-ного изооктана октановое число равно 100) и н-гептана С6Н14 (для 100%-ного н-гептана октановое число равно 0). Например, бензин имеет октановое число 92, это значит, что смесь углеводородов горит так, как горит смесь 92% изооктана и 8% н-гептана.
Фракции смеси различных углеводородов, выкипающие в пределах 180–360 0С (для быстроходных двигателей) и 250–420 0С (для тихоходных двигателей) представляют собой дизельное топливо. Качество дизельного топлива оценивается цетановым числом. Цетановое число характеризует «период задержки воспламенения» - промежуток времени от впрыска в цилиндр двигателя топлива до начала его горения. Чем короче этот период, тем дизельное топливо горит более спокойно и плавно. Для измерения цетанового числа используют смесь цетана СН3(СН2)14СН3 (для 100%-ного цетана это число равно 100) и a-метилнафталина (для 100%-ного a-метилнафталина это число равно 0). Например, если дизельное топливо имеет цетановое число 45, это значит, что смесь углеводородов горит так, как горит смесь 45% цетана и 55% a-метилнафталина.
Получение аммиака. Производство аммиака - важнейший потребитель водорода:
N2 + 3H2 ⇄ 2NH3
Сдвигу равновесия вправо способствует повышение давления и понижение температуры реакции. Обычно реакцию проводят при давлении примерно 30 мПа и температуре около 5000С. В этих условиях равновесная газовая смесь содержит ~ 30% аммиака. В качестве катализатора используется Fe, активированное оксидами кальция, алюминия и калия.
Получение кислот
Получение соляной кислоты. Соляную кислоту получают из газов, образующихся при хлорировании метана и других углеводородов:
СН4 + Cl2 ® CH3Cl + HCl
CH3Cl + Cl2 ®CH2Cl2 + HCl и т. д.
Образующийся в результате хлорирования хлороводород вводят в нижнюю часть колонны (абсорбер), а воду противотоком в верхнюю часть колонны. Остатки малорастворимых в воде органических соединений отделяют от раствора и получают товарную соляную кислоту.
Получение серной кислоты.
Основным потребителем серной кислоты являются заводы по производству минеральных удобрений. Поэтому их стараются строить ближе друг к другу. Значительным потребителем серной кислоты является производство свинцовых аккумуляторов, красителей, взрывчатых веществ, текстиля и кожи.
В органическом синтезе серная кислота используется в реакциях дегидратации, например, при получении серного эфира, сложных эфиров, а также в реакциях гидратации, например, синтезе этилового спирта из этилена. Большинство синтетических моющих средств используют добавки продуктов сульфирования, получаемых в реакции органических соединений с серной кислотой.
Основным исходным сырьем для получения серной кислоты служат сера S, сульфид железа FeS2, сероводород H2S, а также отходящие газы теплоэлектростанций.
На первой стадии получения серной кислоты осуществляют превращение исходного сырья в SO2:
S + O2 = SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2H2S + 3O2 = 2SO2 + 2H2O
На второй стадии окисляют SO2 до SO3 в присутствии ванадиевого катализатора:
2SO2 + О2 = 2SO3
На завершающем этапе получают серную кислоту:
SO3 + Н2О = H2SO4
