5 Ионные реакции осаждения, нейтрализации, гидролиза
| Вид материала | Документы |
- Рекомендации к зачёту, 133.1kb.
- Написать краткие ионные и молекулярные уравнения реакций гидролиза карбоната натрия,, 4.27kb.
- Методический пакет учебного курса, 331.54kb.
- Молекулярно-динамическое моделирование осаждения металлического нанокластера на подложку, 66.11kb.
- Наносимые электрохимическими методами на поверхность детали в результате осаждения, 96.3kb.
- Для подготовки к экзамену по общей химии (2 семестр) Кинетика, 73.49kb.
- Программа коллоквиумов по курсу физической химии, 99.84kb.
- Оглавление, 334.79kb.
- Календарный план занятий по физической химии в весеннем семестре 2008/2009 уч года, 32.67kb.
- Отчет 86 с., 34 рис., 15 табл., 53 источника, 2 приложения. Ключевые слова : структура, 56.56kb.
**Применение второго закона термодинамики к химическим процессам. Почему происходят химические реакции?
Подавляющее большинство химических реакций проводят в системах (реакционных сосудах, промышленных реакторах), которые обмениваются энергией с окружающей средой. Воспользуемся методом расчета, который позволяет найти параметр, определяющий направление самопроизвольного процесса в таких системах.
Изменение энтропии системы, состоящей из окружающей среды и реактора, в котором происходит химическая реакция, выражается уравнением:
S(окр. среда + реак) = Sокр. среда + Sреак = Qокр. среда/Т1 + Sреак
В соответствии с законом сохранения энергии количество теплоты, поступившее из окружающей среды в реактор, где происходит химическая реакция, равно количеству теплоты, полученной химической реакцией:
Qокр. среда =Qреак
Если химический процесс проводят при постоянной температуре, равной температуре окружающей среды, то температуру можно обозначить как Т.
Химический реактор вместе с окружающей средой, с которой реактор обменивается теплотой, можно рассматривать как единую систему. В соответствии со вторым законом термодинамики для системы, состоящей из реактора и окружающей среды, справедливо неравенство, отвечающее самопроизвольному процессу:
S(реак + окр. среда) = (Sреак + Qокр. среда/ Т)
так как Qокр. среда = Qреак, то
[Sреак Qреак/Т]
Такое уравнение может быть использовано в качестве критерия направления самопроизвольного процесса в системе. Оно выражает направление самопроизвольного химического процесса через свойства химической реакции: изменение энтропии Sреак, теплоту Qреак, равную изменению энтальпии H, и температуру Т, при которой идет химическая реакция.
Отбросив индексы (все они относятся к химической реакции), получим:
S H/Т
или
H ТS 0
или
(H ТS) 0
В последнем уравнении функция H ТS соответствует тому параметру, который определяет направление самопроизвольного процесса, т.е. направление химической реакции. Этот параметр называется функцией Гиббса и обозначается символом G:
G = H ТS, тогда (H ТS) =G 0
или
G =H ТS 0
Функция Гиббса G названа в честь американского физика-теоретика Д. У. Гиббса (1839 1903) одного из основоположников химической термодинамики и статистической физики.
Если из уравнения G =H ТS выразить величину H, то получим H = G + ТS Функция Гиббса G представляет собой ту часть энтальпии процесса, которая может быть использована для выполнения полезной работы в системе.
Энтропийная составляющая ТS ни при каких условиях не может быть превращена в работу и представляет собой ту часть теплоты, которая выбрасывается в окружающую среду. Например, как бы мы не совершенствовали автомобильный двигатель, только часть энергии химической реакции горения бензина идет на движение автомобиля. Другая часть энергии, равная ТS, выбрасывается с нагретыми газами в атмосферу, обогревая окружающую среду.
Итак, изменение функции Гиббса служит критерием самопроизвольного процесса в системе:
- в состоянии равновесия G = 0;
- если идет самопроизвольный процесс, то G 0.
Появилась возможность ответить на вопрос: почему идут химические реакции? С позиций термодинамики единственным результатом любого самопроизвольного процесса в природе является движение к состоянию равновесия, к устойчивому состоянию.
Следовательно, химические реакции происходят потому, что реагенты находятся в неустойчивом состоянии и стремятся перейти в устойчивое. При этом функция Гиббса должна уменьшаться: G ≤ 0
Рассмотрим равновесную реакцию
А + В ⇄ С + D
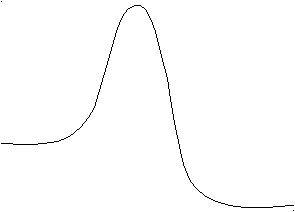
На рис. 62 представлена модель такого процесса. Подобно шарику на склоне исходные химические вещества А и В стремятся перейти в устойчивое состояние. Для шарика это процесс скатывания в ложбину по склону, для химических веществ А и В это реакция образования равновесной смеси веществ А, В, С и D, т. е. переход к химическому равновесию из неравновесного состояния.
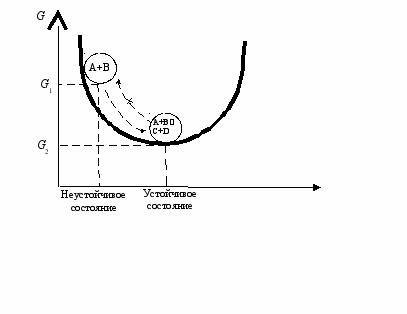
Рис. 62. Изменение функции Гиббса в самопроизвольном процессе. Устойчивому состоянию соответствуют равновесные концентрации участников реакции: А+В ⇄ С+ D
Движение к состоянию равновесия может осуществляться не только со стороны веществ А + В:
А + В С + D
но и со стороны веществ С + D:
С + D А + В
Термодинамические расчеты позволяют ответить на вопрос о том, разрешена с позиций термодинамики данная реакция или нет. Для оценки необходимо знание величины Gr0 = G2 G1, которая при самопроизвольном процессе должна быть меньше нуля. Для такой оценки необходимы табличные значения энтальпий образования и энтропий участников процесса. По табличным значениям стандартных Нf0 и S0 (табл. 10 и 11) рассчитывают в соответствии с законом Гесса значения Нr0 и Sr0 и их подставляют в уравнение
Gr0 = Нr0 ТSr0
Затем вычисляют значение Gr0.
Т а б л и ц а 11
Стандартные энтропии некоторых веществ при 298 К
| Вещество | S0, Дж/мольК | Вещество | S0, Дж/мольК |
| Al(т) Al2О3(т) | 28,35 59,9 | С2Н2(г) С2Н5ОН (ж) | 200,8 160,7 |
| О2(г) O3(г) | 205,0 238,8 | СО(г) СО2(г) | 197,5 213,7 |
| С(графит) С(алмаз) | 5,7 2,368 | Са(т) СаСО3(т) | 41,6 88,7 |
| Н2(г) СН4(г) | 130,5 186,2 | СаО(т) Са(ОН)2(т) | 39,7 76,1 |
| Н2О(г) Н2О(ж) | 188,7 70,1 | NO2(г) NH3(г) | 240,2 192,6 |
| N2(г) NO(г) | 199,9 210,6 | Au(т) Au2О3(т) | 47,4 134 |
| Fe(т) Fe2O3(т) | 27,15 87,4 | | |
Воспользуемся термодинамическими данными для определения направления химического превращения по данным, приведенным в табл. 10 и 11.
Пример 1. Докажите, что в стандартных условиях (250C,
1 атм) графит не превращается в алмаз.
Запишем уравнение химической реакции и используем табличные данные Нf0 и S0 (табл. 10 и 11).
С(графит) = С(алмаз)
Нf0, кДж/моль 0 1,828
S0, Дж/моль К 5,7 2,368
Вычислим по закону Гесса Нr0 и Sr0
Нr0 = Нf0(алмаз) Нf0(графит) = 1,828 0 = 1,828 кДж = 1828 Дж
Sr0 = S0(алмаз)S0(графит)=2,3685,7 = 3,332 Дж/моль К
Вычислим Gr0 при температуре 298 К (250C):
Gr0 = Нr0 Т Sr0 = 1828 298 [3,332] = 2820,9 Дж
Так как Gr0, то реакция превращения графита в алмаз самопроизвольно при температуре 298К не идет. Самопроизвольно идет обратная реакция превращения алмаза в графит. В этом случае Gr0 .
Практически превращения алмаза в графит при комнатной температуре не происходит, так как очень мала скорость процесса.
Пример 2. Воздух состоит из азота и кислорода. Докажите, что реакция образования оксида азота NO в стандартных условиях самопроизвольно не идет и не может служить источником загрязнения воздуха вредным оксидом.
Запишем уравнение химической реакции и используем табличные данные Нf0 и S0 ( табл. 10 и 11).
N2(г) + O2(г) = 2NО(г)
Нf0, кДж/моль 0 0 290,25
S0, Дж/моль К 199,9 205 2210,6
Вычислим по закону Гесса Нr0 и Sr0
Нr0 = 2Нf0(NO) Нf0(N2) Нf0(O2) = 290250 0 0 = 180500 Дж
Sr0 = 2S0(NO) S0(N2) S0(O2) = 2210,6199,9 205 = 16,3 Дж/моль К
Вычислим Gr0 при температуре 298 К (250C):
Gr0 = Нr0 Т Sr0 = 180500 29816,3 = 175642,6 Дж
Так как Gr0, следовательно, в воздухе при 250C реакция превращения азота и кислорода в оксид азота (II) не происходит.
Пример 3. Докажите, что ржавление железа идет в стандартных условиях (250С, р = 1 атм.).
Решение
Запишем уравнение химической реакции и приведем табличные данные Нf0 и S0 (табл. 10 и 11).
2 Fe (т) + 3/2 O2(г) = Fe2O3 (т)
Нf0, кДж/моль 0 0 822,2
S0, Дж/моль К 27,15 205 87,4
Вычислим по закону Гесса Нr0 и Sr0
Нr0 = Нf0(Fe2O3) 2Нf0(Fe) 3/2Нf0(O2) = 822,2 20 3/2 0 = 822,2 кДж
Sr0 = S0(Fe2O3) 2 S0 (Fe) 3/2 S0 (O2) = 87,4 227,15 3/2205 =
274,1 Дж/моль К
Вычислим Gr0 при температуре 298 К (250C):
Gr0 =Нr0Т Sr0=822200 298[ 274,1] = 740518,2 Дж
Так как Gr0, следовательно, реакция превращения железа в оксид железа (III) является самопроизвольным процессом. С момента выплавки металла из железной руды начинается процесс превращения его вновь в железную руду.
Вопросы для проверки знаний
- В чем различие между самопроизвольным и несамопроизвольным процессом?
- Какое состояние системы является результатом самопроизвольного процесса?
- Что является критерием направления процесса в системе?
- Справедливо ли утверждение, что энтропия системы является мерой беспорядка или, другими словами, рассеяния энергии?
- Дайте формулировку второго закона термодинамики.
- В каких случаях говорят, что химическая реакция термодинамически разрешена?
- Почему происходят химические реакции с позиции второго закона термодинамики?
Упражнения
- Расположите вещества в порядке возрастания энтропии при стандартных условиях: 1 моль жидкой воды, 1 моль водяного пара, 1 моль льда.
- Докажите, что только золото среди всех металлов не подвергается окислению кислородом (не превращается в Au2O3) и находится в природе в самородном состоянии.
6.2. Законы кинетики
Полное представление о химической реакции достигается изучением термодинамических и кинетических характеристик процесса.
Функция Гиббса, точнее, знак изменения функции G позволяет получить информацию о направлении химического процесса (влево, вправо).
Химическая кинетика позволяет ответить на вопрос о времени протекания реакции. Важно знать, идет ли реакция в течение сотых и тысячных долей секунды (взрыв) или многих сотен и тысяч лет. Например, превращение алмаза в графит самопроизвольный процесс, т. е. реакция термодинамически разрешена. Но во времени процесс превращения идет с такой низкой скоростью, что его скорость можно принять равной нулю.
Химическая кинетика – это наука о механизме и скорости химической реакции. Рассмотрим механизм и скорость реакции на примере конкретного химического процесса разложения пероксида водорода.
Механизм химической реакции
Напомним, что механизм химической реакции – это последовательность элементарных реакций превращения исходных веществ (реагентов) в продукты реакции. Каталитическое разложение пероксида водорода в водном растворе
2
Fe2+
Н2О2(р-р) 2Н2О(р-р) + О2(г)
является сложной реакцией, идущей по следующему механизму:
- НООН + Fe2+ НО + НО + Fe3+
- НО + НООН Н2О + НОО
- НОО ⇄ Н+ + ОО
- Н+ + НО Н2О
- ОО + Fe3+ О2 + Fe2+
Роль катализатора выполняет ион Fe2+ в составе растворенного в воде FeSO4.
Каталитическое разложение Н2О2 включает пять элементарных реакций. Реакция является элементарной, если она идет в один акт, в одно действие. Столкновение молекулы пероксида водорода с ионом железа (II) происходит в один акт в момент контакта (реакция 1). В результате этой реакции образуются промежуточные частицы: ион гидроксида НО, гидроксильный радикал НО и ион железа Fe3+. Промежуточными они называются потому, что не являются конечными продуктами и принимают участие в последующих элементарных реакциях.
Обратим внимание на реакции 1 и 5. В первой – расходуется ион Fe2+, в последней – он вновь появляется в том же количестве, что и в начале процесса. Катализатор – это химическое соединение, которое участвует в реакции, но количество и состав его не меняется к моменту образования продуктов реакции. Ион Fe2+ участвует в химических превращениях до тех пор, пока не разложится пероксид водорода до кислорода и воды.
Разложение пероксида водорода – сложная реакция. Реакция называется сложной, если конечный продукт получается в результате осуществления двух или более элементарных реакций.
Скорость химической реакции
Скорость химической реакции – это изменение концентрации реагирующего вещества или продукта реакции за единицу времени. В соответствии с определением средняя скорость химической реакции V вычисляется по уравнению:
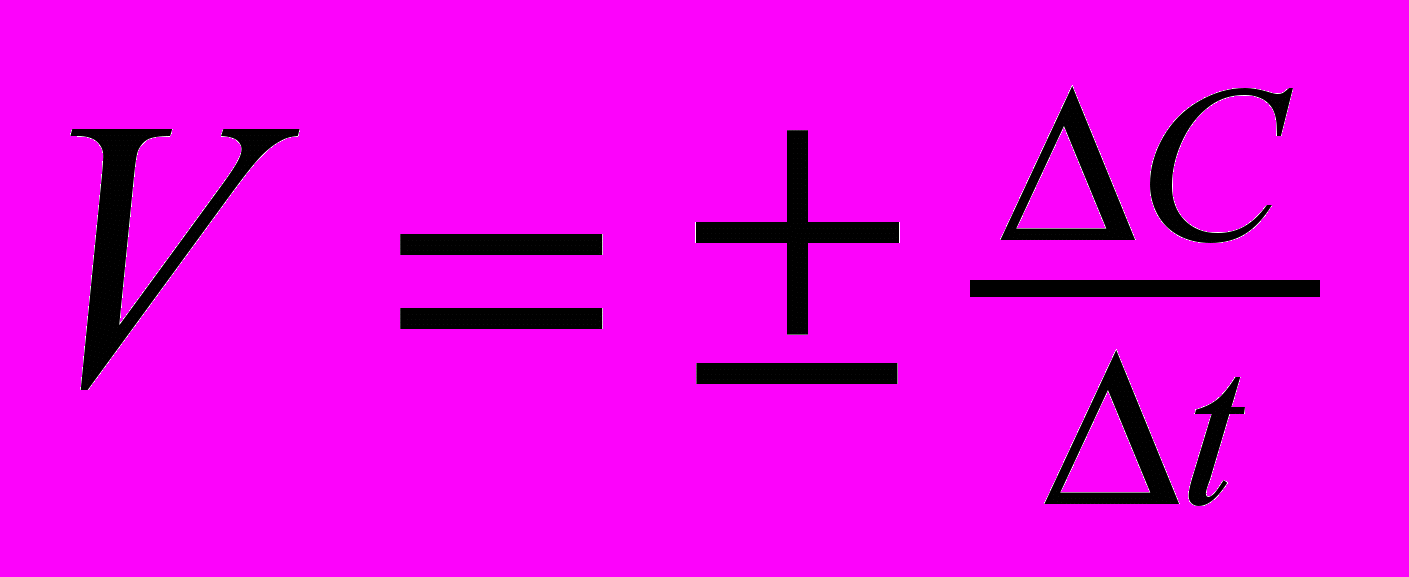 [моль/лсек]
[моль/лсек]где С = Скон – Снач [моль/л] есть изменение концентрации одного из реагентов (тогда перед дробью ставится знак минус) или изменение концентрации одного из продуктов реакции (тогда перед дробью ставится знак плюс) за промежуток времени t = tкон – tнач.
Лабораторный опыт
Скорость реакции каталитического разложения пероксида
водорода
Скорость разложения пероксида водорода изучают по скорости выделения газообразного кислорода на установке, представленной на рис. 63.
В пробирку (1) помещают 10 мл ~ 1% раствора Н2О2, добавляют 1 мл 0,001 мол/л раствора FeSO4. Растворы перемешивают и пробирку соединяют с бюреткой (2) при открытом кране (3). Устанавливают одинаковые уровни на нулевом показании окрашенной жидкости в бюретке и в уравнительном сосуде 4.


3


2




4













1












1




Рис. 63. Установка для изучения скорости разложения Н2О2: 1 – пробирка, содержащая раствор Н2О2; 2 – бюретка для измерения объема выделившегося кислорода; 3 – кран; 4 – уравнительный сосуд
Примерно через минуту после смешения растворов закрывают кран (3), и этот момент считают началом измерения скорости выделения кислорода при разложении Н2О2. Чтобы точно измерить объем выделившегося кислорода в любой момент времени t мин, постоянно поддерживают на одном уровне жидкость в бюретке и уравнительном сосуде.
Опыт лучше выполнять втроем. Один исследователь поддерживает постоянными уровни в бюретке и уравнивающем сосуде, другой отмечает объем кислорода мл через нужные промежутки времени, третий данные измерений объема выделившегося газа и времени опыта записывает в таблицу.
| Время реакции, t, мин | 0 | 1 | 2 | 3 | 4 | 5 | 10 |
| Объем мл выделившегося кислорода | | | | | | | |
По табличным данным строят график в координатах – t. Он должен иметь вид, представленный на рис. 64.

U
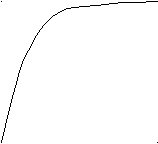
Рис. 64. Изменение скорости выделения О2 во времени при каталитическом разложении пероксида водорода. Отношение /t определяет скорость химической реакции


t, мин

t
Можно установить зависимость скорости реакции V от концентрации катализатора Ск, если повторить опыт при другой (большей или меньшей) концентрации катализатора. Для этого достаточно вычислить пропорциональное скорости реакции отношение:
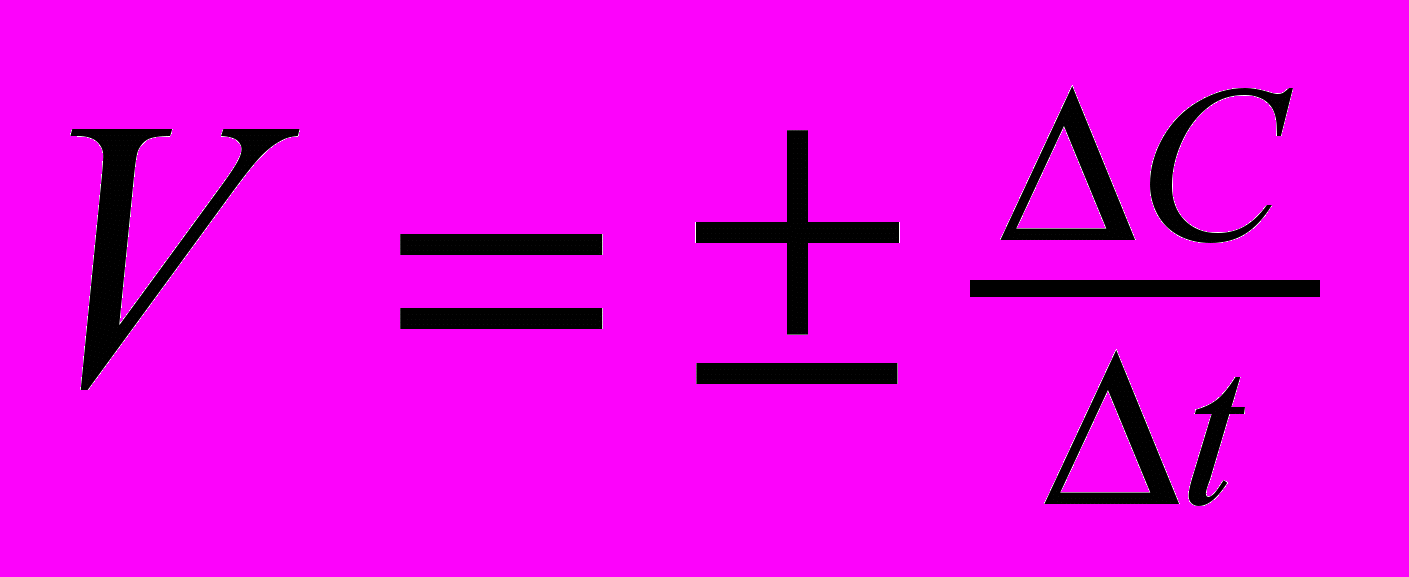 [моль/лсек]
[моль/лсек]для двух различных начальных концентраций катализатора и сравнить их.
**Кинетическое уравнение элементарной реакции
В соответствии с законом действия масс скорость реакции пропорциональна произведению молярных концентраций реагентов, возведенных в степени, равные их стехиометрическим коэффициентам в уравнении элементарной химической реакции. Применительно к элементарным реакциям каталитического разложения пероксида водорода выражение закона действующих масс должно быть представлено уравнениями:
- V1 = k1CHOOHCFe2+ (бимолекулярная реакция второго порядка)
- V2 = k2CHOCH2O (бимолекулярная реакция второго порядка)
- V3 = k3CHOO (мономолекулярная реакция первого порядка)
- V4 = k4CH+COH (бимолекулярная реакция второго порядка)
- V5 = k5COOCFe3+ (бимолекулярная реакция второго порядка)
Число частиц, участвующее в элементарном акте, определяет молекулярность реакции.
Сумма показателей степеней, с которыми концентрации реагирующих веществ входят в уравнение скорости химической реакции, определяет порядок реакции. Порядок и молекулярность в элементарных химических реакциях совпадают.
Тот факт, что скорость реакции прямо пропорциональна произведению концентраций реагентов в элементарной химической реакции, следует из теории соударений. Химическая реакция происходит только в том случае, если молекулы реагентов вступили в непосредственный контакт. Следовательно, первое условие проведения реакции – соударение реагентов.
Число всех возможных соударений, которые могут привести к химической реакции, пропорционально произведению молярных концентраций реагентов.
В обобщенном виде для бимолекулярной элементарной реакции
А—В + С—D А—С + В—D
выражение скорости, учитывающее фактор соударений записывается:
V
 = kCАВСCD
= kCАВСCDФактор соударений
Для мономолекулярной элементарной химической реакции, например, реакции 3 в механизме разложения пероксида водорода, фактор соударения присутствует в неявном виде, хотя выражение закона действия масс это как будто бы не отражает:
НОО Н+ + ОО
V3 = k3CНОО
Однако, если основным источником энергии, необходимой для разрыва химической связи в пероксидном радикале НОО являются молекулы воды (растворитель), элементарная реакция 3 должна быть записана следующим образом:
НОО + Н2О Н+ + ОО + Н2О
тогда
V
Н2О
 3 = kCНООС
3 = kCНООС Фактор соударений
Концентрация воды не меняется, т. к. молекулы воды при соударении с радикалами лишь сообщают энергию для разрыва химической связи в радикале. Поэтому
 вводится в константу скорости реакции:
вводится в константу скорости реакции: , если
, если 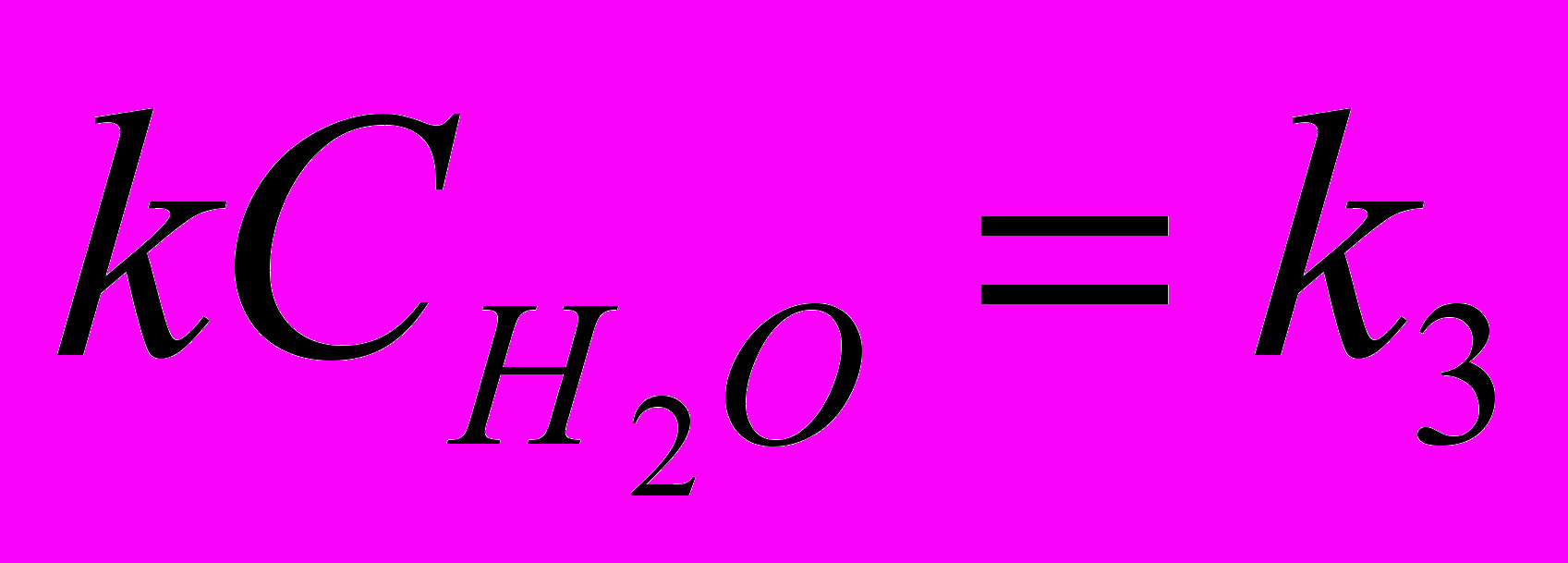 , то
, тоV3 = k3CНОО
Следующее условие осуществления химической реакции – энергетический фактор. Для того чтобы произошел разрыв химических связей и образовались новые связи, необходима энергия, которая называется энергией активации и обозначается символом Е. Энергия, которая превышает среднюю энергию движения молекул реагентов и достаточная для протекания химической реакции, называется энергией активации.
Чтобы раскрыть физический смысл энергии активации химической реакции, представим следующую модель. Плотина перегораживает водоем на две части (рис. 65). Если бы не было плотины, вода самопроизвольно перетекла бы из резервуара с большим уровнем в резервуар с более низким уровнем воды. Так происходит на гидроэлектростанциях. На пути воды, падающей с высоты по трубе в теле плотины, стоит турбина, преобразующая энергию механического движения воды в электрическую энергию. Этот процесс напоминает экзотермическую химическую реакцию. Только в химической реакции энергия химического превращения выделяется в форме тепла (r).
Энергия
системы


Е1
А—В + С—D


r
А—C + В—D
r
r


Реагенты
Продукты реакции


Рис. 65. Модель экзотермического химического превращения.
При проведении химической реакции нет плотины, но существует энергетический барьер. Необходима энергия на преодоление электростатического отталкивания между отрицательно заряженными электронными оболочками молекул и для разрыва химических связей. Преодоление энергетического барьера в химической реакции напоминает ситуацию перебрасывания воды через плотину в шторм, когда сила ветра раскачивает волны до такой высоты (энергия волн), что они способны преодолеть верхний барьер (рис. 65).
Преодоление энергетического барьера в экзотермическом процессе возможно, если повысить температуру настолько, чтобы энергия движения молекул была равна энергии активации Е1.
Преодоление энергетического барьера в эндотермическом процессе возможно, если повысить температуру настолько, чтобы энергия движения молекул была равна энергии активации Е2. Такое химическое превращение напоминает движение волн при шторме с нижнего уровня на верхний через барьер плотины (рис.66).
Энергия
системы


А—В + С—D




Е1



Е2
r
А—C + В—D


Реагенты
Продукты реакции

Рис. 66. Модель химического превращения в эндотермическом процессе.
Возможно ли движение в противоположном направлении с нижнего энергетического уровня на верхний? На плотине возможно, если ветер раскачал волны до таких размеров, что они перебрасываются через плотину. Возможна ли химическая реакция в сторону эндотермического процесса? Ответ положительный. Только в этом направлении требуется преодолеть более высокий энергетический барьер Е2 = r + Е1 (рис. 66).
Чтобы преодолеть плотину через верхний барьер в прямом или обратном направлениях, необходимо затратить энергию ураганного ветра. При проведении химической реакции в прямом или обратном направлении, нужно затратить энергию, равную энергии активации. Это достигается увеличением температуры реакции.
В константе скорости химической реакции k скрыт энергетический фактор. В явном виде зависимость константы скорости реакции от температуры выражается уравнением, которое в химической кинетике известно как уравнение Аррениуса:
k
 = k0еRT
= k0еRTЭнергетический фактор
Константа скорости тем больше, чем выше температура реакции, т. е. k растет с ростом Т в соответствии с уравнением Аррениуса.
Скорость бимолекулярной химической реакции в явном виде включает два фактора: фактор соударений и энергетический фактор:
V = k0eRTCACB
Кроме того, существует пространственный или стерический фактор. Не каждое соударение с энергией, равной энергии активации Е, приводит к химической реакции. Например, реакция образования сложного эфира обусловлена столкновением функциональных групп (реакционных центров) молекул спирта и кислоты:
О О
 ∥ ∥
∥ ∥ROH + HOCR— ROCR + H2O

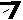
Реакционные центры
Если молекулы сталкиваются радикалами R и R, то реакция не произойдет.
Стерический фактор учитывает предэкспоненциальный множитель k0, входящий в уравнение Аррениуса. Этот множитель во много раз меньше единицы. Например, из множества столкновений в бимолекулярной реакции только одно может оказаться успешным.
Таким образом, скорость химической реакции
А—В + С—D А—С + В—D
зависит от действия нескольких факторов.


 V= k0 eRTCABCCD
V= k0 eRTCABCCD


Стерический фактор учитывает число столкновений реакционными центрами
Энергетический фактор учитывает число столкновений с энергией, равной энергии активации Е
Фактор соударений учитывает все возможные столкновения, которые могли бы привести к химической реакции
Чтобы определить численные значения факторов, влияющих на скорость химической реакции, необходимо проводить экспериментальные исследования каждой конкретной реакции.
** Кинетическое уравнение сложной реакции
О молекулярности сложной реакции не имеет смысла говорить. Например, сложная каталитическая реакция разложения пероксида водорода включает моно и бимолекулярные элементарные реакции. Еще реже встречаются тримолекулярные реакции в составе сложных химических превращений.
Что нужно знать о сложной реакции с позиций кинетики химических реакций? Механизм и уравнение скорости реакции. В этом случае открываются возможности управлять скоростью процесса.
Обратимся снова к реакции каталитического разложения пероксида водорода:
Fe2+
2Н2О2 2Н2О + О2
Скорость разложения пероксида водорода выражается уравнением реакции первого порядка, так как показатель степени, с которым концентрация Н2О2 входит в уравнение скорости реакции, равен 1, хотя стехиометрический коэффициент в уравнении химической реакции равен 2:
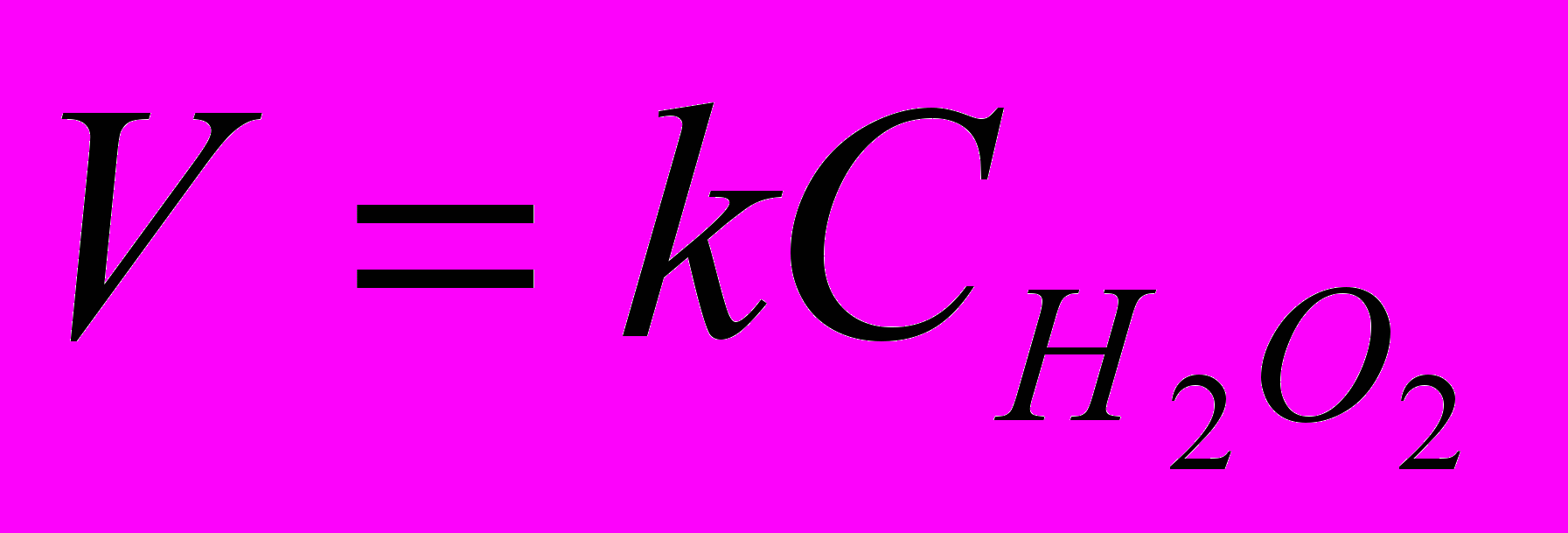
В общем виде для сложной реакции
АСА + ВСВ = продукты реакции,
где А и В стехиометрические коэффициенты, скорость реакции может описываться кинетическим уравнением:

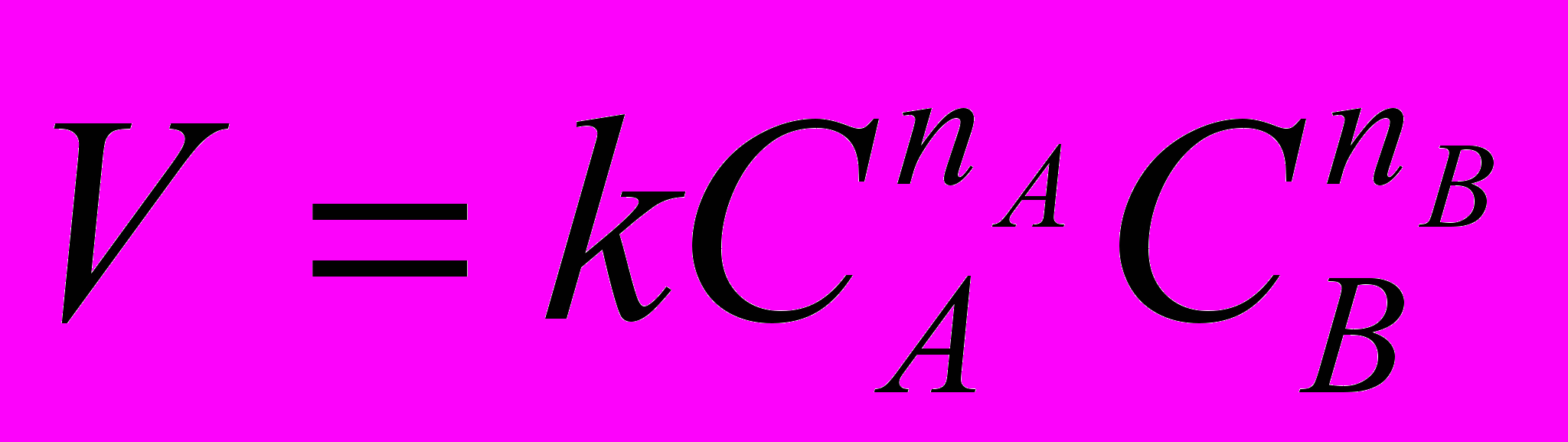 ,
,где nA и nB показатели степени, определяющие общий порядок реакции, равный сумме (nA + nB)
**Влияние катализатора на скорость реакции
Вернемся к механизму каталитического разложения пероксида водорода. Это гомогенная химическая реакция, включающая ряд элементарных реакций:
1. НООН + Fe2+ НО + НО + Fe3+
2. НО + НООН Н2О + НОО
3. НОО ⇄ Н+ + ОО
4. Н+ + НО Н2О
5.ОО + Fe3+ О2 + Fe2+
Ионные и радикальные реакции имеют низкие энергии активации и идут с высокой скоростью. Скорость процесса определяется самой медленной реакцией (1).

Если принять во внимание, что концентрация катализатора не меняется в ходе реакции, то произведение
 представляет собой постоянную величину k1. Тогда
представляет собой постоянную величину k1. Тогда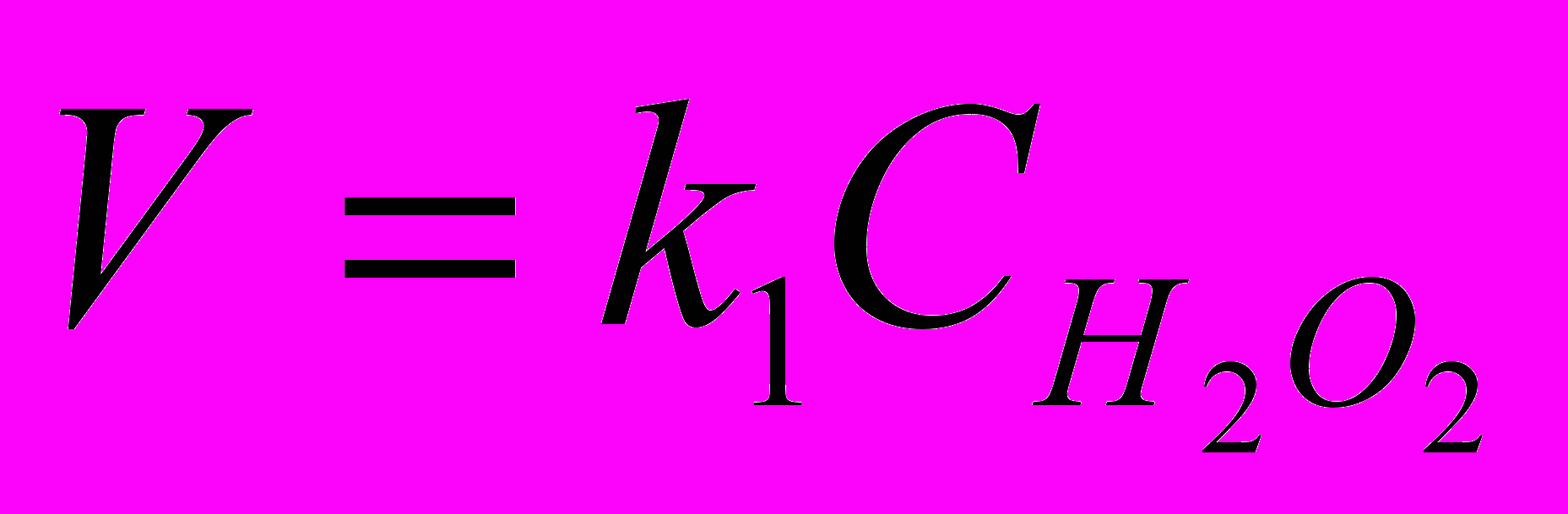 , где k1 =
, где k1 = 
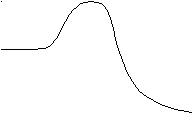
Каков механизм действия катализатора? Катализатор уменьшает энергию активации процесса (рис. 67).

Энергетическое состояние


Е

Н2О2
Екат

r
Продукты реакции
Исходное состояние



Рис. 67. Разложение Н2О2: Е энергия активации реакции в отсутствие катализатора; Екат энергия активации в присутствии катализатора
**Гетерогенные химические реакции
Гомогенные химические реакции протекают в газовой фазе или растворе, когда все реагенты находятся в одной фазе. В гетерогенной химической реакции скорость зависит также от площади поверхности, разделяющей реагенты. Например, поверхность бруска железа медленно окисляется кислородом воздуха. Поверхность, разделяющая кислород и металл, не очень велика и реакция окисления идет медленно.
4Fe(т) + 3O2(г) 2Fe2O3(т)
Дробление куска железа до состояния мелкодисперсного порошка настолько увеличивает площадь поверхности, что реакция может идти быстро и даже с воспламенением.
 ,
,где SFe площадь поверхности раздела.
Практическая работа
