5 Ионные реакции осаждения, нейтрализации, гидролиза
| Вид материала | Документы |
- Рекомендации к зачёту, 133.1kb.
- Написать краткие ионные и молекулярные уравнения реакций гидролиза карбоната натрия,, 4.27kb.
- Методический пакет учебного курса, 331.54kb.
- Молекулярно-динамическое моделирование осаждения металлического нанокластера на подложку, 66.11kb.
- Наносимые электрохимическими методами на поверхность детали в результате осаждения, 96.3kb.
- Для подготовки к экзамену по общей химии (2 семестр) Кинетика, 73.49kb.
- Программа коллоквиумов по курсу физической химии, 99.84kb.
- Оглавление, 334.79kb.
- Календарный план занятий по физической химии в весеннем семестре 2008/2009 уч года, 32.67kb.
- Отчет 86 с., 34 рис., 15 табл., 53 источника, 2 приложения. Ключевые слова : структура, 56.56kb.
Практическая работа
Гальванический элемент
Оборудование и реактивы: 2 стакана на 300 мл, U-образная трубка, гальванометр, медный и цинковый электроды, 15% растворы CuSO4 и ZnSO4, 10% раствор КNO3.
Задание 1. Соберите прибор в соответствии с рис. 53.
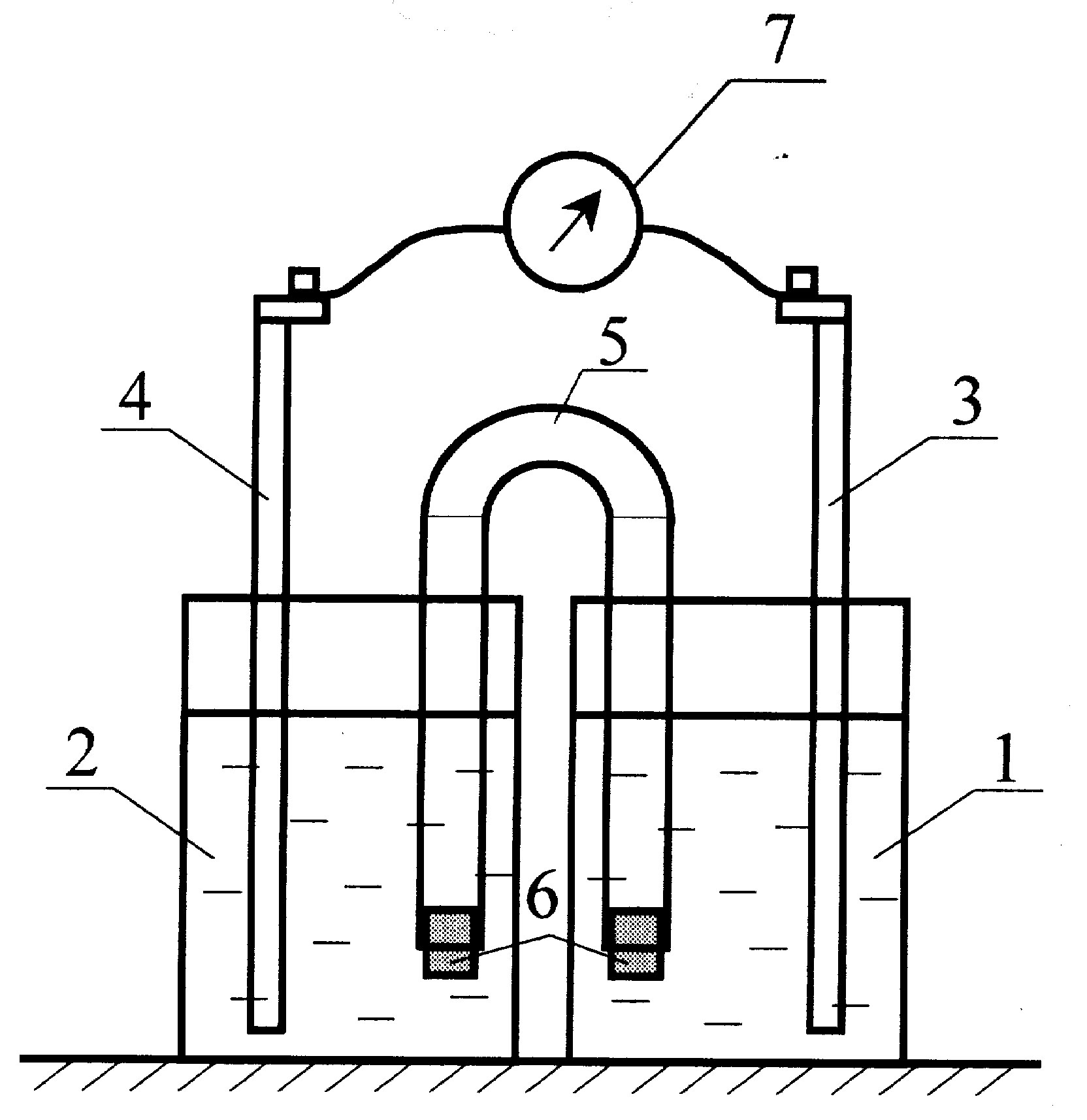
Рис. 53. Схема медно-цинкового гальванического элемента
В стаканы 1 и 2 налейте по 250 мл растворов CuSO4 и ZnSO4. Очистите наждачной бумагой медный (3) и цинковый (4) электроды. В стакан 1 опустите медную пластинку, а в стакан 2 – цинковую. Клеммы обоих электродов присоедините к гальванометру (7). Чтобы соединить растворы электролитов, концы U-образной трубки, заполненной раствором нейтрального электролита, KNO3 (5), закройте пористыми пробками или стекловатой (6), чтобы раствор не выливался из трубки, а ионы К+ и NO3– проникали в окружающий раствор.
Задание 2. Наблюдайте за показаниями гальванометра. Знаки зарядов электродов в цепи (рис. 53) говорят о разной активности металлов. Атомы цинка легко отдают электроны и переходят в виде положительно заряженных ионов в раствор, а ионы меди в растворе принимают электроны (восстанавливаются до металла) и достраивают кристаллическую решетку медного электрода.
Электродвижущая сила гальванического элемента, составленного из двух металлических электродов, вычисляется по установленному для расчета ЭДС правилу. Например, для вычисления Е медно-цинкового гальванического элемента следует из положительного электродного потенциала медного электрода вычесть отрицательный электродный потенциал цинкового электрода:
ЕCu/Zn = j(Cu) - j(Zn) = (+0,34) - ( -0,76) = +1,10В
Задание 3. Нарисуйте прибор в своей тетради и составьте схему собранного вами гальванического элемента. Напишите, какие процессы проходят на аноде, на катоде, приведите суммарное уравнение реакции. Сравните показания гальванометра со значением ЭДС, вычисленным по табличным данным.
Реакции в электролизере
Электрохимическая реакция предполагает разделение реагентов не только в гальваническом элементе, но и в электролизере. Электролизер – это устройство, в котором электрическая энергия расходуется на проведение химической реакции. Электролизер состоит из двух электродов, погруженных в расплав или водный раствор электролита, как показано на рис. 54. Электроды могут быть инертными, т.е. сделанными из веществ, не участвующих в химической реакции, например, графита. Источник постоянного электрического тока поставляет электроны, энергия которых расходуется на электродные химические реакции.




-
+
+
-


Анод
Катод


Источник постоянного тока



Cl-
Na+
H2O
H2O




e-
e-
Графитовые электроды

Рис. 54. Электролиз водного раствора хлорида натрия
Если пропустить ток через расплав хлорида натрия NaCl (Тпл=8010С), то ионы Na+ будут двигаться к катоду, а анионы Cl- к аноду. Ионы натрия, достигнув катода, восстанавливаются, принимая электроны, а хлорид ионы Cl-, отдав электроны аноду, окисляются:
катод (восстановление): 2Na+(ж) + 2е- ® 2Na(ж)
анод (окисление): 2Cl-(ж) ® Cl2(г) + 2е-
Суммарное уравнение:
2Na+(ж) +2Cl-(ж) ® 2Na(ж) + Cl2(г)
На катоде выделяется металлический натрий, а на аноде – газообразный хлор.
В случае электролиза водного раствора хлорида натрия катионы (Na+) проводят электрический ток, но не участвуют в окислительно-восстановительных реакциях. Для восстановления ионов натрия необходим электродный потенциал -2,71В, а для восстановления воды достаточен электродный потенциал -0,83В. Поэтому вместо восстановления ионов натрия до металлического натрия идет реакция восстановления воды:
катод (восстановление): 2Н2О(ж)+2е- ® Н2(г)+2ОН-(р-р)
На аноде окисляются ионы хлора:
анод (окисление): 2Cl-(ж) ® Cl2(г) + 2е-
Суммарная реакция электролиза раствора NaCl:
2Н2О(ж) + 2Cl-(ж) ® Н2(г) + Cl2(г) + 2ОН-(ж)
На катоде выделяется водород, на аноде – хлор, а в растворе вблизи катода накапливается гидроксид натрия NaOH, так как отрицательные заряды ионов ОН- компенсируются положительными зарядами ионов Na+.
Окислительно-восстановительное действие электрического тока намного эффективнее действия химических окислителей и восстановителей. Например, известно, что ни один химический окислитель не может отнять электрон у фторид-иона F-. Получить чистый фтор удалось лишь при электролизе раствора фторида калия во фтористоводородной кислоте. На аноде выделяется фтор, а на катоде водород:
катод (восстановление): 2Н+(ж) + 2е- ® Н2(г)
анод (окисление): 2F-(ж) ® F2(г) + 2е-
Восстановление воды на катоде и окисление ее на аноде - довольно частое явление в электролизе водных растворов. В таких случаях электролит играет роль ионного проводника, обеспечивающего ионную проводимость водного раствора при электролизе воды.
Например, если в электролизере, представленном на рис.54, проводить электролиз раствора Na2SO4, то в процессе электролиза будут участвовать только молекулы воды, давая на катоде водород, а на аноде кислород:
катод (восстановление): 2Н2О(ж)+2е-®Н2(г)+2ОН(р-р)
анод (окисление): 2Н2О(ж) ® 4Н+(р-р) + О2(г) + 2е-
В табл. 9 демонстрируются основные электродные реакции, протекающие при электролизе водных растворов электролитов.
Резюме к табл. 9:
Катионы металлов, имеющие небольшой стандартный электродный потенциал (от Li+ до Al3+) не восстанавливаются на катоде, вместо них восстанавливаются молекулы воды.
- Катионы металлов, имеющие стандартный электродный потенциал больший, чем у Al3+ и меньший, чем у Н+, восстанавливаются на катоде параллельно с молекулами воды.
- Катионы таких металлов, как Cu2+, Ag+, Pt2+, Au3+, имеющие больший, чем у водорода стандартный электродный потенциал, при электролизе восстанавливаются на катоде.
Т а б л и ц а 9
Электродные реакции при электролизе водных растворов
электролитов
| Катионы | Катодная реакция восстановления |
| Li+, K+, Ca2+, Na+, Mg2+, Al3+ | Восстановление воды: 2Н2О(ж) + 2е- ® Н2(г) + 2ОН- |
| Mn2+, Zn2+, Cr3+, Ni2+, Sn2+, Pb2+, H+ | Параллельное восстановление катионов металла и воды: Mz+ + ze- ® M 2Н2О(ж) + 2е- ® Н2(г) + 2ОН- |
| Cu2+, Hg22+, Ag+, Pt2+, Au3+ | Восстановление катионов металла: Mz+ + ze- ® M |
| Анионы | Анодная реакция окисления |
| I-, Br-, Cl-, S2- (А--анион) | Окисление анионов галогена и серы: АZ- ® А + ze- |
| SO42-, NO3-, CO32-, PO43-, F- | Окисление воды: 2Н2О(ж) ® Н+(р-р) + О2(г) + 2е- |
- Анионы бескислородных кислот (I-, Br-, Cl-, S2-) легко окисляются на инертном нерастворимом аноде.
- Если в растворе находятся анионы кислородных кислот SO42-, NO3-, CO32-, PO43-, а также F-, то на инертном аноде окисляются не эти анионы, а молекулы воды с выделением кислорода.
В электролизере, представленном на рис. 54, использовались инертные (графитовые) электроды. Они не участвуют в химических реакциях. В некоторых случаях электродные реакции включают не только окисление и восстановление воды и растворенных веществ, но и металлических электродов.
При электролизе водных растворов с использованием металлических электродов анод окисляется, если его окислительный потенциал выше потенциала воды. Например, медь окисляется легче, чем вода. Свойство металлических электродов участвовать в окислительно-восстановительных реакциях находит применение в процессах очистки металлов от примесей или покрытия одних металлов другими. Обычно медь в промышленности получают из сульфида меди по реакции:
Cu2S(ж) + O2(г) ® 2Сu(ж) + SO2(г)
Такая медь называется губчатой, она содержит до 1% примесей других металлов, главным образом железа, цинка, серебра и золота. Для изготовления электрических проводов проводят рафинирование (очистку) губчатой меди. Для этого ее подвергают электролитической очистке в электролизере (рис. 55).




-
+
+
-


Катод


Источник постоянного тока

Cu2+
H2O



e-
e-







SO42-


Fe3+
Zn2+

Au3+, Ag+
Анод


Рис. 55. Рафинирование меди
В электролизере анод делают из губчатой меди, катод из чистой меди. Электролитом служит раствор медного купороса с добавлением небольшого количества серной кислоты. При электролизе медь анода растворяется, и чистая медь осаждается на катоде:
анод (окисление): Cu(т)® Cu2+(р-р) + 2е-
катод (восстановление): Cu2+(р-р) + 2е- ® Cu(т)
Золото и серебро окисляются труднее, чем медь, и в виде незначительных по массе частичек собираются на дне электролизера. В растворе остаются ионы железа и цинка.
Покрытие одних металлов другими называется гальваническим покрытием или электроосаждением. Для электроосаждения металл, который наносят на поверхность другого металла, делают анодом. Например, медные изделия покрывают слоем серебра, поступающего с серебряного анода.
Практическая работа
Электролиз водных растворов солей
Устройство для электролиза водных растворов представляет собой чашку Петри небольшого диаметра, разделенную полупроницаемой перегородкой (применена малярная лента), чтобы замедлить процесс диффузии (рис. 56). Раствор соли наливают не выше перегородки. Источником постоянного тока служит батарейка напряжением 9В, к которой припаяны изолированные металлические провода, а к ним – угольные электроды, вынутые из разряженной батарейки. Места соединения электродов с проводами изолированы силиконовыми трубками.
На рис. 56 показан процесс электролиза водного раствора хлорида олова (II). 1М раствор SnCl2 следует подкислить для подавления процесса гидролиза. В раствор вертикально опустите угольные электроды по обе стороны от перегородки. Спустя несколько минут после начала электролиза в нижней части катода начинает расти блестящая металлическая лента олова. Слой металла настолько тонок, что под микроскопом хорошо видна его кристаллическая структура.
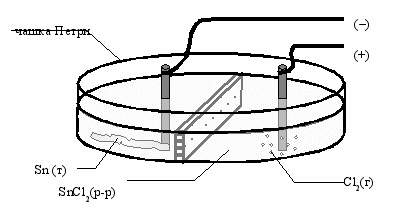
Рис. 56. Прибор для электролиза водного раствора SnCl2
Если использовать раствор ацетата свинца, подкисленный CН3СООН, на катоде довольно быстро растут кристаллы свинца удивительной красоты, которые также можно рассмотреть с помощью микроскопа.
Вариант 1. Проведите электролиз растворов ацетата свинца и карбоната натрия. Напишите уравнения реакций, протекающих на катоде и на аноде, затем суммарное уравнение электролиза водного раствора каждой соли.
Задача 1. Определите w(NaOH), образовавшегося при электролизе 200 г 29,25% раствора хлорида натрия.
Задача 2. При пропускании постоянного тока силой 6,4А в течение 30 минут через расплав хлорида неизвестного металла, на катоде выделилось 1,07 г металла. Определите состав соли, которую подвергли электролизу.
Вариант 2. Проведите электролиз растворов бромида натрия и сульфата натрия. Напишите уравнения реакций, протекающих на катоде и на аноде, затем суммарное уравнение электролиза водного раствора каждой соли.
Задача 1. Определите время, необходимое для осаждения на катоде 6,4 г меди при пропускании постоянного тока силой 5,36А через водный раствор сульфата меди (II). Ответ: 60 минут.
Задача 2. При электролизе водного раствора бромида натрия на аноде выделился бром массой 35 г, что составило 87,5% от теоретически рассчитанного. Какой объем водорода выделился на катоде? Выход водорода считать количественным, т.е. 100%.
Вариант 3. Проведите электролиз растворов иодида калия и ортофосфата натрия. Напишите уравнения реакций, протекающих на катоде и на аноде, затем суммарное уравнение электролиза водного раствора каждой соли.
Задача 1. Через расплавленный оксид алюминия пропускали постоянный ток силой 16А в течение 3 часов. Вычислите массу металла, выделившегося на катоде. Ответ. 16,1 г.
Задача 2. При электролизе 200 г раствора иодида калия выделилось 1,344 л газа (н.у.). Вычислите w(KJ) в исходном растворе.
Вариант 4. Проведите электролиз растворов сульфата цинка и иодида калия. Напишите уравнения реакций, протекающих на катоде и на аноде, затем суммарное уравнение электролиза водного раствора каждой соли.
Задача 1. При электролизе 500 г водного раствора сульфата цинка на катоде выделилось 39 г цинка. Вычислите массу продукта, выделившегося на аноде и w(ZnSO4) в исходном растворе, считая, что электролиз прошел полностью.
Задача 2. Какую массу HCl можно получить из газов, образовавшихся при пропускании тока силой 5,0 А в течение 2 часов через раствор хлорида натрия? Ответ: 13,6 г.
Вопросы для проверки знаний
Какие два признака отличают электрохимическую реакцию от химической реакции?
- Чем отличается электролизер от гальванического элемента?
- Можно ли утверждать, что на аноде всегда идут реакции окисления?
- Можно ли утверждать, что на катоде всегда идут реакции восстановления?
- Какой вид проводимости (ионная или электронная) осуществляется в растворе электролита?
- Почему без солевого мостика гальванический элемент не работает?
Упражнения
Среди водных растворов солей Li2SO4, CuCl2, Ca(NO3)2, Na2SO4 выберите растворы, электролиз которых приводит к разложению воды.
- Напишите уравнения реакций, сопровождающих электролиз водного раствора хлорида цинка.
- При электролизе водного раствора соли значение рН в около электродном пространстве одного из электродов возросло. Выберите правильный вариант ответа: электролизу подвергся раствор: 1) CuCl2; 2) NaCl; 3) Cu(NO3)2
- Напишите уравнение реакции, которая протекает на медном аноде при электролизе водного раствора CuCl2
*Задачи
При электролизе 47,2мл 11,1% раствора хлорида кальция (r = 1,06г/мл) на аноде выделилось 3,36 л газов (н.у.). Полученные газы при нагревании пропущены через трубку, содержащую 15 г металлического магния. Вычислите массовые доли веществ, находящихся в трубке после окончания опыта. Ответ: 9г Mg; 4,75г MgCl2; 8г MgO.
- Раствор смеси 7,22 г дигидрата хлорида бария и хлорида натрия подвергли электролизу до полного разложения солей. К образовавшемуся раствору добавили 26 мл раствора серной кислоты, w(H2SO4) = 19,6%, r = 1,15г/мл. На полную нейтрализацию полученного при этом раствора потребовалось 32 мл раствора КОН (с = 1,25моль/л). Вычислите массовые доли солей в смеси и объем хлора (н.у.), полученного при электролизе.
Ответ: 67,59% BaCl2.2Н2О; 0,896 л Cl2.
- При электролизе раствора CuSO4 на катоде выделилось 12,8 г металла. Найдите объем газа, выделившегося на аноде, и массу образовавшейся кислоты.
- Вычислите массу серебра, выделившегося на катоде при пропускании тока силой 6А через раствор AgNO3 в течение 30 минут.
Ответ: 12 г.
**Коррозия металлов и защита от коррозии
Как только металл выделяется в чистом виде из руды, он немедленно начинает окисляться. Человек извлекает металл из руды, а металл самопроизвольно окисляется на воздухе и снова превращается в руду. Исключение составляет золото. Для него такой процесс на воздухе невозможен. Золото высоко ценится как драгоценный металл и как первоклассный электротехнический материал.
Металлы, соприкасающиеся с газом, подвергается газовой коррозии. Так происходит окисление деталей двигателя внутреннего сгорания при высокой температуре. Идет окислительно-восстановительная реакция:
4Fe + 3O2 = 2Fe2O3
Железо снова возвращается в состояние, в котором находилось в природе.
Н
Взаимодействие металла со средой, ведущее к его разрушению и превращению в оксид, гидроксид или соль, называется коррозией.
а воздухе металлы ведут себя по-разному. На поверхности одних металлов образуется рыхлая пленка оксида или другого химического соединения. Она способна пропускать воздух к поверхности металлической кристаллической решетки (Fe, Na, K). В этом случае коррозия идет до тех пор, пока весь металл не превратится в крошащийся и рассыпающийся порошок. Именно так разрушаются прочные металлические конструкции, рассчитанные служить десятилетия и столетия.
На поверхности других металлов образуется тонкая, но прочная пленка, которая не пропускает кислород воздуха (Al, Be, Cr, Zn, Ni, Cu). Металл более не взаимодействует с кислородом и сохраняется неизменным длительное время.
Металл, соприкасающийся с водой, подвергается электрохимической коррозии. Достаточно капли воды на поверхности железа, чтобы началась электрохимическая коррозия. Там, где находится капля воды, возникает микрогальванический элемент размером с каплю воды.
Представим лист железа, на поверхности которого появилась капля воды. Если она сохранится какое-то время на поверхности, то ионы железа переходят с поверхности кристаллической решетки в раствор. Атом железа оставляет свои электроны в металле, в раствор поступают катионы железа. Избыток электронов устремляется к тому участку поверхности металла, который не закрыт каплей воды. Кислород воздуха принимает электроны и восстанавливается на участке поверхности металла, играющем роль катода.
Катод: О2 + 4е- + 2Н2О = 4НО-
(реакция восстановления кислорода)
Анод: 2Fe = 2Fe2+ + 4е-
(реакция окисления атомов металла)
В результате окислительно-восстановительных реакций в присутствии воды образуется гидроксид железа(II). Суммируем уравнения реакций, протекающих на катоде и аноде:
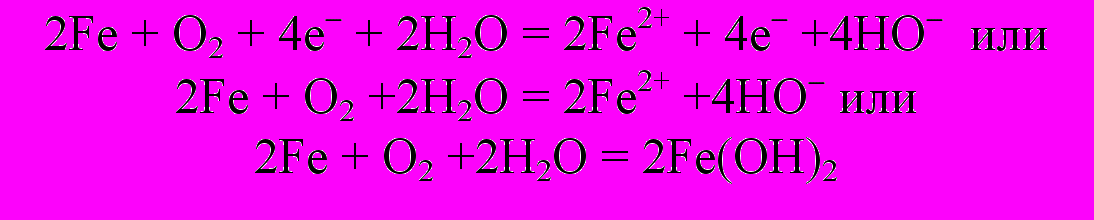
Гидроксид железа (II) окисляется кислородом воздуха и превращается в гидроксид железа (III) буро-красного цвета:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Появление на поверхности металла, подвергающегося электрохимической коррозии, ржавчины в виде небольших точек указывает на возникновение микрогальванических элементов.
Ржавление происходит с любой открытой влаге стороны куска металла. Под каплей постепенно уменьшается толщина стенки металла и образуется лунка. Вероятность попадания влаги в образовавшуюся лунку возрастает, и ржавление продолжается до полного исчезновения металла.
Среди многих методов защиты металлов от коррозии отметим два. Первый заключается в покрытии поверхности металлов красками, полимерными пленками, лаками или другими металлами, проявляющими высокую коррозионную стойкость по сравнению с железом. К металлу перекрывается доступ кислорода воздуха и влаги.
Второй способ - электрохимический. Электрохимическую защиту можно подразделить на протекторную (рис. 57) и катодную (рис. 58).
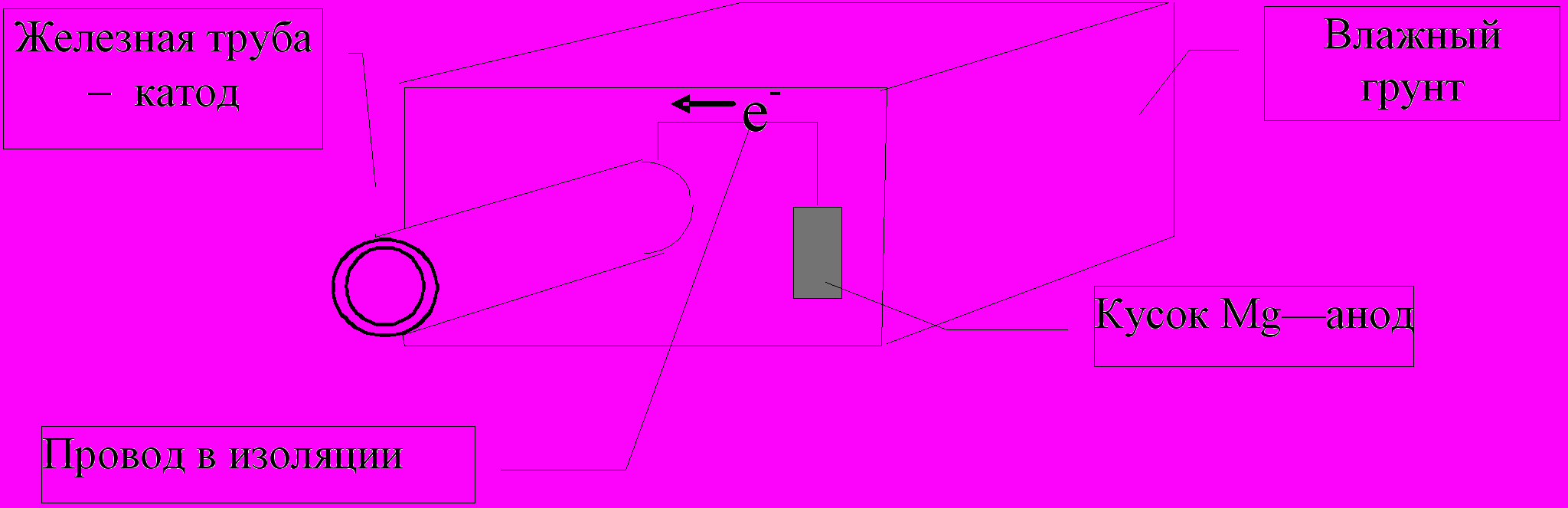
Рис. 57. Электрохимическая (протекторная) защита железной трубы с помощью куска магния более активного по сравнению с железом
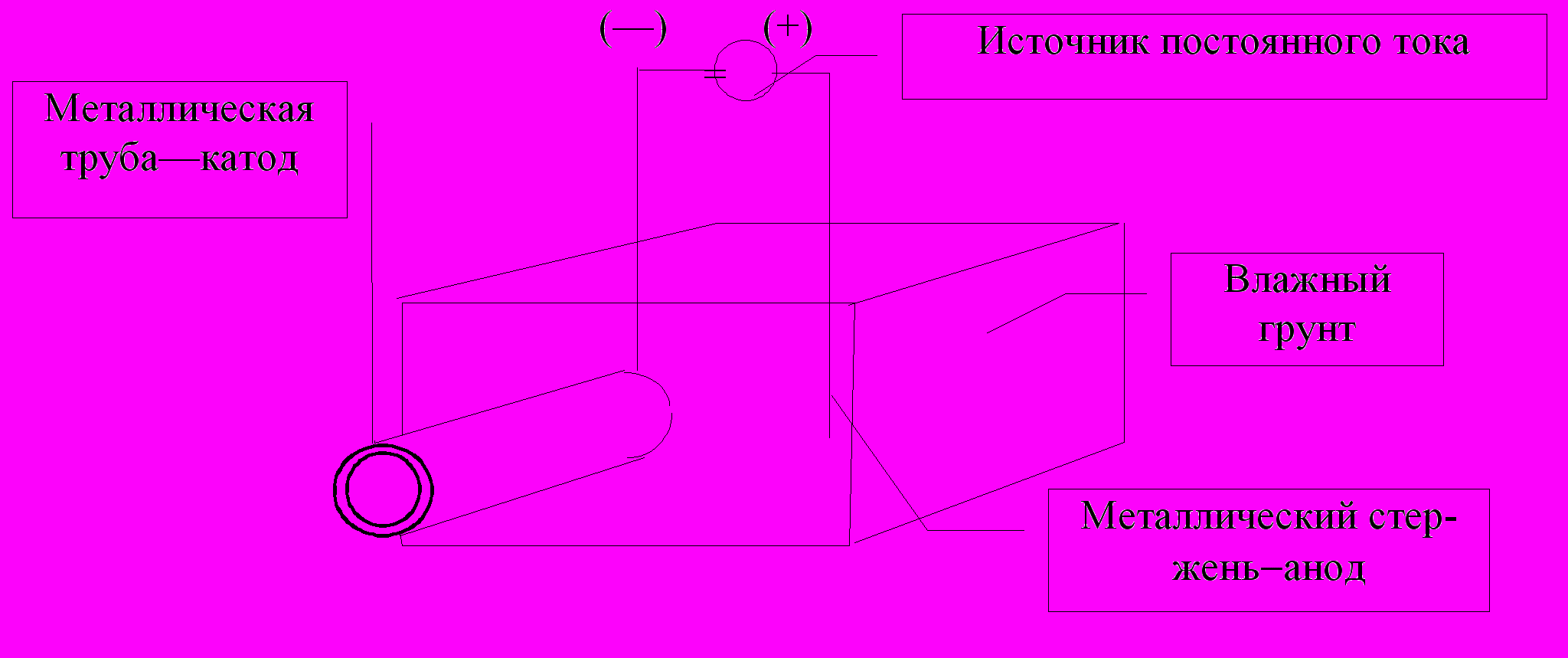
Рис. 58. Электрохимическая (катодная) защита с помощью внешнего источника постоянного тока
При протекторной защите (рис. 57) железная труба не подвергается коррозии, т.к. так как к ней подсоединен кусок более активного металла Mg. В результате окисления Мg железная труба заряжается отрицательно, и положительно заряженные ионы железа не в состоянии оторваться с поверхности металлической кристаллической решетки.
При катодной защите (рис. 58) железная труба подсоединяется к катоду источника постоянного тока, и положительно заряженные ионы железа не могут оторваться с поверхности отрицательно заряженной металлической кристаллической решетки.
Электрохимическую катодную защиту используют для предохранения корпуса автомобиля от коррозии (рис. 59). Отрицательно заряженный корпус автомобиля не подвергается коррозии в той степени, которая была бы возможна без катодной защиты.
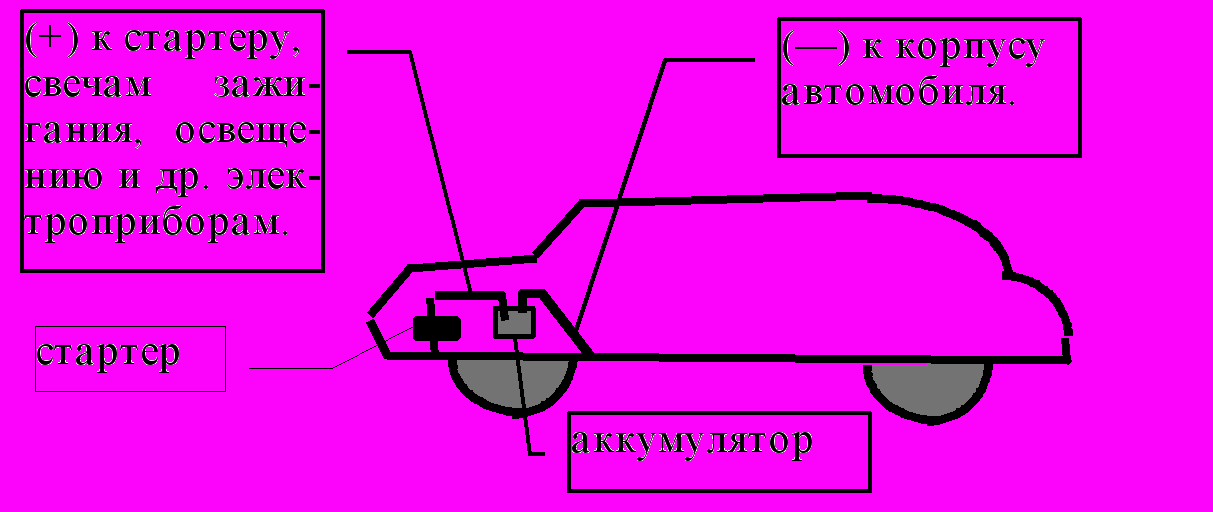
Рис. 59. Катодная защита железного корпуса автомобиля от коррозии
*Вопросы для проверки знаний
Какой процесс называется коррозией металла?
- В чем различие химической и электрохимической коррозии?
- В чем различие катодной и протекторной защиты металлов от коррозии?
*Упражнения
Автомобилист решил защитить автомобиль от коррозии и присоединил корпус к положительному полюсу аккумулятора. Докажите, что произойдет более интенсивная коррозия корпуса, чем в случае, если бы он вообще не подсоединял аккумулятор к корпусу.
- Докажите, что разность электродных потенциалов возникает даже в случае действия гальванического элемента, в котором оба электрода из одного и того же металла.
**5.8. Химический анализ
Кислотно-основное титрование
Метод количественного анализа, основанный на измерении объема раствора известной концентрации (стандартный раствор, титрант), расходуемого в реакции с заданным объемом раствора неизвестной концентрации (анализируемый раствор, проба) называется титриметрией. Для измерения объема берут мерную посуду (рис. 60).
Пипетки – это стеклянные трубки двух видов – с множеством делений и с одним делением (рис. 60 а, б). Они предназначены для отбора определенного объема раствора и переноса его из одного сосуда в другой. Раствор набирают в пипетку с помощью резиновой груши так, чтобы уровень жидкости был несколько выше деления в пипетке. Затем грушу осторожно отсоединяют от пипетки и быстро закрывают верхнее отверстие указательным пальцем. Сливают избыток раствора до деления и зажимают отверстие пальцем так, чтобы отмеренный объем можно было перенести без потерь в коническую колбу для титрования. Отпускают палец, и раствор вытекает в колбу по её внутренней стенке. То, что остается в носике пипетки и не вытекает, в колбу не выдувается, т. к. пипетка калибрована на заводе с учетом этого объема.
Бюретки (рис. 60 в) предназначены для титрования. Они имеют деления, расстояния между которыми обычно соответствуют объему 0,1мл жидкости. Нулевая точка шкалы находится в верхней части бюретки. Бюретку закрепляют вертикально в штативе и заполняют через воронку стандартным раствором (титрантом) чуть выше нулевой отметки. Открывают затвор (кран) и выпускают жидкость, пока нижний мениск раствора не коснется нулевой отметки.
Мерные колбы (рис. 45) отградуированы на заполнение. При заполнении до метки они содержат указанный объем жидкости (при указанной на колбе температуре). При их освобождении жидкость выливается не полностью, поэтому нельзя из мерной колбы на 100 мл отобрать четыре пробы по 25 мл. Мерные колбы служат для приготовления растворов точной концентрации.
Титрование. В коническую колбу помещают отмеренный объем анализируемого раствора и несколько капель индикатора. Медленно выпускают рабочий (стандартный) раствор из бюретки. Значение выливаемого объема считывают по положению нижнего мениска, угол зрения – горизонтальный. Титрование проводят со скоростью 1 мл за 6-8 секунд. Когда по окраске индикатора будет заметно приближение точки нейтральности, стандартный раствор приливают по каплям, всякий раз тщательно перемешивая содержимое колбы.
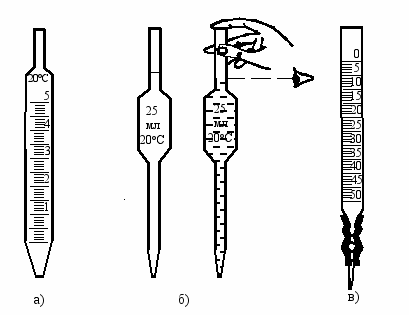
Рис. 60. Мерная посуда: а) пипетка с делениями; б) пипетки с одним делением; в) бюретка
Пример. На титрование 24 мл раствора NaOH расходуется 20 мл раствора HCl концентрации 0,12 моль/л. Вычислите молярную концентрацию раствора щелочи.
