Для подготовки к экзамену по общей химии (2 семестр) Кинетика
| Вид материала | Закон |
СодержаниеБуферные системы Коллоидная химия Растворы ВМС Пример экзаменационного билета Кафедра общей и биоорганической химии Экзаменационный билет № 2 |
- В. И. Ермолаева 1 семестр 2005/06 уч г. График лабораторных занятий по химии для всех, 82.76kb.
- Методические рекомендации к лабораторно-практическим занятиям по общей химии Федеральное, 1679.63kb.
- Тематический план лекций по общей химии для студентов 1 курса медико-профилактического, 169.84kb.
- Тематический план лекций по общей химии (осенний семестр), 28.8kb.
- Рабочая программа дисциплины «Физическая химия» Модуль «Химическая кинетика», 318.27kb.
- Элективные курсы предпрофильной подготовки /химия/ Химия и здоровье, 55.1kb.
- План лекций по аналитической химии на III семестр для студентов, 86.94kb.
- Методические материалы проф. Рыбальченко В. С. Для подготовки к интернет экзамену, 218.07kb.
- Медиапланирование как составляющая рекламной кампании Этапы медиапланирования, 25.75kb.
- Вопросы для подготовки к экзамену по курсу «Налоговое право», 22.63kb.
вопросы ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ПО ОБЩЕЙ ХИМИИ
(2 семестр)
Кинетика
- Скорость химической реакции. Факторы, влияющие на скорость химической реакции. Закон действующих масс Гульдберга и Вааге для равновесных гомогенных и гетерогенных систем. Константа скорости химической реакции, ее физический смысл. Факторы, влияющие на константу скорости реакции. Уравнение Аррениуса.
- Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия и ее физический смысл. Факторы, влияющие на константу равновесия. Связь константы равновесия с изменением стандартной свободной энергии Гиббса (DG°). Факторы, вызывающие смещение равновесия химических и биохимических реакций.
- Катализ и катализаторы. Энергетическая диаграмма химической реакции без катализатора и с введением катализатора. Энергия активации. Понятие об «активных» молекулах и «активированном комплексе». Понятие о биокатализаторах. Понятие об активном центре фермента. Адсорбционный и каталитический участки активного центра. Основные этапы ферментативного катализа. Уравнение Михаэлиса-Ментен. Константа Михаэлиса и ее физический смысл. Графическая зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента.
- Порядок и молекулярность химических реакций. Определение порядка ферментативной реакции при различных концентрациях субстрата при постоянной концентрации фермента.
Растворы
- Понятие раствора. Классификация растворов. Механизм растворения. Термодинамика процесса растворения. Изменение изобарно-изотермического потенциала (свободной энергии Гиббса) при образовании раствора.
- Растворимость газов в жидкостях. Закон Генри. Биологическое значение законов Генри, Дальтона, Сеченова. Связь равновесной концентрации угольной кислоты в плазме крови с парциальным давлением углекислого газа.
- Коллигативные свойства растворов. Закон Рауля и следствия из него. Фазовая диаграмма состояния воды. Следствия из закона Рауля.
- Диффузия и осмос. Влияние различных факторов на скорость диффузии и осмоса. Осмотическое давление. Закон Вант-Гоффа. Биологическое значение осмоса. Понятие гемолиза эритроцитов, плазмолиза и лизиса клеток. Определение молекулярной массы вещества по осмотическому давлению.
- Физико-химические свойства воды. Вывод ионного произведения воды. Значение ионного произведения воды при 25 °С. Логарифмическая форма ионного произведения воды. Водородный и гидроксильный показатели.
- Сильные и слабые электролиты. Константа и степень диссоциации, изотонический коэффициент. Факторы, влияющие на константу и степень диссоциации. Закон разбавления Оствальда, Расчёт рН растворов слабой кислоты и слабого основания, сильной кислоты и сильного основания.
Буферные системы
- Буферные растворы кислотного и оснвного типа. Механизм действия, расчет рН, способы получения.
- Буферная ёмкость. Понятие максимальной буферной ёмкости. Принцип выбора слабых кислот и оснований для приготовления буферных растворов, обладающих максимальной буферной ёмкостью при заданном рН.
- Бикарбонатная и фосфатная буферные системы организма. Механизм действия на примере бикарбонатной буферной системы. Соотношение концентраций компонентов этих систем при физиологическом значении рН.
- Аминокислотные и белковые буферные системы. Буферная емкость этих систем. Формы глицина в водном растворе при различных значениях рН. Зависимость электрофоретической подвижности белков от рН среды.
- Кооперативное действие гемоглобиновой, оксигемоглобиновой и бикарбонатной буферных систем.
Электрохимия
- Электропроводность жидких сред и тканей организма. Удельная и молярная (эквивалентная) электропроводности растворов, их взаимосвязь. Молярная (эквивалентная) электропроводность растворов при бесконечном разведении. Определение степени диссоциации слабого электролита по известным значениям удельной электропроводности и молярной (эквивалентной) электропроводности при бесконечном разведении.
- Законы Кольрауша. Расчет молярной (эквивалентной) электропроводности слабых электролитов при бесконечном разведении с использованием закона Кольрауша.
- Преимущества кондуктометрического метода определения концентраций веществ в растворе. Кондуктометрическое титрование щёлочью сильной кислоты и слабой кислоты.
- Окислительно-восстановительный потенциал. Уравнение Нернста. Металлический электрод, механизм возникновения равновесного потенциала. Уравнение Нернста для металлического электрода.
-
 Окислительно-восстановительный электрод. Механизм возникновения равновесного потенциала платинового электрода, погруженного в раствор, содержащий окисленную и восстановленную форму одного и того же вещества. Зависимость значения равновесного потенциала от различных факторов.
Окислительно-восстановительный электрод. Механизм возникновения равновесного потенциала платинового электрода, погруженного в раствор, содержащий окисленную и восстановленную форму одного и того же вещества. Зависимость значения равновесного потенциала от различных факторов.
- Уравнение Нернста для рН-зависимой окислительно-восстановительной биологической системы. Определение окислителя, восстановителя и направления протекания окислительно-восстановительных реакций биологических систем при помощи стандартных окислительно-восстановительных потенциалов.
- Окислительно-восстановительные реакции, протекающие в гальваническом элементе Даниеля-Якоби. Преобразование химической энергии в электрическую. Определение изменения изобарно-изотермического потенциала и константы равновесия для окислительно-восстановительных реакций, протекающих в гальванических элементах. Электродвижущая сила (ЭДС).
- Потенциометрический метод анализа. Электроды определения. Электроды, применяемые для определения концентрации ионов водорода в биологических жидкостях. Хингидронный электрод определения. Уравнение Нернста для хингидронного электрода. Схема гальванического элемента для определения рН раствора с помощью хингидронного электрода. Устройство стеклянного электрода определения и область его применения. Электроды сравнения. Уравнения Нернста для каломельного и хлорсеребряного электродов.
- Водородный электрод. Водородная шкала потенциалов. Уравнение Нернста для водородного электрода.
Коллоидная химия
1. Поверхностная энергия. Поверхностная активность и поверхностно-активные вещества (ПАВ). Моющее действие ПАВ. Ориентация молекул ПАВ на границе раздела фаз. Правило Дюкло-Траубе.
- Адсорбция и абсорбция, их роль в медицине и биологии. Термодинамические причины адсорбции. Физическая адсорбция и хемосорбция (привести примеры). Селективный характер адсорбции из растворов. Влияние природы адсорбента и адсорбтива на адсорбцию. Избирательный характер адсорбции и его проявление в организме. Правило Панета-Фаянса.
- Теория адсорбции Ленгмюра. Изотерма адсорбции Ленгмюра и её анализ.
- Теория адсорбции Гиббса. Область применения. Положительная и отрицательная адсорбция. Теория адсорбции Фрейндлиха.
- Основные принципы хроматографии. Ионообменная хроматография. Иониты, их применение для разделения белков. Бумажная хроматография.
- Классификация дисперсных систем. Агрегативная и седиментационная устойчивости дисперсных систем. Какие явления лежат в основе метода СОЭ (скорость оседания эритроцитов)?
- Способы получения золей. Электрокинетический потенциал и электрофорез. Строение мицеллы золя.
- Коагуляция гидрофобных золей и факторы на неё влияющие. Механизм процесса коагуляции гидрофобного золя. Порог коагуляции. Правило Шульце-Гарди.
- Классификация эмульсий. Правило выбора эмульгатора. Схема стабилизации эмульсии.
Растворы ВМС
- Сходство и различие свойств растворов высокомолекулярных соединений (ВМС) от свойств истинных растворов низкомолекулярных веществ и коллоидных растворов (золей). Специфические свойства растворов ВМС.
- Вязкость растворов высокомолекулярных соединений, причины аномально высокой вязкости растворов ВМС, способы выражения вязкости: относительная, удельная, приведенная, характеристическая вязкости. Графическое определение характеристической вязкости и расчёт средневязкостной молекулярной массы полимера по её значению. Уравнение Штаудингера.
- Понятие молекулярной массы полимеров. Полидисперсность полимеров. Различные значения средних молекулярных масс полимеров. Методы определения среднечисловой и среднемассовой молекулярной массы высокомолекулярных соединений (ВМС). Коэффициент полидисперсности.
- Термодинамическая устойчивость водных растворов полиамфолитов. Влияние рН среды, и присутствия электролита на процесс высаливания белков.
- Особенности процесса растворения высокомолекулярных соединений (ВМС). Ограниченное и неограниченное набухание. Механизм набухания. Зависимость степени набухания образца ВМС от различных факторов.
- Желатинирование (гелеобразование) растворов высокомолекулярных соединений. Влияние различных факторов на процесс желатинирования. Оптимальные условия для высокой скорости желатинирования. Механизм процесса гелеобразования в растворах высокомолекулярных соединений.
- Структура и физико-химические свойства эластичных гелей. Понятие синерезиса. Зависимость скорости синерезиса от различных факторов. Понятие тиксотропии.
Пример экзаменационного билета
| Государственное образовательное учреждение высшего профессионального образования «Санкт-Петербургский государственный медицинский университет имени академика И.П.Павлова министерства здравоохранения и социального развития» Кафедра общей и биоорганической химии | |
| Специальность «лечебное дело», код 060101 | Дисциплина «Общая химия» |
| Семестр 2 | |
| Экзаменационный билет № 2 | |
. | |
а) соляная кислота; б) раствор гидроксида калия? | |
| |
| 4. Механизм процесса гелеобразования в растворах высокомолекулярных соединений. Структура и физико-химические свойства эластичных гелей. Понятие синерезиса. Зависимость скорости синерезиса от различных факторов | |
| Утверждаю Зав. кафедрой _____________Г.С. Авхутская (подпись) «___» _______ 200__ года | |

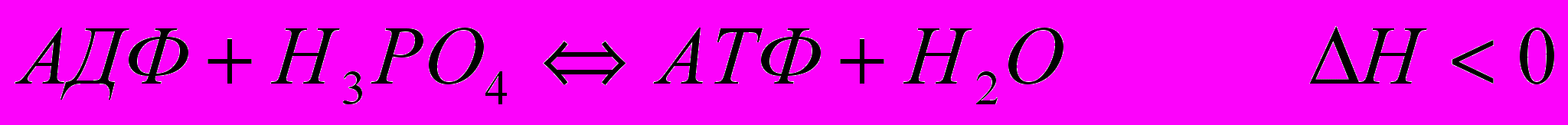 ?
?