Лекционный курс для учащихся дневного отделения Составила
| Вид материала | Документы |
- Лекционный курс для подготовки к экзамену по дисциплине: «аналитическая химия» для, 961.07kb.
- График чтения обзорных лекций по биологии (5 курс дневного отделения и 6 курс заочного, 40.54kb.
- Учебное пособие по курсу «управление банковским продуктом» Составитель: к э. н., доцент, 955.86kb.
- Для учащихся школ и студентов (дневного отделения), 74.7kb.
- Методические рекомендации для студентов дневного отделения Тамбов, 652.18kb.
- Общий курс (для студентов II курса дневного отделения исторического факультета мгу), 244.37kb.
- Факультативный курс для учащихся 3-4 классов. Составила, 243.19kb.
- Учебно-методическое пособие для студентов-бакалавров Iкурса дневного отделения и студентов-специалистов, 1806.19kb.
- Программа по дисциплине «Теория вероятностей и математическая статистика» для студентов, 206.05kb.
- Календарный план лекций для студентов дневного отделения 3 курса педиатрического факультета,, 77.36kb.

МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УПРАВЛЕНИЯ ОБРАЗОВАНИЯ ГОМЕЛЬСКОГО
ОБЛИСПОЛКОМА
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
ГОМЕЛЬСКИЙ ГОСУДАРСТВЕННЫЙ ПРОФЕССИОНАЛЬНО-ТЕХНИЧЕСКИЙ КОЛЛЕДЖ КУЛИНАРИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
ЛЕКЦИОННЫЙ КУРС
для учащихся дневного отделения
Составила
преподаватель химии Т.А.Суханькова
2 - 91 01 01 Производство продукции
и организация общественного
питания
Гомель, 2008г.
| СОДЕРЖАНИЕ | |
| СПИРТЫ | 3 |
| Предельные одноатомные спирты | 4-8 |
| Многоатомные спирты | 9-12 |
| | |
| КАРБОНОВЫЕ КИСЛОТЫ | 12 |
| Одноосновные карбоновые кислоты | 13-19 |
| Непредельные карбоновые кислоты | 19-21 |
| Ароматические карбоновые кислоты | 21-22 |
| Двухосновные карбоновые кислоты | 23-26 |
| | |
| УГЛЕВОДЫ | 26 |
| Моносахариды | 27-32 |
| Дисахариды | 32-35 |
| Полисахариды | 36-40 |
| | |
| ЖИРЫ | 40-49 |
| | |
| МЫЛА | 49-50 |
| | |
| БЕЛКИ | 51-63 |
| | |
| ФЕРМЕНТЫ | 63-67 |
| | |
| ВИТАМИНЫ | 68-71 |
| | |
| ОРГАНИЧЕСКИЕ ПИЩЕВЫЕ ДОБАВКИ | 71 |
| Консерванты в пищевой промышленности | 74-75 |
| Антиоксиданты | 75-76 |
| Пищевые красители | 76-84 |
| Органические заменители сахара | 84-86 |
| Пряности | 86-88 |
| Желирующие вещества | 88-89 |
| Эмульгаторы | 89 |
| Пенообразователи | 90 |
| Загустители | 90 |
| Стабилизаторы | 90 |
| Душистые вещества | 91 |
| Еда завтрашнего дня | 91-95 |

ОПОРНЫЙ КОНСПЕКТ
по теме: «СПИРТЫ»
Спирты - это производные углеводородов, содержащие в молекуле 1 или несколько гидроксильных групп –ОН у насыщенных атомов углерода.
Общая формула: R – (ОН)n
Классификация:
- По строению радикала:
- предельные спирты ( алканолы) – производные предельных углеводородов алканов
Например, СН3ОН- метанол
- непредельные спирты – производные непредельных углеводородов алкенов (алкенолы) и алкинов (алкинолы)
Например, СН2= СН – СН2ОН – аллиловый, пропен-2-ол-1
НС=С – СН2ОН – пропангиловый, пропин-2-ол-1
- ароматические – производные ароматических углеводородов Аренов
Например, бензиловый спирт
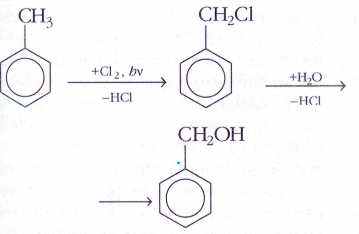
- По количеству групп –ОН:
1. Одноатомные (n=1)
Например, СН3 – СН2 – ОН - этиловый спирт, этанол
2. Двухатомные (n=2)

 Например, СН2 – СН2 – этиленгликоль, этандиол-1,2
Например, СН2 – СН2 – этиленгликоль, этандиол-1,2ОН ОН
3. Трёхатомные (n=3)


 Например, СН2 – СН – СН3 - глицерин, пропантриол-1,2,3
Например, СН2 – СН – СН3 - глицерин, пропантриол-1,2,3ОН ОН ОН
- Многоатомные (n>3)
Например, СН2ОН – (СНОН)4 – СН2ОН – сорбит
! АТОМНОСТЬ определяется количеством групп –ОН.
- По расположению –ОН групп у одноатомных спиртов:
1. первичный : СН3 – ( СН2)3 – ОН – бутанол-1
2
 . вторичный: СН3 – СН2 – СН – СН3 – бутанол-2
. вторичный: СН3 – СН2 – СН – СН3 – бутанол-2ОН
3. третичный: СН3

СН3 – С – СН3 – 2- метилпропанол-2

ОН
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ
- это производные предельных углеводородов - алканов, в которых 1 атом водорода (Н) замещен на гидроксильную группу –ОН.
Общая формула: СnН2n+1OH
Гомологический ряд:
| Формула | Номенклатура | ||
| Историческая | Заместительная (международная, ИЮПАК) | Радикально-функциональная (рациональная) | |
| СН3ОН | карбинол, древесный спирт | метанол | метиловый спирт |
| С2Н5ОН | винный спирт | этанол | этиловый спирт |
| С3Н7ОН | | пропанол | пропиловый спирт |
| С4Н9ОН | бутанол | бутиловый спирт | |
| С5Н11ОН | пентанол | пентиловый спирт | |
| С6Н13ОН | гексанол | гексиловый спирт | |
| С7Н15ОН | гептанол | гептиловый спирт | |
| С8Н17ОН | октанол | октиловый спирт | |
| С9Н19ОН | нонанол | нониловый спирт | |
| С10Н21ОН | деканол | дециловый спирт | |
Правила номенклатуры:
- Найти самую длинную цепь, содержащую – ОН группу
- Пронумеровать, начиная от атома углерода (С), к которому присоединена группа
– ОН
- Назвать алкан самой длинной цепи
- Обозначить группу – ОН окончанием ол
- Цифрой указать положение группы – ОН.
Виды изомерии:
Метанол и этанол изомеров не имеют
- Изомерия углеродного скелета:
Например, бутанол С4Н9ОН имеет 2 изомера:
1) СН3 – СН2 – СН2 – СН2ОН - бутанол-1
2) СН3 – СН – СН2ОН - 2- метилпропанол-1

СН3
- Изомерия положения группы - ОН:
Например, пропанол С3Н7 ОН имеет 2 изомера:
1) СН3 – СН2 – СН2ОН - пропанол-1
2) СН3 – СН – СН3 - пропанол-2

ОН
- Межклассовая изомерия :
Например, вещество составом С3Н8О имеет 2 изомера:
1) С3Н7ОН - пропанол
2) СН3 – О – С2Н5 – метилэтиловый эфир
Физические свойства:
- спирты с количеством атомов С1 – С11 - жидкости, а с С12 – твёрдые вещества;
- с повышением количества атомов углерода растворимость спиртов уменьшается;
- спирты легче воды;
- молекулы спиртов ассоциированы вследствие возникновения между ними водородных связей:
R R R - ассоциаты



О - Н … О – Н … О - Н
Поэтому спирты имеют высокие температуры кипения, хорошо растворимы в воде
СН3ОН- t кип =65°С
С2Н5ОН- t кип =78°С
Получение спиртов:
1. Гидролиз сложных эфиров:
t, H2SO4
СН3 – СОО – С2Н5 + Н2О → С2Н5ОН + СН3СООН
этилацетат эт спирт укс. к-та
2. Брожение :
f дрожжей
С6Н12О6 → 2 С2Н5ОН + 2СО2 ↑
глюкоза эт. спирт
3. Из галогенопроизводных:
t
С2Н5Сl + NаОН → С2Н5ОН + NaCl
хлорэтан
4. Гидратация алкенов:
Н3РО4, t=300°С
Н2С=СН2 + Н2О → С2Н5ОН
этен
5. Восстановление альдегидов:
Ni
СН3СОН + Н2 → С2Н5ОН
ацетальдегид
6. Промышленный способ получения спиртов:
250атм,300°С,каt (ZnO,CuO,Cr2O3)
СО + Н2 → СН3ОН
синтез газ метанол
Химические свойства:
Н

Н – С – Н – Оδ-… Нδ+

Н
Кислород более электроотрицателен, чем водород, поэтому электронная плотность смещается от водорода к кислороду О ← Н . На атоме кислорода накапливается частично отрицательный заряд, а на атоме водорода – положительный .
Т.к. спирты содержат группу ОН, то они должны проявлять основные свойства, а т.к. электронная плотность смещается от водорода к кислороду О ← Н – Н+ , то - кислотные

Реакции, доказывающие, что спирты могут реагировать как кислоты:
- Замещение на атом металла:
2С2Н5ОН + 2 Nа → 2 С2Н5ОNа + Н2 ↑ – качественная реакция
этилат натрия
Натрий реагирует с этиловым спиртом не так энергично, как с водой, поэтому спирт часто используют в лаборатории для уничтожения остатков натрия.
Соли спиртов называются алкоголятами.
- Замещение на радикал – дегидратация:
Н2SО4, t>140°С
С2Н5ОН + С2Н5ОН → С2Н5 – О - С2Н5 + Н2О
диэтиловый эфир
С2Н5ОН + Н2SО4 → С2Н4 + Н2О + Н2SО4
конц.
- Этерификация ( от лат ether- эфир )
t>140°С
С2Н5ОН + НОSО3Н ↔ Н3С – СН2 – О – SО3Н + Н2О
гидролиз этиловый эфир
сложных эфиров серной кислоты
Реакции, доказывающие, что спирты могут реагировать как основания:
- Замещение на атом галогена:
к-та, t
С2Н5ОН + НВr → C2Н5Вr + Н2О
бромэтан
- Отщепление группы ОН:
Н2SО4, t=170°С
С2Н5ОН → Н2С=СН2 + Н2О
Реакции, происходящие в радикале:
Вr
 к-та, t
к-та, t 1
 . 2 СН3 – СН2 – ОН + 3Вr2 → 2 Вr – С – СН2ОН + 3 НВr
. 2 СН3 – СН2 – ОН + 3Вr2 → 2 Вr – С – СН2ОН + 3 НВrВr
трибромэтан (нарколан)
2. Качественная реакция на метанол:
СН3 – СН2 – ОН + I2 → CH3COH + 2HI
йодная

настойка
CH3COH + 3I2 → CI3COH + 3HI
CI3COH + NaOH → CHI3 ↓+ HCOONa
водный йодоформ
раствор (осадок жёлтого цвета)
Окисление:
- первичных спиртов:
С2Н5ОН + [O] → СН3СОН + Н2О
ацетальдегид
- вторичных спиртов:
t
СН3 – СН – СН3 + [O] → СН3 – С – СН3 + Н2О



ОН О
ацетон
- третичных спиртов:
СН3
 t
t

 СН3 – С – ОН + [O] → СН3 – С – СН3 + НСООН + Н2О
СН3 – С – ОН + [O] → СН3 – С – СН3 + НСООН + Н2О
СН3 О
ацетон
Горение:
t
С2Н5ОН + 3О2 → 2СО2 ↑ + 3Н2О
Отдельные представители
МЕТАНОЛ
СН3ОН - бесцветная жидкость с характерным запахом, температура кипения 64,7 °С. Второе название – древесный спирт, т.к. получают перегонкой древесины. Яд! При попадании внутрь повреждают сетчатку глаза, вызывают гибель зрительного нерва и потерю зрения. Доза до 20 мл смертельна. Виной тому — ещё более ядовитый формальдегид СН2О, который образуется в организме при окислении метанола. Как ни странно, но при отравлении метанолом противоядием служит... этиловый спирт. Дело в том, что в организме различные спирты превращаются в альдегиды под действием одного и того же фермента — алкогольдегидрогеназы, отщепляющей от алкоголя водород. Это вещество используется в производстве ядохимикатов и лекарственных препаратов.
ЭТАНОЛ
С2Н5ОН – бесцветная жидкость с характерным запахом, температура кипения 73,8 °С. Второе название – винный спирт. Горюч. Смешивается с водой в любых соотношениях. «Чистый спирт» - 96 %-ный. Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом. Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий. Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название — алкоголь (араб. «ал-кугул»). Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким учёным Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Метиловый и этиловый спирты могут быть использованы для решения продовольственной проблемы, для приготовления на их основе пищевого продукта, получаемого при помощи одноклеточного белка. Использование метанола в качестве горючего и других производственных целей сопряжено с рядом трудностей, связанных с токсичностью и достаточно высокой летучестью этого вещества. Метанол- сильный яд нервной системы. Он обладает способностью накапливаться в организме. При попадании в организм в количестве 5-10мл (1-2 чайных ложки) метанол вызывает поражение зрительного нерва, приводящее к полной слепоте. Опасность метанола усиливается из-за его свойства с этанолом по внешнему виду и запаху. С2Н5ОН считается наименее токсичным из неразветв-ленных спиртов. Тем не менее С2Н5ОН уносит ежегодно более человеческих жизней, чем любое другое химическое вещество.
В последние десятилетия рост потребления спиртного и его последствия стали глобальной проблемой. Обострились и связанные с этим последствия, т. к. алкоголь не только является мощным криминогенным фактором, но и вызывает рост соматической, неврологических и психологических заболеваний, отрицательно влияет на потомство. Учеными установлено, что нормальный уровень содержания С2Н50Н в организме составляет всего лишь 0,018%. Он обусловлен естественными процессами бактериального брожения в кишечнике, т. е. спирт в организме- это один из отходов внутренних биохимических процессов, который организму приходится непрерывно утилизировать. Следовательно, потребляя алкогольные напитки, человек привносит в организм химическое вещество, которое является в нем лишним даже в самых малых количествах. Тем самым он перегружает системы организма, ответственные за выделения этого вещества, что сказывается на нервной системе и функционировании внутренних органов. При этом наибольшая нагрузка ложится на печень. У большинства пьющих и у всех хронических алкоголиков поражена печень. В ней разрушается 95% поступившего алкоголя. Воздействие алкоголя на клетки печени ведет к излишнему увеличению активности ферментов, что отрицательно сказывается на функционировании клеток. Следует заметить, что этиловый спирт распадается в организме до конечных продуктов СО2 и Н2О лишь в том случае, если количество его невелико (не более 20г. в сутки). Если эта доза превышается, то в организме накапливается избыток как самого этилового спирта, так и продуктов его распада. Это ведет к целому ряду побочных отрицательных эффектов, повышенному образованию жира и накопления его в клетках печени, накоплению перекисных соединений, способные разрушать клеточные мембраны, в результате чего содержимое клетки «вытекает» через образовавшиеся поры, и другим весьма нежелательным явлениям, вся совокупность которых приводит к разрушению печени- циррозу - гибель клеток печени, замену их клетками соединительной ткани. По мнению зарубежных исследователей, такой финал гарантируется человеку, употребляющему более 180 г алкоголя в сутки, а при дозе от 60 до 100 г опасность поражения печени считается достаточно высокой. Психическая и физическая зависимость от этанола сопровождается глубокой перестройкой обменных процессов развитием соматических и неврологических нарушений. Чувствительность человека к токсическому воздействию алкоголя тем выше, чем он моложе. Так, для детей смертельная доза алкоголя около З на 1кг массы тела, для подростков 4-5 г . Подсчитано, что систематическое употребление алкоголя сокращает жизнь на 10 лет, а хронические алкоголики живут в среднем на 10-15 лет меньше людей, не злоупотребляющих спиртными напитками. С точки зрения экологии человека, воздействие алкоголя необходимо рассматривать не только в связи с опасностью развития заболеваний печени и нервной системы. Систематическое употребление алкоголя является фактором, который при любых дозах потребления этого химического вещества будет сказываться на здоровьи популяции. Неумеренное потребление алкогольных напитков приводит к алкоголизму — физической и психологической зависимости человека от винного спирта. По своему химическому механизму алкоголизм представляет собой частный случай наркотической зависимости, т. е. нарушения тех или иных звеньев обмена веществ. В малых дозах винный спирт постоянно присутствует в организме, но в этом нет ничего страшного, потому что ферментативные системы поддерживают равновесие между этанолом и продуктом его окисления — сильным ядом ацетальдегидом СН3СНО, который обезвреживается печенью. А вот если алкоголя выпито много, в организме образуется избыток ацетальдегида, и печень трудится без устали до тех пор, пока в конце концов не восстанавливается равновесие. Но такая нагрузка на печень очень часто приводит к серьёзным заболеваниям.
МНОГОАТОМНЫЕ СПИРТЫ
- производные углеводородов, к молекулах которых 2 и более атомов водорода замещены на гидроксильные группы ОН.
Двухатомные спирты
- производные углеводородов, к молекулах которых 2 атома водорода замещены на гидроксильные группы ОН.
2-е название диолы.
