Лекционный курс для учащихся дневного отделения Составила
| Вид материала | Документы |
- Лекционный курс для подготовки к экзамену по дисциплине: «аналитическая химия» для, 961.07kb.
- График чтения обзорных лекций по биологии (5 курс дневного отделения и 6 курс заочного, 40.54kb.
- Учебное пособие по курсу «управление банковским продуктом» Составитель: к э. н., доцент, 955.86kb.
- Для учащихся школ и студентов (дневного отделения), 74.7kb.
- Методические рекомендации для студентов дневного отделения Тамбов, 652.18kb.
- Общий курс (для студентов II курса дневного отделения исторического факультета мгу), 244.37kb.
- Факультативный курс для учащихся 3-4 классов. Составила, 243.19kb.
- Учебно-методическое пособие для студентов-бакалавров Iкурса дневного отделения и студентов-специалистов, 1806.19kb.
- Программа по дисциплине «Теория вероятностей и математическая статистика» для студентов, 206.05kb.
- Календарный план лекций для студентов дневного отделения 3 курса педиатрического факультета,, 77.36kb.
СООН СН 3
циссизакратоновая
Н СН3



 С = С
С = ССООН Н
трансизократоновая
Физические свойства:
на примере акриловой кислоты: жидкость с резким запахом, неограниченно растворима в воде, температура кипения 141 °С, плотность 1,05 г/мл.
Способы получения:
- Окисление непредельных спиртов:
Схема реакции
Н2С=СН – СН2 – ОН + [O] → Н2С=СН – СОН + [O] → Н2С=СН – СООН
аллиловый спирт акриловая кислота
- Дегидратация оксикислот:
t
Н
 3С – СН – СН2 – СООН → Н3С – СН=СН – СООН + Н2О
3С – СН – СН2 – СООН → Н3С – СН=СН – СООН + Н2Ократоновая
ОН
3-оксибутановая кислота
Химические свойства:
Для непредельных карбоновых характерны реакции присоединения по месту кратной связи
- Гидрирование:
t, Ni, Pt
Н2С=СН – СООН + Н2 → Н3С – СН – СООН
акриловая пропановая
- Взаимодействие с галогенами:
Н

 2С=СН – СООН + Вr2 → Н2С – СН - СООН
2С=СН – СООН + Вr2 → Н2С – СН - СООНакриловая
Вr Вr
2,3 – дибромпропановая
3 . Взаимодействие с галогеноводородами
Происходит не по правилу Марковникова.
Формулировка правила: в реакциях алкенов с различными реагентами Н—X (где X — это Сl, Вr, ОН, OR) водород присоединяется к тому атому углерода при двойной связи, с которым связано больше атомов водорода. Однако при наличии в веществе электроноакцепторного заместителя (функциональной группы, оттягивающей на себя электронную плотность) более стабильным оказывается первичный карбокатион, и правило Марковникова не выполняется:

Владимир Васильевич Марковников.
Н2С=СН – СООН + НВr → H2C – CH2 - COOH
 акриловая
акриловаяBr
3- бромпропановая кислота
4. Окисление:
Н3С – СН=СН – СООН + [O] + Н2О → Н3С – СН – СН – СООН

 кратоновая
кратоноваяОН ОН
2,3 – диоксибутановая
t
Н3С – СН=СН – СООН + 4[O] → Н3С – СООН + НООС – СООН
уксусная кислота щавелевая кислота
5. Полимеризация:

 n Н2С= СН → ( - СН2 – СН - )n
n Н2С= СН → ( - СН2 – СН - )n СООН СООН
акриловая полиакриловая
6. Для непредельных карбоновых кислот характерны все реакции, протекающие в группе
-СООН.
АРОМАТИЧЕСКИЕ КАРБОНОВЫЕ КИСЛОТЫ
Простейшая ароматическая кислота- бензойная СООН - бесцветное кристаллическое вещество,
 мало растворимо в холодной и довольно легко в горячей воде, температура кипения 249 °С.
мало растворимо в холодной и довольно легко в горячей воде, температура кипения 249 °С.Способы получения:
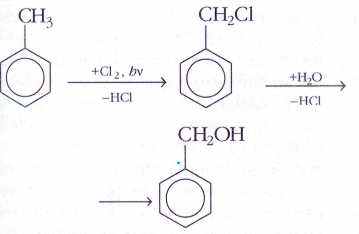
- Окисление толуола кислородом воздуха:
СН3 + О2 → СООН


- Гидролиз бензохлорида
С6Н5ССl + 3 NаОН → С6Н5СООН + NаСl + Н2О
Химические свойства:
- Взаимодействие с галогенами:
FeCl3
СООН + Вr 2 → COOH + HBr

 - Br
- Br 3-бромбензойная
кислота
- Взаимодействие с минеральными кислотами:
t, H2SO4
СООН + НNO3 → COOH + H2О

 - NO2
- NO2 3-нитробензойная
кислота
۩ Интересно знать
Впервые образование блестящих шелковистых кристаллов наблюдал при сухой перегонке смол алхимик Андреас Либавий. Оказалось, что это бензойная кислота C6H5COOH — вещество, в холодной воде плохо растворимое, а в горячей — хорошо. Сама кислота и её сложные эфиры входят в состав многих эфирных масел (например, гвоздичного) и бальзамов. Содержащие бензойную кислоту ягоды брусники и клюквы могут долго храниться, поскольку почти не подвержены гниению. Дело в том, что бензойная кислота убивает болезнетворные бактерии, вызывающие гниение. Благодаря этому свойству, а также нетоксичности бензойную кислоту и её соли (например, бензоат натрия) активно используют в качестве консерванта в пищевой промышленности — добавляют во фруктовые соки, соусы, джемы, безалкагольные напитки.

При охлаждении горячего раствора бензойная кислота выделяется в виде игольчатых кристаллов.
Бензойная кислота содержится в бензойной смоле, в эфирных маслах, особенно её много в клюкве и бруснике.

Как кислота, так и её соль – бензоат натрия является консервирующим вешеством, оказывает менее вредное действие на организм по сравнению с другими консервантами. Эти вещества оказывают сильное бактерицидное действие на дрожжи и другие виды микроорганизмов, подавляет жизнедеятельность бактерий масляного и уксуснокислого брожения, тем самым позволяет предотвратить микробиальную порчу продуктов питания в процессе их приготовления и хранения; увеличить срок хранения пищевых продуктов в несколько раз.
Применяются для консервирования маргарина, плодово-ягодных полуфабрикатов, повидла, мармелада, кондитерских изделий, напитков, рыбных пресервов. Бензоат натрия (Е 211) используется в виде водного раствора, который добавляют к продукту и хорошо перемешивают. Стадия внесения консерванта в продукт определяется технологией его производства.
Оксибензойная кислота- это салициловая кислота.
СООН + → СООН + СН3СООН
 -ОН
-ОН 
 - О – О – С – СН3
- О – О – С – СН3салициловая кислота ацетилсалициловая кислота
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ (ДИКАРБОНОВЫЕ)
- это производные предельных углеводородов - алканов, в которых 2 атом водорода (Н) замещены на карбоксильные группы –СООН.
Общая формула: СnН2n ( СОOH)2
В щавеле, а также в ревене, кислице, шпинате содержится щавелевая кислота НООС—СООН. Эта простейшая двухосновная кислота — продукт распада некоторых аминокислот, например глицина. При нарушениях обмена веществ (в частности, при недостатке витамина В12) в организме человека откладывается её малорастворимая кальциевая соль — оксалат кальция, это и есть так называемое оксалатное отложение солей.
Янтарная кислота НООС—СН2СН2—СООН впервые была выделена алхимиками. Ещё Агрикола наблюдал при прокаливании янтаря образование похожего на соль белого налёта янтарной кислоты (лат. sal succini volatile — «летучая янтарная соль»).
Получение:
[O]

 СН2 – СН2 → CООН
СН2 – СН2 → CООН
ОН ОН СООН
Щавелевая кислота под действием высоких температур разлагается на муравьиную кислоту и углекислый газ:
 СООН t
СООН t→ НСООН + СО2 ↑
СООН
Соли щавелевойкислоты называются оксалатами.
ОКСИКИСЛОТЫ - - это производные предельных углеводородов - алканов, в которых кроме карбоксильных групп –СООН содержатся 1 или несколько гидроксильных групп – ОН.
О
 бщая формула: R - ( СОOH)n
бщая формула: R - ( СОOH)n(OH)n
Представители:
Н3С – СН – СООН - молочная, 2-оксипропановая , α- оксипропионовая

ОН
 яблочная, 2-оксибутандиовая, α-оксибутандиовая кислота
яблочная, 2-оксибутандиовая, α-оксибутандиовая кислотаС
 ООН
ООНС
 Н – ОН - винная, 2,3 – диоксибутановая, α , β – диоксимасляная кмслота
Н – ОН - винная, 2,3 – диоксибутановая, α , β – диоксимасляная кмслотаС
 Н – ОН
Н – ОН СООН
ОН

Н
 ООС – СН2 – С – СН2 – СООН - лимонная, 3- оксипентантриовая кислота
ООС – СН2 – С – СН2 – СООН - лимонная, 3- оксипентантриовая кислотаСООН
Виды изомерии:
- изомерия углеродного скелета
- изомерия положения группы –ОН
- пространственная (оптическая) изомерия – характерна для ассиметрических кислот:
Простейшим примером может служить молекула молочной (2-гидроксипропановой) кислоты: СН3СН(ОН)СООН.

D+ молочная L - молочная
Оптические изомеры молочной кислоты.
D – от лат. dexter – «правый» L – от лат. laevus – «левый»
Многие соединения не содержат асимметрических атомов углерода, но обнаруживают тем не менее явление оптической изомерии. Условия для изомерии такого типа возникают в случае, когда вращение фрагментов молекулы относительно друг друга затруднено.
Изомеры молочной кислоты:
- не вращаются – молочные продукты, квашенная капуста
- правое вращение – в мышцах животных и человека
- левое вращение – при молочнокислом брожении сахаров
Рацематы – это изомеры, которые имеют компоненты вращения, но не вращаются, т.к. правостороннее и левостороннее вращение скомпенсированы.
Для оксикислот характерны все химические свойства присущие карбоновым кислотам и спиртам.
Специфические свойства оксикарбоновых кислот:
t, мин.к-та
1. Н3С – СН – СООН → СН3СОН + НСООН

ОН
2. Н3С – СН – СООН → СН2=СН – СООН + Н2О
 акриловая
акриловаяОН
3
 . НО- СН2 – СН2 – СН2 –СООН → СН2 – СН2 \
. НО- СН2 – СН2 – СН2 –СООН → СН2 – СН2 \О

 СН2 - С /
СН2 - С / О
циклический внутримолекулярный
сложный эфир ( лактон)
Отдельные представители:
Яблочная кислота- существует в виде 2 стереоизомеров и рацемата; бесцветные кристаллы, температура плавления D-изомера- 130,8°С, температура плавления L-изомера- 100°С.
Соли и эфиры яблочной кислоты называются малатами.
α-яблочная кислота содержится в кислых плодах ( незрелых яблоках, крыжовнике, плодах рябины, в виде кальциевой соли – в табаке).
Характерные химические свойства яблочной кислоты:
100 °С
1. → ангидрид
140-150 °С
2. → НООС – С – Н + Н2О


Н – С – СОН
фумаровая к-та
180 °С
3. → фумаровая к-та + малеиновый ангидрид

 (Н – С – СООН - малеиновая к-та)
(Н – С – СООН - малеиновая к-та) Н – С – СООН
Н2О2, КМnО4
4. → оксалилуксусная к-та
Н2SО4
5. → кумалиновая к-та
Применение:
- при производстве вин, фруктовых вод, кондитерских изделий как регулятор кислотности;
- в медицине: слабительное средство, от хрипоты;
- входит в состав косметических препаратов.
Винная кислота - в 1769 г. Шееле при действии серной кислотой на винный камень впервые получил винную кислоту НООС—СН(ОН)СН(ОН)—СООН. Впоследствии выяснилось, что винная кислота существует в виде трёх стереоизомеров. Два из них обладают одинаковыми физическими свойствами, а их молекулы представляют собой зеркальные отражения друг друга (оптические антиподы, или энантиомеры). Это так называемые D- и L-винные кислоты, а винный камень — соль D-формы.
Интересно, что энантиомерные винные кислоты образуют кристаллы, которые также являются зеркальными отражениями друг друга. Смесь равных количеств D- и L-винных кислот (рацемат) называется виноградной кислотой. А вот третья из винных кислот — мезовинная не относится к числу оптически активных веществ.
СООН СООН СООН



Н – С – ОН НО – С – Н Н – С – ОН



НО – С – Н Н – С – ОН Н – С – ОН



СООН СООН СООН
D-винная L-винная мезовинная
Эфиры и соли винной кислоты называются тартратами.
Применение:
- тартрат аммония- разрыхлитель теста, компонент паст для печатчния по шёлковым и шерстяным тканям;
- тартрат натрия- эмульгатор в сыроваренной промышленности, в производстве лекарственных средств;
- гидротартрат натрия – в производстве шипучих напитков
Гомологом щавелевой кислоты является адипиновая кислота НООС(СН2)4СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон .
Высшие кислоты, например стеариновая СН3(СН2)16СООН и пальмитиновая СН3(СН2)14СООН, впервые выделенная из пальмового масла, представляют собой бесцветные твёрдые вещества, не растворимые в воде. Долгое время основным их источником были природные жиры, например свиное сало или говяжий жир. Сейчас эти кислоты получают и синтетически — каталитическим окислением углеводородов нефти. Практическое значение имеют главным образом натриевые соли этих кислот — стеарат натрия C17H35COONa и пальмитат натрия C15H31COONa: они являются основными компонентами мыла.
۩ Интересно знать
Многие карбоновые кислоты — например, яблочная, винная, лимонная, хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы и в результате некоторых других биохимических процессов. Плоды цитрусовых богаты лимонной кислотой: в мякоти апельсина её около 2%, в грейпфруте — до 3%, а в лимоне — 6%. Поэтому неудивительно, что впервые она была выделена Шееле в 1784 г. именно из лимонов. Подобный эксперимент можно проделать и в школьной лаборатории: нужно лимонный сок обработать известью, а продукт этой реакции — кальциевую соль отфильтровать и разложить серной кислотой. Образующаяся в результате лимонная кислота переходит в раствор, который упаривают до начала кристаллизации.
ОПОРНЫЙ КОНСПЕКТ
по теме: «УГЛЕВОДЫ»
- это органические соединения, состав которых выражается формулой Сn(H2O)m (n и m ≥ 4) .
Исключение составляет рамноза – С6Н12О5 .
ИСТОРИЯ ОТКРЫТИЯ УГЛЕВОДОВ
Сахароза (тростниковый сахар) была хорошо известна на Древнем Востоке. Её выделяли из сока сахарного тростника, который сгущали и с помощью молока осветляли, а затем промывали известковой водой или раствором золы. Примеси отделялись вместе с образующейся пеной. Сахарный сироп заливали в формы, он медленно кристаллизовался в них, превращаясь в большие куски сахара — сахарные головы. Родиной сахарного тростника считается Индия (слово «сахар» тоже «родом» из Индии: «сакхара» на языке одного из древних народов полуострова означало сначала просто «песок», а затем — «сахарный песок»). Из Индии это растение было вывезено в Египет и Персию; оттуда через Венецию сахар поступал в европейские страны. Долгое время он стоил очень дорого и считался роскошью. Поисками более доступных природных источников сахара занимался немецкий химик Андреас Сигизмунд Маргграф. В трактате, изданном в 1747 г., он описал свои опыты по получению сахара из свёклы. К концу XVIII в. в Германии вывели сорт свёклы с повышенным содержанием сахара — сахарную свёклу. В 1796—1802 гг. ученик Маргграфа Франц Карл Ахард (1753—1821) разработал способ выделения сахара из свёклы, положивший начало производству сахара не из привозного тростника, а из местного сырья. Постепенно из дорогого лакомства сахар превратился в дешёвый и доступный каждому продукт питания.
Фруктоза была впервые выделена из «медовой воды» в 1792 г. русским химиком Товием Егоровичем Ловицем, а глюкоза открыта в 1802 г. Химия полисахаридов получила развитие после того, как в 1811 г. русский химик Константин Сигизмундович Кирхгоф впервые осуществил гидролиз крахмала.
Классификация:
все известные углеводы можно подразделить на 2 большие группы - простые и сложные.
1. Простые углеводы – моносахариды (монозы) – являются полигидроксикарбонильными соединениями, не способными при гидролизе образовывать более простые углеводные молекулы. Если моносахариды содержат альдегидную группу, то они относятся к классу альдоз (альдегидоспиртов), если кетонную – к классу кетоз (кетоноспирты). Взависимости от числа углеродных атомов в молекуле моносахаридов различают триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т.д.
Альдозы Кетозы
С





 Н2 – СН – СОН триозы СН2 – С – СН2
Н2 – СН – СОН триозы СН2 – С – СН2ОН ОН ОН О ОН
С







 Н2 – СН – СН – СОН тетрозы СН2 – СН – С – СН2
Н2 – СН – СН – СОН тетрозы СН2 – СН – С – СН2ОН ОН ОН ОН ОН О ОН
С









 Н2 – СН – СН – СН – СОН пентозы СН2 – СН – СН – С – СН2
Н2 – СН – СН – СН – СОН пентозы СН2 – СН – СН – С – СН2 ОН ОН ОН ОН ОН ОН ОН О ОН
С











 Н2 – СН – СН – СН – СН – СОН гексозы СН2 – СН – СН – СН – С – СН2
Н2 – СН – СН – СН – СН – СОН гексозы СН2 – СН – СН – СН – С – СН2ОН ОН ОН ОН ОН ОН ОН ОН ОН О ОН
Наиболее часто в природе встречаются пентозы и гексозы.
2. Сложные углеводы: в зависимости от степени полимеризации их подразделяют на низкомолекулярные – дисахариды, высокомолекулярные – полисахариды. Дисахариды по способности восстанавливать ионы металлов делят на восстанавливающие и невосстанавливающие. Полисахариды в зависимости от состава можно также разделить на 2 группы: гомополисахариды ( построены из моносахаридных остатков одного типа) и гетерополисахариды ( построены из остатков разных моносахаридов).
