Использование малоинвазивного электрохимического лизиса при доброкачественных узловых образованиях щитовидной железы (экспериментально-клиническое исследование) 14. 01. 17 хирургия
| Вид материала | Исследование |
- Хирургическая тактика при узловых образованиях щитовидной железы в условиях крупного, 472.21kb.
- Реферат встатье приводятся результаты клинико-экспериментального научного исследования, 262.05kb.
- Современные методы лечения узловых образований щитовидной железы, 110.17kb.
- Диагностика и выбор объема оперативного лечения при доброкачественных узловых образованиях, 133.84kb.
- Оценка параметров качества жизни больных, оперированных по поводу доброкачественных, 381.94kb.
- Применение композиционного материала «эластопоб»- ар при лечении грыж брюшной стенки, 330.27kb.
- Применение лазерной фотостимуляции в детской хирургии (экспериментально-клиническое, 554.39kb.
- Применение озонированного перфторана в комплексном лечении острых перитонитов и профилактике, 652.97kb.
- Комплексное лечение неязвенных гастродуоденальных кровотечений с использованием внутрипросветной, 591.74kb.
- Заболевания щитовидном железы, 94.48kb.
На правах рукописи
Попов Дмитрий Владимирович
Использование малоинвазивного электрохимического лизиса при доброкачественных узловых образованиях щитовидной железы
(экспериментально-клиническое исследование)
14.01.17 – хирургия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2010 г.
Работа выполнена в ФГУЗ «Клиническая больница №83 Федерального медико-биологического агентства России» (гл. врач – Засл. врач РФ, проф. О.П. Кузовлев) и на кафедре хирургии, анестезиологии и эндоскопии ФГОУ «Институт повышения квалификации Федерального медико-биологического агентства России» (зав. кафедры – Засл. врач РФ, проф. Н.П. Истомин)
^ Научный руководитель:
Доктор медицинских наук, профессор Иванов Юрий Викторович
Официальные оппоненты:
Доктор медицинских наук, профессор Ветшев Петр Сергеевич,
ФГУ «Национальный медико-хирургический Центр им. Н.И.Пирогова»
Доктор медицинских наук, профессор ^ Станулис Анатолий Иванович,
ГОУ ВПО «Московский государственный медико-стоматологический университет»
Ведущая организация: Главный военный клинический госпиталь имени академика Н.Н.Бурденко
Защита состоится « » декабря 2010 г. в « 14.00 » часов на заседании совета по защите докторских и кандидатских диссертаций Д 208.123.01 в ФГУ «Национальный медико-хирургический Центр им. Н.И.Пирогова» по адресу: 105203, Москва, ул. Нижняя Первомайская, д. 70.
С диссертацией можно ознакомиться в библиотеке Института усовершенствования врачей ФГУ «Национальный медико-хирургический Центр им. Н.И.Пирогова» по адресу: 105203, Москва, ул. Нижняя Первомайская, д. 65.
Автореферат разослан «___» __________ 2010 г.
Ученый секретарь совета по защите
докторских и кандидатских диссертаций
доктор медицинских наук, профессор Матвеев С.А.
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Среди современных медико-социальных проблем одной из самых актуальных остаются болезни щитовидной железы (ЩЖ). Наблюдаемый повсеместный рост числа больных с заболеваниями ЩЖ происходит преимущественно за счет узловых форм зоба, что приводит к дискуссии по методологии подхода к лечению очаговых доброкачественных поражений ЩЖ (Ветшев П.С. и соавт, 2002, Дедов И.И. и соавт., 2007).
Традиционно лечение доброкачественных узловых поражений ЩЖ в России делится на два подхода. Первый - консервативное лечение узловых форм поражения щитовидной железы (препаратом выбора является L – тироксин). Отрицательной стороной данного подхода является то, что пациенту необходимо пожизненно принимать препарат, при этом лечение не всегда хорошо переносится и удается лишь сдерживать рост узла, а регрессии размеров и полного излечения, как правило, не происходит (Борсуков А.В., 2001, Ворохобина Н.В. и соавт., 2002).
Вторым способом лечения доброкачественных поражений ЩЖ является хирургическое лечение. При этом объем операции, в зависимости от поражения, варьирует от резекции доли щитовидной железы, до тиреоидэктомии. К недостаткам хирургического лечения относят риск возникновения ряда осложнений, например, парез возвратного нерва (до 5%), односторонний паралич голосовых связок (до 4%) и двусторонний паралич (до 1%) (Евменова Т.Д., 1999, Заривгацкий М.Ф. и соавт., 1998, Рововой А.А. и соавт., 2003).
Ещё одним недостатком операции является удаление вместе с узлом здоровой ткани ЩЖ, что может вызвать гипотиреоз. Травма околощитовидных желез приводит к гипокальциемии.
В последнее время появились новые малоинвазивные методики лечения доброкачественных узловых образований ЩЖ: склеротерапия этанолом, криодеструкция, диатермокоагуляция и лазериндуцированная термотерапия, радиочастотная абляция узлов ЩЖ (Александров Ю.К. и соавт., 2005, Барсуков А.Н., 2003, Иванов Ю.В., 2002, Шулутко А.М. и соавт. 2002, Spiezia S., 2009).
Все вышеизложенное побудило нас к поиску нового способа (альтернативного хирургическому) для лечения доброкачественных поражений ЩЖ.
В своей работе мы применяли новую методику - электрохимический лизис (ЭХЛ) в лечении узловых образований ЩЖ. Принцип ЭХЛ основан на прямом воздействии постоянного тока на узел ЩЖ с возникновением асептического некроза (1 этап) и отсроченного химического воздействия на ткань продуктами электролиза в виде щелочи, кислоты и соединений платины (2 этап).
В имеющейся литературе мы встретили лишь единичные экспериментальные работы, посвященные выполнению ЭХЛ при доброкачественных узловых поражениях ЩЖ (Борсуков А.В. и соавт., 2008), что и явилось поводом для проведения настоящего исследования.
^ Цель работы: оценить эффективность малоинвазивного ЭХЛ в лечении доброкачественных узловых образований ЩЖ.
Задачи исследования:
1. Изучить результаты ЭХЛ при воздействии на здоровую ткань ЩЖ животных в различных режимах в условиях эксперимента.
2. Определить в эксперименте оптимальный режим ЭХЛ доброкачественных узловых образований ЩЖ.
3. Разработать показания к методике ЭХЛ у пациентов с узловыми доброкачественными формами поражения ЩЖ.
4. Установить достоверные клинико-инструментальные критерии эффективности использования ЭХЛ при лечении узловых форм поражения ЩЖ.
5. Оценить непосредственные и отдаленные результаты ЭХЛ у больных с доброкачественным узловым поражением ЩЖ.
^ Научная новизна исследования.
Впервые для лечения узловых доброкачественных образований ЩЖ применен метод ЭХЛ при помощи аппарата ECU – 300 фирмы Soering, Германия. Разработаны оптимальные режимы для лечения узловых поражений ЩЖ. Произведена комплексная оценка изменений тканей ЩЖ под воздействием ЭХЛ в различных режимах. Установлены достоверные клинико-инструментальные критерии эффективности использования ЭХЛ при лечении узловых форм поражения ЩЖ. Определены показания и противопоказания к методу.
^ Практическая ценность.
В ряде случаев, у лиц с высоким анестезиологическим риском операции, данная методика позволяет отказаться от традиционного хирургического лечения, а также даёт возможность проводить лечение пациентов с узловыми доброкачественными поражениями ЩЖ амбулаторно. Применение ЭХЛ позволяет получить отличный косметический эффект.
^ Основные положения, выносимые на защиту:
1. Электрохимический лизис является новым безопасным и высокоэффективным методом в эндокринной хирургии и в ряде случаев может быть альтернативой традиционному хирургическому лечению доброкачественных образований щитовидной железы.
2. С помощью аппарата электрохимического лизиса ЕCU-300 удается вызвать прямой некроз ткани узла диаметром до 2,5см, без температурных колебаний в зоне воздействия и с сохранением здоровой ткани щитовидной железы.
3. Электрохимический лизис доброкачественных узловых образований щитовидной железы может выполняться амбулаторно, обладает лучшим косметическим эффектом в сравнении с традиционной операцией, сопровождается меньшим количеством интраоперационных и послеоперационных осложнений.
^ Внедрение результатов исследования в практику.
Изложенные в диссертации теоретические положения и практические рекомендации используются в работе хирургического отделения ФГУЗ «Клиническая больница №83» ФМБА России. Диссертационный материал включен в лекционный курс (по эндокринной хирургии) для курсантов и клинических ординаторов кафедры хирургии, анестезиологии и эндоскопии Института повышения квалификации ФМБА России.
^ Апробация работы. Результаты исследования и основные положения диссертационной работы доложены и обсуждены на научно-практической конференции «Особенности ургентных состояний у геронтологических больных» (Москва-Одинцово, 2008), X научно-практической конференции врачей хирургов ФМБА России «Актуальные вопросы хирургии» (Северодвинск, 2010), ХХХII Итоговой конференции молодых ученых МГМСУ (Москва, 2010).
Апробация диссертации состоялась 01.10.2010 г. на межкафедральном заседании кафедр: хирургии, анестезиологии и эндоскопии; гинекологии и акушерства Института повышения квалификации Федерального медико-биологического агентства РФ; кафедры анестезиологии и реанимации Российской медицинской академии постдипломного образования.
Публикации.
По теме диссертации опубликовано 10 научных работ, из них 4 - в центральных медицинских журналах, рекомендованных ВАК РФ.
^ Структура и объем работы.
Диссертация изложена на 121 странице машинописного текста и включает в себя: введение, обзор литературы, 2 главы описания материалов и методов исследований, 2 главы результатов собственных исследований, обсуждение полученных результатов исследований, выводы, практические рекомендации и список литературы. Работа иллюстрирована 44 рисунками и документирована 9 таблицами. Библиографический указатель содержит 179 источников литературы (132 отечественных и 47 зарубежных).
^ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Экспериментальная часть работы выполнена на 30 животных (собаках) в виварии Государственного научного центра – Института медико-биологических проблем РАН и на 48 пациентах отделения хирургии ФГУЗ Клиническая больница №83 ФМБА России, которым во время традиционной операции проводился интраоперационный электрохимический лизис узлов щитовидной железы. В клиническом исследовании принимали участие 20 пациентов, у которых ЭХЛ являлся самостоятельным методом лечения и 60 больных, оперированных традиционным способом.
Для выполнения ЭХЛ был использован аппарат ECU-300 фирмы Soering, Германия, с платиновыми электродами диаметром G14-G18 и длиной от 60 до 140 мм (рис. 1).

Рисунок 1. Внешний вид аппарата ECU – 300 для ЭХЛ.
Для проведения УЗИ исследования применяли переносную систему Sonoscape SSI-1000 и стационарную систему Hitachi EUB-525. Оценку узловых образований ЩЖ проводили в режимах серошкального сканирования и допплеровского энергетического картирования до - и сразу же после проведения ЭХЛ.
Полученные гистологические препараты изучали на бинокулярном микроскопе «Биолам» при общем увеличении 300 (окуляр - 10, объектив – 20, собственное увеличение микроскопа – 1,5) и 600 (окуляр – 10, объектив – 40, общее увеличение микроскопа – 1,5). Микрофотосъемку проводили на цифровом фотоаппарате Canon Digital IXUS 700, 7.1 megapixels.
Для исследования так же применялся метод электронной микроскопии препаратов ЩЖ после проведения ЭХЛ1. Образцы исследовали и фотографировали в электронном микроскопе JEM 1200 EX II (Япония).
В процессе эксперимента были сформированы три группы животных по 10 собак в каждой различных пород в возрасте от 5 до 15 лет (табл. 1). Все животные перед началом эксперимента проходили общий клинический осмотр. В процессе эксперимента осуществляли динамический контроль за состоянием собак с помощью физикальных, лабораторных и инструментальных методов исследования по стандартным алгоритмам, принятым в ветеринарии. Обращение с животными (содержание, обезболивание, эвтаназия, утилизация останков) осуществлялись в соответствии с положениями руководства «International Guiding Principles for Biomedical Research Involving Animal».
Техника операции:
За 40 минут до операции проводили премедикацию. Поле операции подготавливали в области гортани и верхней трети трахеи. Лучшим оперативным доступом к ЩЖ у собак является передняя треть шеи на уровне 1 — 5 трахеальных колец. После обнажения трахеи легко находили красноватого цвета железистую ткань по бокам трахеи. Затем под визуальным или ультразвуковым контролем в ткань ЩЖ устанавливали стилет-катетеры на расстоянии друг от друга 5-8 мм, вдоль длинника железы на глубину 5-15 мм. После удаления иглы, в катетеры вводили платиновые электроды и начинали процесс ЭХЛ.
Таблица 1
Общая клиническая характеристика групп экспериментальных животных
| Время наблюдения | Возраст (лет) | Вес (кг) | Пол | Клиническое состояние животных до проведения ЭХЛ (Наблюдения в течение недели) |
| Группа 1 Сразу после ЭХЛ (n-10) | 6 – 15 (сред. возр. 8,2г.) | 8 – 24 (сред. вес 12,4кг) | 6 кобелей 4 суки | t- тела 38,6°, аппетит присутствует, нарушения функции органов нет. |
| Группа 2 отсроченные результаты 2 недели после ЭХЛ (n-10) | 9 – 14 (сред. возр. 10,1г.) | 13 – 19 (сред. вес 14,7кг) | 5 кобелей 5 сук | |
| Группа 3 Отдаленные результаты- 1,5 месяца после ЭХЛ (n-10) | 7 – 13 (сред. возр. 8,9г.) | 9 – 26 (сред. вес 15,6кг) | 6 кобелей 4 суки |
В зависимости от группы наблюдения животных, в требуемые сроки, под глубоким наркозом удаляли ЩЖ с зоной некроза после лизиса.
Интраоперационно оценивалась зона деструкции ЩЖ (визуально и под УЗИ контролем), в зависимости от режимов ЭХЛ. Главной задачей данного этапа было получение зоны некроза от 1,5 до 2,5 см, при определенной силе тока и экспозиции. Сила тока в эксперименте варьировала от 40мА до 50мА, а время воздействия - от 5 до 15 минут.
В послеоперационном периоде изучали результаты гистологической оценки процессов происходящих в железе экспериментальных животных через 2 недели и 1 месяц (2 и 3 группа) после проведения ЭХЛ. Так же оценивалось общее состояние собак на протяжении всего периода эксперимента.
Интраоперационный ЭХЛ, выполнен 48 пациентам, обратившимся в клинику с диагнозом - узловой коллоидный зоб (n=28) и многоузловой коллоидный зоб (n=20) для оперативного лечения. Все обратившиеся были женщинами в возрасте от 32 до 60 лет. Для создания максимальной реалистичности экспериментальных данных размеры узлов, на которых перед операцией был проведен ЭХЛ, варьировали от 1,5 до 4 см (медиана 2,02 см). Все пациентки перед операцией проходили стандартное обследование.
У исследованных пациенток выявлялось две формы образования: округлая – 14 (29,1%) и овоидная – 34 (70,9%). Во всех случаях структура узла была однородной, определялся ободок Hallo.
Больным перед операцией выполняли пункционную аспирационную биопсию с цитологическим исследованием – у всех выявлен узловой коллоидный зоб.
Ход операции. После выделения ЩЖ, под УЗИ контролем, устанавливали электроды в узловое образование и проводили его ЭХЛ. Процесс лизиса контролировали с использованием УЗИ аппарата в режиме серой шкалы и при допплеровском картировании.
ЭХЛ узлов проводили последовательно с силой тока 40, 50, 70 и 90 мА, время воздействия на ткань – 15, 20 и 30 мин для каждой указанной силы тока. В данной части эксперимента было использовано по 8 узловых образований ЩЖ на каждый заданный режим.
Электроды устанавливались в центр образования, строго параллельно друг к другу на расстоянии 0,5 - 0,7 см между собой.
При визуальном наблюдении за процессом лизиса четко выделялись взаимосвязанные процессы образования пенообразного субстрата и зон деструкции вокруг электродов, постепенно сливающихся в единый участок визуального некроза тканей.
Отсутствие кровотока в узле, подвергшегося ЭХЛ, являлось показанием для прекращения лизиса. После окончания лизиса электроды удалялись. Выполняли оперативное лечение в объеме от гемитиреоидэктомии до субтотальной резекции ЩЖ в зависимости от показаний.
Проводили морфологическое изучение степени полученного некроза на препаратах удаленной ЩЖ с оценкой эффективности каждого режима.
В клиническом исследовании приняли участие 20 пациентов с диагнозом узловой коллоидный зоб. Контрольную группу составили 60 больных, которые были оперированы по поводу узлового коллоидного зоба. Оценивали ближайшие и отдаленные результаты ЭХЛ, как самостоятельного метода лечения и в сравнении его с результатами, полученными у пациентов после хирургического лечения.
Данные распределения пациенток обеих групп по возрасту представлены в табл. 2.
Таблица 2
Распределение пациенток по возрасту
| Возрастные границы, годы | I группа | II группа | ||
| | Абс. | % | Абс. | % |
| 21-30 | 4 | 20 | 12 | 20 |
| 31-40 | 9 | 45 | 27 | 45 |
| 41-50 | 5 | 25 | 15 | 25 |
| 51-60 | 2 | 10 | 6 | 10 |
| Всего | 20 | 100 | 60 | 100 |
В нашей работе использовалась следующая методика лечения доброкачественных узловых образований ЩЖ методом ЭХЛ.
У всех пациенток перед выполнением ЭХЛ брали письменное согласие на проведение малоинвазивного вмешательства. При этом подробно объяснялись условия проведения исследования, возможные при этом осложнения и побочные эффекты. ЭХЛ выполняли в перевязочном кабинете с соблюдением всех мер асептики и антисептики.
Накануне выполнения ЭХЛ производили контрольное обследование, планирование доступа, объема и времени воздействия. В день малоинвазивного вмешательства выполняли повторное контрольное УЗИ ЩЖ и окончательную разметку.
Зону вмешательства обрабатывали антисептиком. ЭХЛ выполняли чрескожно, введение канюль и электродов осуществляли под местной инфильтрационной анестезией (0,25% раствором новокаина).
Электроды устанавливали под УЗ наведением в реальном масштабе времени и в заданном направлении, выполняли точное позиционирование электродов в узлах ЩЖ. Электроды вводились параллельно друг другу; полярность электродов можно было изменять в ходе процедуры, но при этом всегда использовали два электрода разной полярности. Как правило, электроды не располагали на расстоянии ближе 1,0 см от крупных сосудов и нервов. Положительный заряд подавали на электроды, расположенные ближе к периферии органа и около сосудов, так как образующийся вокруг них коагуляционный некроз препятствовал кровотечению из зоны лизиса.
При выборе параметров исходили из следующих соображений. Основным условием для эффективного проведения ЭХЛ было подаваемое на узел количество электричества. Показатели силы тока (60-80 мА) вызывали повышенное газообразование у электродов и болевые ощущения у пациенток. Поэтому процедуру начинали при силе тока 50-60 мА и экспозиции 5 мин - 1 этап. Воздействие постоянного тока небольшой величины приводило к постепенному уменьшению внутреннего сопротивления узла, что позволяло повышать силу тока и уменьшать напряжение по ходу процедуры. В дальнейшем лизис проводили при силе тока 70 мА, времени воздействия 15-20 минут (2 этап), так как в эксперименте нами было доказано, что эффективность ЭХЛ зависит от силы тока и экспозиции (чем они больше, тем лизис эффективнее).
Ход ЭХЛ контролировали, визуализируя на экране УЗ-прибора - эхопозитивное образование с допплерометрической оценкой сосудов узла (рис. 2).
Р
 исунок 2. Этапы выполнения ЭХЛ и УЗ контроль методики.
исунок 2. Этапы выполнения ЭХЛ и УЗ контроль методики.Сеанс ЭХЛ прекращали при достижении следующих условий:
- Появление в проекции очага эхопозитивного образования.
- Отсутствие в тканевом субстрате из зоны лизиса однородной округлой зоны.
- Отсутствие неизмененных жизнеспособных клеточных структур при срочном цитологическом исследовании вокруг очага.
- Исчезновение исходного кровотока в очаге и вокруг него.
После выполнения ЭХЛ доброкачественных узловых образований ЩЖ и извлечения электродов, через канюлю одного из электродов вводили тонкий трубчатый дренаж, для аспирации пузырьков газа скапливающихся в области проведения лизиса. Накладывали асептическую повязку. Фиксированный к коже лейкопластырем дренаж удаляли через 2 часа. В дальнейшем проводили исследование пациенток на амбулаторном этапе.
^ Результаты исследования и их обсуждение
Наблюдение за поведением и физиологическими показателями животных в ходе эксперимента позволило выявить следующие особенности.
На 1 – 3 сутки после ЭХЛ у всех собак отмечено незначительное повышение температуры тела до 39,5 – 40,5 оС. При этом у животных сохранялся аппетит, двигательная активность. В зоне операции мягкие ткани были слегка припухшими.
Через 1 неделю после ЭХЛ у всех собак температура тела была в пределах нормы, аппетит, поведение и другие физиологические показатели, двигательная активность не отличались от таковых до начала эксперимента. В эти сроки снимали швы с кожной раны.
Через 2 недели после ЭХЛ все физиологические показатели животных, соответствовали таковым первоначальным. Место операции было практически незаметно.
Через 1 месяц после ЭХЛ место операции у всех животных было незаметным. Каких либо изменений в поведении собак, их физиологических показателей по сравнению с таковыми до начала эксперимента не выявлено.
Таким образом, основные функциональные показатели животных имеют свои отличия только в течение недели после выполнения ЭХЛ, а затем они возвращаются к своему исходному уровню.
Определенный практический и научный интерес представляло изучение влияния ЭХЛ на выраженность степени патоморфоза.
В блоке экспериментов, где изменялась сила тока (I) при фиксированной экспозиции наблюдались следующие результаты. В группе послеоперационных препаратов коллоидных узлов ЩЖ увеличение силы тока от 40 мА до 90 мА во всех рассматриваемых вариантах сопровождалось значимым увеличением степени патоморфоза. Таким образом, при силе тока 90 мА независимо от времени воздействия в данной группе деструкция 4 степени наблюдалась в 92% наблюдениях, в 8% - 3 степень деструкции.
Обращает на себя внимание, что при сравнении групп с силой тока I 40 мА и I 90 мA, увеличение степени патоморфоза значимо отличалось (Х2р= 42.38) p < 0,05, при этом коэффициент корреляции Кэндала равен 0,92, что говорит о высокой значимости изменения степени патоморфоза от увеличения силы тока. При сравнении групп с силой тока I 70 мА и I 90 мА при фиксированной экспозиции 30 и 20 минут (Х2р= 6.78) и (Х2р= 7.41) соответственно p > 0,05, достоверной разницы не получено. Это дало нам возможность отказаться в клинических испытаниях от применения режимов с силой тока I 90 мА, так как при большей травматичности режима, достоверной разницы при воздействии на очаг размером до 2,5 см в сравнении с I 70 мА не получено.
В блоке сравнений, где фиксированной являлась сила тока, а изменялась экспозиция, так же получена достоверная разница между увеличением степени патоморфоза и увеличением времени экспозиции p < 0,05, при этом коэффициент Кэндала был равен 0,58, что характеризирует связь между изменением признака как заметную.
Таким образом, по данному разделу работы можно сделать вывод, что степень деструкции напрямую зависит от увеличения силы тока и времени экспозиции. Ведущим фактором увеличения степени некроза играет увеличения силы тока.
Результаты клинического исследования.
ЭХЛ проводили чрескожно, под ультразвуковым мониторированием, с выявлением специфического ультразвукового эффекта, в виде появления эхопозитивного образования вокруг электродов, сохраняющего стабильные размеры в течение 24 часов.
В процессе лизиса в канюле катетера появлялся пенообразный субстрат — это маркер эффективного течения электролиза тканей в зоне лизиса. Этот феномен сопровождается появлением выраженного цветового пятна с хаотичным движением эховключений в зоне лизиса при сканировании в энергетическом допплеровском режиме.
В
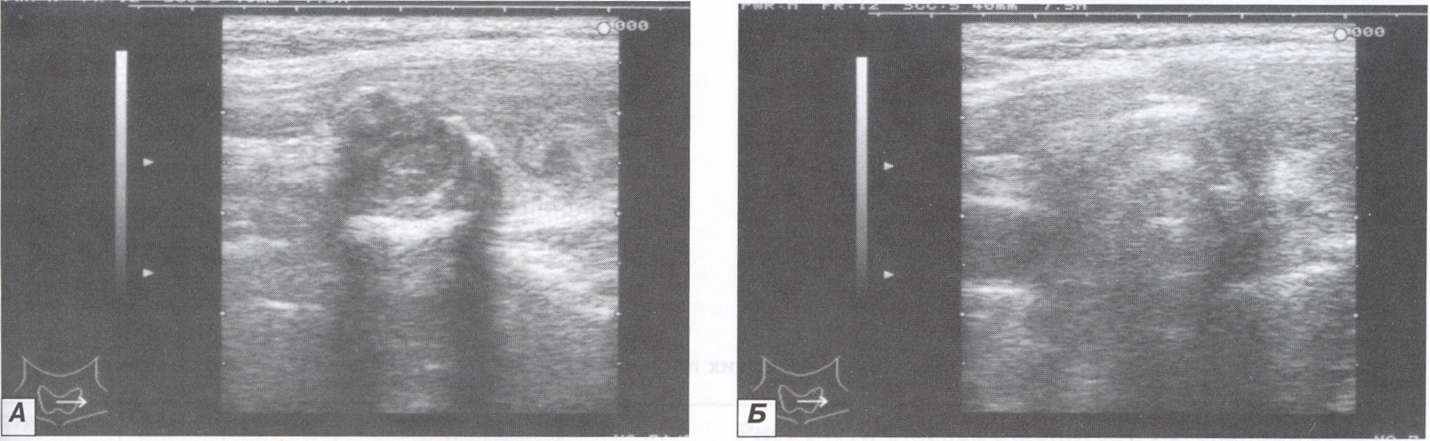 процессе лечения очаговых доброкачественных узловых образований ЩЖ ЭХЛ, ультразвуковая картина менялась. В месте расположения узла формировалась гиперэхогенная зона, вызванная образованием пузырьков газа в области лизиса (рис. 3).
процессе лечения очаговых доброкачественных узловых образований ЩЖ ЭХЛ, ультразвуковая картина менялась. В месте расположения узла формировалась гиперэхогенная зона, вызванная образованием пузырьков газа в области лизиса (рис. 3).Рисунок 3. А. Ультразвуковая томограмма коллоидного зоба в процессе лизиса; Б. Ультразвуковая томограмма коллоидного зоба в конце лизиса.
Оценку эффективности лизиса сначала проводили по стандартной методике, основанной на появлении на экране УЗ-прибора округлого эхопозитивного образования, которое к концу сеанса ЭХЛ должно захватить весь объем узла и не менее 5 мм вокруг него. При достижении УЗ-эффекта капсулы узла начинали постоянное допплеровское исследование артериального сосуда. Гемодинамика в сосуде под воздействием лизиса начинала изменяться. Ниже представлены изменения на спектральных допплерограммах до- и после проведения ЭХЛ (рис. 4).
Во время и после лизиса в месте воздействия определялась эхопозитивная зона, являющаяся маркером патоморфоза тканей 3—4 степени. Наличие данной зоны через 24 часа после ЭХЛ в проекции патологического очага и отсутствие там гемодинамики — высокоспецифичный маркер полной деструкции тканей после лизиса. Истинным размером деструкции в зоне лизиса является эхопозитивная аваскулярная зона через 24 часа после ЭХЛ. Участки очага с сохраненной васкуляризацией, выявленные через 24 часа после лизиса, требуют проведения повторного ЭХЛ в этом месте.
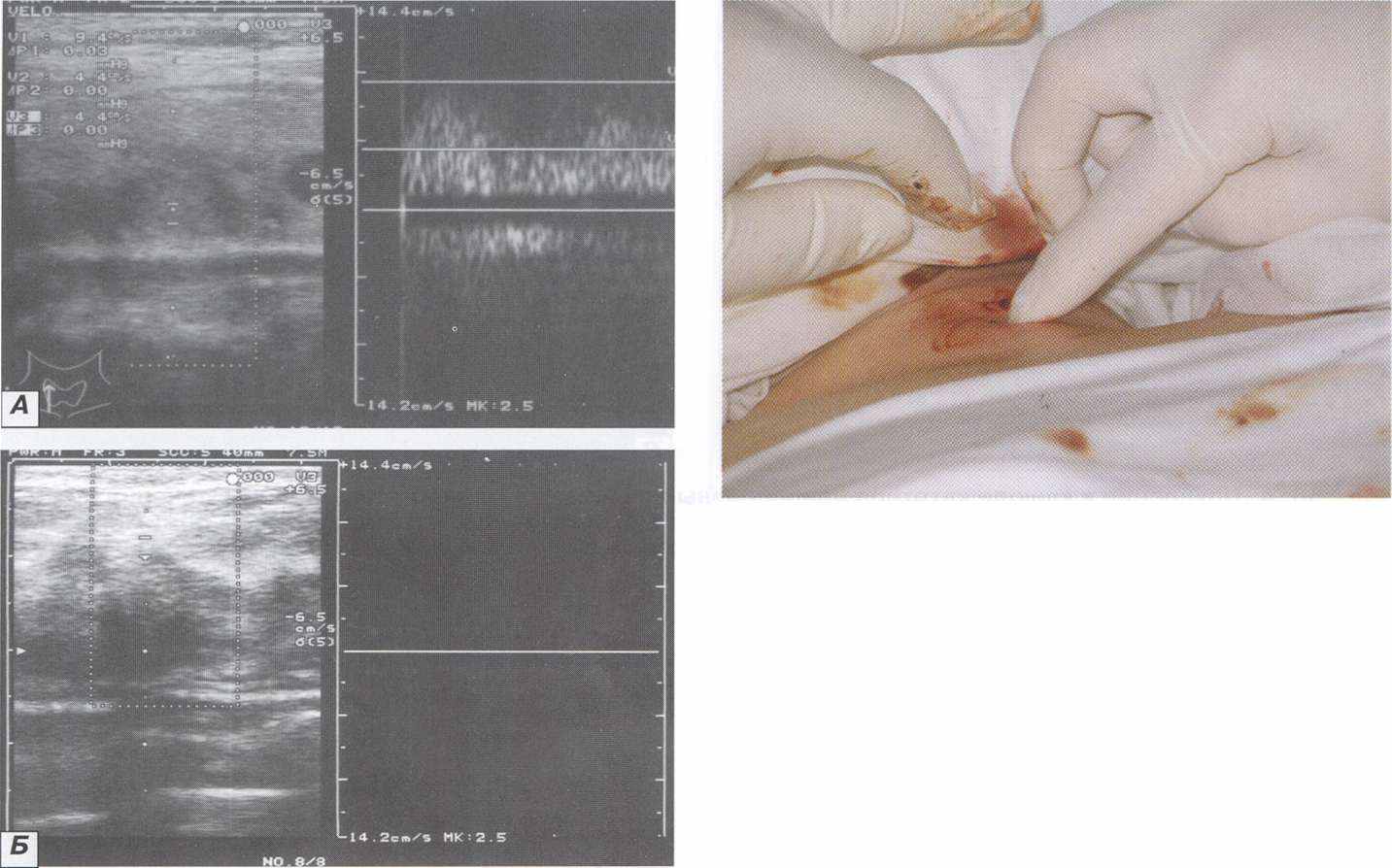

Рисунок. 4. А. Ультразвуковая допплерограмма коллоидного зоба больного до лизиса - определяется стенозированный низкоскоростной артериальный кровоток; Б. Ультразвуковая допплерограмма в зоне лизиса того же больного - отсутствие кровотока через 20 минут лизиса.
Данное условие было достигнуто у всех пациентов в ходе эксперимента, при использовании силы тока 70 мА, время воздействия на узел ЩЖ, зависело от достижения вышеуказанных критериев и составило от 18 до 32 минут (медиана 27 минут). Такая разница во времени, объясняется различными исходными размерами узлов ЩЖ, при узлах 1,5 см для достижения полной деструкции понадобилось от 18 до 20 минут, а при 2,5 см - от 30 до 32 минут.
При амбулаторном динамическом наблюдении за пациентами в течение года были получены следующие результаты (табл. 3).
Таблица 3
Изменения суммарного объема щитовидной железы и узловых образований после ЭХЛ
| ^ Клинический диагноз | До операции | После операции 1 мес. | После операции 3 мес. | ^ После операции 6 мес. | После операции 9 мес. | После операции 12 мес. |
| Узловой коллоидный эутиреоидный зоб (N = 20) | 24,8/5,8 | 20,6/2,6 | 18,4/2,2 | 17,6/2,1 | 17,6/2,1 | 17,4/2,1 |
При оценке абсолютных чисел мы получили в 18 (90%) случаях уменьшение узлов в объеме более чем на 50%, (максимально на 70%). В 2 случаях (10%) уменьшение размеров узла произошло на 44% и 30% соответственно. Ни в одном случае при наблюдении в течение года роста узлов не отмечено.
Изменения гормонального фона пациенток после проведения ЭХЛ представлено в табл. 4.
Таблица 4.
Оценка гормонального фона до и после лечения ЭХЛ узлового коллоидного эутиреоидного зоба
| Название гормона | ^ До операции | После операции 1 мес. | После операции 3 мес. | После операции 6 мес. | После операции 9 мес. |
| Св. Т4 | 16 | 14 | 12 | 17 | 12 |
| Св. Т3 | 3,8 | 3,2 | 3,4 | 3,7 | 3,6 |
| ТТГ | 2,5 | 3,1 | 3,2 | 2,8 | 3,0 |
| АТ к ТПО | 11 | 26 | 20 | 22 | 18 |
| ТГ | 32 | 63 | 54 | 46 | 42 |
Из табл. 4 следует, что после проведения ЭХЛ изменения уровня всех гормонов находились в пределах возрастных норм. Основными показателями, на которые обращали внимание, были изменения уровня гормонов Т4св., Т3св. и ТТГ. При этом клинически значимого изменения динамики данных гормонов не было.
В послеоперационном периоде проведено сравнение результатов ЭХЛ и традиционного хирургического лечения (табл. 5).
Изучение осложнений в раннем послеоперационном периоде в группе пациенток, которым проводилось хирургическое лечение, показали, что у 2 больных (3,3%) после операции возник гипопаратиреоз. У 7 (11,6%) пациенток выявлены признаки гипотиреоза. У 5 (8,3%) больных отмечено появление гематом на шее и у 3 (5%) пациенток после операции возник парез возвратного нерва. При проведении ЭХЛ в клиническом исследовании мы столкнулись лишь с 1 (5%) осложнением, связанным с кровотечением из подкожных вен – было остановлено давящей повязкой. Таким образом, выявлены достоверные различия между двумя исследуемыми группами по признаку «Осложнения» (р < 0,05).
Таблица 5
Сравнительная характеристика осложнений после ЭХЛ и традиционного оперативного вмешательства
| Методика проведения лечения | Осложнения | |||
| Парез возвратного нерва | Гипотиреоз | Гипопаратиреоз | Гематома | |
| ЭХЛ | - | - | - | 1 (5%) |
| Традиционное оперативное лечение | 3 (5%) | 7 (11,6%) | 2 (3,3%) | 5 (8,3) |
Косметический эффект оценивался пациентками по четырех бальной шкале. При удовлетворительном качестве показателей пациентка ставила «+» и «-» при неудовлетворительном результате. Критериями оценки служили: размер, форма, заметность и ощущение дискомфорта в области кожного рубца. Каждой из участниц исследования предлагали поставить «+» или «-» напротив каждого из критериев (табл. 6).
Таблица 6.
Сравнительная характеристика косметического эффекта после оперативного лечения и ЭХЛ
| Метод лечения узловых образований ЩЖ | ^ После операции 1 мес. | После операции 3 мес. | После операции 6 мес. | После операции 12 мес. | ||||
| «+» | «-» | «+» | «-» | «+» | «-» | «+» | «-» | |
| ЭХЛ | 72 | 8 | 75 | 5 | 80 | 0 | 80 | 0 |
| Хирургический | 68 | 172 | 84 | 156 | 107 | 133 | 146 | 94 |
Для комплексной оценки результатов лечения так же использовали такой критерий как длительность пребывания в стационаре (табл. 7).
Таблица 7
Сравнительная характеристика длительности пребывания в стационаре пациенток в группе с ЭХЛ и традиционным оперативным лечением узлового коллоидного зоба
| Метод лечения | Число наблюдений | Среднее | Стандартное отклонение |
| ЭХЛ | 20 | 1.1 | 0.4472 |
| Оперативное лечение | 60 | 3.133 | 0.4305 |
Из представленных данных видно, что наименьшая длительность пребывания в стационаре наблюдалась в группе, где ЭХЛ использовался в качестве самостоятельного метода лечения.
Таким образом, полученные при экспериментально-клиническом исследовании результаты свидетельствуют о том, что метод ЭХЛ при определенных условиях может быть альтернативной традиционной операции у пациентов с узловым коллоидным зобом.
ВЫВОДЫ:
1) Электрохимический лизис здоровой ткани ЩЖ в эксперименте вызывает прямой некроз ткани железы округлой формы, имеющий четкую границу с окружающими тканями, с последующим разрастанием зрелой соединительной ткани и формированием соединительнотканного рубца в очаге воздействия.
2) Наиболее оптимальный режим ЭХЛ доброкачественных образований ЩЖ находится в диапазоне 50-80 мА в течение 15-30 минут для получения полного некроза узла ЩЖ.
3) Использование ЭХЛ как альтернативы хирургическому лечению пациентов возможно при: солитарных узловых образованиях ЩЖ с четкой капсулой не более 2,5 см в диаметре, отсутствие подозрения на злокачественный процесс в узле, эутиреоидное состояние.
4) Достоверными клинико-инструментальными критериями эффективности ЭХЛ непосредственно при выполнении служат: появление на экране УЗ-прибора округлого эхопозитивного образования захватывающего весь объем узла и не меньше 3-5мм вокруг него, исчезновение кровотока по всему периметру узла; в отдаленном периоде уменьшение объема узла более чем на 50% от исходного через 3-6 месяцев, отсутствие рецидива заболевания.
5) При выполнении ЭХЛ возникло 1 осложнение – гематома мягких тканей в области пункции, не потребовавшей оперативного вмешательства. Во всех случаях получен отличный косметический результат. В течение 3 - 6 месяцев в 90% случаях произошло уменьшение объема узлов на 50 - 70% и в 10% случаях – на 30 – 44%. Рецидива заболевания через 1 год не отмечено.
^ ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
1. Для достижения оптимального эффекта электрохимического лизиса доброкачественных узловых образований ЩЖ необходимо: точное позиционирование электродов в узле с помощью УЗИ навигации, расположение анода на периферии, а катода в центре очага.
2. ЭХЛ доброкачественных узловых образований ЩЖ следует проводить при силе тока 70-80 мА и времени воздействия 15-30 минут.
3. ЭХЛ необходимо прекратить при появлении образования повышенной эхогенности, захватывающего весь очаг и 3-5 мм вокруг него и исчезновение кровотока в зоне лизиса по данным цветового допплеровского картирования.
4. Противопоказанием к проведению ЭХЛ являются: узловые образования менее 1см и более 2,5см, наличие при цитологическом исследовании клеточной атипии и полиморфизма клеточных структур, множественных узловых образований в ЩЖ.
^ СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Современные хирургические технологии в лечении дифференцированного рака щитовидной железы // Медицинский вестник МВД. – 2009. - № 2. – с. 14 – 22. (Иванов Ю.В., Соловьев Н.А., Попов Д.В.).
2. Особенности лечебно-диагностической тактики при заболеваниях щитовидной железы // Хирург. - 2010. - №3. – с. 14 - 21. (Иванов Ю.В., Истомин Н.П., Шабловский О.Р., Попов Д.В.).
3. Диагностика и особенности хирургического лечения загрудинных образований щитовидной железы // Хирург. - 2010. - №4. – с. 69 – 73. (Иванов Ю.В., Истомин Н.П., Злобин А.И., Попов Д.В., Соловьев Н.А.).
4. Профилактика интраоперационных осложнений при хирургическом лечении рецидивного диффузно-токсического зоба // Материалы ХХХII Итоговой конференции молодых ученых. – Москва, 2010. – с. 129 -131. (Злобин А.И., Попов Д.В., Соловьев Н.А.).
5. Применение в эксперименте методики электрохимического лизиса в хирургической эндокринологии // Материалы ХХХII Итоговой конференции молодых ученых. - Москва, 2010. – с. 325 - 326. (Попов Д.В., Злобин А.И., Соловьев Н.А.).
6. Новые технологии в диагностике и лечении узловых новообразований щитовидной железы // Материалы ХХХII Итоговой конференции молодых ученых. – Москва, 2010. – с. 380 - 382. (Соловьев Н.А., Попов Д.В., Злобин А.И.).
7. Улучшение качества обследования и лечения больных с узловыми новообразованиями щитовидной железы // Материалы ХХХII Итоговой конференции молодых ученых. – Москва, 2010. – с. 379 - 380. (Соловьев Н.А., Попов Д.В., Злобин А.И.).
8. Роль пункционной тонкоигольной аспирационной биопсии в диагностики узловых образований // Эндоскопическая хирургия. – 2010. - №3. - с. 25-34. (Иванов Ю.В., Панченков Д.Н., Соловьев Н.А., Нечаева О.Е., Юзепчук С.А., Абушенко М.И., Попов Д.В., Злобин А.И.).
9. Первые результаты в эксперименте применения методики электрохимического лизиса в хирургической эндокринологии // Вестник Национального Медико-хирургического Центра им. Н.И. Пирогова. – 2010. - Т. 5. - №2. - с. 18 – 23. (Иванов Ю.В., Попов Д.В., Соловьев Н.А., Злобин А.И.).
10. Особенности диагностики и хирургического лечения узловых новообразований щитовидной железы // Клиническая практика. –2010. - №2. – с. 69 – 77. (Иванов Ю.В., Соловьев Н.А., Союстова Е.Л., Казанцева Е.Э., Нечаева О.Е., Ситников А.В., Попов Д.В., Злобин А.И., Абушенко М.И.).
Список сокращений
АИТ – аутоиммунный тиреоидит
Ат к ТПО - антитела к тиреоидной пероксидазе
ДПС - длительность пребывания в стационаре
^ ПТАБ – пункционная тонкоигольная аспирационная биопсия
РФП - радиофарм препарат
РЧА - радиочастотная абляция
Т3св. – трийодтиронин свободный
Т4св. – тироксин свободный
ТТГ – тиреотропный гормон
УЗИ – ультразвуковое исследование
ЧСТЭ - чрескожная склерозирующая терапия этанолом
ЩЖ – щитовидная железа
ЭХЛ – электрохимический лизис
R-графия – рентгенография
1 Автор благодарит доктора биологических наук, профессора, ведущего научного специалиста отдела патологической анатомии РОНЦ им. Блохина РАМН Е.А. Смирнову за устные советы и методическую помощь.
