Клинико-нейрофизиологическая оценка эффективности комплексной терапии у больных с посттравматическими невропатиями. 14. 01. 11 нервные болезни
| Вид материала | Автореферат |
- «Оценка эффективности и безопасности структурно-резонансной терапии у больных варикозной, 174.61kb.
- Клинико-неврологические и нейропсихологические особенности ишемической болезни мозга, 367.52kb.
- Изучение влияния клинико-социальных факторов на психические расстройства у больных, 464.61kb.
- Автореферат диссертации на соискание ученой степени, 299.92kb.
- Клинико-энцефалографическое тестирование нейропротективных препаратов у больных с хронической, 250.91kb.
- Поленова Юлия Михайловна Динамика качества жизни взрослых больных эпилепсией на фоне, 292.59kb.
- Обоснование применения пармелии в комплексной терапии экземы (клинико-экспериментальное, 349.46kb.
- Дисметаболические полиневропатии: клинико-электронейромиографические критерии диагностики,, 534.59kb.
- Экспериментально клиническое обоснование комплексной терапии больных частичной атрофией, 673.15kb.
- «Санкт-Петербургский государственный медицинский университет имени акад. И. П. Павлова, 672.82kb.
На правах рукописи
Аванесова Оксана Витальевна
Клинико–нейрофизиологическая оценка эффективности комплексной терапии у больных с посттравматическими невропатиями.
14.01.11 – нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва-2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
^ Научный руководитель:
Доктор медицинских наук, доцент Катунина Елена Анатольевна
Официальные оппоненты:
Доктор медицинских наук, профессор Лобов Михаил Александрович
Доктор медицинских наук, профессор Румянцева Софья Алексеевна
^ Ведущее учреждение:
Ярославская Государственная Медицинская Академия Федерального агентства по здравоохранению и социальному развитию.
Защита состоится «24» января 2011 года в 14.00 часов на заседании диссертационного совета Д 208.072.09 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
Автореферат разослан «29» ноября 2010 года.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Л.В. Губский
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Поражение периферических нервов по данным ВОЗ составляют от 8 до 10% от общей заболеваемости и до 50% всех заболеваний нервной системы. Проблема заболеваний периферической нервной системы является одной из ведущих в неврологии (Ирецкая М.В., 1989; Попелянский Я.Ю., 1989; Ласков В.Б., 1990; Жулев Н.М., 1992; Акимов Г.А., 2000; Travell I.S., Simons D.G.,1992; Castorina S. et al, 2001). В неврологических стационарах количество больных с этими заболеваниями достигает 65-80%. Заболевание широко распространено среди лиц трудоспособного возраста. Так 76% случаев с временной утратой трудоспособности составляют заболевания периферической нервной системы (ПНС), что подтверждает социальную значимость данной проблемы (Антонов И.П.,1985; Берзиньш Ю.Э. и соавт.,1991; Лобзин В.С. и соавт.,1991).
Повреждения нервных стволов конечностей возникают вследствие техногенных и природных катастроф, огнестрельных, дорожно-транспортных, спортивных, производственных, бытовых ранений и травм. С течением времени нарастает частота ятрогенного травмирующего воздействия: компрессия нервов вследствие неправильного наложения кровоостанавливающего жгута, глухой гипсовой повязки, следствие грубых манипуляций при репозиции костных отломков или вправлении вывихов, при остеосинтезе и т.д. Значительная распространенность травм периферической нервной системы, длительные сроки стационарного лечения в медицинских учреждениях, частая инвалидизация больных определяют медико–социальную значимость проблемы травматических невропатий.
Применение адекватного лечебного воздействия в терапии посттравматических невропатий требует тщательного изучения клинико-патогенетических особенностей данного заболевания. В настоящее время недостаточно изучены структурно-функциональные изменения нервного волокна, возникающие в результате повреждения в ранние периоды заболевания. Практикующие врачи зачастую оценивают только клинические проявления посттравматических невропатий. Это не всегда позволяет провести раннюю диагностику заболевания, определить точную локализацию компрессии, что приводит к снижению эффективности проводимого лечения.
Вопросы лечения у пациентов с повреждением периферических нервов также представляют собой сложную задачу. Внутриканальные блокады не всегда приводят к ожидаемому результату и, кроме того, сопровождаются рядом осложнений (Берзиньш Ю.Э. и соавт.,1982). Хирургическое вмешательство сопровождается техническими трудностями, частыми осложнениями и, кроме того, восстановление нерва может быть неполным. Нередко остающийся в нерве шовный материал способствует разрастанию соединительной ткани и нарушению кровообращения, поэтому более предпочтительными методами лечения посттравматических невропатий, особенно на ранних этапах, остаются консервативные.
Вместе с тем, остается ряд вопросов, касающихся сроков начала и длительности консервативной терапии, возможности сочетания медикаментозных и немедикаментозных методов лечения, а также объективной оценки эффективности применяемой терапии.
^ Цель исследования: Изучить динамику клинико-нейрофизиологических изменений и эффективность комплексной терапии у больных с посттравматическими невропатиями.
^ Задачи исследования.
- Изучить клинико–нейрофизиологические особенности функционального состояния периферического нейромоторного аппарата при посттравматическом повреждении.
- Исследовать динамику нейрофизиологических изменений на фоне применения комплексной медикаментозной терапии.
- Оценить эффективность включения магнитотерапии в комплекс лечения больных с посттравматическими невропатиями.
- Определить показания к нейрохирургическому лечению у больных с посттравматическими невропатиями.
^ Научная новизна
Разработан и научно обоснован способ комплексного лечения больных с травматическим повреждением нервов, который приводит к более быстрому регрессу клинико-неврологической симптоматики.
Определена роль электрофизиологических исследований (электронейромиографии, электромиографии), для контроля за эффективностью лечения и определения показаний к нейрохирургическому лечению.
Выявлено преимущественное влияние магнитотерапии на выраженность болевого синдрома и вегетативно-трофических расстройств.
Показана необходимость раннего начала (до 3 месяцев) комплексной терапии, способствующей более полному восстановлению функций поврежденного нерва.
^ Практическая значимость
- На основании выполненной работы определены нейрофизиологические исследования для оценки динамики восстановления периферических нервов при травматическом повреждении.
- Предложен комплекс лечебных мероприятий, включающий медикаментозную терапию и магнитотерапию для лечения больных с травматическими невропатиями.
- Результаты проведенного исследования свидетельствуют о необходимости более раннего начала комплексной терапии с оценкой эффективности лечения методами электромиографии, электронейромиографии.
- Методы электромиографии, электронейромиографии должны обязательно быть включены в схему обследования больных с посттравматическими невропатиями, что необходимо учитывать при оснащении травматологических отделений.
- Отсутствие динамики нейрофизиологических показателей, после проведенного курса комплексной терапии, свидетельствует о неблагоприятном восстановительном прогнозе и необходимости решения вопроса о хирургическом лечении.
^ Положения, выносимые на защиту
- Наиболее ранними проявлениями компрессионных невропатий являются чувствительные расстройства в виде парестезий и онемения в зоне иннервации поврежденного нерва, а также изменение параметров проведения по сенсорным волокнам. Выраженные клинические проявления (болевой синдром, двигательные нарушения, атрофии) и нарушение проведения по двигательным волокнам периферических нервов отмечаются в более поздние сроки заболевания.
- Посттравматические невропатии сопровождаются изменением паттерна электромиографии в виде урежения и снижения амплитуды кривой, а также уменьшением амплитуды моторного и сенсорного ответов, снижением скорости проведения импульса (СПИ) по сенсорным и двигательным волокнам, увеличением латентного периода мышечного ответа, блоком проведения.
- Включение магнитотерапии в комплекс лечения больных с травмами периферических нервов приводит к ускорению темпов восстановительной динамики с преимущественным воздействием на чувствительные и вегетативные проявления.
^ Внедрение результатов исследования
Результаты исследования внедрены в практику работы травматологического отделения ГКБ №1 и ГКБ №4, используются в клинике нервных болезней Российского государственного медицинского университета при проведении лекций и практических занятий на циклах ФУВ.
^ Апробация диссертации
Материалы диссертации были представлены и рекомендованы к защите на совместной научно-практической конференции коллектива сотрудников кафедры неврологии и нейрохирургии с курсом ФУВ лечебного факультета ГОУ ВПО РГМУ и сотрудников отделений №12 и №13 ГКБ №1 от 25 июня 2010 года.
^ Публикации по теме диссертации:
По теме диссертации опубликовано 6 печатных работ, из них 2 статьи в рецензируемом журнале.
Объем и структура работы.
Диссертация изложена на 155 страницах машинописного текста и состоит из введения, обзора литературы, глав по материалам исследования, заключения, выводов, практических рекомендаций, библиографического указателя, включающего 115 отечественных и 72 иностранных источников. Диссертация иллюстрирована19 рисунками, содержит 40 таблиц.
^ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования и лечения
Обследовано 60 больных с различными вариантами травматических невропатий в возрасте от 20 до 69 лет (мужчин 22 человека, женщин 38 человек). Средний возраст больных составил 53,3±14,7 года. Все больные были разделены на 2 клинические группы. Первая группа (30 человек) – больные, которым проводилась только медикаментозная терапия. Вторая группа, состоящая из 30 человек – пациенты, которые наряду с медикаментозной терапией получали курс магнитотерапии. Группы были сопоставимы по тяжести двигательных нарушений, а также по полу и возрасту. В исследование вошли 10(16,6%) больных - с повреждением лучевого нерва, 14(23,3%) больных - с повреждением срединного нерва, 22(36,6%)больных - с невропатией локтевого нерва, 10(16,6%)больных - с невропатией малоберцового нерва, у 4(6,6%) пациентов отмечалась плечевая плексопатия.
Комплексное обследование больных с посттравматическими невропатиями включало в себя: исследование неврологического статуса с использованием провокационных тестов (тест Тинеля, пальцевого сдавления, эливационный, манжетный), шкал (шкала, оценивающая тяжесть невропатии в баллах (Dyck P.J.,1988), шкала, оценивающая симптомы невропатии (Dyck P.J.,1988) и визуальная аналоговая шкала боли (Карих Т. Д.,1990)). Для объективизации функционального состояния периферических нервов и контроля за эффективностью лечения использовались методы электромиографии (ЭМГ) и электронейромиографии (ЭНМГ). Нейромиографическое исследование у больных проводилось на электронейромиографе «Нейро-МВN» фирмы «Нейрософт» с компьютерной регистрацией и обработкой данных. Для электромиографии использовались накожные регистрирующие электроды, в виде диска, с межэлектродным расстоянием 20 мм. Активный электрод располагался в проекции двигательной точки мышцы, референтный – над сухожилием. Кольцевой заземляющий электрод располагался проксимальнее. Кожа пациента обрабатывалась спиртом. Для уменьшения подэлектродного сопротивления использовался специальный гель. Пациент находился в удобной позе. В помещении поддерживалась комфортная температура воздуха. Электромиограмма с мышц верхних и нижних конечностей записывалась в состоянии покоя, при тонических пробах (ближняя и отдаленная синергии) и при активном мышечном сокращении. Для анализа ЭМГ использовалась классификация Ю.С. Юсевич (1958), согласно которой выделяют 4 типа кривых: 1тип - интерференционная кривая, частотой 50 Гц, характерная для нормальной мышцы; 2тип – характеризуется урежением ритмической активности (менее 50 Гц); 3 тип – залпы ритмических осцилляций, встречается при поражении экстрапирамидной системы; 4 тип - отсутствие биоэлектрической активности, что наблюдается при периферических параличах, грубой атрофии мышцы различного генеза.
В комплекс электронейромиографического исследования входило: вычисление скорости проведения импульса по двигательным и сенсорным волокнам периферических нервов, вычисление амплитуды, латентности и длительности моторного и сенсорного ответов в мышцах верхних и нижних конечностей.

Рисунок 1. Схема наложения электродов при проведении стимуляционной ЭМГ
^ Методика лечения.
Первая группа больных (30 человек) - получала комплексную медикаментозную терапию с включением вазоактивных препаратов (сермион - 4 мг внутримышечно, 8 инъекций на курс, с последующим переходом на пероральный прием по 5мг × 3 раза в день в течение 1 месяца), ингибиторов антихолинэстеразы (нейромидин - 15 мг внутримышечно, 10 инъекций на курс, после назначался препарат внутрь, по 20мг×2 раза в день в течение 1 месяца) и витаминов группы В (мильгамма 2,0 мл (тиамин гидрохлорид 100 мг, пиридоксин гидрохлорид 100 мг, цианокобаламин гидрохлорид 1000 мкг) внутримышечно, 10 инъекций на курс, после назначался препарат в драже, по 100мг×3 раза в день, длительностью 4 недели). Вторая группа (30 человек) – пациенты, которым наряду с аналогичной медикаментозной терапией назначалась магнитотерапия с помощью аппарата «Магнитер АМТ-01». Воздействие магнитных полей осуществлялось на область поражения с помощью прямоугольного индуктора, который устанавливался без давления на кожу пациента, таким образом, чтобы направление регенерации нерва соответствовало направлению магнитных силовых линий. Индукция магнитного поля, воздействовавшего на нервный ствол, составляла 10-12 мТл, воздействие осуществлялось по 10 - 12 минут. Использовали непрерывный режим воздействия. Курс лечения состоял из 10 процедур, проводимых ежедневно.
При наличии выраженного болевого синдрома больным назначался финлепсин (200мг) или нейронтин (300мг) на длительный срок и применялись в индивидуально подобранной дозировке.
При наличии у больных отека поврежденной конечности мы использовали дегидратационные средства: верошпирон или триампур 1т × 2раза в день в течение 10 дней.
^ Результаты исследования и их обсуждение.
У больных с повреждением нервного ствола на основании проведенного исследования отмечались двигательные, чувствительные, а также вегетативно–трофические нарушения. В клинической картине компрессионных невропатий на ранних стадиях заболевания преобладали субъективные расстройства чувствительности в виде парестезий, чувства онемения в зоне иннервации поврежденного нерва - у 46 (76,6%) больных. В 53 наблюдениях (88,3%) имели место объективные нарушения болевой чувствительности по периферическому типу в виде гипестезии, у 5(8,3%) больных выявлялась гиперестезия. Вегетативно-трофические расстройства (в основном при поражении срединного нерва) в виде бледности или цианоза кожных покровов в дистальных отделах конечностей определялись у 6(10%) больных, а сухость и трофические нарушения со стороны кожных покровов – у 6(10%) больных в зоне иннервации поврежденного нерва. У всех больных на момент исследования были выявлены парезы мышц, иннервируемых поврежденным нервом, различной степени тяжести. У 15 (25%) больных было выявлено снижение мышечной силы до 4 баллов, у 16 (26,6%) – до 3 баллов, у 9 (15%) больных – до 2 баллов, у 20(33,3%) пациентов отмечались резко выраженные двигательные расстройства - до 0-1балла. Гипотрофия (в результате дегенерации мышечных волокон) выявлялась в 30% случаев (18 больных).
При применении провокационных тестов у больных - наиболее информативным оказался тест Тинеля, он выявлялся у 44(73,3%) больных. У 38(63,3%) больных выявлялся положительный тест пальцевого сдавления, у 18(30%) больных - положительный манжеточный тест, у 18(30%) больных - положительный элевационный тест.
У всех больных, вошедших в исследование, был выявлен болевой синдром, который оценивался по визуальной аналоговой шкале боли (Карих Т. Д.,1990). Наивысший суммарный балл, при оценке болевого синдрома по визуальной аналоговой шкале боли (ВАШБ) был выявлен у больных с невропатией срединного нерва - 5,7±1,0 балла. У больных с невропатией лучевого нерва он составил 2,7±2,0 балла; с невропатией локтевого нерва - 1,7±0,6 балла; с невропатией малоберцового нерва - 4,6±2,0 балла; с плечевой плексопатией – 2,0±0,7балла.
Оценивая степень поражения нерва по шкале функциональных неврологических нарушений (Dyck P.J.,1988), наибольший суммарный балл выявлен у больных с невропатией малоберцового нерва (13±2,9 балла), наименьший суммарный балл отмечался у больных с невропатией локтевого нерва (4,7±0,7 балла). Высчитывая суммарный балл у больных по шкале, оценивающей симптомы невропатии (Dyck P.J.,1988) – наибольшие проявления симптомов невропатии отмечались у больных с поражением срединного нерва – 6,8±0,5 баллов (таблица1).
Таблица 1.Распределение больных с травмами периферических нервов в зависимости от баллов по шкале функциональных неврологических нарушений (Dyck P.J.,1988) и шкале, оценивающей симптомы невропатии (Dyck P.J.,1988).
| Повреждение нерва | Суммарный балл по шкале функциональных неврологических нарушений,(Dyck P.J.,1988). | Суммарная оценка симптомов невропатии, (Dyck P.J.,1988). |
| локтевой | 4,7±0,7 | 4,6±0,2 |
| лучевой | 10,2±0,2 | 5,5±0,5 |
| срединный | 8,5±1,2 | 6,8±0,5 |
| малоберцовый | 13,0±2,9 | 5,45±0,2 |
Для оценки степени тяжести посттравматических невропатий у больных, мы использовали классификацию Жулева С.Н. (1996)
1 степень (легкая) – наличие парестезий, болевого синдрома, слабо выраженных вегетативных расстройств в зоне иннервации соответствующего нерва.
2 степень (средняя) – наличие парезов и гипотрофии мышц, иннервируемых соответствующим нервом, умеренно выраженных вегетативных расстройств, парестезии в зоне иннервации пораженного нерва, болевого синдрома.
3 степень (тяжелая) – наличие парезов и гипотрофии мышц, иннервируемых компремированным нервом, выраженных вегетативных расстройств, парестезии в зоне иннервации пораженного нерва, болевого синдрома.
Тяжелая степень поражения диагностировалась у 15(25%) больных; средняя степень тяжести у 27 (45%) больных; легкая степень была представлена у 18(30%) больных.
При проведении электромиографии у больных с повреждением нервного ствола было выявлено, значительное снижение электрогенеза соответствующих мышечных групп, в виде уменьшения амплитуды биопотенциалов по сравнению с нормальными величинами почти в два раза (в среднем на 569 мкВ), появления неритмичных потенциалов фасцикуляций. У 3 (5%) больных с невропатией лучевого нерва регистрировалось биолектрическое молчание, в 3 (5%) случаях ЭМГ 4 типа регистрировалась при плечевой плексопатии и в 2 (3%) случаях – при невропатии малоберцового нерва.
Анализируя параметры ЭНМГ исследования у больных с травмой периферических нервов наиболее ранним показателем компрессии нерва являлось снижение локальной скорости проведения по сенсорным волокнам на уровне компрессии. Скорость проведения по сенсорным волокнам, пораженным в результате компрессии была почти в два раза ниже нормы (24,9±4,7 м/с при средней норме 50 м/с) и варьировала в зависимости от тяжести поражения от 21,5м/с до 44,2м/с. В результате компрессии нерва происходило снижение амплитуды сенсорного ответа в среднем до 5,4 ± 2,4мВ (средняя норма 7 мВ).
На более поздних стадиях развития травматических невропатий выявлялось снижение локальной скорости проведения по двигательным волокнам, что свидетельствовало о более выраженном поражении периферического нерва в области компрессии. В среднем СПИ по двигательным волокнам на уровне компрессии, при травматических невропатиях в наших наблюдениях уменьшилась до 34,5±2,7 м/с (61,3% от нормального значения СПИ по двигательным волокнам). Измерение СПИ по сенсорным волокнам являлось более чувствительным и, соответственно, более информативным тестом по сравнению с измерением СПИ по моторным волокнам того же нерва. Кроме того, у больных в результате компрессии происходило снижение амплитуды моторного ответа в среднем до 1,64±0,6мВ (средняя норма 6 мВ). При этом показатели амплитуды М-ответа коррелировали с тяжестью клинической симптоматики.
Основным паттерном туннельной невропатии при проведении ЭНМГ исследования, у наблюдаемых нами больных, выступал блок проведения по поврежденному нерву (снижение амплитуды и увеличение его длительности при стимуляции выше зоны поражения) у больных. При наличии у больного блока проведения по данным ЭНМГ, амплитуда М-ответа при стимуляции проксимальней места компрессии периферического нерва снижалась в среднем на 39%. В среднем при блоке проведения амплитуда М-ответа выше места компрессии была 3,5±1,01мВ, ниже компрессии – 5,3±1,0мВ. Наличие блока проведения в сочетании с данными клинического обследования позволило достаточно точно выявлять локализацию компрессии нерва. Основываясь на этих данных, мы определяли место воздействия магнитных полей.
^ Результаты лечения.
С целью оценки эффективности проводимого лечения у пациентов в разных группах нами проведен анализ клинических и нейрофизиологических данных с выделением следующих групп:
- Значительное улучшение - полная или более чем 80% нормализация субъективных жалоб больных и объективного клинического осмотра, а также данных дополнительного обследования.
- Улучшение – уменьшение более чем на 50% нарушений со стороны субъективных жалоб, объективного и дополнительного обследования.
- Незначительное улучшение – практически основано на нормализации субъективных жалоб пациентов, без заметного улучшения объективных данных дополнительного обследования.
- Без улучшения – отсутствие положительных субъективных и объективных сдвигов.
В результате комплексного лечения с использованием магнитотерапии нами выявлено более выраженное положительное влияние на клинические проявления травматических невропатий, прежде всего, это касалось уменьшения выраженности болевых ощущений. Применения магнитотерапии привело к полному купированию болевого синдрома у 15 (50%) больных. В группе больных, получавших только медикаментозную терапию, подобный результат отмечался у 7 (23%) пациентов. Таким образом, субъективное ощущение боли к концу курса лечения было заметно выше у больных, получавших только медикаментозную терапию.
Под воздействием магнитотерапии отмечено положительное влияние на чувствительные расстройства, вегетативно-трофические и двигательные нарушения. У 23(76,6%) больных регрессировали парестезии в виде ощущения покалывания, «ползания мурашек», в зоне иннервации пораженного нерва, быстрее уменьшалась отечность ткани. У больных, которые получали только медикаментозную терапию, парестезии уменьшились у 9 (30%) больных. Явления гипестезии, гиперестезии исчезли у 15 (50%) больных, получавших дополнительно в лечении курс магнитотерапии и у 8 (26,6%) больных, в лечение которых не использовали магнитотерапию.
На фоне магнитотерапии у 16 (53,3%) больных отмечался более быстрый регресс двигательных нарушений, практически полный объем движений при активном сокращении мышц пострадавшей конечности был констатирован нами у 5 (16,6%) больных. В группе больных, получавших только медикаментозную терапию значительное улучшение двигательных функций выявлялось у 13 (43,3%) больных. Практически полный объем движений при активном сокращении мышц пострадавших конечностей был констатирован нами у 2 (6,6%) больных.
Нами отмечена четкая зависимость эффективности лечения в зависимости от стадии заболевания. Среди поступивших на лечение – 22 (36,6%) пациента находились в остром периоде заболевания (от начала заболевания до поступления на лечение прошло не более 30 дней). В сроки от 1 до3 месяцев от начала заболевания на лечение поступило 18 (30%) больных. У 20 (33,3%) больных наблюдалась хроническая стадия (от начала заболевания до поступления на лечения проходило свыше 3 месяцев). Эффективность лечения была выше у больных с ранним началом комбинированной терапии. У больных с длительностью травмы более 3 месяцев возможности восстановления были значительно ниже. Значительное улучшение наблюдалось у 16 (26,6%) пациентов с острой стадией заболевания, у 9 (15%) пациентов с подострой стадией и у 4 (6,6%) пациентов с хронической стадией заболевания.
В целом под влиянием лечения с применением магнитотерапии уменьшилось количество больных со средней степенью тяжести с 14 (46,6%) до 9 (30%), тяжелая степень поражения диагностировалась у 1 (3,3%) пациента, увеличилось количество больных с легкой степенью тяжести с 9 (30%) до 15 (50%). Полное выздоровление мы диагностировали у 5 (16,6%) пациентов. В группе больных, где в лечении магнитотерапия не применялась, количество пациентов со средней степенью тяжести уменьшилось крайне незначительно с 13 (43,3%) до 11(36,6%), тяжелая степень поражения диагностировалась у 3 (10%) больных, количество больных с легкой степенью тяжести возросло с 9 (30%) до 14 (46,6%). Полное выздоровление мы диагностировали у 2 (6,6 %) пациентов.
Положительная динамика клинических проявлений травматических невропатий в результате лечения совпадала с благоприятной динамикой нейрофизиологических данных. В группе больных, получавших комплексное лечение с применением магнитотерапии, регистрировалось значительное улучшение электронейромиографических, электромиографических показателей.
После проведенного курса лечения с использованием магнитотерапии на ЭМГ выявлялось увеличение амплитуды кривой максимального мышечного напряжения на стороне двигательных нарушений до 892,8±78,6мкВ. В то время как, амплитуда кривой максимального мышечного напряжения до лечения составила 401,9±62 мкВ. У 5(16,6%) больных к концу курса лечения с применением магнитотерапии амплитуда на стороне поражения была сопоставима с показателями на здоровой стороне, и составила 1201,4±78,2мкВ.
В группе больных, получавших только медикаментозную терапию, амплитуда кривой максимального мышечного напряжения до лечения составила 421±58,9 мкВ, после проведенной медикаментозной терапии амплитуда кривой максимального мышечного напряжения на стороне двигательных нарушений увеличилась до 716±62,4 мкВ. Во всех случаях повреждения периферических нервов прирост амплитуды кривой максимального мышечного напряжения за период лечения был статистически достоверным (р<0,001).
Таблица 2. Динамика ЭНМГ – показателей у больных с периферической нейропатией под влиянием лечения в обеих группах.
| Показатели ЭНМГ | Группа больных получавших медикаментозное лечение + магнитотерапию | Группа больных получавших только медикаментозное лечение | Р1 | Р2 | Р3 | ||
| До лечения | После лечения | До лечения | После лечения | ||||
| СПИ по двигательным волокнам, (м/с) | 34,5±2,7 | 54,8±2,8 | 31,7±2,6 | 45,7±2,3 | 0,05 | 0,05 | 0,05 |
| СПИ по сенсорным волокнам, (м/с) | 24,9±4,7 | 57,8±4,2 | 26,4±5,3 | 42,4±5,2 | 0,05 | 0,05 | 0,05 |
| Латентность моторного ответа, мс | 6,8±0,7 | 2,4±0,4 | 6,5±0,8 | 3,2±0,4 | 0,05 | 0,05 | 0,05 |
| Латентность сенсорного ответа, мс | 5,2±0,6 | 2,6±0,5 | 4,6±0,6 | 3,2±0,5 | 0,05 | 0,05 | 0,07 |
| Амплитуда моторного ответа, (мВ) | 1,64±0,6 | 3,95±0,6 | 1,65±0,7 | 2,7±0,5 | 0,05 | 0,05 | 0,05 |
| Амплитуда сенсорного ответа, (мВ) | 5,4±2,4 | 9,8±1,9 | 5,0±2,1 | 7,9±2,4 | 0,05 | 0,05 | 0,09 |
р1 - достоверность различий показателей до и после лечения в группе больных, получавших дополнительно магнитотерапию;
р2 - достоверность различий показателей до и после лечения в группе больных, получавших только медикаментозную терапию;
р3- достоверность различий показателей между группой больных, получавших медикаментозное лечение и группой больных, получавших дополнительно магнитотерапию.
По данным ЭНМГ – исследования, в группе больных, получавших помимо комплексного лечения курс магнитотерапии, СПИ по двигательным волокнам увеличилась в среднем на 20,6±2,7 м/с (54%), СПИ по сенсорным волокнам в среднем на 28,5±4,3 м/с (71%). В то время как в группе больных, получавших только медикаментозную терапию, СПИ по двигательным волокнам увеличилась лишь на 13,9±2,6м/с (41%), СПИ по сенсорным волокнам на 16,02±5,09м/с (58%) .
В результате комплексного лечения больных, которое включало магнитотерапию, амплитуда моторного ответа возросла с 1,64±0,7 мВ до 3,94±0,9 мВ, амплитуда сенсорного ответа с 5,4±2,4мВ до 9,8±1,9мВ; у группы больных, получавших только медикаментозное лечение, амплитуда моторного ответа возросла с 1,65±0,7 мВ до 2,7±0,9 мВ, амплитуда сенсорного ответа с 5,0±2,1мВ до 7,9±2,4мВ.
При оценке амплитуды М-ответа у пациентов с блоком проведения по компримированному нерву более выраженные сдвиги произошли также в группе больных, получавших в лечении дополнительно магнитотерапию, где соотношение амплитуды М-ответа выше зоны поражения к амплитуде М-ответа ниже зоны компрессии увеличилось с 1,85±0,6мВ до 1,0±0,6мВ. В группе без использования магнитотерапии это соотношение изменилось не столь существенно с 1,48±0,5мВ до 1,08±0,5мВ.
В целом, суммарная оценка эффективности лечения показала, что в группе больных, получавших в комплексном лечении дополнительно магнитотерапию, выраженное улучшение отмечалось у 16 (53,3%) больных. В группе, где мы не использовали дополнительно в лечении магнитотерапию, выраженное улучшение было отмечено лишь у 13 (43,3%) больных. Отсутствие положительной динамики отмечалось у 1 (3,3%) больного, получавшего дополнительно в комплексном лечении курс магнитотерапии и у 8 (26,6%) больных, получавших только медикаментозную терапию.
Рисунок 2. Сравнительная эффективность лечения у группы больных, где применяли в комплексном лечении дополнительно магнитотерапию с группой больных, без использования магнитотерапии.
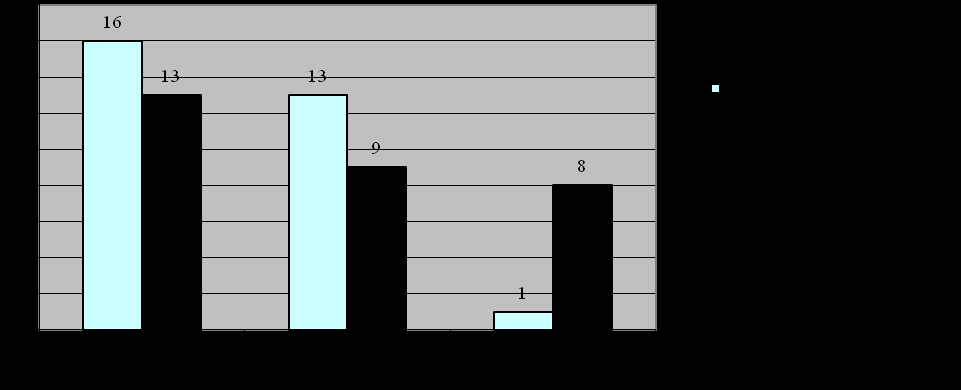
Таким образом, назначение магнитотерапии в комплексном лечении травматических невропатий более значительно улучшает клиническое течение заболевания по сравнению с группой больных, получавших одно медикаментозное лечение. Включение магнитотерапии в комплекс лечения приводит к более быстрому и полному купированию болевого синдрома или уменьшению его интенсивности, к более быстрому и полному исчезновению гипестезии, редукции вегетативно–трофических расстройств, а также к более быстрому восстановлению двигательных функций, что подтверждается нейрофизиологическими методами.
У 9 (15%) из 60 больных, с травмами периферических нервов, после проводимого консервативного лечения улучшения не отмечалось. Мы повторно этим больным провели курс комплексного лечения с применением магнитотерапии. После 1 курса лечения оценка силы паретичных мышц в среднем составляла 3,8 балла; после завершения 2 курса терапии этот показатель составил 3,91 балла (р>0,05). Также не было достигнуто улучшения в сенсорной и вегетативной сферах. Отсутствовала динамика болевого синдрома. Оценка боли по ВАШБ после 1 курса лечения составила 4,3 балла, после завершения 2 курса лечения - 4,02 балла, что является статистически не достоверным (р>0,05).
Отсутствие динамики клинических проявлений у больных после проведенных курсов лечения находилось в прямой корреляции с нейрофизиологическими параметрами. При проведении ЭМГ исследования у больных после первого курса лечения амплитуда биопотенциалов мышц составила 683,5±38,5мкВ, после второго курса комплексного лечения с применением магнитотерапии амплитуда биопотенциалов мышц составила 684,7±38,5мкВ, что являлось статистически не достоверным (р>0,05).
СПИ по двигательным волокнам после первого курса лечения была 41,8±2,9 м/с, после проведенного второго курса лечения с применением магнитотерапии СПИ по двигательным волокнам была 41,9±2,9м/с, что являлось статистически не достоверным (р>0,05). После проведенного повторного курса комплексного лечения с применением магнитотерапии не наблюдалось прироста амплитуды моторного ответа.
Таким образом, результаты наблюдения показали отсутствие динамики клинических и нейрофизиологических показателей за период (1 и 2 курс) проведенного лечения, что свидетельствовало о нецелесообразности проведения дальнейшей консервативной терапии и необходимости нейрохирургического вмешательства.
Результат нашего исследования показал необходимость ранних сроков начала лечения с применением методов медикаментозного и немедикаментозного лечения и нецелесообразность последующих повторных курсов при отсутствии динамики клинической картины и нейрофизиологических показателей к моменту завершения 2 курса медикаментозной терапии.
^ ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ.
- В комплекс лечения больных с посттравматическими невропатиями наряду с медикаментозным лечением необходимо включать магнитотерапию, что обеспечивает более быстрое и полное клиническое восстановление.
- Назначение магнитотерапии показано, прежде всего, пациентам с наличием болевого синдрома и вегетативно–трофических нарушений.
- Для оценки тяжести посттравматических невропатий и эффективности применяемой терапии необходимо использовать методы электромиографии, электронейромиографии.
- Показанием к проведению нейрохирургического лечения является отсутствие динамики клинической картины и нейрофизиологических показателей после повторного курса комплексной терапии.
ВЫВОДЫ.
- Развитие компрессионных невропатий сопровождается появлением чувствительных нарушений с последующим присоединением двигательных расстройств, что коррелирует с динамикой электронейромиографических показателей, в виде снижения скорости проведения импульса по сенсорным волокнам, снижения амплитуды сенсорного ответа и последующим изменением показателей по моторным волокнам.
- Травматические невропатии сопровождались изменением патерна кривой электромиографического исследования в виде ее урежения и снижения амплитуды, а также показателей электронейромиографического исследования в виде уменьшения амплитуды моторного и сенсорного ответов, снижения скорости проведения импульса по сенсорным и двигательным волокнам, увеличения латентного периода, блоком проведения.
- Сравнительное изучение эффективности медикаментозной терапии и комплексного лечения с включением магнитотерапии у больных с посттравматическими невропатиями выявило: ускорение темпов восстановительной динамики в группе больных, получавших магнитотерапию. Отмечено преимущественное воздействие магнитотерапии на выраженность болевого синдрома и вегетативно-трофических изменений.
- Отсутствие положительной динамики клинической картины и электрофизиологических показателей на фоне повторного комплексного лечения являлось показанием к нейрохирургическому лечению.
^ СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Катунина Е.А., Авакян Г.Н., Бездольный Ю.Н., Исмаилов А.М., Титова Н.В., Аванесова О.В. Эпидемиология паркинсонизма // «Журнал неврологии и психиатрии им. С.С. Корсакова» 2009, №11. С.76-80
- Катунина Е.А., Аванесова О.В., Пестовская О.Р., Абдурахманова Е.К., Бездольный Ю.Н. Применение ингибиторов ацетилхолинэстеразы при лечении заболеваний периферической нервной системы // Фарматека, 2009, №15 (189). C.52-55.
- Катунина Е.А., Аванесова О.В. Применение препарата пантогам актив в комплексной терапии дистанических гиперкинезов // 17 Российский национальный конгресс «Человек и лекарство», сборник материалов конгресса 2010, С.130.
- Катунина Е.А., Аванесова О.В., Авакян Г.Н. Клинико-нейрофизиологическая оценка эффективности комплексной терапии у больных с посттравматическими невропатиями // 9 Межрегиональная научно-практическая конференция «Актуальные вопросы неврологии», сборник материалов конференции 2010, Новосибирск, С.42.
- Воловец С.А., Станкевич П.В., Емелин Е.В., Аванесова О.В., Байкова Н.В. Перспективы реабилитационного лечения инвалидов в городе Москве // 2 Международная конференция «Равные права-равные возможности», сборник материалов конференции 2010, М.,С.67.
- Катунина Е.А., Малыхина Е.А., Аванесова О.В., Макарова А.А., Абдурахманова Е.К., Гридякин В.И.Применение препарата пантогам актив в комплексной терапии дистанических гиперкинезов// «Журнал неврологии и психиатрии им. С.С. Корсакова» 2010, №11. С.59-63.
