Мусієнко М. М., Панюта О. О. Біотехнологія рослин. Навчальний посібник
| Вид материала | Документы |
- Ослин навчальний посібник до лабораторних занять з фізіології рослин для студентів, 2678.12kb.
- Удк 581. 8 (075. 8) Брайон О. В., Панюта О. О., Паршикова Т. В., Славний, 518.84kb.
- Практикум з педагогіки вищої школи: Навчальний посібник за модульно-рейтинговою системою, 411.72kb.
- Дмитриченко М. Ф., Навчальний посібник, 2529.95kb.
- Дмитриченко М. Ф., Навчальний посібник, 2842.03kb.
- Наталя Чабан навчальний посібник з історії української культури мвс україни, 9171.9kb.
- Програма вступних фахових випробувань за спеціальністю «фізіологія рослин» освітньо-кваліфікаційний, 164.35kb.
- Рекомендовано Міністерством освіти України як навчальний посібник для студентів архітектурних, 1979.84kb.
- Т. Г. Сабірзянов Печі ливарних цехів. Гриф «Навчальний посібник», 375.04kb.
- Н. М. Борівська Навчальний посібник містить цікавий матеріал стосовно урок, 283.61kb.
Умови культивування протопластів
Середовище. Основна вимога до середовищ полягає у тому, щоб у процесі культивування не відбувалося руйнування ізольованих протопластів, бо до утворення клітинної стінки протопласти – це дуже ніжні структури, і щоб воно було оптимальним для утворення клітинами колоній.
Як правило, середовище має складатися з осмотичного стабілізатора, неорганічних сполук, джерел вуглецю, вітамінів, джерел органічного азоту і фітогормонів. Як осмотичний стабілізатор можна використовувати маніт, сорбіт та їхні комбінації. Склад мінеральних солей відповідає складу мінеральних солей в середовищах для культивування клітин рослин. Можна міняти співвідношення амонійного та нітратного азоту залежно від потреб клітин, збільшувати концентрацію CaCl2 для стабілізації клітинної стінки, що формується.
Як джерело вуглецю використовують глюкозу, сахарозу, їх суміш. Сахароза не завжди може бути придатним компонентом середовища для протопластів. У деяких випадках додають рибозу, ксилозу, фруктозу, манозу та інші цукри.
До складу вітамінів при культивуванні ізольованих протопластів мають входити тіамін HCl (В1), піридоксин HCl (В6) і нікотинова кислота (РР). При невеликій щільності висіву необхідно додавати й інші вітаміни.
Як джерела азоту до середовища додають амінокислоти, найчастіше використовують гідролізат казеїну, який є сумішшю амінокислот і додають його в тому разі, коли в середовищі недостатній вміст неорганічного азоту, а його концентрацію вже не можна збільшити.
Ауксини і цитокініни необхідні для клітинного ділення і подальшого розвитку рослинних клітин. Як правило використовують 2,4-Д, НОК, кінетин, БАП, зеатин. Оптимальні концентрації фітогормонів підбирають у кожному конкретному випадку.
Важливого значення при культивуванні ізольованих протопластів набувають і інші умови. Так, рН середовища має становити від 5,4 до 5,8.
Температура, при якій культивують ізольовані протопласти варіює в значній мірі залежно від виду. Так, для протопластів одного представника злаків – росички (Digitaria sanguinalis) оптимальною є температура 30 °С, а для пшениці 22 °С. Більшість ізольованих протопластів культивується при температурі 24 – 26 °С.
Що стосується інтенсивності світла, то у більшості випадків дослідники прийшли до висновку, що світло високої інтенсивності згубно впливає на ізольовані протопласти. Але оптимальні значення освітленості варіюють у широких межах. Так, люцерна утворює колонії у абсолютній темряві (100 – 700 Лк), а для протопластів Nemesia strumosa (немезія – норичникові) оптимальний ріст спостерігали при освітленості 80 000 Лк.
Суттєвим фактором культивування є щільність висіву протопластів. При дуже низькій щільності протопласти часто не діляться. З іншого боку, при дуже високій щільності труднощі виникають на пізніших стадіях, коли на ріст можуть впливати продукти обміну, що виділяються. Оптимальна щільність протопластів у культурі 104 – 106 пр/мл. Дещо компенсувати високу щільність висіву протопластів можна додавши до живильного середовища активоване вугілля.
У процесі культивування ізольовані протопласти регенерують нову клітинну стінку і перетворюються у звичайну клітину, яка культивується in vitro. Саме ця обставина робить ізольовані протопласти зручною моделлю для вивчення формування целюлозних мікрофібрил. Дрібні протопласти, отримані із меристематичної тканини, починають формувати стінку приблизно через 1,5 години після початку культивування і через добу клітинна стінка повністю покриває протопласти. Протопласти із дорослих листків мають більші розміри і регенерують стінку значно повільніше: через 4 години з’являються перші осередки новоутворення стінки, а через добу стінка ще не утворює суцільний покрив.
Спостереження за регенерацією клітинної стінки у протопластів скімії показали, що у цей період спостерігається сильне збільшення ендоплазматичного ретикулума. Припускають, що у шорстких ділянках ендоплазматичного ретикулума утворюються ферменти, які беруть участь у синтезі попередників целюлози.
У ході регенерації целюлозних компонентів клітинної стінки, можна виділити два періоди:
Ій період – синтез іде дуже повільно і приводить до утворення незначної кількості целюлози;
ІІй період – починається приблизно через 8 діб після культивування, і характеризується різким збільшенням (у 5 разів) швидкості синтезу целюлози.
Заново синтезована клітинна стінка не містить пектинові речовини.
Як правило, ізольовані протопласти більшості видів рослин через добу утворюють клітинну стінку, а через 2 – 3 доби відбувається перший поділ. Другий поділ відбувається на 7 – 8 добу, потім утворюється 8-клітинні колонії і на 21 – 30 добу культивування формуються багатоклітинні колонії.
При перенесенні їх на агарове середовище утворюється калюс, із якого можна отримати цілу рослину. Регенерація рослин відбувається або через ембріогенез, або через утворення калюсу з подальшою індукцією морфогенезу.
^
ЗЛИТТЯ ІЗОЛЬОВАНИХ ПРОТОПЛАСТІВ
Ізольовані протопласти за той час поки вони не утворили клітинну стінку, можуть зливатися між собою. Злиття протопластів може бути спонтанним. Це явище, причиною якого може бути збереження плазмодесм між сусідніми клітинами, відбувається дуже рідко. Тривала інкубація або зависока концентрація ферментної суміші різко зменшують спонтанне злиття. А тому для стимуляції злиття протопластів запропоновано ряд методів.
Перше повідомлення про злиття ізольованих протопластів зроблене Kюстер у 1909 році. Для індукції злиття протопластів він випробував кілька речовин і прийшов до висновку, що найефективнішим є нітрат кальцію, хоча частота злиття протопластів була низькою.
Протягом останніх 20 років, в якості індукторів злиття ізольованих протопластів випробували: NaNo3, штучну морську воду, лізоцим, желатину, високе рН – висока концентрація Са++, антитіла, рослинний лектин конвалін, ПЕГ, полівініловий спирт, позитивно заряджені синтетичні фосфоліпіди та інші речовини.
На даний час найпоширенішою є методика, коли для індукції злиття протопластів використовують розчини з високим рН (9 – 11) і концентрацією іонів Са++ (100 – 300 мМ). При цьому протопласти попередньо аглютинують за допомогою розчину ПЕГ. Використовуючи цю методику можливо стимулювати до злиття 10 – 50 % протопластів.
Зімерман з співробітниками у 1981 році розробили фізичний метод злиття протопластів, у якому як індуктор злиття використовують імпульси електричного струму. Протопласти поміщають в камеру, де створюється неоднорідне, змінне електричне поле. За цих умов на електродах формуються агрегати, які складаються з 2 – 3 протопластів, або між електродами формуються “ланцюжки” із 5 – 6 протопластів (це явище відомо як діелектрофорез). До цієї системи додатково додається одиничний імпульс, який викликає злиття протопластів в агрегаті. Всі фізичні параметри підбираються індивідуально. Злиття відбувається при питомій електропровідності середовища нижчій 10-4 См/см. Цю умову задовольняє 0,5 М розчин маніту, який відноситься до неелектролітів: його питома електропровідність 1,4·10-5 См/см.
Злиття, що індукується електричним струмом, має таке пояснення: імпульс короткої тривалості викликає руйнування мембран протопластів, що стикуються. Навколо “дірки” можливий обмін ліпідними молекулами, утворення ліпідних містків, що призводить до злиття мембран. Це енергетично більш вигідний стан, ніж існування двох пошкоджених мембран.
Ефективність електрозлиття залежить від віку рослини, походження протопластів, їх розмірів, довжини “ланцюжка”, щільності суспензії протопластів, тривалості дії поодинокого імпульсу.
Для автоматизації процедури електрозлиття ізольованих протопластів розроблено і вже застосовується ряд установок. Наприклад, Electro Cell Manipulator 200 (США), або установка, створена НВО “Корна” (Росія). Ці установки складаються з генератора напруги, генератора поодиноких імпульсів, підсилювача потужності, кювет з платиновими електродами.
Отже, у всіх методах злиття протопластів на першому етапі відбувається їх агрегація.
Аналіз експериментальних матеріалів, що стосується структури і властивостей мембран при впливі індукторів злиття, показує, що в умовах високого рН, під дією високих концентрацій Са2+ у рослинних протопластів відбувається збільшення плинності мембран. ПЕГ не викликає збільшення плинності мембран, а сприяє агрегації протопластів.
Розробка способів індукції злиття протопластів разом з розвитком техніки культивування клітин in vitro, що дає можливість отримання ізольованих протопластів, їх культивування, утворення калюсу, а в подальшому цілої рослини, сформували новий і перспективний метод гібридизації рослин – парасексуальну, або соматичну гібридизацію.
Соматична гібридизація – гібридизація рослин в обхід статевого схрещування, при якій як батьківські клітини використовують ізольовані протопласти соматичних клітин або клітини, що культивуються in vitro.
Цей метод дозволяє схрещувати філогенетично віддалені види рослин, які неможливо схрестити звичайним статевим шляхом, отримувати асиметричні гібриди. На відміну від статевого схрещування, де відбувається одностороннє виключення протоплазми, при соматичній гібридизації в утвореному гібриді обидва партнери мають відносно рівний цитоплазматичний статус. Злиття протопластів сприяє об’єднанню двох різних цитоплазм. У більшості випадків злиття ізольованих протопластів призводить до утворення або гібрида, або цибрида (цитоплазматичного гібрида) (Рис.6).
Цибридна клітина містить цитоплазму обох партнерів, а ядро – одного. Утворення рослин з гібридною цитоплазмою і органелами обох партнерів, але з ядром лише одного виду можливе у тому разі, якщо після злиття протопластів не відбувається з’єднання ядер і одне ядро дегенерує. Утворення цибридів можливе і в тому випадку, коли один із протопластів позбавлений ядра або воно інактивоване шляхом опромінення.

Рис. 6. Схеми успадкування батьківських ядерних (кружок) і позаядерних (овал) детермінант при соматичній і статевій гібридизаціях.
Цибридизація дозволяє ввести цитоплазматичні гени, які несуть ознаки ЦЧС (цитоплазматичної чоловічої стерильності), стійкості до деяких гербіцидів і патогенів.
Перший нестатевий міжвидовий гібрид вищих рослин отриманий в 1972 р. шляхом злиття ізольованих протопластів двох видів тютюну: Nicotiana glauca i N. Langsdorfii. Одним із найцікавіших соматичних гібридів є pomato – гібрид картоплі й томату, одержаний у 1978 р. І хоча цей гібрид поки що стерильний, а діаметр його плодів не перевищує 3 мм, саме його існування привертає увагу до методу прогресивних селекціонерів.
На сьогодні методами соматичної гібридизації отримані внутрішньовидові (дурману, петунії та ін.), міжвидові (петунії, моркви, дурману, картоплі), міжродові (томати + картопля; арабідопсис + турнепс; дурман + красавка) та міжродинні гібриди (горох + тютюн; цибуля + тютюн). Однак у багатьох випадках гібридні рослини, отримані таким способом, в певній мірі, ненормальні. Наприклад соматичний гібрид між арабідопсисом і турнепсом, який є рослиною-монстром. Аномалії, що виникають, є результатом хромосомної незбалансованості.
Особливий інтерес становлять міжцарственні гібриди, які отримані від злиття протопластів рослинних і тваринних клітин. Описані гібриди між протопластами моркви і людини, тютюну і людини та інші.
^
СЕЛЕКЦІЯ СОМАТИЧНИХ ГІБРИДІВ
Селекцію соматичних гібридів здійснюють кількома методами.
При механічній ізоляції використовують морфологічно різні типи батьківських протопластів, після злиття продукти з’єднаних протопластів виявляють візуально під мікроскопом, ізолюють мікропіпеткою і культивують окремо. Наприклад при злитті протопластів тютюну і моркви як селективні маркери використовували зелені хлоропласти тютюну і червоно-оранжеві хромопласти моркви.
Другим методом, який дозволяє проводити відбір соматичних гібридів, є фізіологічна комплементація – спільна взаємодоповнююча дія різних генів. Протопласти двох видів тютюну N. glauca і N. langsdorfii утворювали клітинні стінки, але не могли ділитися і утворювати калюс на середовищі Нагата і Такебе. В той же час протопласти гібриду ділилися і утворювали калюс. Ще однією особливістю гібридного калюсу була здатність рости на середовищі без гормонів, що дало можливість створити цей метод селекції.
Існують також інші методи відбору соматичних гібридів. Наприклад: селекція за стійкістю до антибіотиків, гербіцидів, аналогів амінокислот і т.д.
Використання ізольованих протопластів не обмежується можливістю отримання соматичних гібридів. Ізольовані протопласти широко використовують у клітинній селекції та генетичній трансформації.
Контрольні запитання і завдання
1. Що таке ізольований протопласт?
2. Які існують методи виділення ізольованих протопластів?
3. Які фактори впливають на життєздатність ізольованих протопластів?
4. Чому у середовища для виділення та культивування ізольованих протопластів обов’язково додавати осмотичний стабілізатор?
5. Які речовини використовують при виділенні ізольованих протопластів як осмотичні стабілізатори?
6. Які ферменти використовують для виділення ізольованих протопластів?
7. Що обумовлює вибір складу ферментної суміші?
8. Із якого рослинного матеріалу можна виділяти ізольовані протопласти?
9. За яким методом проводять виділення ізольованих протопластів? Охарактеризуйте його.
10. Як щільність висіву ізольованих протопластів впливає на їхню життєздатність?
11. Що таке соматична гібридизація?
12. Які існують способи злиття ізольованих протопластів?
13. Які існують способи відбору та ідентифікації соматичних гібридів?
14. Які соматичні гібриди були одержані методом злиття ізольованих протопластів?
^ ГЕНЕТИЧНА ТРАНСФОРМАЦІЯ
Крім соматичної гібридизації і клітинної селекції є ще один метод створення in vitro покращених форм господарсько цінних рослин – це генетична трансформація.
Термін трансформація походить від латинського transformatio – перетворення і означає зміни в геномі та спадкових властивостей організму.
Генетична трансформація досягається шляхом проникнення крізь канали клітинної мембрани екзогенної ДНК і взаємодії останньої з клітинним геномом.
На відміну від соматичної гібридизації і клітинної селекції генетичну трансформацію розглядають як спосіб отримання більш обмежених і специфічних генетичних змін. У багатьох випадках окрема важлива у сільськогосподарському відношенні ознака, що контролюється одним або невеликою кількістю генів, може бути змінена шляхом трансформації, при цьому більша частина геному залишається без змін. Технологія рекомбінантних ДНК дозволяє виділити у чистому вигляді і в достатній кількості будь-який ген і при наявності вектора або іншим способом вбудувати цей ген до складу хромосомної ДНК і добитися його експресії. Використання цієї технології робить пошук цілеспрямованим і значно розширює можливості маніпулювання генетичним апаратом при скороченні часу отримання нових форм рослин.
В усьому світі проводяться дослідження по визначенню, виділенню, клонуванню і введенню в рослини генів, які відповідають за стійкість до холоду, посухи, засолення, тобто до стресових впливів оточуючого середовища, за стійкість до шкідників, гербіцидів і пестицидів, хвороб тощо. Той факт, що геном рослин вивчений гірше, ніж геном ссавців значно ускладнює такі дослідження. На сьогодні розроблено багато підходів до проблеми трансформації, однак з практичної точки зору відносно простий і відтворюваний метод базується на використанні Agrobacterium tumеfaciens.
A.tumеfaciens – це ґрунтова бактерія із родини Rhizobiaceae, яка здатна, поселяючись на раневих поверхнях рослин викликати утворення пухлин. Власне пухлинотворним агентом є плазміда, частина якої – Т-ДНК (від англ. transferred DNA), переноситься в хромосоми клітин рослини (Рис. 7). Плазміда – невелика кільцева молекула ДНК, здатна до стабільного, не зв’язаного з хромосомами існування і автономної реплікації (біосинтез дочірніх ДНК). Плазміди можуть вбудовуватися у хромосоми. Плазміди локалізовані в цитоплазмі бактеріальних клітин і клітинах деяких дріжджів. Після трансформації рослинні клітини починають швидко і неорганізовано рости і синтезувати особливі речовини – опіни (похідні амінокислот і цукрів), які бактерії використовують як джерело азоту і вуглецю. Тобто утворення пухлин супроводжується перебудовою метаболізму клітин, і вони починають синтезувати сполуки, необхідні лише для бактерій.
Раніше припускали, що ^ A. tumеfaciens вражає саме пошкодженні рослини внаслідок руйнування клітинної стінки і усунення фізичного бар’єру, який ускладнює проникнення бактерій у клітину. Однак сьогодні вважається, що індуктором генетичної трансформації у агробактерій є фенольні сполуки, ацетосирингон і гідроксіацетосирингон, які виділяють рослини при пораненнях.Плазміди, які викликають пухлини називаються Ті-плазмідами (від англійського tumor inducing – індукуючі пухлину). Це кільцеві молекули ДНК
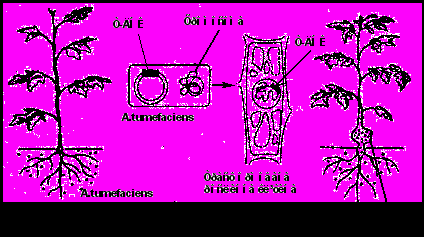
Рис.7. Етапи індукції корончатого галу після інфікування рослини ^ Agrobacterium tumеfaciens.
довжиною близько 200 кб (3-5 % від розміру хромосоми агробактерії), які стабільно зберігаються в агробактеріях при температурі нижче 300С. В бактеріальних клітинах вони реплікуються автономно. Ті-плазміди розрізняють за типом опіну, який синтезується. Найчастіше зустрічаються плазміди, які кодують нопалін або октопін. Вважається, що клітина може містити лише один тип плазміди: або октопінову, або нопалінову.
Генетична карта Ті-плазміди повністю не розшифрована. З’ясовано тільки 4 ділянки: дві онкогенні (Т-область і vir-область) і дві ділянки (OR1, CON), які визначають морфологію пухлин, забезпечують реплікацію плазмід та їхню кон’югацію (Рис. 8). Генетичні дослідження показали, що гени, які відповідають за індукцію пухлини, синтез опінів і пригнічення диференціації, розташовані близько один від одного і входять до складу Т-області плазміди, яка вбудовується у хромосому клітини при інфекції. Т-сегмент має довжину близько 20 кб (10 % Ті-плазміди) і вбудовується в різні, очевидно неспецифічні, області хромосоми. На Т-області картовано сім генів, які відповідають за синтез опіну і за пригнічення диференціації клітин. Слід відмітити, що всі гени, які відповідають за перенесення та інтеграцію Т-ДНК, знаходяться не в Т-ДНК, а в області вірулентності (vir-область).
У тих випадках, коли важко регенерувати цілі рослини із окремих клітин, для трансформації використовують Agrobacterium rhizogenes, яка викликає посилене утворення коренів при зараженні рослин. Рослини багатьох видів можуть регенерувати із культури коренів, які індукує ця бактерія. Плазміди, які викликають коренеутворення, називають Ri-плазмідами (від англійського root inducing – індукуючий корені). Корені швидко ростуть у культурі подібно до тканини пухлин і відсутність бактерій не впливає на їхній ріст. З’ясувалося, що клітини корінців також містять опіни, а їх геноми містять по декілька копій Т-ДНК. Ri-плазміди відрізняються від Ті-плазмід тим, що вони є природними
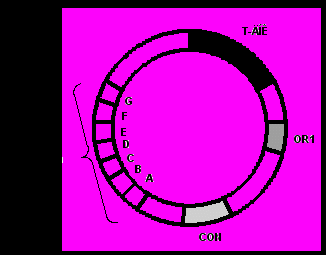
Рис.8. Узагальнена генетична карта Ti-плазміди ^ Agrobacterium tumеfaciens:
vir-область – забезпечує вірулентність;
Т-ДНК – містить ген, який контролює синтез тільки одного із опінів;
OR1 –ділянка реплікації;
CON – ділянка кон’югації.
векторами, після трансформації якими рослинні клітини здатні регенерувати у здорові фертильні рослини. У даний час ці плазміди розглядають як перспективніші вектори для генетичної трансформації рослинних клітин.
^ ВЕКТОРИ ДЛЯ ГЕНЕТИЧНОЇ ТРАНСФОРМАЦІЇ РОСЛИН
Вектор – молекула ДНК, що має здатність до автономної реплікації в клітині-хазяїні, в яку можна ввести додатковий фрагмент чужорідної ДНК і надалі забезпечити його реплікацію (як вектор можна використовувати плазміду).
^ Плазміди агробактерій як вектори для трансформації
Унікальні біологічні властивості Ті-плазміди роблять її ідеальним вектором для перенесення генів. Вона має широке коло господарів, вбудовує ДНК до складу хромосоми, де вона реплікується і більша її частина транслюється з утворенням білка. Однак із-за великих розмірів (від 200 до 800 кб) маніпуляції з Ті-плазмідою ускладнені, вставити ген в плазміду традиційними методами стає неможливим.
Незважаючи на це сконструйовано декілька векторів для рослинних клітин. Усі вектори на основі Ті-плазмід організовані подібно і мають такі елементи:
- селективний маркерний ген, наприклад, ген неоміцинфосфотрансферази, який забезпечує стійкість трансформованних рослинних клітин до канаміцину,
- сайт ініціації реплікації, який дозволяє плазміді реплікуватися в E.coli,
- права фланкуюча послідовність Т-ДНК, яка необхідна для інтеграції Т-ДНК в клітинну ДНК рослин,
- полілінкер (множинний сайт клонування) для вбудовування гена в ділянку між межами Т-ДНК.
Ці вектори не містять онкогенних послідовностей, а тому після перенесення з їхньою допомогою ДНК в ядро рослинної клітини нормальний ріст рослини не порушується. Але оскільки такі вектори не містять генів vir, то вони самі не здатні забезпечити транспорт та інтеграцію Т-ДНК в клітини рослини-хазяїна. Для вирішення цієї проблеми розроблено два методи.
У першому випадку для введення чужорідної ДНК використовують коінтегративну векторну систему, яка передбачає використання проміжного вектора (Рис. 9).
Спочатку Т-ДНК за допомогою рестриктаз вирізають із плазміди і вставляють у вектор для клонування в E. coli ( наприклад, pBR322). Плазміду з Т-ДНК розмножують і, використовуючи стандартні методи, вбудовують чужорідний ген всередину Т-області і знову розмножують з уже вставленим геном. Потім отриману рекомбінантну плазміду вводять в клітини A. tumefaciens, які несуть повну Ті-плазміду. В результаті подвійного кросинговеру (гомологічної рекомбінації) між гомологічними районами Т-ДНК частина рекомбінантної плазміди, яка містить чужорідний ген, включиться в Ті-плазміду, замістивши у ній нормальну Т-ДНК. Нарешті, бактеріями, які мають Ті-плазміду з вбудованими генами, заражають рослини і в результаті отримують клітини корончатого гала, які будуть містити Т-область з вбудованим у неї чужорідним геном.
Другий поширений метод введення чужорідної інформації полягає у використанні бінарної векторної системи. Бінарний вектор містить ініціації реплікації і для E. coli, і для A. tumefaciens, але не містить генів vir. Всі стадії клонування проводять в E. сoli, а потім вектор вводять в A. tumefaciens. Штам-реципієнт A. tumefaciens несе модифіковану неонкогенну (“роззброєну”) Ті-плазміду: вона містить повний набір vir-генів, але з неї видалена частина (або вся) Т-ДНК, так що Т-ДНК не може бути транспортована. В цій системі на неонкогенній Ті-плазміді синтезуються продукти vir-генів. Продукуючи білки, які кодуються vir-генами, неонкогенна Ті-плазміда сприяє вбудовуванню Т-ДНК із бінарного вектора в хромосомну ДНК рослини. Поширений бінарний вектор – рBin19.
^
Вектори на основі ДНК-вмісних вірусів рослин
Останнім часом, як кандидати на роль векторів для перенесення генів у рослини, розглядають ДНК-вмісні віруси рослин. Найперспективнішим у цьому плані і тому найкраще вивченим є вірус мозаїки цвітної капусти CaMV (cauliflower mozaic virus), який вражає в основному рослини родини хрестоцвітих. Частинки цього вірусу мають діаметр коло 50 нм і містять кільцеву ДНК розміром 8 кб.
Невеликий розмір геному CaMV дає можливість маніпулювати in vitro з вірусною ДНК, як з бактеріальною плазмідою, а потім вводити її в рослини шляхом втирання в листки. Інфікування незначної кількості клітин приводить до зараження всієї рослини, так як вірус швидко поширюється, передаючись від клітини до клітини. При використанні 1-5 мкг клонованої ДНК для
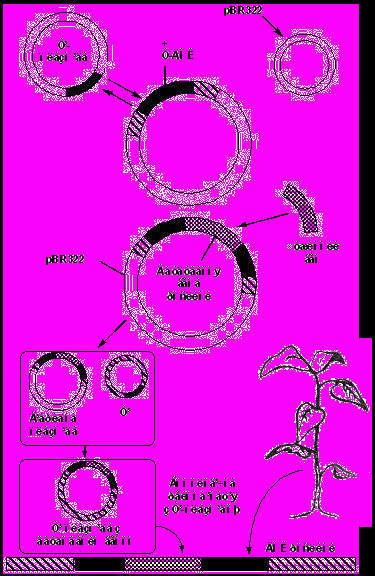
Рис. 9. Використання Ti-плазміди як вектора для перенесення генів у рослинні клітини.
інфікування однієї рослини шляхом механічної інокуляції досягається майже 100%-ва ефективність інфекції.
Для клонування ДНК CaMV в ^ E. сoli використовують плазмідні вектори E. сoli, наприклад, рВR322. Після обробки відповідними рестриктазами ДНК CaMV і рВR322 і лігування утвориться гібридна плазміда, яка здатна до ампліфікації в E. сoli.
Серед переваг векторних систем на основі вірусів слід відмітити малий розмір геному, що дає можливість легко маніпулювати вірусною ДНК та високу копійність вірусної ДНК у клітинах заражених рослин (до 50000 на клітину).
Недоліками цих векторних систем є невелика ємність вектора (менше 800 п.н.) і обмежене коло господарів – хрестоцвіті. Але слід відзначити, що сильні вірусні промотори можуть використовуватися для експресії чужорідних генів в інших векторних системах. Наприклад, промотор 35S вірусу мозаїки цвітної капусти є сильним промотором, який не проявляє тканиноспецифічності експресії і активний не тільки в клітинах хрестоцвітих, але і в клітинах рослин інших родин.
Як вектори для трансформації може бути використана хлоропластна і мітохондріальна ДНК.
^ МЕТОДИ ПЕРЕНЕСЕННЯ ЧУЖИННИХ ГЕНІВ У РОСЛИНИ
Перші експерименти по генетичній трансформації з використанням агробактерій проводили шляхом простого нанесення культури бактерій на раневі поверхні рослин. Пухлини, що утворювалися переносили на безгормональні живильні середовища, які містили антибіотики для елімінації бактерій. Цей спосіб був не дуже зручним у роботі, оскільки припускав використання тільки онкогенних штамів агробактерій, крім того, значну кількість у тканинах пухлини становили нетрансформовані клітини, що ростуть за рахунок фітогормонів, які виділяють трансформанти.
Сучасні методи перенесення нових генів можна розділити на дві групи. До першої групи відносять методи введення генів за допомогою природних векторів (на основі Ті-, Ri-плазмід, вірусів і віроїдів), а до другої – прямі методи введення чужорідної ДНК у геном вищих рослин (пряма трансформація ізольованих протопластів, мікроін’єкції, електропорація, упакування в ліпосоми, біолістика та інші) (Рис. 10).
Серед методів першої групи найчастіше використовують відносно простий і зручний метод “листових дисків”. Суть методу полягає в тому, що із листків рослини нарізають смужки або диски. Їх заражають агробактеріями і сумісно культивують на твердому або рідкому середовищах. Спочатку агробактерія потрапляє до місця пошкодження і приєднується до клітини. Контакт з пошкодженою рослиною “включає” гени vir- і Т-області. Індуктором цих процесів є ацетосирингон пошкоджених частин рослини. Через 4-5 годин починається перенесення Т-ДНК Ті-плазміди в клітину рослини, що закінчується через 8-9 годин від моменту попадання бактерії на поверхню рослини.
Потім диски відмивають від бактерій рідким живильним середовищем з антибіотиком – для елімінації бактерій, трохи підсушують фільтрувальним папером і поміщають на живильні середовища для регенерації, які містять селективний агент для відбору трансгенних регенерантів. Цей метод з незначними модифікаціями з успіхом застосований для генетичної трансформації самих різних видів класу дводольних.
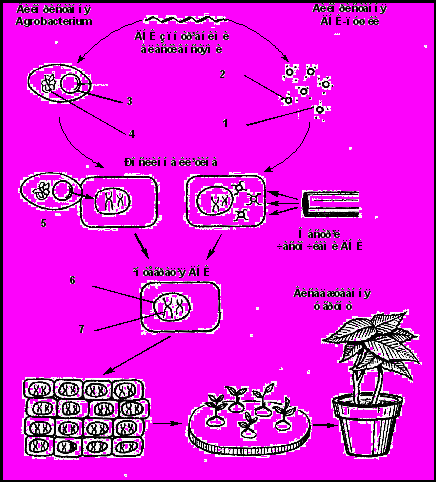
Рис. 10. Два основні методи створення трансгенних рослин:
1 – ДНК; 2 – металічні частинки; 3 – плазміда, яка індукує пухлини; 4 – бактеріальна хромосома; 5 – перенесення ДНК; 6 – ядро; 7 – рослинна хромосома.
Тривалий час вважали, що агробактерії здатні трансформувати тільки клітини голонасінних і дводольних рослин, однак недавно з’явились докази їх здатності трансформувати і однодольні рослини, у тому числі і злаки. Однією із причин, що обмежують агробактеріальну трансформацію злаків, вважали нездатність їхніх клітин до синтезу фенольних сполук, які індукують перенесення Т-ДНК, проте є повідомлення про синтез таких сигнальних молекул у однодольних рослин.
На сьогодні за допомогою генетичної трансформації, опосередкованої A.tumefaciens, отримано трансгенні рослини картоплі, томатів, рапсу, бавовни, льону, соняшника, цукрового буряка, люцерни, моркви, сої, баклажана, суниці, винограду, хризантеми, дурману, осики і тополі, красавки, каланхое, тютюну та інші.
„Пряме перенесення генів” має ряд переваг:
по-перше, зникає потреба вводити рекомбінантну ДНК до складу плазмідної ДНК;
по-друге, прямий метод перенесення генів ефективний для клітин однодольних.
Вперше трансформовані клітинні лінії були отримані після обробки ізольованих протопластів тютюну розчином ПЕГ у присутності Ті–плазміди і ДНК тимуса теляти.
Оптимізація умов проникнення плазмідної ДНК у ізольовані протопласти рослин привела до розробки методу електропорації (деякі автори називають цей метод електропульсацією), який оснований на використанні короткочасних, тривалістю від кількох десятків мікросекунд до кількох десятків мілісекунд, імпульсів електричного струму високої напруги (від 200 до 1500 В/см) у присутності ДНК. Хоча механізм, який приводить до посилення проникнення молекул ДНК ще невідомий, вважають, що в результаті електроімпульсації утворюються тимчасові транспортні канали, через які проникають макромолекули. Метод електропорації дозволив отримувати генетичну трансформацію з ефективністю від 0,01 % до 0,1 % від кількості протопластів, які використовуються у досліді. У деяких випадках ефективність трансформації досягала 10 %.
Головним недоліком методу електропорації є необхідність роботи з ізольованими протопластами, що обмежує його застосування для багатьох сільськогосподарських культур.
Одним із способів подолання цих труднощів є розробка методів генетичної трансформації шляхом мікроін’єкції ДНК у рослинну клітину. Цей метод застосовують для трансформації ізольованих протопластів, багатоклітинних структур (ембріоїдів, меристем, інтактного насіння) і генеративних клітин рослин.
Для мікроін’єкцій використовують мікроголку з зовнішнім діаметром 2 мкм і внутрішнім 1-1,25 мкм. Об’єм ін’єкцій у кожний протопласт становить (1-10)·10-4 мл, при концентрації ДНК – 0,1-1,0 мкг/мкл.
^ Метод упаковки ДНК в ліпосоми полягає в інкапсулюванні ДНК у сферичні тільця із фосфоліпідними оболонками, які зливаються безпосередньо з мембраною або поглинаються клітинами (ендоцитоз).
Найперспективнішим на сьогодні, є спосіб генетичної трансформації рослин з використанням установки під назвою „short gun” – „дробовик”, який отримав назву бомбардування мікрочастинками (particle bombardment), або біолістика – біологічна балістика (biolistic transformation). Суть методу полягає в тому, що на частинки металу (вольфраму або золота) діаметром 0,6-1,2 мкм осаджується ДНК, а потім ці частинки розганяють в установці і обстрілюють рослинні тканини. Частинки застрягають всередині рослинної клітини і потім в цих тканинах тестують транзієнтну активність генів, що переносяться. Біолістику можна використати для введення чужорідної ДНК в суспензію рослинних клітин, культури клітин, меристематичні тканини, незрілі зародки, протокорми, колеоптилі і пилок широкого кола рослин: кукурудза, пшениця, ячмінь, батат, соя, тютюн, баклажан, рис, жито, овес та інші (табл. 7).
Таблиця 7
Трансгенні рослини, отримані методом бомбардування різних рослинних клітин мікрочастинками
| Рослина | Джерело клітин |
| Кукурудза | Суспензія зародкових клітин, незрілі зиготичні зародки |
| Рис | Незрілі зиготичні зародки, калюс зародкового походження |
| Ячмінь | Клітинна суспензія, незрілі зиготичні зародки |
| Пшениця | Незрілі зиготичні зародки |
| Жито | Меристема |
| Сорго | Незрілі зиготичні зародки |
| Просо | Незрілі зиготичні зародки |
| Орхідні | Протокорми |
| Банан | Суспензія зародкових клітин |
| Тополя | Калюс |
| Ялина європейська та канадська | Соматичні зародки |
| Горох | Зиготичні зародки |
| Огірок | Зародковий калюс |
| Батат | Калюс |
| Клюква | Частини стебла вирощених in vitro рослин |
| Півонія | Пилок |
| Люцерна | Зародковий калюс |
| Боби | Зиготичні зародки |
| Бавовна | Зиготичні зародки |
| Виноград | Суспензія зародкових клітин |
| Земляний горіх | Зародковий калюс |
| Тютюн | Пилок |
Крім того, за допомогою цього методу були перенесені гени у хлоропласти і мітохондрії. Однією із переваг генетичної трансформації пластидної ДНК є дуже високий рівень експресії чужорідних генів, що пов’язано з дуже великою кількістю копій (до 50000) хлоропластного геному у клітині.
Варто відзначити, що на сьогодні методи генетичної трансформації використовують для вирішення слідуючих завдань селекції: біологічна фіксація азоту не бобовими рослинами, підвищення ефективності фотосинтезу, створення рослин, стійких до несприятливих факторів середовища, гербіцидів, хвороб і шкідників, підвищення якості рослинного білка. Уже клоновані і вбудовані в геном рослин багато господарськоцінних генів. Серед них гени, що визначають стійкість до вірусної інфекції, гербіцидів, шкідників, несприятливих умов оточуючого середовища. Основні проблеми у цій області досліджень пов’язані з виділенням генів, що кодують названі вище ознаки. Тоді як існуючі способи генетичної трансформації вищих рослин забезпечують можливість отримання трансформантів майже у будь-якого господарсько-цінного виду, хоча умови трансформації потребують оптимізації у кожному конкретному випадку.
^
ТРАНСГЕНИ І ЕКОЛОГІЯ
При оцінці міри ризику пов’язаного з дослідженнями по генетичній інженерії, серед вчених немає повної одностайності. Висловлюються різні думки про те, чи може біотехнологія негативно вплинути на здоров’я людини і його безпеку, на генетичне різноманіття, стабільність популяцій диких форм життя або функціонування екологічних систем в цілому.
Одні дослідники вважають, що застосування генетичної інженерії безпечне і необхідний лише мінімальний контроль. Прихильники цієї точки зору вважають, що немає принципових відмінностей між генетичною інженерією і селекцією, що відбувається у природі, або традиційною селекцією, що здійснює людина. Відмінність лише у швидкості процесу. Природна селекція йде значно повільніше, ніж у лабораторії, але продовжується вже мільйони років. Це ж і у відношенні традиційної селекції, яка ведеться людиною протягом сторіч і отримані різновидності не викликали серйозних проблем. У багатьох випадках нові генетичні модифікації мали переваги, хоча точна їх природа не була відома.
У порівнянні з традиційним схрещуванням в генетичній інженерії виконуються відомі, попередньо точно сплановані специфічні модифікації. Тому немає будь-яких причин очікувати більших проблем від генно-інженерних організмів, ніж від організмів, отриманих шляхом традиційної селекції. Точне знання послідовностей ДНК, що вводяться і детальне розуміння функцій продуктів введених генів, є основою для максимального зниження ризику таких експериментів для людини і тварин.
На користь доказу про безпеку генетичної інженерії свідчить той факт, що 90-ті роки минулого століття у різних країнах світу ознаменувалися розгортанням польових випробувань рослин, змінених з застосуванням методів генетичної інженерії. Це – соя, кукурудза,бавовник, папайя, рис, цукровий буряк, пшениця, картопля, помідори, виноград і багато інших. Якщо в 1996 р. площі, на яких вирощували трансгенні рослини складали 3 млн.га, то в 1997 р. – 12 млн.га, в 1998р. – 26 млн.га, в 1999 р. – 40 млн. га, а в 2003 р. – майже 60 мільйонів гектарів. Основні країни учасниці вирощування у відкритому ґрунті: США, Канада, Аргентина, Китай, Іспанія.
Вцілому у світі проведено понад 25000 польових випробувань принаймі 60 різних видів генетично трансформованих рослин у 45 країнах світу і ніяких шкідливих наслідків впливу генетично модифікованих організмів не спостерігали.
Згідно другої точки зору з розвитком досліджень по генетичній інженерії, які пов’язані з випуском трансгенних організмів в природне середовище, зростає потенціальна безпека порушення екологічної рівноваги, непередбаченого перенесення введених генів іншим організмам (наприклад, ознаки гербіцидотолерантності від культурних рослин бур’янам ), зменшення як місцевого, так і глобального різноманіття сільськогосподарських культур. Деякі спеціалісти вважають, що не про всіх трансгенних організмів теоретично передбачити, чи будуть вони безпечні. І нарешті, у ході досліджень можуть бути створені нові біотипи, які не існували у природі раніше.
Оскільки ніхто не знає точно, як будуть вести себе нові організми до того як вони випущені в природне середовище, а лабораторні досліди не можуть замінити випробувань у відкритому ґрунті, такі дослідження необхідні, але проводити їх слід з великою обачністю. Кожний організм повинен проходити через декілька послідовних стадій випробувань і на кожній стадії отримувати спеціальний дозвіл, тобто кожен випуск має здійснюватись на основі принципу поступового розширення експерименту з ретельною оцінкою на кожному етапі.
Вчені із Національної академії наук США і Королівської комісії по охороні оточуючого середовища Великобританії одностайні у думці, що при проведенні досліджень з генетичної інженерії потрібний ретельний контроль, але немає підстав вважати, що результати таких досліджень можуть бути катастрофічними. Їх варто розглядати скоріше за все як новий етап впливу людської діяльності на оточуюче середовище, але не в більшій мірі ніж це було раніше. У гіршому випадку це може дати результат, аналогічний введенню деяких не властивих даній місцевості організмів, який спостерігали раніше, наприклад, кролики в Австралії.
Нарешті є ще одна – крайня точка зору, згідно якої нова технологія має бути заборонена, оскільки знання про неї недостатні, щоб забезпечити повну безпеку.
Пропозиції про тимчасовий мораторій на випробування у відкритому ґрунті організмів, отриманих методами генетичної інженерії, висувались у Німеччині, Великобританії, а також у Європейському парламенті. Однак цей підхід не зустрічає підтримки у більшості спеціалістів і на сьогодні ЄС відмовився від мораторію на використання ГМ рослин.
Більшість вчених єдині у думці, що дослідження з трансгенними організмами потребують ретельного контролю. Існує необхідність в узгоджених на міжнародному рівні принципах, відповідно до яких буде оцінюватися потенційний ризик та здійснюватиметься управління всіма аспектами нових біотехнологій. Необхідно прийняти відповідні закони та впровадити засоби оцінки ризиків, які можуть виникати при появі генетично модифікованих організмів.
^
Контрольні запитання і завдання
1. Що таке генетична трансформація?
2. Які існують способи генетичної трансформації?
3. Що таке плазміда?
4. Що таке вектор?
5. Охарактеризуйте Ti-плазміду.
6. Що таке Т-ДНК?
7. Яка організація векторів на основі Ті-плазмід?
8. Назвіть переваги використання векторів на основі ДНК-вмісних вірусів рослин.
9. Які недоліки використання векторів на основі ДНК-вмісних вірусів рослин?
10. Перерахуйте основні методи перенесення чужорідних генів у рослини.
11. Які переваги “прямого перенесення генів”?
12. Охарактеризуйте метод біологічної балістики як найперспективніший спосіб генетичної трансформації рослин.
^ ПРАКТИЧНИЙ КУРС
Приготування і стерилізація живильних середовищ
Живильне середовище - основний фактор успішного культивування ізольованих органів, тканин і клітин рослин. Основними компонентами живильних середовищ є мінеральні солі (макро- і мікроелементи), джерело вуглеводневого живлення (звичайно сахароза або глюкоза), вітаміни і регулятори росту (табл.8).
