Мусієнко М. М., Панюта О. О. Біотехнологія рослин. Навчальний посібник
| Вид материала | Документы |
- Ослин навчальний посібник до лабораторних занять з фізіології рослин для студентів, 2678.12kb.
- Удк 581. 8 (075. 8) Брайон О. В., Панюта О. О., Паршикова Т. В., Славний, 518.84kb.
- Практикум з педагогіки вищої школи: Навчальний посібник за модульно-рейтинговою системою, 411.72kb.
- Дмитриченко М. Ф., Навчальний посібник, 2529.95kb.
- Дмитриченко М. Ф., Навчальний посібник, 2842.03kb.
- Наталя Чабан навчальний посібник з історії української культури мвс україни, 9171.9kb.
- Програма вступних фахових випробувань за спеціальністю «фізіологія рослин» освітньо-кваліфікаційний, 164.35kb.
- Рекомендовано Міністерством освіти України як навчальний посібник для студентів архітектурних, 1979.84kb.
- Т. Г. Сабірзянов Печі ливарних цехів. Гриф «Навчальний посібник», 375.04kb.
- Н. М. Борівська Навчальний посібник містить цікавий матеріал стосовно урок, 283.61kb.
Етап 3.
1. Приготувати 100 мл 7,5%-го розчину хромового ангідриду.
2. У 30 пробірок налити по 2 мл розчину хромової кислоти.
3. Із кожного варіанта досліду приготувати по 3 наважки калюсної тканини по 0,1 г, які помістити у пробірки з розчином для мацерації.
4. Пробірки помістити у термостат при 250С на 24 год.
Час інкубації для кожної культури підбирають експериментально.
5. Перед підрахунком ретельно, але акуратно, струсити вміст пробірки, щоб вийшла рівномірна суспензія клітин. Якщо вона дуже густа, то її треба розвести водою (розведення враховують при перерахунку).
6. Піпеткою з широким кінчиком швидко нанести по краплі суспензії клітин на кожну сітку лічильної камери Фукс-Розенталя, закрити її склом і притерти його до бічних граней сіток до появи кілець Ньютона.
7. Провести підрахунок клітин у чотирьох великих квадратах, розташованих по діагоналях сітки лічильної камери (рис.3). Підраховувати в обох сітках.
8. Промити камеру, заповнити знову і провести повторний підрахунок.
Операцію повторювати 3 рази для кожної пробірки.
9. Кількість клітин в 1 г калюсної тканини обчислюють за формулою:
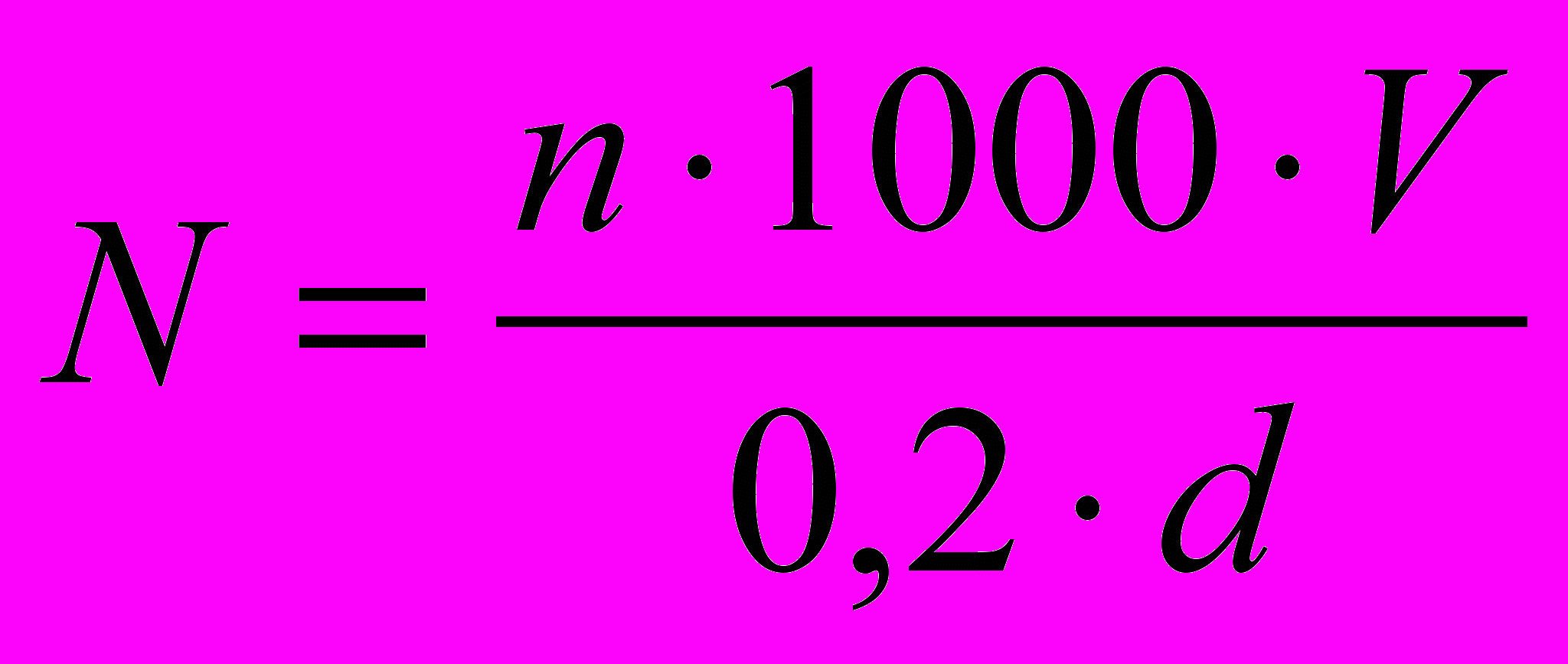 ,
,де N - кількість клітин в 1 г калюсної тканини; n - кількість клітин у одному великому квадраті; 0,2 - глибина камери Фукс-Розенталя; d - наважка калюсної тканини, яку взяли для підрахунку клітин (г); V - кінцевий об’єм суспензії клітин.
10. Побудувати гафік залежності кількості клітин в 1 г калюсної тканини від співвідношення 2,4-Д:кінетин. Зробити висновок про оптимальне співвідношення ауксин:цитокінін у середовищі для калюсу.
^ КлітиннА суспензіЯ
Робота 12. Отримання клітинної суспензії
з калюсної тканини
Мета роботи: набуття навичок по отриманню клітинних суспензій; отримати суспензійну культуру картоплі (тютюну, топінамбура тощо).
^ Матеріали і обладнання: калюсна культура картоплі (тютюну, топінамбура тощо), вирощена на середовищі для калюсу №1 ( табл. 8 ), колби Ерленмейера на 250 мл з рідким (без агару) середовищем для калюсу №1 (100 мл середовища на колбу), стерильні чашки Петрі, фольга, пінцети, скальпелі, спирт, спиртівка, ламінар-бокс, шейкер, стерильні лійки з нейлоновими фільтрами.
^ ХІД РОБОТИ
1. Перенести шматочки калюсної тканини у стерильну чашку Петрі.
2. Стерильним пінцетом подрібнити калюс на фрагменти.
3. Фрагменти калюсної тканини помістити у колби Ерленмейера з рідким живильним середовищем ( 2-3г/100 мл ).
4. Колби з рослинним матеріалом культивувати у темряві на шейкері при 120 об/хв.
5. Через 10-14 днів середовище з клітинною суспензією профільтрувати через нейлон.
6. Фільтрат розділити на 3 порції, які розлити у стерильні колби Ерленмейера.
7. До клітинної суспензії додати свіже середовище, довести об’єм до 100 мл.
8. Колби з суспензійною культурою знову помістити на шейкер.
9. Субкультивування клітинної суспензії проводити кожні 14-18 днів.
Для цього у ламінар-боксі із колби з клітинною суспензією забрати 50-60 мл ( 2/3 об’єму) середовища з клітинами і замінити свіжим середовищем того ж складу. Відібране середовище перенести у стерильну колбу Ерленмейера і свіжим середовищем довести об’єм до 100 мл.
^ МІКРОКЛОНАЛЬНЕ РОЗМНОЖЕННЯ РОСЛИН
Робота 13. Мікроклональне розмноження рослин
живцями
Мета роботи: оволодіти методикою вегетативного розмноження рослин in vitro, яка базується на активації пазушних меристем.
^ Матеріали і обладнання: асептичні рослини картоплі, гвоздики або тютюну, стерильне середовище МС (у пробірках для рослин картоплі і гвоздики або баночках для рослин тютюну), стерильні чашки Петрі, скальпелі, пінцети, спирт, спиртівка, ламінар-бокс.
^ ХІД РОБОТИ
1. Пробірку з рослиною протерти спиртом і обпалити горло у полум’ї спиртівки.
2. Стерильним пінцетом витягти рослину-регенерант із пробірки, в якій вона росла і помістити її у стерильну чашку Петрі.
3. Підтримуючи рослину пінцетом, скальпелем порізати стебло на сегменти довжиною приблизно 10 мм так, щоб частина над брунькою становила 2-3 мм, а під нею - 5-7 мм. Обрізати листки.У верхівки рослини листки не обрізати.
4. Пінцетом перенести кожний сегмент у пробірку з живильним середовищем МС.
Пазуха листка має знаходитись над середовищем.
5. Культивувати при температурі 250-280С, освітленні 2-3 клк, 16-годинному фотоперіоді, відносній вологості повітря 70-75%.
6. Через 3-4 тижні з пазушних бруньок розвиваються рослини-регенеранти, які знову можна використати для розмноження живцюванням та інших цілей.
^ Робота 14. Стебловий органогенез із листкових дисків тютюну
Мета роботи: отримати рослини тютюну, регенеровані із листкових дисків.
Матеріали і обладнання: рослини тютюну, вирощені in vitro, баночки зі стерильним середовищем МС, чашки Петрі з середовищем МКР-1 (табл. 15), стерильні чашки Петрі, скальпелі, пінцети, спирт, спиртівка, парафілм, ламінар-бокс.
Таблиця 15
^Середовища для мікроклонального розмноження тютюну та моркви
(1 л середовища)
Компоненти | МКР-1 | МКР-2 | МКР-3 | МКР-4 | МКР-5 |
Макро МС | 100 мл | 100 мл | 100 мл | 100 мл | 100мл |
Мікро МС | 1 мл | 1 мл | 1 мл | 1 мл | 1 мл |
| Fe-хелат | 5 мл | 5 мл | 5 мл | 5 мл | 5 мл |
| Мезоінозит | 100 мг | 100 мг | 100 мг | 100 мг | 100 мг |
| В1 | 0,1 мг | 0,1 мг | 0,1 мг | 0,1 мг | 0,1 мг |
| В6 | 0,5 мг | 0,5 мг | 0,5 мг | 0,5 мг | 0,5 мг |
| РР | 0,5 мг | 0,5 мг | 0,5 мг | 0,5 мг | 0,5 мг |
| БАП | 1 мг | | | 0,1 мг | 0,1 мг |
| Кінетин | | 0,5 мг | | | |
| НОК | 0,1 мг | | | | 2 мг |
| ІМК | | 2 мг | | | |
| 2,4-Д | | | 1 мг | 2 мг | |
| Сахароза | 3% | 3% | | 3% | 3% |
| Агар | 0,8% | 0,8% | | 0,8% | 0,8% |
| рН | 5,6-5,8 | ||||
