Мусієнко М. М., Панюта О. О. Біотехнологія рослин. Навчальний посібник
| Вид материала | Документы |
- Ослин навчальний посібник до лабораторних занять з фізіології рослин для студентів, 2678.12kb.
- Удк 581. 8 (075. 8) Брайон О. В., Панюта О. О., Паршикова Т. В., Славний, 518.84kb.
- Практикум з педагогіки вищої школи: Навчальний посібник за модульно-рейтинговою системою, 411.72kb.
- Дмитриченко М. Ф., Навчальний посібник, 2529.95kb.
- Дмитриченко М. Ф., Навчальний посібник, 2842.03kb.
- Наталя Чабан навчальний посібник з історії української культури мвс україни, 9171.9kb.
- Програма вступних фахових випробувань за спеціальністю «фізіологія рослин» освітньо-кваліфікаційний, 164.35kb.
- Рекомендовано Міністерством освіти України як навчальний посібник для студентів архітектурних, 1979.84kb.
- Т. Г. Сабірзянов Печі ливарних цехів. Гриф «Навчальний посібник», 375.04kb.
- Н. М. Борівська Навчальний посібник містить цікавий матеріал стосовно урок, 283.61kb.
8. Стерильним пінцетом перенести один експлантат у стерильну чашку Петрі, яка встановлена на столику бінокулярного мікроскопа, який попередньо стерилізувався УФ променями у ламінар-боксі.
9. Під бінокулярним мікроскопом, притримуючи верхівку пагона очним пінцетом, очним скальпелем відділити покривні листки і листкові примордії. Меристему з одним-двома листковими примордіями і субапікальною тканиною відділити стерильним лезом. Цю операцію проводять із кожним експлантатом.
10. Ізольовану меристему стерильним пінцетом перенести на живильне середовище.
11. Пробірки з рослинним матеріалом культивувати при температурі 23-260С, освітленні 2-3клк, 16-годинному фотоперіоді, відносній вологості 70-75%.
12. Через 4-6 днів перевірити стерильність рослинного матеріалу. Через 25-30 днів мають вирости рослинки суниці.
Результати представити у таблиці 11.
Як рослинний матеріал у даній роботі можна використовувати пагони смородини, гвоздики, гербери, троянди, хризантеми, антуріума та інших рослин.
^ КАЛЮСНА КУЛЬТУРА
Робота 8. Отримання первинного калюсу
із різних експлантатів асептичних рослин
Мета роботи: отримати калюсну тканину із експлантатів листкового, стеблового, черешкового і міжвузлового походження; порівняти частоту калюсоутворення на експлантатах різного походження.
^ Матеріали і обладнання: асептичні рослини картоплі, гвоздики або тютюну, чашки Петрі зі стерильним середовищем для калюсу ( табл. 8 ), стерильні чашки Петрі, скальпелі, пінцети, леза, спирт, спиртівка, ламінар-бокс, парафілм.
^ ХІД РОБОТИ
1. Стерильним пінцетом витягти рослину із пробірки (картопля, гвоздика) або баночки (тютюн) і помістити її у стерильну чашку Петрі.
2. Підтримуючи рослину пінцетом, скальпелем розрізати її на експлантати: стебло, міжвузля, листок і черешок ( 5-10 мм ).
На листках зробити додаткові надрізи.
3. Експлантати помістити у чашки Петрі з калюсогенним середовищем.
4. Закрити чашку. Підписати.
5. Чашки з рослинним матеріалом культивувати у термостаті при температурі 250+10С.
6. Через 25-30 днів провести візуальне визначення частоти калюсоутворення на експлантатах.
Результати записати у таблицю 12.
Таблиця 12
| № п/п | Тип експлантата | ^ Загальна кількістьексплантатів | Кількість експлантатів, що утворили калюс | Індекс росту | |
| штук | % | ||||
| | | | | | |
^ Робота 9. Дослідження явища фізіологічної полярності
Полярність - це фізіологічна нерівноцінність протилежних полюсів певної клітини, органа або цілої рослини. У рослин вона виникла як наслідок нерівномірного впливу факторів навколишнього середовища на різні частини рослини. Полярність властива всім рослинним організмам, але найбільшого розвитку досягла у вищих рослин. Найяскравіше полярність виявляється при вкоріненні живців: на верхньому кінці живця розвиваються бруньки, а на нижньому кінці утворюються корені незалежно від положення живця в просторі. Мабуть, у зв’язку з цим калюс утворюється більш інтенсивно на боці експлантата, який на материнській рослині обернений до кореня, тому при отриманні калюсу на фрагментах стебла, шматочках кореня моркви експлантати поміщають на агар апікальною стороною. У разі ізолювання експлантата із бульб (топінамбур, картопля) полярність не має суттєвого значення. Для повного виключення впливу полярності експлантати бульб можна поміщати на середовище тангентально. Крім цього, якщо шматочок тканини досить великого розміру, його варто поміщати в середовище апікальним кінцем, при невеликих розмірах експлантата дотримання умов полярності стає менш важливим.
^ Мета роботи: ознайомитись із явищем фізіологічної полярності при культивуванні рослинних тканин in vitro.
Матеріали і обладнання: коренеплоди моркви, чашки Петрі зі стерильним середовищем для калюсу №2 ( табл.8 ), стерильні чашки Петрі, скальпелі, пінцети, пробкові свердла, спирт, спиртівка, ламінар-бокс, парафілм.
^ ХІД РОБОТИ
1. Простерилізувати коренеплоди моркви (робота 5).
2. Стерильним пробковим свердлом вичленити циліндр тканини: там, де гладкий зріз - апікальний кінець, а де надірваний – базальний.
3. Циліндр тканини скальпелем порізати на диски товщиною 1,5-2 мм.
4. Частину дисків помістити на середовище для калюсогенезу апікальною стороною донизу, а другу частину - помістити на середовище базальною стороною донизу.
5. Чашки Петрі з рослинним матеріалом культивувати у термостаті при 250+10С.
6. Через 5-6 тижнів порівняти частоту калюсоутворення на експлантатах моркви у першому та другому варіантах досліду. Частоту калюсоутворення визначають як відсоток експлантатів, які утворили калюс від загальної кількості експлантатів.
Результати записати у таблицю 13.
Таблиця 13
| № п/п | Положення експлантата на середовищі | Загальна кількість експлантатів (штук) | Частота калюсоутворення (%) |
| | | | |
^ Робота 10. Отримання перевивної калюсної культури
Первинний калюс, що утворився на експлантатах через 4-6 тижнів, переносять на свіже живильне середовище - перевивають ( субкультивують ). Розмір трансплантата при культивуванні на агаровому середовищі коливається від 60 до 100 мг маси тканини на 30-40 мл живильного середовища.
^ Мета роботи: наростити калюсну тканину і отримати перевивну культуру.
Матеріали і обладнання: чашки Петрі з експлантатами, на яких утворився калюс, чашки Петрі зі стерильним середовищем для калюсу ( табл. 8 ), пінцети, скальпелі, стерильні чашки Петрі, спирт, спиртівка, ламінар-бокс, парафілм.
^ ХІД РОБОТИ
1. Експлантат з первинним калюсом перенести у стерильну чашку Петрі.
2. Притримуючи експлантат пінцетом, скальпелем зрізати калюс.
3. Скальпелем поділити калюсну тканину на рівні фрагменти, які перенести на свіже живильне середовище.
4. Підписати чашку Петрі і закрити парафілмом.
5. Чашки культивувати у термостаті при 250+10С.
6. Через 4-6 тижнів від нарослої калюсної тканини відділити шматочки агарового середовища, а калюс розділити на рівні фрагменти, які перенести на свіже живильне середовище для калюсу.
Для підтримання калюсної культури дану операцію необхідно проводити кожні 4-6 тижнів.
^ Період субкультивування встановлюють для кожної культури експериментально.
Робота 11. Дослідження впливу співвідношення ауксин:цитокінін у живильному
середовищі на ріст калюсної тканини та її тип
Мета роботи: візуально визначити тип калюсної тканини на середовищах з різним співвідношенням ауксин:цитокінін; визначити співвідношення ауксин:цитокінін, яке забезпечує максимальний приріст маси калюсної тканини.
^ Матеріали і обладнання: чашки Петрі з калюсом (картоплі, тютюну, сої, топінамбура тощо), маточні розчини макро- та мікросолей МС, Fe-хелату, вітамінів, 2,4-Д, кінетин, інозит, сахароза, агар, 1N KOH, пеніцилінові флакончики, фольга, мірний циліндр, мірні піпетки, ваги, рН-метр, автоклав, стерильні чашки Петрі, скальпелі, пінцети, спирт, спиртівка, хромовий ангідрид, пробірки, камера Фукс-Розенталя, мікроскоп.
^ ХІД РОБОТИ
Робота складається з кількох етапів.
Етап 1.
1. Приготувати 1л середовища МС з додаванням 3 мг/л 2,4-Д ( робота 2).
2. Розділити середовище на 10 частин по 100 мл і розлити по пронумерованих стаканчиках.
3. До середовища у кожний стаканчик додати відповідну кількість кінетину від 0,1 до 1 мг/л (0,1, 0,2, 0,3...1 мг/л).
4. Середовище розлити по пеніцилінових флакончиках (по 5 мл), закрити фольгою і проавтоклавувати.
Етап 2.
1. У боксі 4-6-ти тижневу калюсну тканину розділити на рівні фрагменти, які перенести на середовище у пеніцилінові флакончики.
20-30 експлантатів залишити і окремо зважити для встановлення середньої маси експлантата.
2. Флакончики з калюсом культивувати у термостаті при 250+10С.
3. Через 6 тижнів візуально визначити тип калюсу і кожний шматочок калюсу вийняти із флакончика, відокремити від нього агар і зважити.
4. Відносний приріст маси калюсної тканини визначити за формулою:
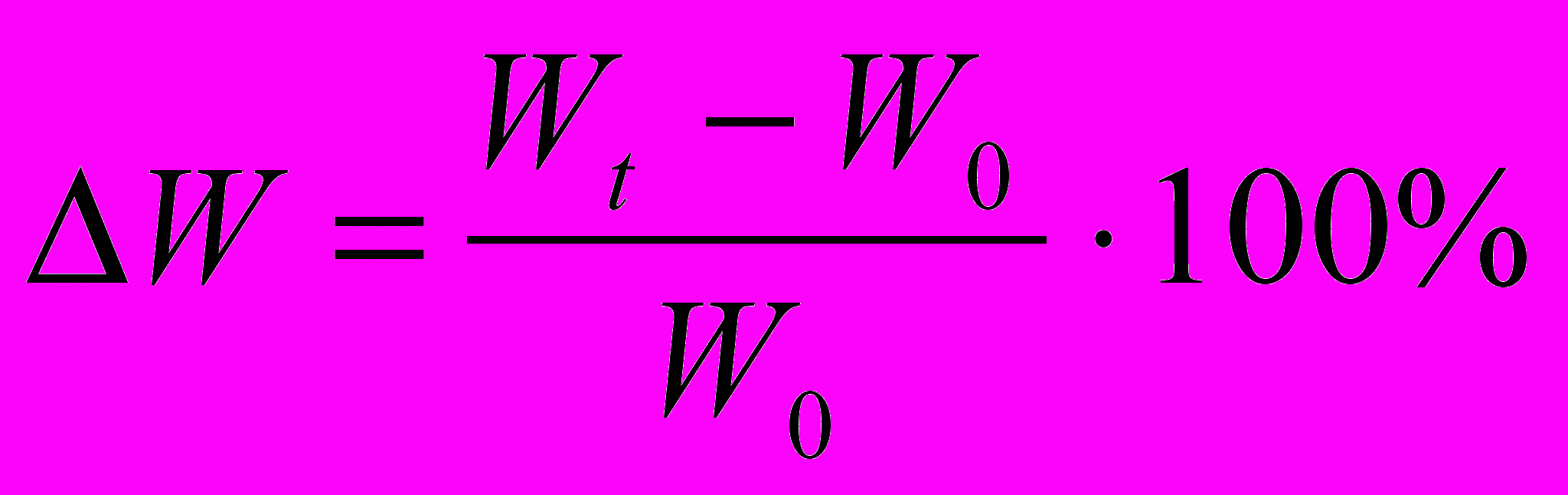 ,
,де ∆W - відносний приріст маси,
W0 - початкова маса калюсу,
Wt - кінцева маса калюсу.
Результати записати у таблицю 14 і побудувати діаграму.
Таблиця 14
| № п/п | Вміст кінетину у середовищі (мг/л) | Середня вага калюсу, мг | Відносний приріст маси калюсу, % | Тип калюсу | |
| початкова | кінцева | ||||
| | | | | | |
