Природа мембранного потенциала покоя
| Вид материала | Документы |
- 2 Современные представления о генерации мембранного потенциала покоя, 153.42kb.
- Міністерство охорони здоров’я України Український центр наукової медичної інформації, 290.67kb.
- Конкурсе методических разработок Тема: «Природа источник познания», 20.22kb.
- Медицинский портал студентам, врачам, медицинские книги, 246.39kb.
- Уроки з курсу “Я І Україна”, 590.67kb.
- М. Ю. Лермонтова Вцелом ряде произведений М. Ю. Лермонтова храм является значимым пространством, 252.48kb.
- 1. Дифференциальный каскад (ДК) на биполярных транзисторах: схема, режим покоя каскада, 54.47kb.
- Розділ 3 Економіка підприємства та організація виробництва, 221.25kb.
- План управления (менеджмент-план) природного парка «зона покоя укок» на 2009-2013, 3525.68kb.
- Задачи: углубить общее представление о строении эукариотической клетки на основе раскрытия, 356.11kb.
21. Роль нейромедиаторов и синаптических рецепторов в генерации возбуждающих и тормозных постсинаптических потенциалов.
Дубинин
3.4. Постсинаптические потенциалы. Распространение потенциала действия по нейрону
Запуск импульсной активности в нервной системе осуществляют два основных фактора. Первый из них — стимулы, действующие на чувствительные клетки сенсорных систем и изменяющие проницаемость их мембраны. Это приводит к развитию особых рецепторных потенциалов и в итоге — к генерации ПД.
Второй фактор — выделение медиатора из пресинаптического окончания. Попав в синаптическую щель, медиатор воздействует на постсинаптическую мембрану, возбуждая или тормозя следующий нейрон.
Процессы подобного возбуждения или торможения связаны с деятельностью еще одного типа ионных каналов — лиганд-зависимых (хемочувствительных). Они находятся на мембране, непосредственно окружающей синаптический контакт. Обычно они закрыты. Их открывание происходит лишь при появлении медиатора, несущего сигнал химического вещества (отсюда термин «хемочувствительные»).
Лиганд-зависимые каналы можно разделить на три основных класса: избирательно проницаемые по отношению к ионам Na+, ионам К+ и ионам Cl−. Отрывание первых из них приведет к входу в клетку ионов Na+ и деполяризации нейрона (рис. 3.14, а), во время которой разность потенциалов на мембране оказывается приближенной к порогу запуска ПД. В этот момент меньший, чем обычно, стимул может вызвать реакцию нейрона, т. е. нервная клетка находится в относительно возбужденном состоянии. В связи с этим локальная деполяризация мембраны под действием медиатора была названа возбуждающим постсинаптическим потенциалом (ВПСП). Медиаторы, вызывающие ВПСП, отнесены к группе возбуждающих медиаторов.
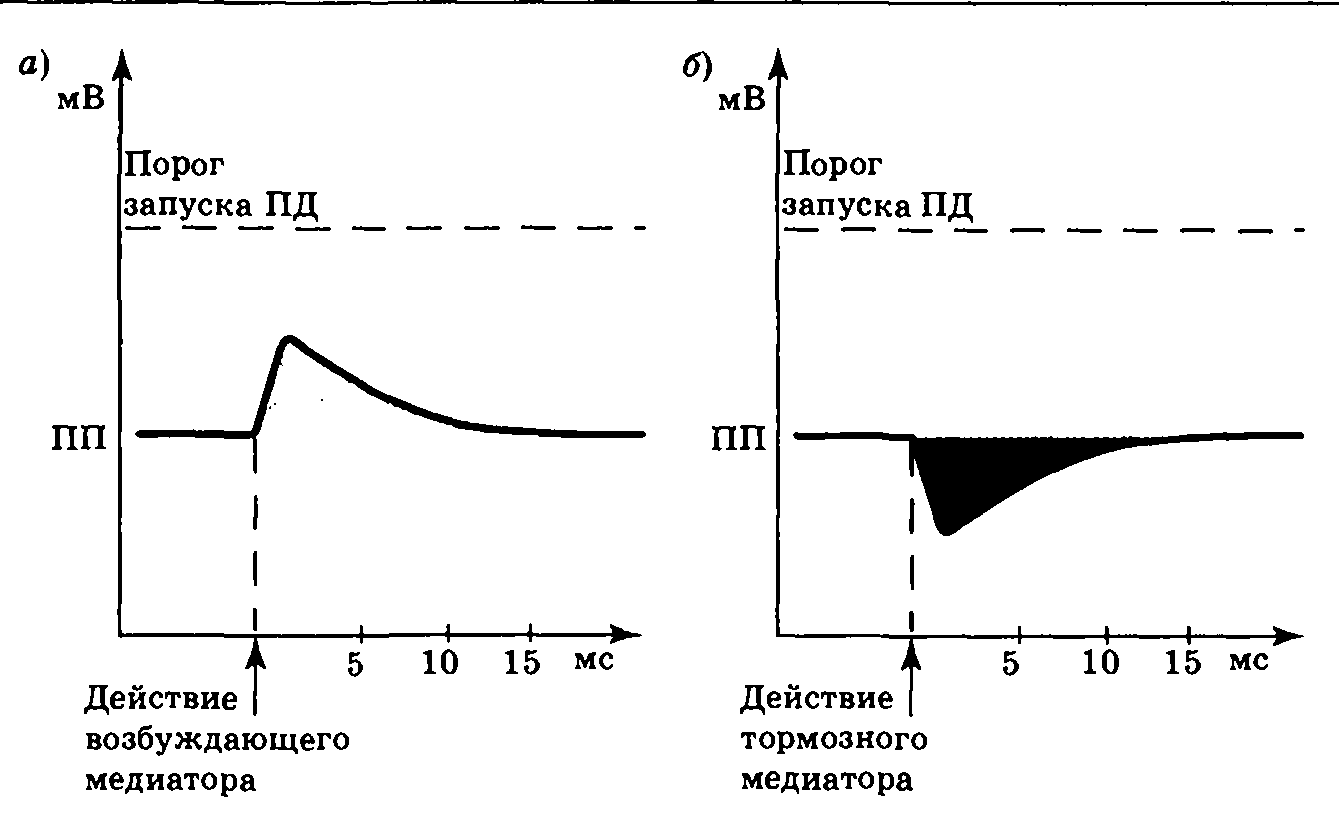 |
| Рис. 3.14. Изменение разности потенциалов на мембране нервной клетки при возникновении ВПСП (а) и ТПСП (б) |
Открывание хемочувствительных Cl−-каналов приводит к входу в клетку ионов хлора; открывание К+-каналов — к выходу ионов калия. В этих случаях возникает гиперполяризация и разность потенциалов на мембране нейрона увеличивается по абсолютной величине (рис. 3.14, б), поэтому для запуска ПД необходим больший, чем обычно, стимул. Следовательно, нервная клетка находится в относительно заторможенном состоянии. В связи с этим локальная гиперполяризация мембраны под действием медиатора была названа тормозным постсинаптическим потенциалом (ТПСП). Медиаторы, вызывающие ТПСП, отнесены к группе тормозных медиаторов.
Усредненные параметры ВПСП и ТПСП весьма близки (рис. 3.14). Их длительность составляет обычно около 10 мс (иногда 50—100 мс), что существенно больше, чем в случае ПД. Амплитуда ВПСП и ТПСП определяется длительностью и крутизной наклона их первой фазы, которая зависит от количества и длительности существования медиатора в синаптической щели. Амплитуда одиночных постсинаптических потенциалов в ЦНС составляет 1—5 мВ. В крупном нервно-мышечном синапсе аналог ВПСП — потенциал концевой пластинки, может достигать 40 и более мВ.
При детальном анализе сигнала можно видеть, что первые фазы ВПСП и ТПСП имеют ступенчатый характер, т. е. нарастают дискретно, шагами (квантами). Такая дискретность связана с тем, что выброс медиатора в синаптическую щель также идет квантами, где квант — одна везикула. В каждой везикуле содержится несколько тысяч молекул медиатора, и их воздействие на постсинаптическую мембрану вызывает сдвиг потенциала примерно на 0,1 мВ.
В подавляющем большинстве случаев (кроме потенциала концевой пластинки) одиночный ВПСП не способен запустить ПД, так как возбуждение, вызываемое медиатором, не дорастает до порогового уровня. Для достижения порога запуска ПД необходима суммация (наложение) нескольких ВПСП.
Выделяют два варианта суммации — временную и пространственную. Временная суммация — объединение эффектов стимулов, пришедших по одному «каналу» с большой частотой (рис. 3.15): если к еще не угасшему ВПСП присоединить второй, затем третий и т.д., — возникнет реальная возможность запустить ПД. Это означает, что сигнал, достигший синапса, достаточно интенсивен и «заслуживает» того, чтобы быть переданным дальше по сети нейронов.
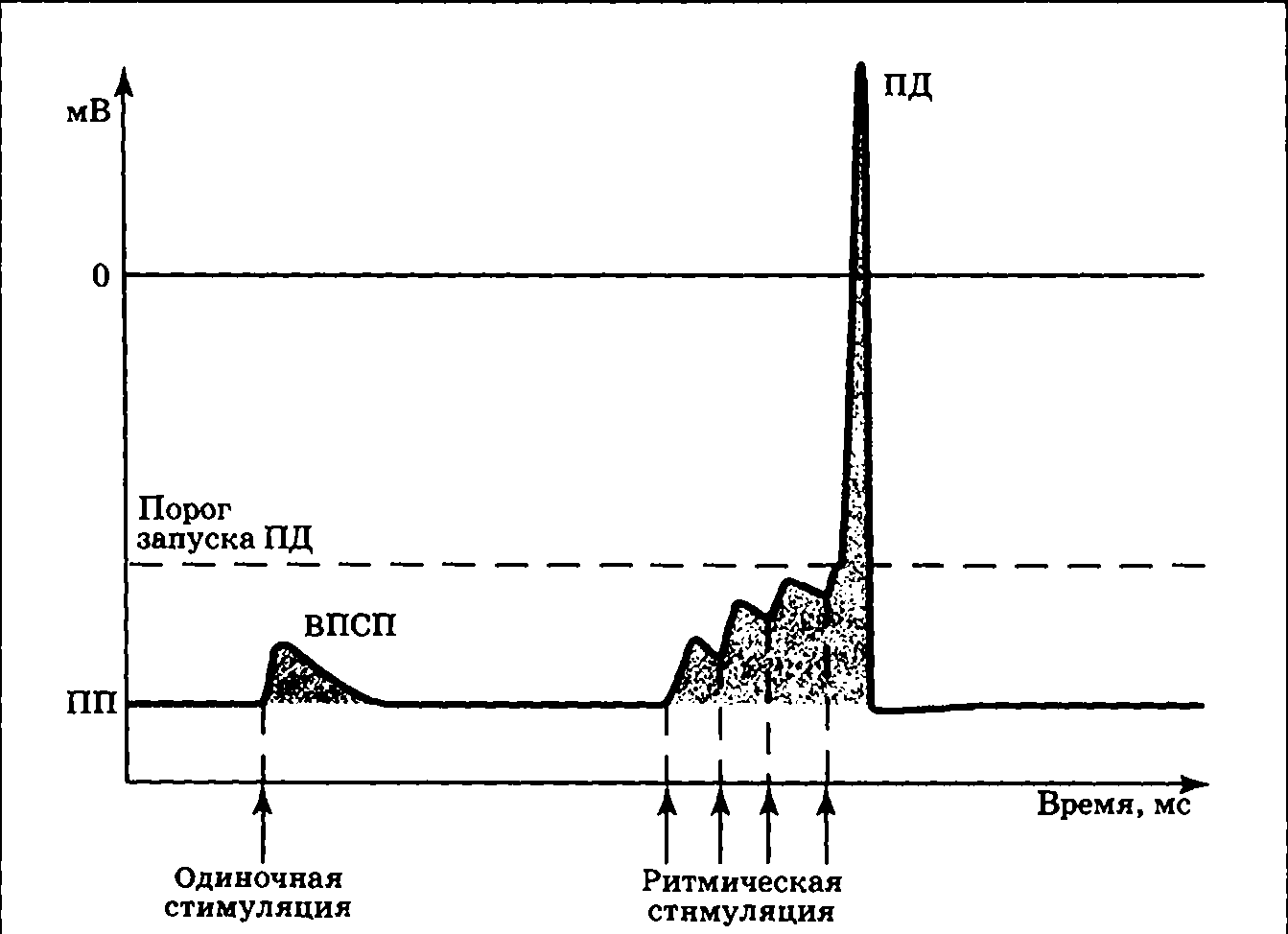 |
| Рис. 3.15. Схема временной суммации ВПСП, возникающих при повторной стимуляции синапса, выделяющего возбуждающий медиатор |
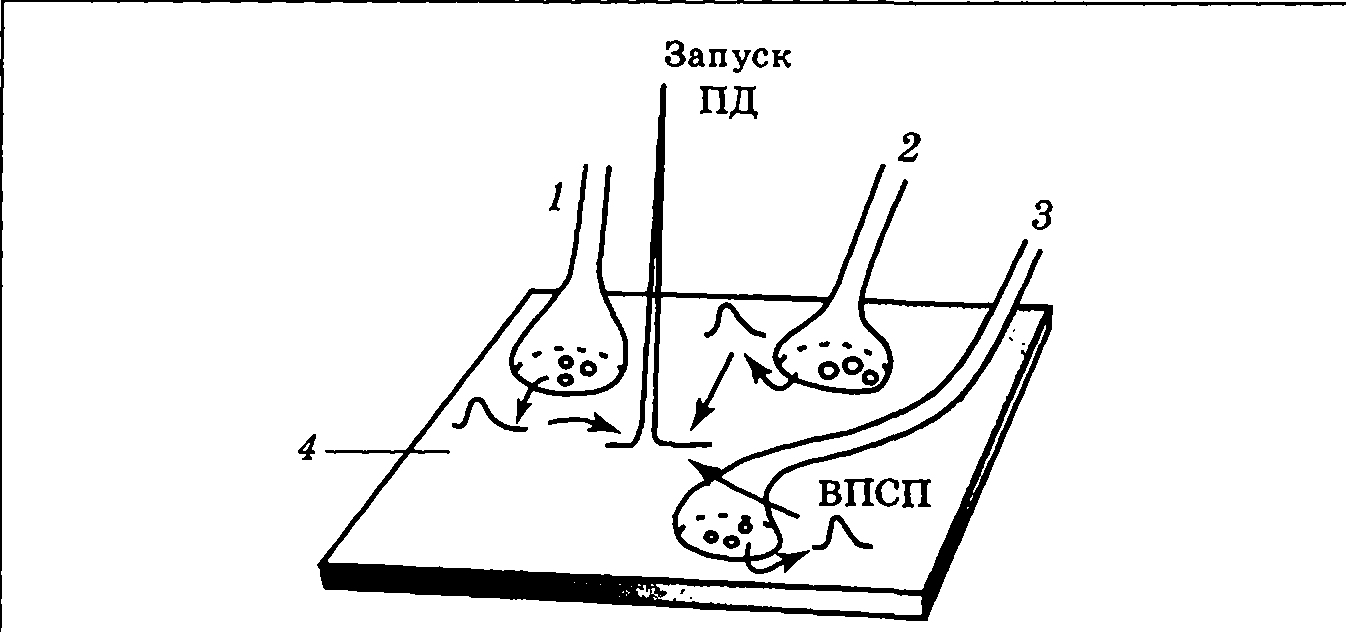 |
| Рис. 3.16. Схема пространственной суммации ВПСП в результате одновременного срабатывания синапсов 1 — 3 |
Пространственная суммация заключается в наложении друг на друга ВПСП соседних синапсов 1—3 в некоторой близлежащей точке постсинаптической мембраны 4 (рис. 3.16), обладающей потенциал-зависимыми ионными каналами. Схема пространственной суммации напоминает логическую ячейку по типу «И», т. е. результат положительный, если несколько условий будут выполнены (несколько входных сигналов одновременно достигнут нервной клетки).
В ходе деятельности нейронов эффекты пространственной и временной суммации объединяются, и чем больше синапсов участвуют в этом процессе (срабатывают относительно одномоментно), тем больше вероятность достичь порога запуска ПД. При этом часть синапсов может обладать тормозными свойствами и вызывать ТПСП, вычитающиеся из суммы возбуждающих влияний. В результате в первом приближении условие запуска ПД в каждый момент времени можно определить следующим образом:
ПП + (сумма всех ВПСП) − (сумма всех ТПСП) > порог запуска ПД
22. Возбудимость мембраны различных частей нейрона
В нейроне подавляющее большинство нейрональных синапсов находится на дендритах нейрона. Однако наиболее эффективно вызывают возбуждение нейрона синаптические контакты, расположенные на теле нейрона. Это связано с тем, что постсинаптические мембраны этих синапсов располагаются в непосредственной близости от места первичного возникновения ПД, располагающегося в аксонном холмике (место отхождения аксона от тела). Близость соматических синапсов к аксонному холмику обеспечивает участие их возбуждающего постсинаптического потенциала (ВПСП) в механизмах генерации ПД (некоторые авторы называют их генераторными синапсами). Также большой возбудимостью обладает мембрана в местах первого ветвления крупных дендритов. Чем ближе конкретный синапс к этим точкам, тем больше его вклад в управление генерацией ПД. Одного ТПСП, возникшего рядом с аксональным холмиком, может оказаться достаточно для прекращения проведения сигнала.
Генераторный пункт нейрона, т. е. место возникновения ПД - аксонный холмик (но ПД также может возникать в перехватах Ранвье, и на части мембраны дендритов). Синапсы на нем отсутствуют, отличительной особенностью мембраны аксонного холмика является ее высокая возбудимость, в 3 — 4 раза превосходящая возбудимость сома-дендритной мембраны нейрона, что объясняется более высокой концентрацией Na-каналов на аксонном холмике, отсутствием на нем миелиновой оболочки. ВПСП достигает аксонного холмика, обеспечивая здесь уменьшение мембранного потенциала до критического уровня. В этот момент в аксонном холмике возникает ПД.
Роль дендритов в возникновении возбуждения до сих пор дискутируется. Дендритные синапсы удалены на значительное расстояние от генераторного пункта нейрона, по этой причине их ВПСП не могут вызвать там должную деполяризацию и обеспечить генерацию ПД. Считают, что синаптический аппарат дендритов проявляет себя при одновременном поступлении возбуждения к значительному числу дендритных синапсов. При этом суммарный дендритный ВПСП, изменяя мембранный потенциал генераторного пункта на подпороговом уровне, лишь делает возбудимость большей или меньшей в зависимости от временных и амплитудных характеристик колебаний мембранного потенциала генераторного пункта относительно величины критического уровня деполяризации.
23. Возможные механизмы генерации потенциала действия нейрона в естественных условиях
Потенциал действия - это электрофизиологический процесс, выражающийся в быстром колебании мембранного потенциала покоя вследствие перемещения ионов в клетку и из клетки и способный распространяться без затухания. ПД обеспечивает передачу сигналов между нервными клетками, между нервными центрами и рабочими органами. ПД подчиняется закону «все или ничего», но не подчиняется закону силовых отношений, т. е. закону силы. При малом раздражении клетки ПД либо совсем не возникает, либо достигает максимальной величины, если раздражение является пороговым или сверхпороговым. Слабое (подпороговое) раздражение может вызвать локальный потенциал, который подчиняется закону силы: с увеличением силы стимула величина его также возрастает.
Запуск импульсной активности в нервной системе осуществляют два основных фактора. Первый из них — стимулы, действующие на чувствительные клетки сенсорных систем и изменяющие проницаемость их мембраны. Это приводит к развитию особых рецепторных потенциалов и в итоге — к генерации ПД.
Второй фактор — выделение медиатора из пресинаптического окончания. Попав в синаптическую щель, медиатор воздействует на постсинаптическую мембрану, возбуждая или тормозя следующий нейрон.
Механизм возникновения ПД. Если действие раздражителя на клеточную мембрану приводит к началу развития ПД, далее сам процесс развития ПД вызывает фазовые изменения проницаемости клеточной мембраны, что обеспечивает быстрое движение Na+ в клетку, а К+ — из клетки. Это наиболее часто встречаемый вариант возникновения ПД. Величина мембранного потенциала при этом сначала уменьшается до нуля, изменяет знак заряда, а затем снова восстанавливается до исходного уровня. Эти изменения мембранного потенциала предстают в виде пикового потенциала - ПД. Если заблокировать процесс выработки энергии, ПД некоторое время будет возникать. Но после исчезновения градиентов концентраций ионов (устранения потенциальной энергии) клетка генерировать ПД не будет. ПД проходит следующие фазы: 1). фаза деполяризации — процесс исчезновения заряда клетки до нуля; 2) фаза инверсии - изменение заряда клетки на противоположный, т.е. весь период ПД, когда внутри клетки заряд положительный, а снаружи отрицательный; 3) фаза реполяризации — восстановление заряда клетки до исходной величины (возврат к потенциалу покоя). Главную роль в возникновении ПД играет Na+, входящий в клетку при повышении проницаемости клеточной мембраны и обеспечивающий всю восходящую часть пика ПД. Однако проницаемость мембраны для К+ тоже играет важную роль. Если повышение проницаемости для К+ предотвратить, то мембрана после ее деполяризации реполяризуется гораздо медленнее, только за счет медленных неуправляемых каналов (каналов утечки ионов), через которые К+ будет выходить из клетки.
Для достижения порога запуска ПД необходима суммация (наложение) нескольких ВПСП. Выделяют два варианта суммации — временную и пространственную. Временная суммация — объединение эффектов стимулов, пришедших по одному «каналу» с большой частотой: если к еще не угасшему ВПСП присоединить второй, затем третий и т.д., — возникнет реальная возможность запустить ПД.
Пространственная суммация заключается в наложении друг на друга ВПСП соседних синапсов в некоторой близлежащей точке постсинаптической мембраны.
В ходе деятельности нейронов эффекты пространственной и временной суммации объединяются, и чем больше синапсов участвуют в этом процессе (срабатывают относительно одномоментно), тем больше вероятность достичь порога запуска ПД. При этом часть синапсов может обладать тормозными свойствами и вызывать ТПСП, вычитающиеся из суммы возбуждающих влияний. В результате условие запуска ПД в каждый момент времени можно определить следующим образом:
ПП + (сумма всех ВПСП) − (сумма всех ТПСП) > порог запуска ПД
И
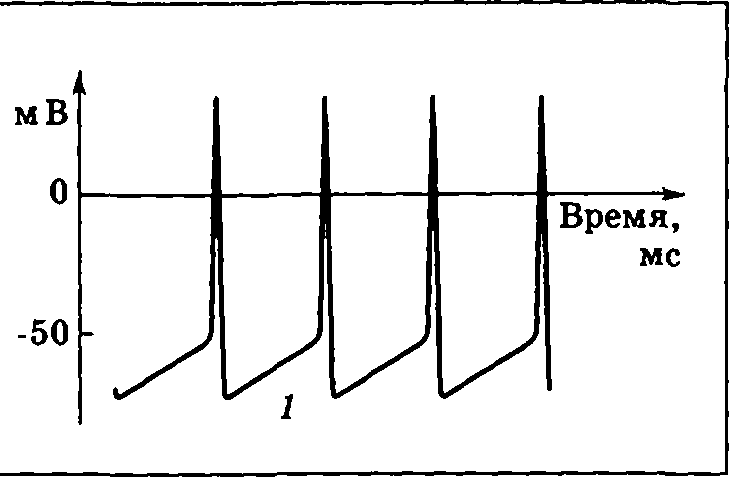 нтересным вариантом генерации ПД являются пейсмекерные нейроны (клетки-пейсмекеры). Они обладают большой постоянной проницаемостью мембраны для ионов Na+. В результате у клеток-пейсмекеров не существует стабильного ПП. Разность потенциалов на их мембране постоянно стремится вверх. Когда она достигает порогового значения, происходит запуск ПД. После ПД заряд внутри клетки оказывается на довольно низком уровне, ПП вновь растет и запускается следующий ПД, в целом же наблюдается ритмический рисунок разрядов (рис. 3.12). Рост заряда 1 внутри клетки, связанный с большим током утечки Na+, приводит к периодической самопроизвольной генерации потенциалов действия. Нейроны-пейсмекеры находятся в дыхательном центре продолговатого мозга, сходные же свойства имеют клетки центра сердечного автоматизма.
нтересным вариантом генерации ПД являются пейсмекерные нейроны (клетки-пейсмекеры). Они обладают большой постоянной проницаемостью мембраны для ионов Na+. В результате у клеток-пейсмекеров не существует стабильного ПП. Разность потенциалов на их мембране постоянно стремится вверх. Когда она достигает порогового значения, происходит запуск ПД. После ПД заряд внутри клетки оказывается на довольно низком уровне, ПП вновь растет и запускается следующий ПД, в целом же наблюдается ритмический рисунок разрядов (рис. 3.12). Рост заряда 1 внутри клетки, связанный с большим током утечки Na+, приводит к периодической самопроизвольной генерации потенциалов действия. Нейроны-пейсмекеры находятся в дыхательном центре продолговатого мозга, сходные же свойства имеют клетки центра сердечного автоматизма.Рис. 3.12. Изменение разности потенциалов на мембране пейсмекерного нейрона
Принципиальна новое, что вносит пейсмекерный потенциал в функционирование нейрона, заключается в следующем: пейсмекерный потенциал превращает нейрон из сумматора синаптических потенциалов в генератор.
При изучении нейронов оказалось что даже если нейрон «молчит», на постсинаптической мембране все равно наблюдаются периодические изменения мембранного потенциала - редкие, очень низкоамплитудные, кратковременные случаи деполяризации. Эти потенциалы были названы миниатюрными потенциалами (МП).
МП возникают в ответ на случаи спонтанного выброса медиатора из пресинапса в синаптическую щель. Как правило, свое содержимое в этом случае выбрасывают буквально единичные везикулы, поэтому МП отражают действие на постсинаптическую мембрану одного кванта медиатора - минимально возможной порции медиатора, которая может быть выброшена в щель, то есть содержимого одной везикулы.
24. Потенциалы глиальных клеток.
Глиальные клетки не обладают импульсной активностью, подобно нервным, однако мембрана глиальных клеток имеет заряд, формирующий мембранный потенциал, который отличается большой инертностью. Изменения мембранного потенциала медленны, зависят от активности нервной системы, обусловлены не синаптическими влияниями, а изменениями химического состава межклеточной среды. Мембранный потенциал нейроглии равен 70— 90 мВ.
Глиальные клетки способны к передаче возбуждения, распространение которого от одной клетки к другой идет с декрементом. При расстоянии между раздражающим и регистрирующим электродами 50 мкм распространение возбуждения достигает точки регистрации за 30—60 мс. Распространению возбуждения между глиальными клетками способствуют специальные щелевые контакты их мембран. Эти контакты обладают пониженным сопротивлением и создают условия для электротонического распространения тока от одной глиальной клетки к другой.
Вследствие того, что нейроглия очень тесно контактирует с нейронами, процессы возбуждения нервных элементов сказываются на электрических явлениях глиальных элементов. Это влияние может быть обусловлено тем, что мембранный потенциал нейроглии зависит от концентрации ионов К+ в окружающей среде. Во время возбуждения нейрона и реполяризации его мембраны вход ионов К+ в нейрон усиливается, что значительно изменяет его концентрацию вокруг нейроглии и приводит к деполяризации ее клеточных мембран.
Электрические свойства мембраны глиальных клеток. Цитоплазма этих клеток содержит
высокие концентрации ионов К+, а мембрана практически не пропускает другие ионы.
Поэтому МП приближается к калиевому равновесному потенциалу (около -90 мВ) и ведет
себя в точном соответствии с уравнением Нернста. Сопротивление мембраны глиальных
клеток приближается к таковому у нейронов, но способность к генерации нервных
импульсов и их проведению отсутствует. Межклеточные щели между нейронами и глией
шириной около 20 нм препятствуют прямому распространению токов возбуждения в
глиальные клетки. В то же время электрические разряды нейронов сопровождаются
деполяризацией глиальных клеток, пассивно отражающей накопление ионов К+ в
межклеточном пространстве. МП возвращается к норме в результате поглощения и
диффузии калия. Возникающие таким образом колебания МП вносят свой вклад в
регистрируемые внеклеточными электродами потенциалы (например,
электроэнцефалограмма, электроретинограмма). Мембрана глиальных клеток содержит
рецепторы, которые могут регулировать внутриклеточные процессы (например, глутаматные
рецепторы гигантских глиальных клеток пиявки регулируют входящие кальциевые токи, а β-
адренорецепторы астроцитов контролируют внутриклеточную концентрацию цАМФ).
25. Природа и функции ГЭБ.
Гемато-энцефалический барьер (ГЭБ— физиологический барьер между кровеносной системой и центральной нервной системой. ГЭБ имеется у всех позвоночных, главной его функцией является поддержание гомеостаза мозга.
Гемато-энцефалический барьер защищает нервную ткань от циркулирующих в крови микроорганизмов, токсинов, клеточных и гуморальных факторов иммунной системы, которые воспринимают ткань мозга как чужеродную. Он выполняет функцию высокоселективного фильтра, через который в мозг поступают питательные вещества, а в кровеносное русло выводятся продукты его жизнедеятельности.
Организм человека и высших животных обладает рядом специфических физиологических систем, обеспечивающих приспособление (адаптацию) к постоянно изменяющимся условиям существования. Этот процесс тесно связан с необходимостью обязательного сохранения постоянства существенных физиологических параметров, внутренней среды организма, физико-химического состава тканевой жидкости межклеточного пространства.
Среди гомеостатических приспособительных механизмов, призванных защитить органы и ткани от чужеродных веществ и регулировать постоянство состава тканевой межклеточной жидкости, ведущее место занимает гематоэнцефалический барьер. По определению Л. С. Штерн, гематоэнцефалический барьер объединяет совокупность физиологических механизмов и соответствующих анатомических образований в центральной нервной системе, участвующих в регулировании состава цереброспинальной жидкости (ЦСЖ).
В представлениях о гематоэнцефалическом барьере в качестве основных положений подчеркивается следующее: 1) проникновение веществ в мозг осуществляется главным образом не через ликворные пути, а через кровеносную систему на уровне капилляр — нервная клетка; 2) гематоэнцефалический барьер является в большей степени не анатомическим образованием, а функциональным понятием, характеризующим определенный физиологический механизм. Как любой существующий в организме физиологический механизм, гематоэнцефалический барьер находится под регулирующим влиянием нервной и гуморальной систем; 3) среди управляющих гематоэнцефалическим барьером факторов ведущим является уровень деятельности и метаболизма нервной ткани.
Гематоэнцефалический барьер регулирует проникновение из крови в мозг биологически активных веществ, метаболитов, химических веществ, воздействующих на чувствительные структуры мозга, препятствует поступлению в мозг чужеродных веществ, микроорганизмов, токсинов.
Основной функцией, характеризующей гематоэнцефалический барьер, является проницаемость клеточной стенки. Необходимый уровень физиологической проницаемости, адекватный функциональному состоянию организма, обусловливает динамику поступления в нервные клетки мозга физиологически активных веществ.
Функциональная схема гематоэнцефалического барьера включает в себя наряду с гистогематическим барьером нейроглию и систему ликворных пространств . Гистогематический барьер имеет двойную функцию: регуляторную и защитную. Регуляторная функция обеспечивает относительное постоянство физических и физико-химических свойств, химического состава, физиологической активности межклеточной среды органа в зависимости от его функционального состояния. Защитная функция гистогематического барьера заключается в защите органов от поступления чужеродных или токсичных веществ эндо- и экзогенной природы.
Ведущим компонентом морфологического субстрата гематоэнцефалического барьера, обеспечивающим его функции, является стенка капилляра мозга. Существуют два механизма проникновения вещества в клетки мозга: через цереброспинальную жидкость, которая служит промежуточным звеном между кровью и нервной или глиальной клеткой, которая выполняет питательную функцию (так называемый ликворный путь), и через стенку капилляра. У взрослого организма основным путем движения вещества в нервные клетки является гематогенный (через стенки капилляров); ликворный путь становится вспомогательным, дополнительным.
Проницаемость гематоэнцефалического барьера зависит от функционального состояния организма, содержания в крови медиаторов, гормонов, ионов. Повышение их концентрации в крови приводит к снижению проницаемости гематоэнцефалического барьера для этих веществ.
Функциональная система гематоэнцефалического барьера представляется важным компонентом нейрогуморальной регуляции. В частности, через гематоэнцефалический барьер реализуется принцип обратной химической связи в организме. Именно таким образом осуществляется механизм гомеостатической регуляции состава внутренней среды организма.
Регуляция функций гематоэнцефалического барьера осуществляется высшими отделами ЦНС и гуморальными факторами. Значительная роль в регуляции отводится гипоталамо-гипофизарной адреналовой системе. В нейрогуморальной регуляции гематоэнцефалического барьера важное значение имеют обменные процессы, в частности в ткани мозга. При различных видах церебральной патологии, например травмах, различных воспалительных поражениях ткани мозга, возникает необходимость искусственного снижения уровня проницаемости гематоэнцефалического барьера. Фармакологическими воздействиями можно увеличить или уменьшить проникновение в мозг различных веществ, вводимых извне или циркулирующих в крови
26. Трофические функции нервных и глиальных клеток.
Трофика нейрона. Внутри нейрона находится желеобразное вещество — нейроплазма. Тела нервных клеток выполняют трофическую функцию по отношению к отросткам, т. е. регулируют их обмен веществ.
Трофическое влияние на эффекторные клетки организма с помощью химических веществ самих нервных клеток.
Питательная функция глии была предположена Гольджи, исходя из структурных соотношений нервных и глиальных клеток и соотношения последних с капиллярами мозга. Отростки протоплазматических астроцитов (сосудистые ножки) тесно контактируют с базальной мембраной капилляров, покрывая до 80% их поверхности. Трофическая функция глиальных клеток осуществляется либо одним астроцитом (сосудистая ножка ножка на капилляре а другие отростки – на нейроне), либо через систему астроцит – олигодендроцит – нейрон. Показано также что глиальные клетки принимают участие в образовании гемато-энцефалического барьера, обеспечивающего, как известно, селективный перенос веществ из крови в нервную ткань. Однако, следует отметить, что существенная роль глиальных клеток в функционировании гемато-энцефалического барьера признается не всеми исследователями
27. Концепции реактивности и активности в рассмотрении функционирования нейрона.
Парадигма реактивности: нейрон, как и индивид, отвечает на стимул. С позиций традиционной парадигмы реактивности поведение индивида представляет собой реакцию на стимул. В основе реакции лежит проведение возбуждения по рефлекторной дуге: от рецепторов через центральные структуры к исполнительным органам.
Нейрон при этом оказывается элементом, входящим в рефлекторную дугу, а его функция — обеспечением проведения возбуждения. Тогда совершенно логично рассмотреть детерминацию активности этого элемента следующим образом: ответ на стимул, подействовавший на некоторую часть поверхности нервной клетки, может распространяться дальше по клетке и действовать как стимул на другие нервные клетки. В рамках парадигмы реактивности рассмотрение нейрона вполне методологически последовательно: нейрон, как и организм, реагирует на стимулы. В качестве стимула выступает импульсация, которую нейрон получает от других клеток, в качестве реакции — следующая за синаптическим притоком импульсация данного нейрона.
Парадигма активности: нейрон, как и индивид, достигает «результат», получая необходимые метаболиты из своей микросреды.
28. Стандартные диапазоны фоновой электроэнцефалограммы.
ЭЭГ - метод регистрации электрической активности (биопотенциалов) головного мозга через неповрежденные покровы головы (интактный метод), позволяющий судить о его физиологической зрелости, функциональном состоянии, наличии очаговых поражений, общемозговых расстройствах и их характере.
(Регистрация биопотенциалов непосредственно с обнаженного мозга называется электрокортикографией, ЭКоГ, и обычно проводится во время нейрохирургических операций).
Первым ученым, продемонстрировавшим возможность такой регистрации электрической активности головного мозга человека был Ганс Бергер (работы 1929-1938 гг).
Основными понятиями, на которые опирается характеристика ЭЭГ, являются:
-средняя частота колебаний
-максимальная амплитуда
-фаза
Суммарная фоновая ЭЭГ коры и подкорковых образований мозга животных, варьируя в зависимости от уровня филогенетического развития и отражая цитоархитектонические и функциональные особенности структур мозга, также состоит из различных по частоте медленных колебаний.
Одной из основных характеристик ЭЭГ является частота. Однако из-за ограниченных перцепторных возможностей человека при визуальном анализе ЭЭГ, применяемом в клинической электроэнцефалографии, целый ряд частот не может быть достаточно точно охарактеризован оператором, так как глаз человека выделяет только некоторые основные частотные полосы, явно присутствующие в ЭЭГ. В соответствии с возможностями ручного анализа была введена классификация частот ЭЭГ по некоторым основным диапазонам, которым присвоены названия букв греческого алфавита:
альфа — 8—13 Гц,
бета — 14—40 Гц,
тета — 4—6 Гц,
дельта — 0,5—3 Гц,
гамма — выше 40 Гц и др.).
У здорового взрослого человека при закрытых глазах регистрируется основной альфа-ритм. Это так называемая синхронизированная ЭЭГ.
При открытых глазах или при поступлении сигналов от других органов чувств происходит блокада альфа-ритма и появляются бета-волны. Это называется десинхронизацией ЭЭГ.
Тета-волны и дельта-волны в норме у бодрствующих взрослых не выявляются, они появляются только во время сна.
Для ЭЭГ подростков и детей напротив характерны более медленные и нерегулярные дельта-волны даже в бодрствующем состоянии.
В зависимости от частотного диапазона, но также и от амплитуды, формы волны, топографии и типа реакции различают ритмы ЭЭГ, которые также обозначают греческими буквами. Например, альфа-ритм, бета-ритм, гамма-ритм, дельта-ритм, тета-ритм, каппа-ритм, мю-ритм, сигма-ритм и др. Считается, что каждый такой «ритм» соответствует некоторому определённому состоянию мозга и связан с определёнными церебральными механизмами.
29.Вызванная суммарная биоэлектрическая активность головного мозга.
Вызванная электрическая активность головного мозга - биоэлектрическая активность головного мозга, возникающая в постимпульсном интервале в ответ на афферентную стимуляцию или на прямое раздражение структур мозга. Различают:
- вызванную активность одиночных нейронов;
- вызванные комплексные реакции;
- вызванные потенциалы и др.
Электрическая активность головного мозга — одно из проявлений метаболизма, находящее свое отражение в различных (импульсных и градуальных) изменениях потенциала возбудимых мембран. В результате суперпозиции этих элементарных проявлений электрогенеза возникает широкий спектр различных электрических реакций головного мозга, с достаточной полнотой отражающих как функции целого мозга, так и функции различных мозговых образований. В зависимости от способа и условий регистрации в электрофизиологии могут отдельно рассматриваться изменения мембранного потенциала, потенциалы действия, электроэнцефалограмма (суммарная биоэлектрическая активность), медленная электрическая активность, вызванные потенциалы и т.д. Регистрация Э. а. г. м. занимает важное место в нейрофизиологии, психофизиологии, диагностической и лечебной работе и т.д., т.к. позволяет оценивать внутрицентральные отношения и функциональное состояние мозга при восприятии, внимании, формировании и воспроизведении следа памяти, реализации других функций мозга.
Электроэнцефалография (ЭЭГ) (греч. enkephalos – мозг + gramma – запись) – это регистрация суммарной электрической активности головного мозга. Электрические колебания в коре головного мозга обнаружили Р. Кетон (1875) и В.Я. Данилевский (1876). Впервые ЭЭГ у животных была зарегистрирована В.В. Правдич-Неминским (1913 – 1925), а у человека – Г. Бергером (1929), которые описали основные ритмы ЭЭГ. Запись ЭЭГ возможна как с поверхности кожи головы, так и с поверхности коры в эксперименте и в клинике при нейрохирургических операциях. В этом случае она называется электрокортикограммой. Служит для анализа изменения мозговой активности в тех или иных экспериментальных ситуациях. Запись ЭЭГ производится с помощью биполярных (оба активны) или униполярных (активный и индифферентный) электродов, накладываемых попарно и симметрично в лобно-полюсных, лобных , центральных, теменных, височных и затылочных областях мозга. В клинике обычно используется запись с помощью 10-12 электродов. Основными анализируемыми параметрами являются частота и амплитуда волновой активности. Кроме записи фоновой ЭЭГ используют функциональные пробы: экстероцептивные (световые, слуховые и др.), проприоцептивные, вестибулярные раздражители, гипервентиляция, сон.
Происхождение волн ЭЭГ выяснено недостаточно. Наиболее вероятно, что ЭЭГ отражает алгебраическую сумму возбуждающих и тормозных постсинаптических потенциалов ( ВПСП и ТПСП) множества нейронов. На основании данных о физиологических процессах строятся гипотезы о работе различных психических структур, таких как восприятие, внимание, мышление, память, эмоции, движения, речь и саморегуляция. Кроме того в силу существования стойких индивидуальных особенностей ЭЭГ данный метод может использоваться в дифференциальной психологии и психофизиологии.
Ритмы мозга.
Ритмы мозга (греч. rhytmos – равномерное чередование) — спонтанная электрическая активность мозга, обусловленная суммацией электрической активности нейронов. В электроэнцефалограмме можно выделить следующие ритмы: альфа, бета, гамма, дельта, тета.
Альфа–ритм в состоянии относительного покоя имеет частоту — 8–13 Гц, среднюю амплитуду — 30–70 мкВ с периодическим усилением и ослаблением (альфа–веретена). Фиксируется в первую очередь в затылочных отделах головного мозга. Анализ характеристик альфа–ритма важен при изучении когнитивных процессов, возрастной динамики и индивидуальных особенностей. Вызывается таламо–кортикальными и интракортикальными процессами. По мнению Г. Уолтера, альфа–ритм — это свидетельство процесса сканирующих поисков паттерна, он затухает, когда паттерн найден.
Бета–ритм представляет собой низкоамплитудные (с амплитудой в 4–5 раз меньше, чем у альфа–ритма), треугольные по форме колебания с частотой 13–25 Гц.. Фиксируется при умственной работе, при эмоциональном напряжении и в условиях воздействия внешних раздражителей.
Гамма–ритм характеризуется частотой 25–30 Гц. и амплитудой до 25 мкВ. Обычно маскируется более медленными волнами.
Мю–ритм по частоте и амплитуде похож на затылочный альфа–ритм. Фиксируется в области роландовой извилины коры головного мозга. Изменения мю–ритма связаны только с влиянием кинестезических раздражителей. Так, при выполнении любых движений происходит блокировка мю–ритма.
Тета–ритм имеет частоту 4–8 Гц. и амплитуду 10–200 мкВ. При низкой амплитуде (25–35 мкВ) тета–ритм входит как компонент в нормальную ЭЭГ. Познавательная активность приводит к увеличению мощности и пространственной синхронизации тета–волн. Если в состоянии бодрствования наблюдаются пароксизмальные и асимметричные тета–волны, то это может свидетельствовать о патологии. Для детей, у которых тета–ритм относительно более выражен, повышена вероятность проявления черт неуравновешенности и агрессивности, свидетельствующих о затруднений социальной адаптацией. По мнению Г. Уолтера, тета–ритм обеспечивает сканирование чувства удовольствия.
В том или ином психологическом состоянии набор ритмов, составляющих электроэнцефалограмму, меняется. При активации (психическом напряжении, решении задач, работа) происходит усиление высокочастотных ритмов, а при достижения покоя (сне) — низкочастотных. В частности, при достижении состояния гипнотического сна исчезает альфа–ритм, снижается частота и амплитуда бета–ритма, нарастают дельта— и тета–ритмы, а в состоянии дза–дзен резко возрастает альфа–ритм и происходит синхронизация ритма 2–й половины. При альфа–ритме со значением 10,5 гц достигается глубокая релаксация. Отмечено также, что ритмы мозга гипнолога и испытуемого, подвергающегося воздействию гипноза, синхронизируются. Низкий бета–ритм (15 гц) свидетельствует о нормальном состоянии бодрствования, высокий бета–ритм (30 гц) — о наркотическом опьянении, низкий тэта–ритм (4 гц) — о глубоком сне, а более высокий (7 гц) — о медитативном „путешествии вне тела“.
Вопрос 30.Вызванные потенциалы.
Вызванными потенциалами называются биоэлектрические сигналы, которые появляются с постоянными временными интервалами после определенных внешних воздействий. В англоязычной литературе распространено название - потенциалы, тесно связанные с определенными внешними факторами (event-related potentials-ERP), предложенное Воганом в 1969 году.
Воган различает 5 классов таких потенциалов:
- Сенсорные ВП
- Моторные ВП
- Потенциалы с большим латентным периодом, связанные со сложными психологическими факторами
- Сдвиги постоянного потенциала
- Потенциалы немозгового происхождения.
Сенсорные ВП в свою очередь подразделяются в зависимости от модальности на зрительные, соматосенсорные, слуховые и в зависимости от периода времени анализа (иначе говоря времени возникновения потенциала после стимула) на коротколатентные (мозгового ствола), средне- и длиннолатентные.
ЗРИТЕЛЬНЫЕ ВП: Наиболее часто исследуют ВП на вспышку света и обращение шахматного паттерна. Регистрирующие электроды располагают в проекционных зрительных зонах ( на 2 см выше затылочного бугра и на 2 см в стороны от сагиттальной линии).
СОМАТОСЕСОРЫЕ ВП: Возможно получение ССВП при раздражении любого периферического нерва. В клинической практике чаще используется срединный нерв. Интенсивность стимуляции- до появления отчетливых сок- ращений мышц кисти (по другой методике на 50-60 мкВ выше сенсорного порога). Поочередно слева и права. Регистрирующие электроды располагают над постцентральной извилиной, контрлатерально стороне стимуляции.
СЛУХОВЫЕ ВП: Для стимуляции используют звуковые щелчки. Регистрируют ВП в области конвекса.
СТВОЛОВЫЕ ВП: ВП возникающий в первые 10 мсек после стимула. По модальностям - слуховые и соматосенсорные.
ДИАГНОСТИКА: Метод связан с выделением слабых и сверхслабых изменений электрической активности мозга в ответ на стимул (звуковой, световой, соматосенсорный и т.д.) и широко используется благодаря применению для их регистрации компьютерной техники. По типу предъявляемого стимула ВП подразделяют на: зрительные вызванные потенциалы (ЗВП), акустические или слуховые вызванные потенциалы (АВП), соматосенсорные вызванные потенциалы (ССВП) и т.д. Использование ВП является неоценимым средством для раннего обнаружения и прогноза неврологических расстройств при различных заболеваниях, таких как инсульт, опухоли головного мозга, последствия черепно-мозговой травмы, а также рассеянный склероз и другие демиелинизирующие заболевания. Исследования показывают, что зрение доставляет нам 70% информации, слух - 15% и осязание 10%. Раннее определение степени дисфункции трех наиболее важных сенсорных чувств и состояния их сенсорных функций методом ВП является, таким образом, жизненно важным для применения адекватного лечения различных заболеваний. В последнее время ВП находят широкое применение для объективного исследования центральных механизмов нарушения сенсорных функций. Объективная оценка степени нарушения и уровня поражения анализаторной системы, не требующей словесного отчета больного, представляет удобство при исследовании маленьких детей, психически измененных пациентов или негативно настроенных на обследование больных. В настоящее время основные области применения методики ВП: оценка расстройств зрительного пути, тестирование функций слуха, оценка состояния сенсомоторной коры, нарушение коры мозга, локализация нарушений ствола мозга, сотояние когнитивных функций мозга, нарушение периферических нервов, нарушение движений глаз и процессов в сетчатке, нарушение в проводящих путях спинного мозга, оценка комы и смерть мозга.
ОСОБЕННОСТИ ВП У ЗДОРОВЫХ В РАЗНЫХ ВОЗРАСТНЫХ ГРУППАХ: Общая тенденция от периода новорожденности до окончательного созревания мозга (примерно к 18 годам), проявляется в усложнении формы ВП, появлении всех обязательных компонентов; уменьшении их латентных периодов и амплитуд. До 40-50 лет характеристики ВП остаются достаточно стабильны- ми. Приблизительно с 5-й декады жизни в ВП начинается умеренное нарастание латентных периодов ранних и поздних компонентов с увеличением их амплитуд, причем, более выраженно это проявляется у компонентов N2 и P3.
ИЗМЕНЕНИЯ ВП У БОЛЬНЫХ С ОПУХОЛЯМИ ГОЛОВНОГО МОЗГА: В большинстве случаев, при локализации опухоли в полушариях мозга, изменения ВП происходят по деструктивному типу, т.е. в зависимости от тяжести поражения наблюдается снижение амплитуды компонентов ВП (иногда их полное исчезновение) и удлинение латентных периодов. Наиболее выраженные на- рушения регистрируются в зонах специфических сенсорных проекций. При субтенториальной локализации опухоли со вторичным вовлечением ствола мозга может наблюдаться выраженное нарастание амплитуды всех компонентов ВП (по другим данным снижение амплитуды). Т.е. изменения ВП при стволовых поражениях носят нелокализованный и диффузный характер, что, отражает преимущественное нарушение неспецифических влияний ствола в отношении ВП.
ИЗМЕНЕНИЯ ВП У БОЛЬНЫХ ЭПИЛЕПСИЕЙ: Диагностическими признаками эпилепсии служат следующие критерии: 1. Значительная вариабельность формы ВП 2. Высокая амплитуда ВП, особенно компонентов в области N2-P4 и послеразряда 3. Снижение амплитуды ВП в процессе гипервентиляции 4. Преобразование ВП в комплексы пик-волна, острая волна - медленная волна.
ИЗМЕНЕНИЯ ВП ПРИ ЦЕРЕБРАЛЬНО-СОСУДИСТЫХ НАРУШЕНИЯХ: Изменения ВП при инсультах проявляются в снижении амплитуды и увеличении латентных периодов по сравнению с интактным полушарием. Изменения при прогрессирующих МК изучены значительно меньше.
Вопрос № 31 Моторные потенциалы.
Моторные вызванные потенциалы
Моторные вызванные потенциалы - это электрические потенциалы мышцы или спинного мозга, возникающие в ответ на раздражение моторной зоны коры или двигательных путей ЦНС. В клинических исследованиях регистрируют составной потенциал действия мышцы, вызванный чрескожной магнитной стимуляцией моторной зоны коры. В результате сильного, но кратковременного воздействия магнитного поля в нервной ткани возникают стимулирующие токи. Исследование это безболезненно и безопасно.
Изменение моторных вызванных потенциалов наблюдается при неврологических заболеваниях, поражающих двигательные пути ЦНС, - например, при рассеянном склерозе и болезнях мотонейронов . Возможности этого исследования еще не получили окончательной оценки. При помощи метода моторных вызванных потенциалов можно уточнить прогноз неврологических заболеваний - например, оценить вероятность восстановления двигательной функции после инсульта, а также контролировать состояние двигательных путей во время нейрохирургических операций.
