Природа мембранного потенциала покоя
| Вид материала | Документы |
СодержаниеСравнение химического и электрического синапсов Химический синапс Физиологический эффект Точность передачи информации Чувствительность к температуре Ионотропные рецепторы Метаботропные рецепторы Катехоламины = норадреналин + адреналин + дофамин. Индоламины = Серотонин + Гистамин. Глутаминовая кислота Аспаргиновая кислота Гамма-аминомасляная кислота (ГАМК) Билет 16. Вторичные посредники. 18. Отличие некроза от апоптоза. Роль стволовых клеток и апотоза в индивид. развитии и некоторых нервных заболеваниях Основные отличительные черты некроза и апоптоза Результатом апоптоза Среди заболеваний нервной системы Болезнь Паркинсона Болезнь Альцгеймера Синдром Дауна (СД). ... 4 5 6 7 8 9 10 Сравнение химического и электрического синапсов:
13. Синаптическая передача возбуждения Вариант1: Синаптическая передача — распространение возбуждения через синапс. В пресинаптическом окончании медиатор накапливается в синаптических пузырьках (везикулах). Возбуждение, приходящее по пре-синаптической терминали, деполяризует пресинаптическую мембрану, пузырьки подходят к синаптической мембране, и медиатор выходит в синаптическую щель. Затем он диффундирует к постсинаптической мембране, действует на ее рецепторы, вследствие чего изменяется ее проницаемость, на ней возникает возбуждающий (ВПСП) или тормозной потенциал (ТПСП). Суммация возбуждающих и тормозных потенциалов определяет возникновение в клетке деполяризации или гиперполяризации. При клеточной деполяризации возникает потенциал действия, при гиперполяризации клетка находится в тормозном состоянии. Как только медиатор перестает действовать на ионный канал начинается процесс терминации синаптической передачи:
Медиатор в синаптической щели расщепляется специальными ферментами, и продукты расщепления всасываются вновь в пресинаптическое окончание. В автономной нервной системе имеется три вида синаптической передачи: электрическая, химическая и смешанная. Химическая осуществляется по определенным закономерностям, среди которых выделяют два принципа. Первый (принцип Дейла) заключается в том, что нейрон со всеми отростками выделяет один медиатор. Как стало теперь известно, наряду с основным в этом нейроне могут присутствовать также другие передатчики и участвующие в их синтезе вещества. Согласно второму принципу, действие каждого медиатора на нейрон или эффектор зависит от природы рецептора постсинаптической мембраны. Насчитывают более десяти видов нервных клеток, которые продуцируют в качестве основных разные медиаторы: ацетилхолин, норадреналин, серотонин и другие биогенные амины, аминокислоты, АТФ. В зависимости от того, какой основной медиатор выделяется окончаниями аксонов автономных нейронов, эти клетки принято называть холинергическими, адренергическими, серотоиинергическими, пуринергическими и т. д. нейронами. Каждый из медиаторов выполняет передаточную функцию, как правило, в определенных звеньях дуги автономного рефлекса. Так, ацетилхолин выделяется в окончаниях всех преганглионарных симпатических и парасимпатических нейронов, а также большинства постганглионарных парасимпатических окончаний. Кроме того, часть постганглионарных симпатических волокон, иннервирующих потовые железы и, по-видимому, вазодилататоры скелетных мышц, также осуществляют передачу с помощью ацетилхолина. В свою очередь норадреналин является медиатором в постганглионарных симпатических окончаниях (за исключением нервов потовых желез и симпатических вазодилататоров) — сосудов сердца, печени, селезенки. Медиатор, освобождающийся в пресинаптических терминалах под влиянием приходящих нервных импульсов, взаимодействует со специфическим белком-рецептором постсинаптической мембраны и образует с ним комплексное соединение. Белок, с которым взаимодействует ацетилхолин, носит название холинорецептора, адреналин или норадреналин — адренорецептора и т. д. Местом локализации рецепторов различных медиаторов является не только постсинаптическая мембрана. Обнаружено существование и специальных пресинаптических рецепторов, которые участвуют в механизме обратной связи регуляции медиаторного процесса в синапсе. Вариант 2: Впервые гипотезу о химической передаче сигнала между нейронами с участием особых веществ-посредников - нейромедиаторов - выдвинул английский ученый Т. Эллиот (T. Elliott) еще в 1904 году. Затем благодаря работам австрийского физиолога Отто Леви (Otto Loewi), английского физиолога Генри Дейла (Henry Dale) и русского физиолога Александра Самойлова эта идея нашла экспериментальное подтверждение. В 1936 году Леви и Дейл были удостоены Нобелевской премии по физиологии и медицине "за исследование химической природы передачи нервного импульса". В отличие от других клеток организма нейроны обладают длинными отростками (аксонами и дендритами), позволяющими им контактировать между собой и с окружающими клетками (у млекопитающих длина аксонов может быть более метра). Концентрация некоторых ионов (в первую очередь ионов калия, натрия, кальция и хлора) внутри отростков и в окружающей их среде различна. За счет этого появляется разность потенциалов по отношению к мембране аксона. Ионы могут проникать внутрь отростков и выходить из них через специальные белковые ионные каналы, пронизывающие внешние стенки аксонов. Таким образом, вдоль аксона одного нейрона нервный импульс передается как электрический сигнал: в виде изменения разности потенциалов (сами ионы вдоль отростка не перемещаются, а служат только для создания электрического напряжения). Передача сигнала между нейронами осуществляется с помощью синаптических контактов (синапсов). Синапс представляет собой место взаимодействия окончаний отростков через небольшой зазор (синаптическую щель). Как только электрический импульс достигает синапса, в аксон передающего нейрона (пресинаптического) устремляются ионы кальция, запускающие выделение нейромедиатора в синаптическую щель. Затем молекулы медиатора диффундируют к отростку принимающего сигнал нейрона (постсинаптического). На принимающей стороне находятся белковые рецепторы для молекул медиатора, которые одновременно являются ионными каналами, впускающими ионы внутрь отростка. Присоединение молекул медиатора к рецепторам-каналам постсинаптического нейрона открывает их для ионов, вследствие чего происходит изменение электрического потенциала, и сигнал перемещается дальше уже снова в виде электрического импульса. Описанный механизм характерен для прямой (или быстрой) синаптической передачи, а соответствующее действие медиаторов было названо ионотропным. Быстрая передача призвана обеспечивать немедленную реакцию нервной системы на внешние воздействия. В организме человека быстрая синаптическая передача отвечает за регулирование восприятия, движений, речи. В начале 1970-х годов было показано, что некоторые нейромедиаторы, такие как серотонин, норадреналин, дофамин, действуют в нервной системе по механизму, совершенно отличному от быстрой синаптической передачи. Американский биохимик Пол Грингард (Paul Greengard) установил, что эти медиаторы не просто изменяют мембранный потенциал, а на глубоком уровне влияют на обмен веществ в самом нейроне, приводя к длительным изменениям в способности синапсов проводить сигналы. Это явление было названо непрямой (или медленной) синаптической передачей, ответственной за такие сложные свойства нервной системы, как эмоции и память. Эффекты, связанные с медленной передачей, получили название метаботропные. Позднее американский физиолог Эрик Кендел (Eric Kandel) установил ключевые стадии формирования кратковременной и долговременной памяти по механизму медленной синаптической передачи. Оказалось, что при относительно слабом входящем стимуле метаботропные медиаторы, проникая в постсинаптический нейрон, вызывают изменение структуры белковых ионных каналов, тем самым изменяя восприимчивость нейронов к импульсам и эффективность передачи сигнала синапсами. Эти структурные изменения могут сохраняться довольно долго (от нескольких минут до нескольких дней). Так формируется кратковременная память. По прошествии некоторого времени каналы могут снова принять первоначальную форму, и слабый стимул, вызвавший их, будет "забыт". Если стимул сильный, то нейромедиатор через каскад биохимических реакций дает сигнал ядру нейрона запустить синтез новых белков, под действием которых может меняться структура самого синапса (например, увеличивается площадь синаптического контакта) или начаться рост новых отростков для формирования дополнительных межнейронных связей. Такие изменения структуры могут сохраняться до конца жизни организма, являясь материальным носителем его долговременной памяти. Медленная синаптическая передача выполняет модулирующую функцию, она прокладывает новые пути для распространения сигналов быстрой передачи. Некоторые из них остаются "тропинками", другие превращаются в "скоростные шоссе". В 2000 году Грингард и Кендел совместно со шведским фармакологом Арвидом Карлсоном (Arvid Carlsson) были удостоены Нобелевской премии по физиологии и медицине в первую очередь за открытие и исследование медленной синаптической передачи. Вопрос 14. Синаптические рецепторы. Синаптические рецепторы весьма многообразны по структурной организации и молекулярному воплощению, но все они имеют по крайней мере три последовательных функциональных элемента: узнающий участок, элемент связи и преобразователь. Узнающий участок призван выделить «свой» медиатор и отреагировать на его появление. Преобразователь, или исполнительный элемент, непосредственно реализует активацию рецептора и запускает потенциал действия. По расположению: пресинаптические и постсинаптические рецепторы. Пресинаптические рецепторы реализуют механизм обратного захвата. Если медиатора выделено слишком много, то он появляется в синаптической щели. Рецепторы это улавливают и прекращают передачу медиатора, а лишнее количество захватывается обратно в сому. По структуре: ионотропные (быстрые) и метаботропные (медленные). Ионотропные рецепторы: Связаны с каналами для мелких ионов (натрий, калий, хлор); Непосредственно контролируют открытие ионных каналов; Генерируют очень быстрый ответ мембраны нейрона в виде изменения в ней ионных токов для Na, K, Ca, Cl. Метаботропные рецепторы: Действуют через систему вторичных посредников и запускают каскад реакций внутри клетки; Активизируют внутриклеточные процессы с помощью вторичных посредников; Генерируют медленные метаболические ответы. Холинорецепторы – рецепторы, взаимодействующие с ацетилхолином. Бывают трёх типов: А) Мускариновые – возбуждаемые мускарином (возбуждение) Б) Никотиновые – возбуждаемые никотином (эйфория) В) Мускарино-никотиновые – постсинаптические рецепторы нервно-мышечных тканей. Вопрос 15. Нейромедиаторы и нейромодуляторы. Нейромедиаторы (нейротрансмиттеры) — биологически активные химические вещества, посредством которых осуществляется передача электрического импульса с нервной клетки через синаптическое пространство. Нейромедиаторы характеризуются способностью реагировать со специфическими белковыми рецепторами клеточной мембраны, инициируя цепь биохимических реакций, вызывающих изменение трансмембранного тока ионов, что приводит к деполяризации мембраны и возникновению потенциала действия. Нейромодуляторы - химические вещества, которые действуют как нейромедиаторы, но не ограничиваются синаптической щелью, а рассредотачиваются повсюду, модулируя действие многих нейронов в определенной области. Ацетилхолин. По химическому строению ацетилхолин представляет собой соединение двух молекул — азотсодержащего холина и остатка уксусной кислоты: Ацетилхолин в качестве медиатора работает в трех функциональных блоках нервной системы: в нервно-мышечных синапсах, периферической части вегетативной нервной системы и некоторых областях ЦНС. Ацетилхолин является медиатором мотонейронов нервной системы, которые расположены в передних рогах серого вещества спинного мозга и двигательных ядрах черепных нервов. Их аксоны направляются к скелетным мышцам и, разветвляясь, образуют нервно-мышечные синапсы. В ЦНС ацетилхолин вырабатывается частью нейронов ретикулярных ядер моста и интернейронами полосатого тела базальных ганглиев и некоторых других локальных зон. Рассматривается роль этого медиатора в регуляции уровня бодрствования, а также в системах памяти, двигательных системах. Доказана эффективность применения антагонистов ацетилхолина при ряде двигательных нарушений. Выделяясь из пресинаптического окончания, ацетилхолин действует на постсинаптические рецепторы. Эти рецепторы неоднородны и различаются локализацией и рядом свойств. Выделено два типа рецепторов: первый, помимо ацетилхолина, возбуждается под действием алкалоида табака никотина (никотиновые рецепторы), второй тип активируется ацетилхолином и токсином мухомора мускарином (мускариновые рецепторы). В периферической НС ацетилхолин является основным медиатором нервно-мышечного синапса, действуя на никотиновые холинорецепторы. В вегетативной нервной системе ацетилхолин осуществляет передачу в симпатических и парасимпатических ганглиях (выделяется из окончаний преганлионарных волокон), а также влияет на работу внутренних органов, выделяясь из периферических окончаний парасимпатических нервов (мускариновые рецепторы). Биогенные амины (моноамины). Биогенные амины – это биологически активные вещества, оказывающие воздействие на процессы торможения и возбуждения в коре головного мозга и подкорковых центрах, вызывающие изменения артериального давления расширением или ужением сосудов и другие изменения в организме. Большинство из моноаминов действуют через метаботропные рецепторы. Синтезируются в головном мозге из разных аминокислот (катехоламины из тирозина, а индоламины из триптофана). Моноамины - самая большая группа медаторов, которая делится на катехоламины и индоламины. Катехоламины = норадреналин + адреналин + дофамин. Норадреналин. Образуется в мозговом слое надпочечников и в нервной системе, служит медиатором проведения нервного импульса через синапс, повышает артериальное давление, стимулирует углеводный обмен. Основной источник адренергических аксонов – голубое пятно и прилежащие участки среднего мозга. Проекции голубого пятна образуют часть восходящей ретикулярной активизирующей системы мозга, направленной из ретикулярной формации в кору больших полушарий. Этот путь регулирует внимание, уровень бодрствования, возбуждение и суточные ритмы. Много норадреналина в ВНС. Норадреналин также участвует в формировании когнитивных и адаптационных процессов. Адреналин. Это гормон мозгового слоя надпочечников, выделяющийся в кровь преимущественно при напряжении (стрессе). В качестве медиатора адреналин не встречается, это гормон. Дофамин. Это нейрогормон и медиатор нервной системы, биохимический предшественник норадреналина и адреналина. Дофаминэнргические нейроны находятся преимущественно в среднем мозге, в т.н. чёрной субстанции и ядре покрышки среднего мозга, а также в гипоталамусе. В последнее время появляются данные об участии в патогенезе шизофрении нейропептидов, тем более что ест тесная связь между эндорфиновой и дофаминовой системами мозга. У шизофреников количество дофамина выше нормы. Дофамин вызывает положительные эмоции. Натуральный аналог – пейот. Индоламины = Серотонин + Гистамин. Серотонин. Это биологически активное вещество, содержащееся в крови и тканях животных и человека, является медиатором как на периферии, так и в нервных центрах. Примерно 90% серотонина синтезируется клетками пищеварительного тракта. В ЦНС серотонинэргические нейроны есть в ядрах шва продолговатого мозга, а также в центральном сером цеществе среднего мозга и варолиевом мосту. Эти нейроны иннервируют кору больших полушарий, гиппокамп, бледный шар, миндалину, гипоталамус. Самая высокая концентрация серотонина – в эпифизе. Там он превращается в мелатонин. Серотонин участвует в регуляции эмоционального поведения, двигательной активности, пищевого поведения, полового поведения, терморегуляции. С нарушениями в серотонинэргичесой системе связывают развитие алкогольной зависимости, некоторых форм тревожности. Важная роль в осуществлении сложных форм поведения, включая агрессию и формирование социальных отношений в популяции. Антагонист серотонина – ЛСД. Гистамин. Это гормон и медиатор группы моноаминов, в значительных количествах освобождающийся при аллергических реакция, шоке, ожоге. Вызывает расширение кровеносных сосудов, сокращение гладкой мускулатуры, повышение секреции олвной кислоты в желудке. Тела гистаминовых нейронов в головном мозге сконцентрированы в гипоталамусе, а их аксоны расходятся почти во все отделы ЦНС. Блокада гистаминовой системы сопровождается сонливостью. Разблокирование – активностью, агрессией. Аминокислоты. Медиаторы-аминокислоты являются самыми распространёнными медиаторами в НС. До 80% нейронов выделяют из своих окончаний аминокислоты в качестве медиаторов.
Глутаминовая кислота – основной возбуждающий медиатор в ГМ. Образуется в мозге из глюкозы. Больше всего глутамата в конечном мозге и мозжечке. Принимает участие в процессах памяти, является медиатором сенсорных путей. Аспаргиновая кислота – возбуждающий медиатор среднего мозга, нижней оливы продолговатого мозга и серого вещества спинного мозга. АК регулирует спинномозговые рефлексы. Обе возбуждающие аминокислоты участвуют в регуляции состоянии беспокойства.
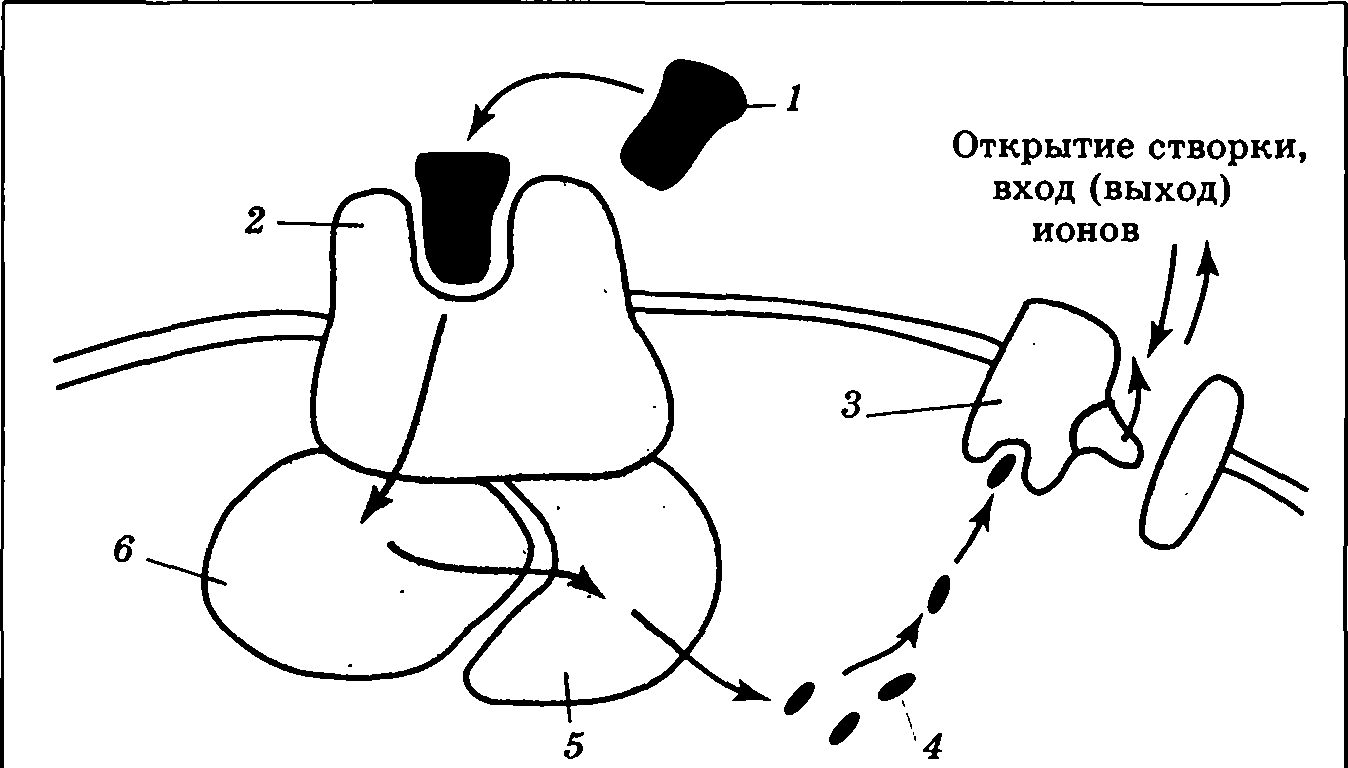
Гамма-аминомасляная кислота (ГАМК) – образуется в мозге из глутаминовой кислоты. Много ГАМК в коре больших полушарий, в коре мозжечка, в чёрной субстанции среднего мозга, в сетчатке глаза. Успокаивающий, усыпляющий эффект. Нельзя использовать, т.к. не проходит ГЭБ. ГАМКа – ионотропные, ГАМКб – метаботропные. Нарушение ГАМК-эргической системы – эпилепсия, расстройство сна, дисфункции в сердечно-сосудистой системе. Глицин – тормозной медиатор спинного и в меньшей степени ГМ. Тела синтезирующий глицин нейронов в основном в спинном и продолговатом мозге, в ядрах черепномозговых нервов, в промежуточном мозге. Только один тип рецепторов – ионотропный. Глицин обеспечивает возвратное торможение мотонейронов спинного мозга, уменьшает психомоторную расторможенность. Пуриновые медиаторы. Пурины – группа природных азотистых гетероциклических соединений и их производных. В качестве модулятором и в меньшей степени медиаторов встречаются в основном аденозин, а также АТФ(аденозинтрифосфорная кислота). Пурины действуют через особый тип рецепторов – пуриновые, основной из которых – метаботропный А1-рецептор. Рецепторы действуют в периферической НС, в афферентных окончаниях болевых волокон. Аденозин – нейромодулятор, оказывает в основном тормозное влияние на возбуждающие синапсы. Физиологическая роль пуринэргической системы в том, что при длительной нагрузке на мозг в нём образуется большое количество АМФ (аденозинмонофосфорной кислоты), которая тормозит работу синапсов через А1-рецепторы, защищая ЦНС в экстремальных условиях. А вещества, блокирующие работу этих рецепторов, способны активизировать НС: кофеин, теофилин, теобромин. Пептидные медиаторы. Это вещества, состоящие из цепочек аминокислот. Первым из них было открыто вещество Р (от powder — порошок), выделенное из сухого порошка спинного мозга. Его введение в кровь в очень малых дозах вызывает расширение кровеносных сосудов и спазм кишечника. Наиболее изученной группой пептидных медиаторов считаются опиоидные пептиды. Их название происходит от опиума — субстанции, выделенной из мака и обладающего анальгетическим и эйфорическим действием. Под влиянием опиума по мере увеличения дозы наблюдается обезболивание, успокоение и засыпание. В 1803 г. было выделено основное действующее начало опиума, названное морфином. Показано, что обезболивающие эффекты морфина осуществляются через задние рога спинного мозга, через гипоталамус, где расположен центр положительных эмоций. Засыпание связано с общим торможением стволовых структур. Сверхбольшие дозы морфина могут вызвать остановку дыхания. Синтез медиаторов-пептидов (в том числе опиоидных) протекает значительно сложнее по сравнению с синтезом медиаторов других групп. В ходе этого процесса рибосомы вначале строят белок-предшественник, а затем особые ферменты вырезают из него необходимые фрагменты, причем один белок может содержать внутри себя несколько медиаторов-пептидов. Основной механизм действия опиоидов в ЦНС — пресинаптическое торможение выделения медиаторов. Существуют нейропептиды, избирательно управляющие половым поведением, пищевой мотивацией, терморегуляцией. В целом соединения этой группы образуют сложную иерархическую систему, в которой одни нейропептиды активируют или подавляют высвобождение других нейропептидов. Последние способны воздействовать как на метаболизм нейронов, так и на функционирование «классических» медиаторных систем; при этом сфера влияний конкретного нейропептида часто ограничивается узким кругом эффектов, связанных, например, только с какой-либо одной биологически значимой потребностью или с определенным типом памяти. Билет 16. Вторичные посредники. На постсинаптической мембране выделяют два типа рецепторов — ионотропные и метаботропные Ионотропнный В случае ионотропного рецептора чувствительная молекула содержит не только активный центр для связывания медиатора, но также ионный канал. Воздействие «первичного посредника» (медиатора) на рецептор приводит к быстрому открыванию канала и развитию постсинаптического потенциала. Метаботропный При присоединении медиатора, и возбуждении метаботропного рецептора изменяется внутриклеточный метаболизм, т.е. течение биохимических реакций С внутренней стороны мембраны к такому рецептору присоединен целый ряд других белков, выполняющих ферментативные и частью передающие («посреднические») функции (рис.). Белки-посредники относятся к G-белкам. Под влиянием возбужденного рецептора G-белок воздействует на белок-фермент, обычно переводя его в «рабочее» состояние. В результате запускается химическая реакция: молекула-предшественник превращается в сигнальную молекулу — вторичный посредник.
Вторичные посредники — это мелкие, способные к быстрому перемещению молекулы или ионы, передающие сигнал внутри клетки. Этим они отличаются от «первичных посредников» — медиаторов и гормонов, передающих информацию от клетки к клетке. Наиболее известным вторичным посредником является цАМФ (циклическая аденозинмонофосфорная кислота), образуемая из АТФ с помощью фермента аденилатциклазы. Похожа на него цГМФ (гуанозинмонофосфорная кислота). Другими важнейшими вторичными посредниками являются инозитолтрифосфат и диацилглицерол, образуемые из компонентов клеточной мембраны под действием фермента фосфолипазы С. Чрезвычайно велика роль Ca2+, входящего в клетку снаружи через ионные каналы или высвобождающегося из особых мест хранения внутри клетки («депо» кальция). В последнее время много внимания уделяется вторичному посреднику NO (оксиду азота), который способен передавать сигнал не только внутри клетки, но и между клетками, легко преодолевая мембрану, в том числе от постсинаптического нейрона к пресинаптическому. Заключительный шаг в проведении химического сигнала — воздействие вторичного посредника на хемочувствительный ионный канал. Это воздействие протекает либо непосредственно, либо через дополнительные промежуточные звенья (ферменты). В любом случае происходит открытие ионного канала и развитие ВПСП либо ТПСП. Продолжительность и амплитуда их первой фазы будет определяться количеством вторичного посредника, которое зависит от количества выделившегося медиатора и длительности его взаимодействия с рецептором. Таким образом, механизм передачи нервного стимула, используемый метаботропными рецепторами, включает в себя несколько последовательных этапов. На каждом из них возможна регуляция (ослабление либо усиление) сигнала, что делает реакцию постсинаптической клетки более гибкой и адаптированной к текущим условиям. Вместе с тем это же приводит к замедлению процесса передачи информации 17. Современные представления о принципе Дейла. Дейл (1875-1918) – английский физиолог, в 1914 г. им было выделено вещество ацетилхолин, позже, уже в тридцатые годы он вместе со своими сотрудниками показал, что ацетилхолин является нейромедиатором в нервно-мышечном синапсе. Полученные данные позволили Дейлу сформулировать предположение о том, что поскольку каждый нейрон представляет собой единую метаболическую систему то, следовательно, во всех его пресинаптических окончаниях должен высвобождаться один и тот же медиатор. Это предположение и было названо принципом Дейла. Однако, в последние годы получены данные, убедительно свидетельствующие о совместимости нейроактивных веществ в одном нейроне, о возможности синтеза, транспорта и выведения одним и тем же нейроном нескольких разных нейроактивных в-в, в том числе и нейромедиаторов. В современном звучании его можно сформулировать как положение о метаболической зависимости аксона и его окончаний от тела клетки. Т. обр. в настоящее время представление о хим. проведении сигналов в нервной клетке основывается на принципе множественности хим. сигналов, это подразумевает, что в индивидуальном нейроне синтезируется более одного медиатора, при этом каждое пресинптическое окончание способно выделить несколько медиаторов , сочетание которых может быть неодинаковым для разных синапсов одного и того же нейрона. Поэтому привычное понятие “один нейрон- один медиатор” следует понимать как условное. 18. Отличие некроза от апоптоза. Роль стволовых клеток и апотоза в индивид. развитии и некоторых нервных заболеваниях. Некроз (греч. nekros - мертвый) возникает в результате прямого воздействия патогенного фактора (микроорганизм, ишемия и др.), нарушающего целостность мембраны клетки. Это приводит к массивному выбросу индукторов воспаления и к миграции иммунных клеток к очагу поражения. В результате в зоне поврежденной клетки развивается септическое или асептическое (в зависимости от причины) воспаление. При этом происходят характерные изменения как в ядре, так и в цитоплазме. Ядро сморщивается, наблюдается конденсация хроматина (каропикноз), затем он распадается на глыбки (каризрексис) и растворяется (кариолизис). В цитоплазме происходят денатурация и коагуляция белков. Мембранные структуры распадаются. Нарушаются окислительно-восстановительные процессы и синтез АТФ в митохондриях, и вся клетка начинает страдать от нехватки энергии. Постепенно клетка распадается на отдельные глыбки, которые захватываются и поглощаются макрофагами. На месте в прошлом функционально активной клетки формируется соединительная ткань. Апоптоз (греч. аро - отделение + ptosis - падение) по морфологическим признакам существенно отличается от некроза и имеет ряд специфических особенностей. Факторами, инициирующими апоптоз, являются возрастание экспрессии генов - индукторов апоптоза (или угнетение генов-ингибиторов) либо повышенное поступление кальция внутрь клетки. Клеточная мембрана при этом остается сохранной. Несмотря на внешнюю сохранность мембраны митохондрий, нарушаются окислительно-восстановительные процессы в основном за счет блокирования 1 митохондриального комплекса. Результатом описанных выше процессов является возрастание синтеза протеаз, которые начинают постепенно расщеплять внутриклеточные структуры. От мембраны клетки отщемляются небольшие везикулы, наполненные содержимым цитоплазмы (митохондрий, рибосомы и др.), окруженные мембранным липидным бис(оем. Клетка соответственно уменьшается в объеме и сморщивается. Отщепившиеся везикулы поглощаются соседними клетками. Ядро сморщивается на завершающих стадиях процесса, хроматин частично конденсируется, что говорит о сохранной активности ряда участков ДНК. Оставшиеся от клетки элементы фагоцитируются тканевыми макрофагами без развития воспалительной реакции и формирования соединительной ткани.
Результатом апоптоза является постепенное и медленное избавление от "ненужных" в функциональном отношении на данный момент клеток. При этом не развивается воспаление и не нарушается нормальное функционирование соседних клеток, а также не происходит соединительнотканного замещения, что позволяет сохранить структуру органа. Функциональные элементы клетки, находящейся в состоянии апоптоза, не разрушаются, а поглощаются другими клетками и могут использоваться дальше. Особенно большую роль апоптоз играет в эмбриогенезе, когда важно постепенно избавляться от выполнивших свою функцию клеток, а активное фагоцитирование с развитием реакции воспаления может нарушить созревание плода. Среди заболеваний нервной системы особую роль апоптоз играет в развитии церебральных дегенерации. Триггерные факторы апоптоза ЦНС сегодня изучены недостаточно. Предполагаются влияние нейротропных, персистирующих внутриклеточно вирусов; нарушение считывания генетической информации; воздействие индукторов апоптоза. Все эти факторы пока еще не получили достаточного подтверждения. Общим для всех дегенеративных заболеваний ЦНС является снижение устойчивости нервных клеток к стимуляторам апоптоза - эксайтоаминокислотам, вирусным белкам или ионам кальция (см. выше). Однако цепь событий, приводящих к апоптозу, имеет существенные различия при разных заболеваниях Болезнь Паркинсона (БП). В патогенезе БП важную роль играет нарушение функции митохондрий за счет блокирования 1 митохондриального комплекса. Результатом этого является снижение содержания в клетках АТФ и последующее уменьшение образования глутатиона - универсального антиоксиданта ЦНС. Следующим этапом патогенеза является окислительный стресс, связанный с накоплением свободных радикалов. В условиях окислительного стресса происходит активация NMDA-рецепторов, приводящая к повышенному входу кальция внутрь клетки и дальнейшему развитию апоптоза; некоторые авторы считают также, что окислительный стресс может дополнительно вызывать экспрессию гена р53 с последующей стимуляцией дегенерации нервных клеток. Процесс избирательно поражает нейроны подкорковых образований мозга, в большей степени стриатума и компактной части черного вещества. Изучение медикаментозной терапии БП с этих позиций показало, что специфическая терапия препаратами леводопы может активировать апоптоз, поскольку усиливает окислительный стресс. Так, при обработке культуры нейронов раствором дофамина в физиологической концентрации (0,1-1 мМ) в течение 24 ч обнаружены признаки, характерные для апоптоза: фрагментация ДНК, дезинтеграция аксонов, сморщивание клеток. Такие же изменения наблюдались и при обработке клеточных культур раствором леводопы. Напротив, применение агонистов дофаминовых рецепторов и блокаторов моноаминоксидазы типа В приводит к увеличению выживаемости культуры стволовых клеток в эксперименте, что предположительно связывают с активацией нейротрофических факторов, ингибирующих апоптоз. W. Tatton сообщает, что нейропротективное действие препаратов - ингибиторов моноаминоксидазы (L-депренил) может также быть результатом возрастания экспрессии генов-ингибиторов апоптоза. Болезнь Альцгеймера (БА). Патогенез БА до настоящего времени остается невыясненным. Одним из возможных патогенетических механизмов считается внутриклеточное отложение (3-амилоида и предшественника амилоидного белка (amyloid precursor protein - АРР). В первую очередь при этом страдают ацетилхолинергические нейроны базального ядра Мейнерта, результатом чего являются недостаточность холинергических терминалей и дегенерация клеток коры головного мозга, преимущественно теменно-височно-затылочной области. В нейронах, хронически обрабатываемых раствором, содержащим компоненты амилоида, развиваются изменения, типичные для апоптоза: отпочковывание везикул от мембраны и фрагментация ДНК. Процессы, происходящие в культуре клеток, при этом равнозначны при воздействии как (3-амилоида, так и АРР. Помимо этого, отмечается внутриклеточное отложение амилоида, также препятствующее нормальной жизнедеятельности клетки. Не исключено, что апоптоз при БА реализуется по механизму ускоренного старения с патологическим накоплением кальция внутри клетки за счет активации NMDA-рецепторов с последующей активацией протеаз и разрушением клеточных структур. Синдром Дауна (СД). СД, или трисомия хромосомы 21, является одной из наиболее частых генетических причин умственной отсталости. Основными характерными признаками СД служат уменьшенное количество нейронов ЦНС и извращенное дифференцирование нервных клеток. Причины и ход нейродегенеративного процесса при СД до конца не выяснены. Показано, что кортикальные нейроны эмбрионов с трисомией-21 до определенного момента нормально развиваются в культуре, однако потом начинают подвергаться апоптозу. Представляет интерес тот факт, что при СД, как и при БА, отмечаются интрацеллюлярные отложения амилоида в церебральных нейронах, что, возможно, косвенно указывает на сходный патогенез этих заболеваний. Стволовые клетки Найдены не только в основных регенерирующих тканях, таких, как эпителий и кровь, но также в статических тканях, таких, как нервная система и печень, где они играют центральную роль в тканевом росте и сохранении. Механизм, с помощью которого стволовые клетки поддерживают популяции высоко дифференцированных короткоживущих клеток, как кажется, включает критический баланс между альтернативными путями (судьбами): дочерние клетки либо сохраняют идентичность стволовых клеток, либо инициируют дифференциацию. Недавние исследования на низших организмах выявили регуляторный механизм ассимитричных клеточных делений стволовых клеток. В этих моделях окружение, вероятно, обеспечивает ключевые инструктивные сигналы для выбора судьбы клеток. Наше понимание сейчас распространяется на внутренние механизмы клеточной полярности, которая влияет на ассиметричные деления стволовых клеток/12 Вот, что нашла. Из 1-ой лекции по анатомии. Хотя сами по себе нервные клетки могут размножаться и восстанавливаться. Например, стволовые клетки. Какое-то количество дендритов не специализируется и в случае необходимости стволовые клетки получают сигнал о необходимости «прийти на помощь», они прибывают на место повреждение и начинают специализироваться. Например, при инсульте значительная часть клеток гибнет, а некоторая восстанавливается из стволовых клеток. Билет № 19 Постсинаптические потенциалы Постсинаптический потенциал - это изменение мембранного потенциала постсинаптической мембраны в ответ на импульс, поступивший от пресинаптического нейрона (относительно кратковременные колебания мембранного потенциала (чаще десятки миллисекунд, реже секунды), возникающие в результате местного воздействия медиатора на постсинаптическую мембрану ). Различают возбуждающий постсинаптический потенциал и тормозной постсинаптический потенциал . Амплитуда постсинаптических потенциалов зависит от количества выделенного медиатора. Взаимодействуя со специфическими рецепторами постсинаптической мембраны, медиаторы увеличивают её проницаемость для определённых ионов, которые входят в клетку или выходят из неё в соответствии с электрохимическим градиентом. Если этот процесс приводит к уменьшению трансмембранной разности потенциалов (деполяризации), постсинаптические потенциалы являются возбуждающими (ВПСП). Тормозные постсинаптические потенциалы (ТПСП) выражаются в гиперполяризации клетки, обусловленной действием тормозного медиатора. Как правило, нервная клетка имеет большое число синаптических входов; приходящие к ней сигналы алгебраически суммируются. В клетках, спонтанно генерирующих потенциалы действия, ВПСП увеличивает, а ТПСП уменьшает частоту разрядов. В «молчащих» клетках ВПСП может вызвать одиночный или групповой разряд, а одновременно возникший ТПСП блокировать этот эффект. Таким образом, с помощью постсинаптических потенциалов осуществляется управление возбудимостью нервных клеток. 20 Гиперполяризационное и деполяризационное торможение Ткань может находиться в трех состояниях: покоя, возбуждения и торможения. Возбуждение и торможение - это два активных состояния, которые возникают под действием раздражителей и сопровождаются энергозатратами. По механизму возникновения выделяют два вида торможения: деполяризационное и гиперполяризационное. Деполяризационное торможение В основе его лежит механизм деполяризации мембраны, что приводит к утрате или существенному снижению способности реагировать на другие стимулы ( клетка в состоянии возбуждения заторможена, т.е клетки не отвечают на действие других раздражителей, (рис. 4.1).  Рис.4.1. Фаза абсолютной рефрактерности на пике потенциала действия Разновидность деполяризационного торможения - парабиотическое торможение (торможение по Н.Е. Введенскому). Оно развивается в клетке под влиянием определенного вещества - парабиотика, которое меняет функциональное состояние клетки, нарушая ее функциональную лабильность. Основной причиной этого торможения является уменьшение функциональной лабильности клеток. Снижение лабильности характеризуется увеличением времени проведения импульсов, удлинением времени деполяризации и особенно реполяризации мембраны и следовых потенциалов (рис. 4.2 а,б,в).  Рис. 4.2. Изменение функциональной лабильности клетки под влиянием парабиотика приводящее к парабиотическому торможению. А - уравнительная фаза Б - парадоксальная фаза В - тормозная фаза Парабиотик нарушает энергетические функции клеток: синтез и ресинтез АТФ, что замедляет работу Na-K насоса. Это приводит к изменению проницаемости мембраны для ионов и стойкой деполяризации. Процесс перехода из нормального состояния в парабиотическое происходит в несколько фаз. 1. Уравнительная фаза характеризуется тем, что на частые и редкие импульсы возникает одинаковая реакция. Для каждой ткани характерна своя функциональная лабильность. Нервная ткань проводит ~ 500 импульсов в секунду, мышечная - 300 импульсов в секунду, самая низкая лабильность в синапсах ~ 120 импульсов в секунду. Например, при снижении функциональной лабильности в нервной клетке до 200 импульсов в секунду она будет отвечать в одинаковой степени на более частые (300-400-500) и более редкие импульсы (200) (рис. 4.2 а). Если убрать парабиотик, ткань постепенно восстанавливает свою лабильность, но если парабиотик будет продолжать действовать, то наступит вторая фаза. 2. Парадоксальная фаза характеризуется тем, что на редкие импульсы ткань будет отвечать, а на частые нет. Эта фаза возникает потому, что функциональная лабильность продолжает уменьшаться, удлиняется период рефракторной фазы и ткань перестает реагировать на частые импульсы (рис. 4.2 б), которые попадают в рефрактерный период. 3. Тормозная фаза, наступает при продолжении действия парабиотика (рис. 4.2 в), прекращается ответ ткани на любые по частоте и силе импульсы, поскольку в клетках не происходит реполяризации мембраны и она остается в состоянии абсолютной рефрактерности. Нарушается ресинтез АТФ, (причем повреждение насосов происходит быстрее, чем нарушение каналов). В клетку попадает Na (вслед за ним - H2O, клетка может разбухнуть и погибнуть). Восстановить клетку из этого состояния невозможно. Таким образом, по мере развития парабиотического торможения уменьшается функциональная лабильность ткани. Этот вид торможения развивается под влиянием анестетиков, спирта, других веществ, являющихся парабиотиками. Гиперполяризационное торможение Его суть заключается в том, что увеличивается потенциал мембраны по отношению к покою, в связи с чем снижается способность клетки реагировать на раздражители. Возникшее явление характеризуется понижением возбудимости (рис. 4.3). Одним из проявлений этого вида является положительный следовой потенциал, который возникает после потенциала действия и связан с тем, что еще часть ионов К+ не возвращена в клетку ( на наружной поверхности мембраны остается достаточно большое количество ионов К+ ). В этом состоянии наблюдается явление относительной рефрактерности, т.е уменьшение ответа клетки на раздражитель. Необходим более сильный стимул, чтобы клетку возбудить. Из состояния гиперполяризации труднее достичь критического уровня деполяризации, чем из состояния покоя (рис. 4.3). Такое торможение чаще всего развивается в связи с большим выходом К+ наружу и большим поступлением Cl- в клетку. Изменение проницаемости мембран для К+ и Cl-, которое приводит к гиперполяризации мембраны, происходит под влиянием гамма - аминомасляной кислоты (ГАМК), вещества которое вырабатывают специальные нервные клетки (клетки Реншоу); серотонина и некоторых других веществ. Эти вещества увеличивают проницаемость мембраны для К+ и Cl- и приводят к гиперполяризации мембраны (более -100 мв) - формируется тормозной потенциал. Клетка переходит в состояние пониженной возбудимости.  Рис. 4.3. Схема возникновения гиперполяризационного иорможения. Работа нервной системы чаще всего связана с этим видом торможения. В зависимости от места возникновения торможения различают: пресинаптическое (А) и постсинаптическое (Б); центральное и периферическое (рис. 4.4).  Рис. 4.4. Пресинаптическое (А) и постсинаптическое (Б) торможение При пресинаптическом торможении чаще всего возникает деполяризация пресинаптической мембраны, в результате чего уменьшается выделение медиатора и передача импульса в синапсе. Постсинаптическое торможение развивается обычно по механизму гиперполяризационного и связано с возникновением тормозного постсинаптического потенциала (ТПСП) под влиянием нейромедиаторов (ГАМК, серотонина). Центральное торможение имеет место в ЦНС, и впервые было описано И.М. Сеченовым в 1840 г. Накладывая кристаллик NaCl на зрительные бугры (таламус) мозга лягушки, он обнаружил увеличение времени двигательной рефлекторной реакции на раздражитель. Это послужило основанием для заключения, что в ЦНС имеются специфические тормозные центры, возбуждение которых кристалликом соли вызывает торможение в центрах спинномозговых рефлексов (рис. 4.5). Позднее было доказано, что одни и те же центры могут находиться в состоянии возбуждения и в состоянии торможения; а специфическими тормозными центрами могут являться клетки Реншоу, выделяющие тормозной медиатор - ГАМК.  Рис. 4.5. Схема опыта "Сеченовское торможение" Периферическое торможение было описано братьями Вебер на примере торможения деятельности сердца при раздражении блуждающего нерва. Периферическое торможение развивается вне ЦНС, в органах, и по механизму может быть как гиперполяризационное, так и деполяризационное. Совокупность возбудительных и тормозных процессов в ЦНС и на периферии определяет специфическую биологически целесообразную деятельность нервной системы и различных органов. Рецепторный потенциал Возбуждение и торможение, которое возникает в нервной системе, создает все многообразие ответных реакций, обеспечивая процессы регуляции в организме. Существует специальная нервная структура, функция которой заключается в том, что она воспринимает различные раздражители и обеспечивает трансформацию любого вида энергии в нервный импульс. Эта структура называется рецептор. В рецепторе можно выделить две части: воспринимающую и трансформирующую. Воспринимающая устроена таким образом, что стимул, действуя на нее, формирует в этих структурах генераторный (рецепторный потенциал). Это происходит вследствие растяжения мембраны клеток (проприорецепторы мышечной ткани), при действии механической волны (звуковые рецепторы), при изменении напряжения, давления (барорецепторы), при изменении электрохимического градиента (при действии химических веществ - хеморецепторы). Если сила раздражителя и время действия увеличиваются, потенциал в этой части рецептора также увеличивается и удлиняется (рис. 4.6).  Рис. 4.6. Изменение рецепторного потенциала в зависимости от стимула. При длительном действии раздражителя возникает явление привыкания (адаптации) рецептора, т.е уменьшается амплитуда потенциала. Чем дольше действие раздражителя, тем быстрее наступает привыкание, чем сильнее раздражитель, тем хуже идет адаптация. Этот потенциал запускает во второй части рецептора формирование потенциала действия (ПД). Потенциал действия по уровню деполяризации везде одинаков. Он отличается по количеству импульсов, длительности интервалов между импульсами. Это явление называется трансформация рецепторного потенциала в потенциал действия. Рецепторный потенциал, как и местный, не распространяется (имеет локальный характер). Потенциал действия отвечает по принципу "все или ничего", обладает способностью к распространению. На выходе из рецепторов регистрируется ПД, который легко распространяется по нерву. В рецепторе создается частотный (сенсорный) код, который характеризует данный раздражитель. В зависимости от частоты и силы раздражителя, он будет отличаться количеством, частотой и длительностью импульсов, но не будет отличаться амплитудой (она одинакова). Любой по количеству стимул, действуя на соответствующий рецептор, трансформируется в ПД. Благодаря этому в НС по волокнам распространяются биопотенциалы с разной частотой и длительностью. |