Исследование эфективности направленного транспорта нимодипина в магнитоуправляемых носителях при синдроме ишемии-реперфузии головного мозга 14. 03. 06 фармакология, клиническая фармакология
| Вид материала | Исследование |
- Клиническая эффективность и фармакоэпидемиология лекарственных средств у детей с аллергическим, 462.25kb.
- Изучение эффектов мексидола и его комбинации с гимантаном при экспериментальном паркинсоническом, 394.22kb.
- Типовые учебный план и программа для клинических ординаторов по специальности «клиническая, 656.73kb.
- «исследование на доклиническом уровне иммунотропных свойств низкомолекулярных пептидов, 273.02kb.
- Исследование качества жизни и фармакоэкономические особенности лечения эпилепсии, 336.43kb.
- «Клиническая фармакология» Специальность: 111201 Ветеринария Пояснительная записка, 94.74kb.
- «Экспериментальная и клиническая фармакология» журнал к сведению, 84.61kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 10 Фармакология,, 197.39kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Оптимизация фармакотерапии плоского лишая 14. 00. 25. фармакология, клиническая фармакология, 214.56kb.
Также проводилось патоморфологическое исследование внутренних органов павших и выживших животных (по истечении срока наблюдения они забивались). При изучении хронической токсичности, кроме морфологического исследования, оценки веса, потребления воды и корма, исследовали клинические и биохимические показатели крови: содержание гемоглобина, эритроцитов, гематокрит, содержание лейкоцитов, тромбоцитов.
Из биохимических показателей определяли: концентрацию глюкозы, мочевины, билирубина, активность аланиновой и аспарагиновой аминотрансфераз и альфа-амилазы сыворотки, сывороточное железо.
Исследование системной кинетики и распределения магнитной жидкости и нимодипина у кроликов с моделью синдрома ишемии-реперфузии головного мозга. Моделирование ишемии головного мозга проводилось в остром эксперименте на кроликах породы «шиншилла» путем окклюзии обеих сонных артерий продолжительностью 2 часа под уретановым наркозом. Артерии выделяли на уровне C3-C4. Окклюзию артерий моделировали путем временного пережатия с помощью натяжения резиновой держалки-лигатуры.
Проведение направленного магнитоуправляемого транспорта нимодипина. Наркотизированных уретаном животных фиксировали в специальном станке, над теменной областью создавали магнитное поле индукцией 0,8 Тл с помощью цилиндрического постоянного магнита марки Р-60-06-30-N из сплава NeFeB диаметром 30 мм. Магнитоуправляемые эритроцитарные тени вводили внутривенно или внутриартериально (интракаротидно) после фиксации животного и создания магнитного поля.
Определение концентрации нимодипина. Определение концентрации нимодипина в плазме и гомогенатах органов проводили методом высокоэффективной жидкостной хроматографии (хроматограф «Милихром-5-3», Россия). В ходе исследования измеряли концентрацию нимодипина в следующих органах и тканях: плазма крови, ткань головного мозга, печени, почек, легких, жировая и мышечная ткань.
Исследование системной и церебральной гемодинамики, церебрального метаболизма и процессов перекисного окисления липидов. Состояние церебрального кровотока исследовали методом билатеральной реоэнцефалографии (реограф Р-4-02, Россия). При анализе реограмм определяли следующие показатели: реографический индекс (РИ); реографический коэффициент (РК); дикротический индекс (ДКИ); время общего кровенаполнения (ВНобщ); β – продолжительность катакроты. Уровень системного артериального давления оценивали прямым методом путем канюляции бедренной артерии.
Исследование процессов перекисного окисления липидов. Активность перекисного окисления липидов исследовали методом хемилюминесценции на флюориметре-хемилюминометре «Флюорат-02-АБЛФ-Т», (Россия) в крови яремной вены. Определяли следующие параметры биохемилюминесценции: интенсивность максимальной вспышки хемилюминесенции (Imax), светосумму (S) и тангенс угла наклона кинетической кривой (tg α2).
Статистическая обработка результатов исследования. Полученные данные обработаны статистически. Проверка нормальности распределения количественных признаков проводилась с помощью критерия Шапиро-Уилка. При подтверждении гипотезы нормальности распределения и равенстве дисперсий использовался критерий Стьюдента, в противном случае применялись методы непараметрической статистики (критерий W Вилкоксона). При сравнении качественных эффектов применялся критерий χ2. Критическое значение уровня значимости различий принималось равным 5% (р≤0,05).
Результаты исследования
Первым этапом исследования стала разработка методики получения магнитоуправляемых эритроцитарных теней с нимодипином. В качестве прототипа нами была использована методика приготовления эритроцитарных теней, разработанная на кафедрах физиологии и госпитальной хирургии Ульяновского государственного университета (Генинг Т.П., Левин И. Г. и соавт.). Методика включает в себя следующие этапы: приготовление отмытых эритроцитов, приготовление эритроцитарных теней, загрузка теней магнитной жидкостью FLW 001.40 и нимодипином. Нами была предложена дополнительная очистка полученных эритроцитарных контейнеров путем повторного центрифугирования их взвеси и удаления невключенного препарата. Кроме того, для повышения эффективности методики было подобрано оптимальное соотношение объемов теней и инкорпорируемого препарата (Кт/п). Для этого исследована эффективность загрузки при разных значениях Кт/п – от от 2:1 до 1:10. Результаты исследования представлены в таблице 2.
Таблица 2
Характеристики эритроцитарных контейнеров с магнитной жидкостью при различных технологиях насыщения
| Показатель | Значения показателя при различном соотношении объема теней к объему вводимого препарата (Кт/п) | ||||||
| 2:1 (2) | 3:2 (1,5) | 1:1 (1) | 1:2 (0,5) | 1:3 (0,33) | 1:5 (0,2) | 1:10 (0,1) | |
| Ht, % | 54±3,7 | 41±2,8 | 35±2,4 | 15±1,05 | 11±0,7 | 6±0,4 | 3,5±0,2 |
| Средний диаметр контейнеров, мкм | 56±3,9 | 75±5,2 | 104±7,2 | 99±6,9 | 107±7,4 | 108±7,5 | 105±8,1 |
| % клеток > 70 мкм | 8,3±1,2 | 51±3,5 | 65±4,5 | 60±4,2 | 67±4,7 | 71±4,9 | 68±4,5 |
| % включенного препарата | 67±4,6 | 58±4,06 | 54±4,3 | 31±2,1 | 25±1,7 | 15±1,2 | 8±0,6 |
| Число фрагментов эритроцитов, ‰ | 24,5±1,7 | 19,8±1,4 | 23,9±1,6 | 17,6±1,2 | 18,3±1,3 | 15,8±1,1 | 20,5±1,4 |
| Масса препарата, в 1 носителе, пг | 92,5±6,4 | 80,0±5,6 | 74,5±5,2 | 42,8±2,9 | 34,5±2,4 | 20,7±1,4 | 11,0±0,7 |
Доказательством включения магнитной жидкости FLW 001.40 в тени был факт ее определения в экстракте из контейнеров после их повторного центрифугирования. Как видно из таблицы, доля препарата, включенного в тени, снижалась пропорционально уменьшению Кт/п и гематокрита, составляя 67% при Кт/п= 2, 54% при Кт/п=1 и 8% при Кт/п=0,1. При максимальных значениях концентрации теней (соотношениях тени/препарат 2,0 и 1,5) средний диаметр получаемых контейнеров был низким, составляя 56 и 75 мкм соответственно. При соотношении, равном 1, диаметр получаемых контейнеров достигал 100 мкм и не изменялся при дальнейшем снижении Кт/п.
Процент клеток, имеющих диаметр более 70 мкм и наиболее эффективно выполняющих транспортную функцию увеличивался при уменьшении Кт/п от 2,5 до 1 и в дальнейшем не изменялся.
Следует отметить, что несмотря на большой процент включения препарата в тени при высоких значениях Кт/п, возможности использования эритроцитов как контейнеров использовались не полностью. Среда содержала большое количество не заполненных препаратом теней, масса включенного в тени препарата (в расчете на 1 клетку) была низкой.
Таким образом, проведенные исследования доказали возможность получения магнитоуправляемых эритроцитарных теней (МУЭТ) и позволили разработать методику, обеспечивающую максимально эффективное насыщение контейнеров путем оптимизации соотношения объемов теней и включаемого в них вещества. Это соотношение оказалось близким к единице. При больших значениях отношения «тени/препарат» было низким количество полноценных контейнеров, а при уменьшении Кт/п значимо снижался процент включенного в тени препарата (из-за снижения гематокрита и увеличения объема внеклеточной жидкости), что приводило к значимому перерасходу включаемого в тени вещества.
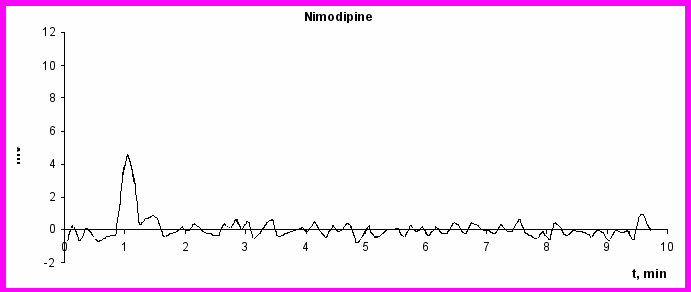
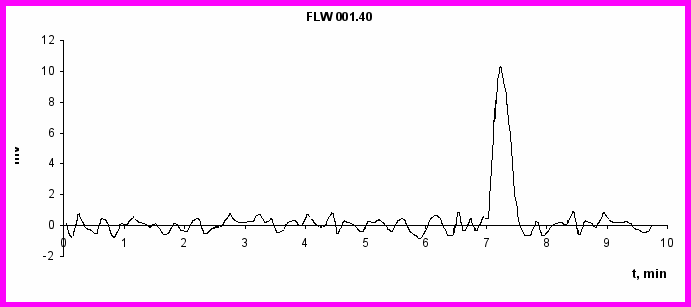
Вторым этапом исследования стала оценка возможности создания многокомпонентной транспортной системы, содержащей лекарственный препарат (нимодипин) и магнитный наполнитель (магнитную жидкость FLW 001.40). Для этого изучена эффективность разделения смеси данных реагентов с помощью гель-хроматографии с последующим количественным определением каждой субстанции. Проведено 3 серии экспериментов. В 1-й серии экспериментов хроматографированию подвергали субстанцию нимодипина, во 2-й – магнитную жидкость FLW 001.40, в 3-й – смесь субстанции нимодипина и магнитной жидкости в массовом соотношении 1:10. Соотношение соответствует дозам препаратов, в которых предполагалось включать их в эритроцитарные тени. На рис. 3. приведены хроматограммы нимодипина, магнитной жидкости FLW 001.40 и смеси нимодипина с магнитной жидкостью FLW 001.40. При хроматографировании субстанции нимодипина регистрировался единственный пик, время удержания которого составило 1,22±0,03 мин. Концентрации примесей в субстанции находились вне пределов разрешения метода.
a.
б.
в.
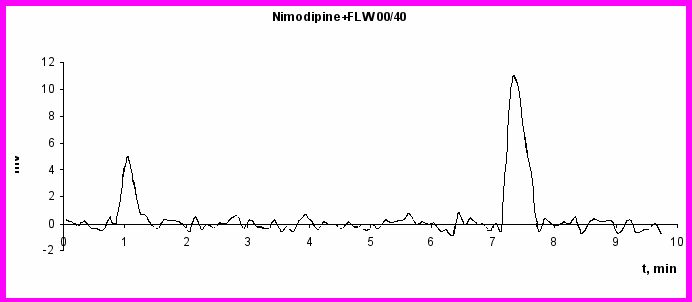
Рис. 3 Хроматограммы: а) нимодипина (25 мкг/мл); б) магнитной жидкости FLW 001.40 (200 мг/мл Fe); в) смеси Нимодипина (25 мкг/мл)с магнитной жидкостью FLW 001.40 (200 мг/мл Fe)
Зависимость площади пика от концентрации в диапазоне концентраций нимодипина 1 - 50 мкг/мл была практически линейной, что позволило построить калибровочную кривую для его количественного определения. При хроматографировании магнитной жидкости также регистрировался единственный пик, время удержания для него было равно 7,44±0,13 мин. В пределах исследованных концентраций (10 – 500 мкг/мл по Fe) отмечалась линейная зависимость площади пика от концентрации с Rкорр=0,997. При хроматографировании смеси нимодипина с магниитной жидкостью регистрировалось 2 пика. Время удержания первого составило 1,26±0,04 мин, второго – 7,49±0,09 мин, что позволило идентифицировать их как пики соответственно нимодипина и МЖ FLW 001.40. Площади пиков соответствовали взятым для исследования концентрациям субстанций, что свидетельствует об отсутствии расходования компонентов смеси. Последнее является косвенным подтверждение отсутствия образования ковалентных связей между нимодипином и компонентами МЖ при выбранных условиях совместной инкубации.
Таким образом, проведенные исследования продемонстрировали возможность хроматографического разделения смеси нимодипина с магнитной жидкостью FLW 001.40, что указывает на отсутствие образования устойчивых связей между нимодипином и компонентами магнитной жидкости и свидетельствует возможности совместного включения данных субстанций в клеточные контейнеры (эритроцитарные тени).
Третьим этапом работы стало сравнительное токсикологическое исследование магнитной жидкости FLW 001.040 в свободной и инкапсулированной в эритроцитарные тени форме.
При исследовании острой токсичности были определены летальные и максимально-переносимые дозы для свободной магнитной жидкости FLW 001.040. и эритроцитарных теней. В таблице 3 приведены токсикологические характеристики исследованных субстанций в пересчете на магнетит (Fe3O4). В скобках указаны объемы магнитной жидкости, соответствующие указанным значениям.
Таблица 3
Характеристики эритроцитарных контейнеров с магнитной жидкостью при различных технологиях насыщения
| Показатель | Значения показателей для различных субстратов | |
| Свободная МЖ | Эритроцитарные тени с МЖ | |
| LD50 | 548 мг/кг (1,89 мл/кг) | 812 мг/кг (2,8 мл/кг) |
| LD 50 min | 412 мг/кг (1,42 мл/кг) | 522 мг/кг (1,8 мл/кг) |
| LD 50 max | 737 мг/кг (2,54 мл/кг) | 928 мг/кг (3,24 мл/кг) |
