«исследование на доклиническом уровне иммунотропных свойств низкомолекулярных пептидов коллагена» 14. 00. 25 фармакология, клиническая фармакология 14. 00. 36 аллергология и иммунология
| Вид материала | Исследование |
- Клиническая эффективность и фармакоэпидемиология лекарственных средств у детей с аллергическим, 462.25kb.
- Исследование качества жизни и фармакоэкономические особенности лечения эпилепсии, 336.43kb.
- «Клиническая фармакология» Специальность: 111201 Ветеринария Пояснительная записка, 94.74kb.
- «Экспериментальная и клиническая фармакология» журнал к сведению, 84.61kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 10 Фармакология,, 197.39kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Оптимизация фармакотерапии плоского лишая 14. 00. 25. фармакология, клиническая фармакология, 214.56kb.
- Исследование эфективности направленного транспорта нимодипина в магнитоуправляемых, 359.89kb.
- Лекарственные растительные средства в профилактике респираторных заболеваний у детей, 439.68kb.
- Оптимизация противотромботической терапии острого инфаркта миокарда 14. 00. 06 кардиология, 862.58kb.
На правах рукописи
Милешина Светлана Евгеньевна
«ИССЛЕДОВАНИЕ НА ДОКЛИНИЧЕСКОМ УРОВНЕ ИММУНОТРОПНЫХ СВОЙСТВ
НИЗКОМОЛЕКУЛЯРНЫХ ПЕПТИДОВ КОЛЛАГЕНА»
14.00.25 – фармакология, клиническая фармакология
14.00.36 – аллергология и иммунология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2007
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию».
Научные руководители:
| Доктор медицинских наук, профессор | Козлов Иван Генрихович |
| Кандидат медицинских наук, доцент | Дмитриева Наталья Борисовна |
Официальные оппоненты:
| Член-корр. РАМН, доктор медицинских наук, профессор ГОУ ВПО Российский государственный медицинский университет | Шимановский Николай Львович |
| Доктор медицинских наук, профессор ГНЦ Институт иммунологии ФМБА России | Ярилин Александр Александрович |
Ведущая организация:
ГУ НИИ фармакологии им. В.В. Закусова РАМН
Защита диссертации состоится «21» января 2008 года в 14.00 часов на заседании диссертационного совета Д 208.072.01 при Российском государственном медицинском университете, по адресу: 117997, г. Москва, ул. Островитянова, д. 1.
С диссертацией можно ознакомиться в библиотеке университета.
Автореферат разослан «7» декабря 2007 года.
Ученый секретарь
Диссертационного совета,
д.м.н., профессор П.Х. Джанашия
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
К настоящему времени накоплено множество данных о роли иммунной системы в патогенезе многих заболеваний. Иммунные нарушения приводят к утяжелению течения заболевания, его хронизации, резистентности к традиционной симптоматической терапии. В связи с этим поиск новых лекарственных средств, способных корригировать иммунные нарушения приобретает на современном этапе все большую актуальность.
Одним из перспективных направлений терапии иммунных нарушений является использование в качестве лекарственных препаратов иммунорегуляторных пептидов. Большой интерес в этом плане представляют фрагменты гликопротеидов экстраклеточного матрикса (ЭКМ).
Коллагеновые пептиды (КП) являются низкомолекулярными продуктами ограниченного протеолиза коллагеновых белков – обязятельных компонентов ЭКМ. По имеющимся в литературе данным они способны оказывать существенное влияние на функции различных видов клеток [Золотарев И.А., 2006; Davis G.E., Bayless K.J., 2000; Koo L.Y., 2002; Luzak B., 2003; Maeshima Y., 2001; Simeon A., 2000]. Что же касается влияния КП на клетки иммунной системы, то в литературе такая информация встречается редко. Однако целый ряд косвенных данных позволяет предполагать наличие у КП значительного регуляторного потенциала. Благодаря эндогенному происхождению, низкой видоспецифичности, малому размеру и наличию высокоспецифичных рецепторов на клетках, КП являются перспективными веществами для создания новых иммунотропных препаратов.
Кроме прикладного значения, исследование свойств КП имеет и важный теоретический аспект. Изучение биологических эффектов этого нового класса регуляторных агентов является актуальным для более глубокого и всестороннего понимания механизмов развития различных физиологических и патологических процессов, протекающих в организме в целом и в иммунной системе в частности.
Поэтому целью данной работы явилось изучение иммунотропных и других фармакодинамических эффектов низкомолекулярных пептидов коллагена.
Для достижения данной цели были поставлены следующие задачи:
- Получить фракцию низкомолекулярных пептидов коллагена I типа.
- Оценить действие КП на спонтанную и индуцированную различными агентами пролиферацию мононуклеарных клеток периферической крови человека.
- Изучить эффекты КП в отношении нейтрофилов и макрофагов: миграционную активность, фагоцитоз, продукцию активных форм кислорода и апоптоз.
- Исследовать влияние КП на течение острой генерализованной инфекции у мышей.
- Изучить влияние КП на плазменно-коагуляционный гемостаз.
- Исследовать действие КП на пролиферацию фибробластов человека.
Научная новизна работы
В ходе работы был модернизирован метод получения препарата низкомолекулярных пептидов, являющихся аналогами продуктов воспалительной деградации коллагена. Впервые было проведено комплексное тестирование фармакодинамических эффектов КП на иммунокомпетентных клетках человека. Было выявлено, что основной мишенью для КП в иммунной системе являются макрофаги и нейтрофилы. В отношении этих клеток КП оказывают провоспалительное действие, которое выражается в активации миграционных, фагоцитарных и синтетических функций лейкоцитов.
Впервые было показано, что действие КП на лимфоциты человека носит модулирующий характер, зависящий от степени активации клеток. Данный эффект КП проявляется только в отношении Т-лимфоцитов и не наблюдается в случае В-клеток.
Впервые выявлено, что введение КП при экспериментальном перитоните у мышей увеличивает среднюю продолжительность жизни и количество выживших животных, а также снижает интенсивность процесса спайкообразования.
Впервые было исследовано влияние КП на плазменно-коагуляционный гемостаз человека. Было выявлено, что, в зависимости от концентрации, КП способны оказывать как прокоагулянтное, так и антикоагулянтное действие.
Также было продемонстрировано, что в широком диапазоне концентраций КП вызывают усиление пролиферации фибробластов.
Практическая значимость
В процессе работы был модернизирован метод получения фракции КП, позволяющий сократить время выделения и увеличить выход активных пептидов. Совокупность данных, полученных о влиянии КП на иммунокомпетентные клетки, открывает большие возможности для их применения в качестве иммуностимулирующих препаратов. Так, возможно их использование, как при острых, так и при хронических вялотекущих инфекционных заболеваниях. Не исключено их применение в качестве адъювантов при вакцинации. Такой эффект КП, как усиление пролиферации фибробластов, может быть использован для ускорения репаративных процессов.
Данные, полученные в ходе исследования, представляют также фундаментальный интерес и позволяют начать полномасштабные исследования регуляторного влияния КП в отношении клеток, участвующих в воспалении и иммунном ответе.
Основные положения, выносимые на защиту:
- КП оказывают выраженное стимулирующее действие на все функции нейтрофилов и макрофагов периферической крови человека: усиливают поглотительную и переваривающую способность фагоцитов, активируют в них продукцию свободных радикалов и увеличивают миграционную активность клеток.
- КП обладают модулирующим действием на пролиферацию активированных Т-лимфоцитов человека и не действуют на В-клетки.
- КП значительно повышают резистентность животных к стафилококковой инфекции.
Апробация работы
Основные положения диссертации были доложены на V Съезде иммунологов и аллергологов СНГ (С.-Петербург, 2003), II Международной конференции «Современные аспекты реабилитации в медицине» (Ереван, 2005), II Российской конференции по иммунотерапии и иммунореабилитологии (Москва, 2005), IV конференции иммунологов Урала «Актуальные проблемы фундаментальной и клинической иммунологии и аллергологии» (Уфа, 2005), Российской научно-практической конференции «Современные технологии в иммунологии: иммунодиагностика и иммунотерапия» (Курск, 2006), Всероссийской конференции молодых ученых «Иммунитет и аллергия: от эксперимента к клинике» (Пермь, 2006), VIII Конгрессе «Современные проблемы аллергологии, иммунологии и иммунофармакологии» (Москва, 2007).
Работа апробирована на совместном заседании кафедры фармакологии, кафедры и отдела иммунологии ГОУ ВПО РГМУ Росздрава. По материалам диссертации опубликовано 9 печатных работ.
Внедрение результатов исследования
Результаты диссертации внедрены в учебный процесс на кафедре фармакологии ГОУ ВПО РГМУ Росздрава.
Разработанные в диссертации модели и методы используются в экспериментальной работе отдела иммунологии ГОУ ВПО РГМУ Росздрава и отдела молекулярной и экспериментальной гематологии, онкологии и иммунологии ФНКЦ Детской гематологии, онкологии и иммунологии Росздрава.
Объем и структура диссертации
Диссертация изложена на 120 страницах машинописного текста, иллюстрирована 25 рисунками, содержит 4 таблицы. Работа состоит из введения, обзора литературы, описания материалов и методов исследования, результатов собственных исследований, обсуждения полученных данных, выводов и списка литературы. Библиографический указатель включает 155 ссылок на литературу, из них 46 отечественных и 109 зарубежных источника.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
При проведении большинства исследований руководствовались методиками, рекомендованными для доклинических исследований новых фармакологических веществ [Хабриев Р.У. и др., 2005].
Объекты исследования. Для экспериментальных исследований использовали венозную кровь здоровых добровольцев, не имеющих инфекционных и аллергических заболеваний. Добавление в кровь антикоагулянта осуществляли в зависимости от изучаемого объекта: при оценке функций лейкоцитов использовали гепарин (50 ЕД – на 1 мл крови), при изучении активности лимфоцитов – 2,7 раствор натриевой соли ЭДТА, при исследовании действия смеси пептидов на гемостаз в качестве стабилизатора применяли 3,8% раствор цитрата натрия. Объектом исследований служила как цельная кровь, так и выделенные из нее на градиенте плотности популяции клеток: мононуклеарные клетки (МНК) и нейтрофилы.
В работе также использовали фибробласты линии М-19 (человеческие эмбриональные диплоидные клетки). Данная линия была получена в Институте полиомиелита и вирусных энцефалитов РАМН. Культуру фибробластов поддерживали пассированием в стандартных условиях.
Исследования также проводили на экспериментальных животных. Эксперименты поставлены на 480 мышах-самцах линии CBA массой 20-22 г 8-10-недельного возраста. В опытах использовали животных, прошедших карантинный режим вивария РГМУ и не имевших внешних признаков каких-либо заболеваний. Все животные содержались в одинаковых условиях на стандартном рационе вивария РГМУ. Экспериментальные группы животных формировали рандомизированно по 10 мышей в каждой. В контрольные и опытные группы входили мыши одного возраста, полученные из питомника одновременно, разброс по исходной массе животных составлял не более 10%. Все исследования на животных проводили не менее чем в трех повторных сериях опытов, в первой половине дня. Для проведения иммунологических исследований мышей выводили из опыта методом цервикальной дислокации.
Тестируемая смесь коллагеновых пептидов. В настоящей работе исследовали эффекты смеси низкомолекулярных (<10 кДа) коллагеновых пептидов (КП). КП получали самостоятельно методом ферментативной деградации коллагена I типа. Методика получения КП. Коллаген I типа выделяли из хвостовых сухожилий лабораторных крыс методом уксуснокислой экстракции с последующим высаливанием в градиенте хлорида натрия. Затем из полученного уксуснокислого раствора формировали трехмерный экстраклеточный матрикс, путем повышения pH и ионной силы раствора. Далее коллагеновый матрикс подвергали ферментативному гидролизу, используя бактериальную коллагеназу Cl. hystoliticum, очищенную от примесей неспецифических протеаз методом гель-фильтрации на Sephadex G-100. На последнем этапе получали низкомолекулярную фракцию путем ультрафильтрации коллагенового лизата через мембраны с диаметром пор <10 кДа. Определение концентрации коллагена и КП проводили спектрофотометрически при длине волны 558 нм с помощью специфического окрашивания оксипролина реактивом Эрлиха [Light N.D., 1985].
Действие КП изучали в трех диапазонах концентраций: низкой (1 мкг/ мл), средних (10-100 мкг/мл) и высокой (1000 мкг/мл). При постановке всех экспериментов параллельно с опытными, вели контрольные пробы, в которые вместо КП добавляли полный гидролизат коллагена I типа в эквивалентных объемах.
Методы исследования
1. Выделение клеток из периферической крови человека. Клетки выделяли в стерильных условиях градиентным методом. Для получения фракции МНК использовали раствор фиколл-урографина плотностью 1,077 гсм3 [Boyum A., 1968]. Выделение нейтрофилов проводили на двойном градиенте фиколл-урографина, применяя растворы плотностью 1,077 гсм3и 1,119 гсм3 [Подосинников И.С. и др., 1981]. Для проведения опытов in vitro клетки культивировали в среде RPMI 1640 с добавлением 10% эмбриональной коровьей сыворотки, 10 мМ Хепес-буфера (рН 7,2) и антибиотиков: 100 ед/мл пенициллина и 100 мкг/мл стрептомицина.
2. Определение спонтанной и индуцированной различными активаторами пролиферации лимфоцитов. Оценку пролиферации клеток производили радиоизотопным методом, подсчитывая включение 3Н-тимидина в ДНК делящихся клеток. Была использована концентрация МНК 0,2х106 кл/лунку. Для оценки индуцированной пролиферации МНК использовали митогены – фитогемагглютинин (ФГА) и поквид (ПВ), а также моноклональные анти-CD3 антитела Ico-90 в дозах, вызывающих максимальный и субмаксимальный пролиферативный ответ лимфоцитов. Для ФГА эти концентрации были 10 и 2,5 мкг/мл, для ПВ – 5 и 1 мкг/мл, а для анти-CD3-Ат – 2,5 и 1 мкг/мл, соответственно. При определении уровня спонтанной пролиферации вместо активаторов добавляли раствор Хенкса в эквивалентном объеме.
3. Определение продукции активных форм кислорода нейтрофилами и моноцитами. Продукцию активных форм кислорода проводили методом люминол-зависимой хемилюминесценции (ХЛ). В работе оценивали спонтанную и индуцированную зимозаном ХЛ.
4. Изучение фагоцитарной активности клеток периферической крови. Количественную поглотительную активность фагоцитов изучали в цельной крови методом проточной лазерной цитометрии [Пинегин Б.В., 2001], используя в качестве агента для фагоцитоза стафилококк, меченный зеленым флуоресцентным красителем - флуоресцеин-5-изотиоционатом (ФИТЦ). Оценку поглотительной и переваривающей способности фагоцитов проводили в цельной крови, используя модификацию классического микробиологического метода [Карпищенко А.И., 1999] с последующей микроскопией мазков. Исследовали такие показатели как фагоцитарный индекс, фагоцитарное число и показатель завершенности фагоцитоза (ПЗФ).
5. Оценка апоптоза в клетках. Исследование апоптоза лимфоцитов и нейтрофилов проводилось методом цитофлуориметрического определения количества ДНК с использованием дифференциального флуоресцентного красителя пропидиум йодида.
6. Исследование миграции нейтрофилов и макрофагов. Миграцию фагоцитов оценивали в модели in vivo на мышах по выходу клеток в брюшную полость. С целью стимуляции выхода нейтрофилов и макрофагов, в брюшную полость мышей вводили КП в концентрации 1-1000 мкг/мышь. Животным контрольной группы 1 вводили раствор Хенкса, контрольной группы 2 – 2% раствор пептона. Далее через 24 или 72 часа животных забивали, брюшную полость тщательно промывали раствором ФСБ, промывочную жидкость собирали и подсчитывали в ней количество клеток.
7. Изучение влияния КП на течение острой генерализованной инфекции проводили в модели экспериментального перитонита. Заболевание воспроизводили путем внутрибрюшинного введения мышам суточной культуры Staphylococcus aureus. КП вводили животным однократно: за 24 часа до инфицирования стафилококком (профилактическое назначение КП) или спустя 16 часов после инфицирования (лечебное назначение КП). Животным контрольных групп вводили раствор Хенкса. Действие КП оценивали по разнице в показателях средней продолжительности жизни (СПЖ) и выживаемости мышей в контрольной и опытных группах на десятые сутки после инфицирования. Ряд животных выводили из опыта методом цервикальной дислокации, вскрывали брюшную полость и проводили осмотр и фотосъемку.
8. Исследование плазменного гемостаза. Оценку плазменно-коагуляционного звена гемостаза проводили общепринятыми в лабораторной практике методами на автоматическом коагулометре, используя фотометрический режим измерения. В работе использовали готовые наборы реактивов (Instrumentation Laboratory). В бестромбоцитарной плазме определяли показатели: активированное частичное тромбопластиновое время, протромбиновое время, тромбиновое время, концентрацию фибриногена.
9. Определение пролиферативной активности фибробластов линии M-19. Пролиферацию фибробластов оценивали радиоизотопным методом с применением 3Н-тимидина. Была использована концентрация фибробластов 5×103 кл/лунку.
10. Статистическая обработка полученных результатов. При постановке всех экспериментов параллельно с опытными вели контрольные пробы. Характер вариабельности результатов экспериментов подчинялся законам нормального распределения. Статистическую обработку результатов экспериментальных данных проводили с помощью пакета анализа данных программного обеспечения «Microsoft Excel XP» путем расчета средней арифметической (М) и средней ошибки средней арифметической (m). Для оценки достоверности выявленных различий средних арифметических в группах использовали t-критерий Стьюдента, разницу считали достоверной при P<0,05. Для сравнения динамики гибели животных в разных группах использовали статистический комплекс программ GraphPadPrism for Windows (5 версия). Для оценки достоверности различий кривых выживаемости использовали log-rank тест.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Действие КП на спонтанную и активированную различными агентами пролиферацию лимфоцитов периферической крови человека. Влияние КП на пролиферативную активность лимфоцитов изучали с помощью радиоизотопного метода, для чего выделенные из периферической крови МНК культивировали в течение 72 ч в присутствие 1-1000 мкг/мл КП, а затем сравнивали значения включений 3H-тимидина в клетки, обработанные пептидами, и в контроле. При исследовании активированной пролиферации лимфоцитов, кроме КП в культуры добавляли стимулирующие вещества (ФГА, ПВ и моноклональные анти-CD3-Ат) в дозах, вызывающих максимальный и субмаксимальный пролиферативный ответ лимфоцитов. Эффект КП оценивали, сравнивая уровень пролиферации клеток в культурах, обработанных пептидами и в контроле (только активирующие агенты).
Было выявлено, что эффект КП зависит от вида активирующего агента, от концентрации пептидов, а также от уровня пролиферативной активности клеток (рис. 1.).
| Рисунок 1. Влияние КП на спонтанную и индуцированную пролиферацию МНК |
 |
В соответствии с полученными результатами, КП обладали следующими эффектами в отношении лимфоцитов:
- Индуцировали дополнительное увеличение пролиферации слабостимулированных клеток (активированных субмаксимальными дозами ФГА и анти-CD3-Ат). Наиболее эффективными оказались средние концентрации КП (10-100 мкг/мл): 212,0±15,3% (P<0,05) - для ФГА-активированных лимфоцитов и 213,2±16,8% (P<0,05) - для анти-CD3-стимулированных клеток. Аналогичные закономерности были получены в нестимулированных культурах МНК (149,1±9,2%, P<0,05).
- В случае максимальной активации лимфоцитов, эффект КП не зависел от дозы и выражался в незначительном усилении пролиферации анти-CD3-стимулированных (в среднем, 120,5±9,6%) и ингибировании ФГА-активированных лимфоцитов (около 77%).
- На поквид-активированные лимфоциты КП ни в одной из исследуемых концентраций не действовали (табл. 1.).
Учитывая специфичность использованных митогенов в отношении клеток иммунной системы, можно сделать вывод, что КП влияют на активацию Т-лимфоцитов (ФГА- и анти-CD3-стимуляция) и не действуют на В-лимфоциты (поквид-стимуляция). В связи с этим, дальнейшего исследования действия КП на гуморальный иммунный ответ мы не проводили.
Таблица 1. Влияние КП на индуцированную ПВ пролиферацию МНК
| Концентрация КП (мкг/мл) | Эффект КП (% от контроля) | |
| субмакс. доза ПВ | макс. доза ПВ | |
| 1 | 111,8±5,8 | 100,8±4,3 |
| 10 | 95,7±3,4 | 97,9±5,9 |
| 100 | 100,3±7,8 | 96,3±2,8 |
| 1000 | 99,3±5,1 | 103,0±4,5 |
Выявленная способность КП оказывать ингибируюшее действие на пролиферативную активность Т-лимфоцитов человека (максимальные дозы ФГА) могла быть связана с индукцией апоптоза в этих клетках.
Действие КП на апоптоз лимфоцитов периферической крови человека. Для изучения влияния КП на апоптоз нестимулированных лимфоцитов, выделенные из периферической крови МНК инкубировали в течение 12 ч в присутствие 1-1000 мкг/мл КП. Для изучения влияния КП на апоптоз активированных лимфоцитов, помимо КП (1 и 100 мкг/мл) в клеточные культуры вносили анти-CD3-Ат в дозах, вызывающих субмаксимальный и максимальный пролиферативный ответ (2,5 и 1 мкг/мл, соответственно), а инкубацию клеток проводили в течение 24 и 72 ч. Затем образцы окрашивали пропидиум-йодидом и цитофлуориметрически определяли количество суб-, ди- и тетраплоидных клеток.
Как видно из данных, представленных на рис. 2, в нестимулированных контрольных культурах (без добавления КП) через 12 ч количество апоптозирующих клеток составило 7,8±0,6%. КП ни в одной из исследуемых концентраций не только не увеличивали число апоптозирующих клеток, но и даже незначительно, но достоверно снижали этот показатель (P<0,05).
| Рисунок 2. Уровень апоптоза в нестимулированных МНК под действием КП |
 |
В культурах активированных лимфоцитов КП в исследуемых концентрациях также не вызывали апоптоза даже при длительном культивировании клеток. Более того, наблюдалась некая тенденция к снижению развития апоптоза в культурах, обработанных низкими дозами КП (табл. 2.). Таким образом, можно сделать вывод, что подавление пролиферации активированных Т-лимфоцитов под действием КП не происходит в результате индукции в клетках апоптоза.
Таблица 2. Уровень апоптоза в культурах МНК, стимулированных анти-CD3-Ат и КП
| Анти-CD3-Ат | |||||
| Субмаксимальные дозы | Максимальные дозы | ||||
| время культивирования | КП (мкг/мл) | % апоптоза | время культивирования | КП (мкг/мл) | % апоптоза |
| 24 часа | 0 | 14,2±1,8 | 24 часа | 0 | 10,8±1,7 |
| 1 | 15,3±2,5 | 1 | 9,9±2,8 | ||
| 100 | 14,0±1,5 | 100 | 13,2±2,5 | ||
| 72 часа | 0 | 28,3±2,3 | 72 часа | 0 | 32,4±0,7 |
| 1 | 21,8±1,4* | 1 | 24,8±2,3* | ||
| 100 | 31,0±0,8 | 100 | 33,1±1,2 | ||
*P<0,05 по отношению к контролю
Усиление пролиферации слабостимулированных лимфоцитов под действием КП могло быть опосредовано непрямой стимуляцией клеток, а именно через воздействие пептидов на антигенпрезентирующие клетки. С целью проверки данного предположения была проведена серия экспериментов по изучению действия КП на функциональную активность фагоцитов периферической крови.
Влияние КП на фагоцитарную реакцию нейтрофилов и моноцитов периферической крови человека. В работе изучали действие КП на поглотительную и переваривающую способность фагоцитов периферической крови. Количественную оценку поглотительной активности клеток исследовали методом проточной лазерной цитометрии, для чего цельную кровь инкубировали в течение 30 мин с ФИТЦ-меченными Staphylococcus aureus в присутствие КП в диапазоне концентраций 1-1000 мкг/мл, а затем определяли фагоцитарный индекс – количество флуоресцирующих (т.е. фагоцитировавших) клеток к общему числу нейтрофилов или моноцитов.
Результаты опытов свидетельствовали о том, что КП не изменяли количества фагоцитирующих клеток (нейтрофилов и моноцитов). И в контрольных (вместо КП добавляли раствор Хенкса) и в опытных образцах процент флуоресцирующих клеток составлял 80,0±4,0% – в гейте нейтрофилов и 74,3±3,6% – в гейте моноцитов. Увеличение времени инкубации крови с бактериями до 3 ч в присутствие КП также не изменяло поглотительной активности лейкоцитов по сравнению с контролем (около 87,6±5,2% – в гейте нейтрофилов и 78,1±4,2% – в гейте моноцитов). Отсутствие эффекта КП на число фагоцитов, во многом, могло быть связано с несовершенством использованной методики, т.к. она скорее ориентирована на выявление ингибирующих воздействий, чем на обнаружение эффекта стимуляторов. Поэтому далее исследование действия КП на фагоцитоз проводили классическим микроскопическим методом.
Цельную гепаринизированную кровь инкубировали в течение 30 и 60 мин. со Staphylococcus aureus в присутствие разных концентраций КП (1-1000 мкг/мл) или раствора Хенкса (контроль), после чего готовили мазки. Мазки фиксировали, окрашивали по Романовскому-Гимзе и исследовали микроскопией в иммерсионной системе, подсчитывая фагоцитарный индекс, фагоцитарное число и показатель завершенности фагоцитоза (ПЗФ). Данные об отсутствии влияния КП на количество фагоцитов крови, полученные при микроскопии мазков, подтвердили результаты цитофлуориметрии. КП ни в одной из концентраций не изменяли фагоцитарный индекс. Однако КП продемонстрировали выраженный эффект на качественные параметры фагоцитоза (рис. 3). Было выявлено, что наиболее эффективной является концентрация пептидов 100 мкг/мл, при которой в несколько раз увеличивалась как поглотительная, так и переваривающая способность лейкоцитов (фагоцитарное число составляло 160,8±8,6%, P<0,05; ПЗФ – 74,8±1,8%, P<0,05).
Влияние КП на продукцию активных форм кислорода нейтрофилами и моноцитами периферической крови. Одной из причин усиления бактерицидной функции фагоцитов под действием КП могла быть активация в этих клетках продукции свободных радикалов. Для проверки данного предположения цельную кровь инкубировали в течение 1 ч в присутствии КП, а
| Рисунок 3. Изменение фагоцитоза нейтрофилов под действием КП | |
| А. Действие КП на поглотительную активность клеток | B. Действие КП на бактерицидную активность клеток |
 |  |
| Рисунок 4. Усиление зимозан-индуцированной хемилюминесценции лейкоцитов под действием КП |
 |
затем измеряли спонтанную и индуцированную зимозаном хемилюминесценцию. В соответствии с полученными данными, эффект КП зависел от исходного состояния клеток: пептиды не влияли на нестимулированные фагоциты, но увеличивали ХЛ-ответ у предактивированных клеток (рис.4). Данный эффект КП также проявлялся только в средних концентрациях (10-100 мкг/мл), составляя 135,7±7,1% и 124,0±6,0%, соответственно (P<0,05). Результаты нашего исследования об активирующем действии КП на лейкоциты сопоставимы с литературными данными. Отдельные исследователи продемонстрировали способность некоторых низкомолекулярных КП вызывать «оксидативный взрыв» в нейтрофилах и моноцитах/макрофагах, а также индуцировать синтез протеолитических ферментов [Laskin D.L., 1994].
Действие КП на развитие апоптоза нейтрофилов. Далее мы исследовали влияние КП на запрограммированную клеточную гибель нейтрофилов. Оценку апоптоза проводили методом цитофлуориметрического определения количества ДНК в нейтрофилах, выделенных из периферической крови человека, используя дифференциальный краситель пропидиум йодид. В соответствии с полученными результатами, ни в одной из исследованных концентраций КП не изменяли апоптоз интактных нейтрофилов (данные не показаны).
Исследование миграционной активности лейкоцитов под действием КП в модели in vivo. На следующем этапе работы, для подтверждения полученного in vitro активирующего действия КП на функции фагоцитов были выполнены исследования in vivo на мышиной модели. В этих экспериментах изучалась способность КП при внутрибрюшинном введении вызывать хемотаксис нейтрофилов и макрофагов. Хемотаксическую активность клеток при введении пептона или КП оценивали по индексу стимуляции (ИС), который рассчитывали по формуле: ИС = A/B, где A – количество клеток при введении пептона или КП, а B – количество клеток при введении раствора Хенкса (контроль). Для оценки эффекта КП сравнивали ИС при обработке КП и при введении стандартного индуктора миграции фагоцитов – пептона.
Как видно из результатов, представленных на рис. 5, КП в широком диапазоне концентраций (10-1000 мкг/мышь) являются хемотаксинами для нейтрофилов и макрофагов, причем для миграции нейтрофилов оптимальной является концентрация КП 100 мкг/мышь (ИС составлял 2,4±0,2%; P<0,05), а для макрофагов – 1000 мкг/мышь (ИС был 2,6±0,2; P<0,05). Следует отметить, что эффект КП на миграцию фагоцитов в брюшную полость был сравним с действием пептона, который использовался в концентрации (4 мг/мышь) в несколько раз превышающей максимальную дозу КП.
| Рисунок 5. Влияние КП на миграцию фагоцитов in vivo | |
| A. Миграция нейтрофилов | B. Миграция макрофагов |
 |  |
Вторым важным результатом этого фрагмента исследований явилось отсутствие изменений в выживаемости животных (3 суток) или их поведенческих реакциях даже после введения КП в самой высокой концентрации (1000 мкг/мышь).
Таким образом, можно заключить, что КП обладают преимущественной направленностью действия в отношении фагоцитирующих клеток, которая выражается в усилении всех основных их функций. Следующей нашей задачей являлось изучение эффективности КП в условиях моделирования инфекционного процесса in vivo.
Влияние КП на развитие острой генерализованной инфекции. Исследование противоинфекционного эффекта КП проводили на модели острой генерализованной инфекции – перитонита мышей, индуцированного внутрибрюшинным введением S. aureus. КП вводили в брюшную полость мышей однократно в дозе 100 мг/кг, которая наиболее эффективно активировала функции фагоцитов in vitro.
Опыты показали, что КП значительно повышали резистентность организма к инфекции. Динамика гибели мышей, построенная в виде кривых выживаемости по методу Kaplan-Meier (рис. 6.), представляет достоверность различий (P; log-rank тест) в увеличении СПЖ и проценте выживаемости животных при использовании КП в дозе 100 мг/кг по сравнению с контролем. При однократном введении КП в лечебном режиме (через 16 часов после заражения стафилококком) выживаемость мышей повысилась до 80,0±12,6% (P=0,0048). Введение КП в той же дозе в профилактическом режиме (за 24 часа до инфицирования) давало наибольший абсолютный процент выживаемости, равный 90,0±9,5% (P=0,0023).
| Рисунок 6. Динамика гибели мышей с перитонитом при профилактическом и лечебном назачении КП в дозе 100 мг/кг | |
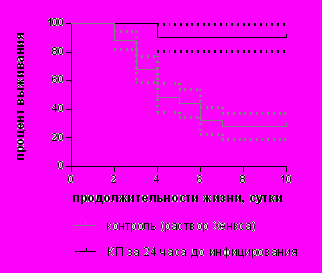 |  |
Таким образом, можно сделать вывод, что назначение КП как в профилактическом, так и в лечебном режиме, приводит к снижению смертности и увеличению средней продолжительности жизни мышей.
Кроме того, при вскрытии выживших животных было сделано интересное наблюдение – у мышей, получавших КП, отмечалось снижение интенсивности процесса спайкообразования. Причем лучшие показатели выживаемости и уменьшения спаечного процесса были получены при профилактическом применении КП (данные не показаны).
Так как реакция воспаления всегда сопровождается изменениями в системе свертывания крови и функционировании клеток соединительной ткани, мы провели серию экспериментов, посвященных изучению влияния КП на гемостаз и пролиферацию фибробластов.
Действие КП на систему гемостаза. Для исследования влияния КП на плазменно-коагуляционный гемостаз цитратную кровь инкубировали в течение 15 мин. при 37ºC в присутствие КП (1-1000 мкг/мл) и затем центрифугированием отделяли бестромбоцитарную плазму, в которой спектрофотометрически определяли показатели: АЧТВ, протромбиновое время, тромбиновое время, концентрацию фибриногена.
Полученные результаты свидетельствуют о том, что действие КП на функционирование системы гемостаза изменялось в зависимости от их концентрации (рис. 7). В низких и средних концентрациях (1-100 мкг/мл) пептиды обладали слабыми прокоагулянтными свойствами: изменение параметров составляло в среднем 10% по сравнению с контролем, но было достоверным. Напротив, КП в высоких дозах (1000 мкг/мл), оказывали выраженный антикоагулянтный эффект (P>0,05). Следует, однако, отметить, что все изменения показателей плазменного гемостаза при воздействии КП колебались в пределах клинической нормы.
Полученные результаты, несмотря на использование только ориентировочных методов оценки свертывания крови (АЧТВ, протромбиновое и тромбиновое время), позволяют предположить следующий механизм действия КП. Одновременное и однонаправленное изменение показателей во всех трех тестах указывает на то, что КП действует на заключительный этап свертывания – превращение фибриногена в фибрин. Измерение концентрации фибриногена также свидетельствует об этом. В литературе встречаются данные, подтверждающие это предположение. В одном из исследований было показано ингибирование полимеризации фибрина под действием некоторых коротких фрагментов коллагена I типа [Martinez-Lemus L.A., 2003]. Следует также отметить, что дозозависимый модулирующий эффект КП в отношении гемостаза хорошо укладывается в рамки известных данных о развития воспалительной реакции.
| Рисунок 7. Влияние КП на параметры гемостаза |
 |
Действие КП на пролиферативную активность фибробластов линии M-19. Не только целые коллагеновые молекулы, но и их фрагменты способны регулировать функции фибробластов [Золотарев И.А., 2006; Koo L.Y., 2003; Simeon A., 2000]. В данной работе мы исследовали действие суммарной фракции КП на пролиферативную активность фибробластов человека линии М-19. Для этого клетки линии M-19 засевали в низких концентрациях и после периода адаптации к ним одновременно добавляли КП в концентрациях от 1 до 1000 мкг/мл и 3Н-тимидин. По окончании культивирования анализировали включение радиоактивной метки в ДНК делящихся клеток. В контрольные культуры вместо КП добавляли полный гидролизат коллагена I типа. Как было обнаружено, КП во всех исследованных концентрациях ускоряют деление фибробластов (рис. 8). При этом наиболее эффективными являлись средние (10-100 мкг/мл) концентрации пептидов (132±10,1% и 150±5,3%, соответственно) (P<0,05).
| Рисунок 8. Влияние КП на пролиферацию фибробластов линии M-19 |
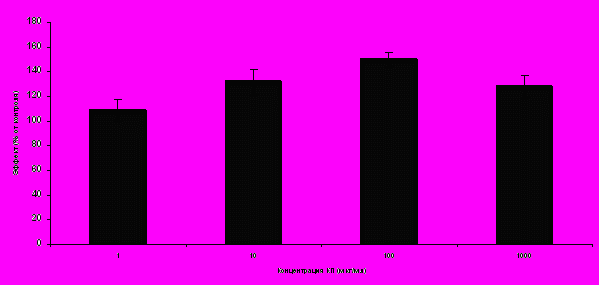  |
Подводя итог проделанной работы можно сделать два основных заключения.
Во-первых, КП являются мощными регуляторами функций клеток, являющихся основными участниками воспалительной реакции. По широте и степени выраженности эффектов их безусловно можно отнести к группе физиологически активных пептидов и включить в подгруппу регуляторных пептидов с преимущественно иммунотропной и провоспалительной активностью.
Во-вторых, выявленные в моделях, рекомендованных для экспериментального доклинического испытания лекарственных веществ, фармакодинамические эффекты КП, создают предпосылки для разработки новых препаратов, предположительно иммуномодулирующего действия.
ВЫВОДЫ
- Коллагеновые пептиды в концентрациях 10-100 мкг/мл значительно усиливают поглотительную и бактерицидную активность лейкоцитов периферической крови человека, а также стимулированную зимозаном продукцию свободных радикалов этими клетками.
- На модели in vivo (линейные мыши) коллагеновые пептиды в широком диапазоне концентраций индуцируют хемотаксис нейтрофилов и макрофагов. По степени выраженности данный эффект пептидов сравним с эффектом стандартного активатора миграции фагоцитов – пептона.
- Коллагеновые пептиды в концентрациях 1-100 мкг/мл усиливают пролиферацию МНК человека, стимулированных субмаксимальными дозами ФГА или анти-CD3 антител (Т-лимфоциты). При максимальной стимуляции пролиферации МНК эффект пептидов зависит от природы используемого митогена. Во всех исследованных концентрациях коллагеновые пептиды не оказывают влияния на пролиферацию МНК человека, стимулированных поквид-митогеном (В-лимфоциты).
- Однократное введение КП увеличивает выживаемость и среднюю продолжительность жизни животных в модели острой генерализованной инфекции (стафилококковый перитонит мышей).
- Коллагеновые пептиды в концентрациях 1-100 мкг/мл проявляют прокоагулянтные свойства, а в высокой концентрации (1000 мкг/мл), наоборот, оказывают антикоагулянтный эффект. Все изменения показателей плазменного гемостаза при воздействии коллагеновых пептидов изменяются в пределах клинической нормы.
- Во всех исследованных концентрациях коллагеновые пептиды активируют пролиферацию эмбриональных фибробластов человека.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Davidova N.V., Gorlina N.K., Sharova S.E. (Mileshina S.E.), Cheredeev A.N., Kozlov I.G. Method to evaluate the proliferation of activated lymphocytes in a three-dimensional collagen matrix // Russian Journal of Immunology, 2002, Vol. 7 (Suppl. 4), P. 335-342.
- Козлов И.Г., Давыдова Н.В., Шарова С.Е. (Милешина С.Е.), Горлина Н.К., Чередеев А.Н. Взаимодействие лимфомных и лейкозных клеток с коллагеновым матриксом // Аллергология и иммунология, Москва, 2003, том 4, № 2, С. 133. Материалы V Юбилейного съезда иммунологов и аллергологов СНГ. Санкт-Петербург, 8-11 июля 2003 г.
- Давыдова Н.В., Шарова С.Е. (Милешина С.Е.), Жукова И.Б., Дмитриева Н.Б., Дибирова Г.О., Козлов И.Г. Пролиферативная активность лимфоцитов при взаимодействии с фибриллярным коллагеном 1 типа // Russian Journal of Immunology, 2004, Vol. 8 (Suppl. 1), P. 11. Тезисы докладов Объединенного иммунологического форума. Екатеринбург, 31 мая – 4 июня 2004 г.
- Шарова С.Е. (Милешина С.Е.), Козлов И.Г., Дмитриева Н.Б., Давыдова Н.В., Жукова И.Б., Дибирова Г.О., Логинова О.В. Миграция и пролиферация активированных лимфоцитов в трехмерном коллагеновом матриксе при различных путях активации // Аллергология и иммунология, Москва, 2005, том 6, №2, С. 160. Тезисы II Российской конференции по иммунотерапии и иммунореабилитологии. Москва, 1-3 февраля 2005 г.
- Шарова С.Е. (Милешина С.Е.), Козлов И.Г., Дмитриева Н.Б., Давыдова Н.В., Жукова И.Б., Дибирова Г.О., Логинова О.В. Фибриллярный коллаген ингибирует пролиферацию лимфоцитов, предактивированных различными агентами // Материалы II Международной конференции «Современные аспекты реабилитации в медицине». Ереван, 29 сентября – 1 октября 2005 г. Труды конференции, С. 256.
- Шарова С.Е. (Милешина С.Е.), Козлов И.Г., Дмитриева Н.Б., Емельянов А.Ю., Давыдова Н.В., Жукова И.Б. Влияние коллагеновых пептидов на пролиферативную активность фибробластов // Иммунология Урала, Уфа, 2005, №1(4), С. 30-31. Материалы IV конференции иммунологов Урала «Актуальные проблемы фундаментальной и клинической иммунологии и аллергологии». Уфа, 17-19 октября, 2005 г.
- Шарова С.Е. (Милешина С.Е.), Дмитриева Н.Б., Давыдова Н.В., Емельянов А.Ю., Козлов И.Г. Модулирующий эффект коллагеновых матрикинов на пролиферацию мононуклеарных клеток человека // Russian Journal of Immunology, 2006, Vol. 9 (Suppl. 3), P. 131. Материалы Российской научно-практической конференции «Современные технологии в иммунологии: иммунодиагностика и иммунотерапия». Курск, 16 - 18 мая, 2006 г.
- Милешина С.Е., Дмитриева Н.Б., Давыдова Н.В., Козлов И.Г. Модулирующее влияние коллагеновых пептидов на пролиферацию лимфоцитов человека // Вестник уральской медицинской академической науки, Екатеринбург, 2006, №3-1(14), С. 152-155.
- Милешина С.Е., Дмитриева Н.Б., Дибирова Г.О., Козлов И.Г. Низкомолекулярные пептиды коллагена активируют продукцию свободных радикалов лейкоцитами периферической крови человека // Российский аллергологический журнал, Москва, 2007, №3, приложение 1, С. 30. Труды VIII Конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии». Москва, 27 – 29 июня 2007 г.
СПИСОК СОКРАЩЕНИЙ
| АЧТВ | – активированное частичное тромбопластиновое время |
| ДНК | – дезоксирибонуклеиновая кислота |
| ИС | – индекс стимуляции |
| КП | – коллагеновые пептиды |
| МНК | – мононуклеарные клетки |
| ПВ | – поквид |
| ПЗФ | – показатель завершенности фагоцитоза |
| СПЖ | – средняя продолжительность жизни |
| ФГА | – фитогемагглютинин |
| ФИТЦ | – флуоресцеин -5-изотиоционат |
| ФСБ | – фосфатно-солевой буфер |
| ХЛ | – хемилюминесценция |
| ЭКМ | – экстраклеточный матрикс |
