Оптимизация диагностической и лечебной тактики у больных с ангиодисплазиями 14. 00. 44 сердечно-сосудистая хирургия 14. 00. 19 лучевая диагностика, лучевая терапия
| Вид материала | Автореферат |
СодержаниеКлинические симптомы Нижние конечности Методы исследования Статистическая обработка полученных данных Результаты клинических и инструментальных Подключ. артерия Контроль (n=10) |
- Комплексная лучевая диагностика в оценке репаративного процесса при лечении больных, 429.1kb.
- Лучевая терапия различными видами ионизирующего излучения в комплексном лечении больных, 785.18kb.
- Адъювантная лучевая терапия рака желудка. 14. 00. 14 онкология 14. 00. 19 лучевая диагностика,, 304.24kb.
- Ультразвуковая диагностика и малоинвазивные методы лечения осложнений после оперативных, 622.01kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.65kb.
- Селиверстов Павел Владимирович лучевая диагностика диспластически-дистрофического синдрома, 488.95kb.
- Структурно-денситометрический анализ ткани легких у больных хобл 14. 00. 43 пульмонология, 332.85kb.
- Рефлексотерапия в реабилитации больных поздними лучевыми повреждениями и паллиативной, 426.37kb.
- Радионуклидная диагностика воспалительных заболеваний опорно-двигательного аппарата, 543.39kb.
- Нейтронная и нейтронно-фотонная терапия злокачественных новообразований слюнных и щитовидной, 340.88kb.
Первичное обращение при венозной форме заболевания отмечено в 41 (37,2 %) случае. Остальным 69 пациентам ранее было проведено какое-либо лечение – оперативное (удаление ангиоматозных тканей, флебэктомия в системе поверхностных вен, СВЧ-гипертермия и, даже, скелетизация и перевязка магистральных артерий), склеротерапия.
При венозных дисплазиях преобладала распространенная форма поражения – 59 (53,6 %) пациентов. Ограниченная форма диагностирована в 30 (27,3 %), диффузная - в 21 (19,1 %) наблюдении.
Основной жалобой у пациентов с венозными ангиодисплазиями было наличие опухолевидного образования, припухлости в зоне поражения – 95 (86,4 %) наблюдений, увеличивающегося при физической нагрузке, при наклонах головы или при задержке дыхания (в случае локализации в области и головы и шеи). Увеличение конечности в объеме отмечалось у 83,1 % пациентов, при распространенном и диффузном поражениях выявление этого признака доходило до 100 % (табл. 6).
Уплотнения (флеболиты) при пальпации зоны поражения (в случае венозного ангиоматоза) определялись редко – у 13 (11,8%) пациентов. Клиническое выявление этого симптома наиболее часто встречалось при локализации патологического процесса на конечностях - 13,7-17,4 % .
Таблица 6.
Клиническая симптоматика у больных с венозными формами ангиодисплазий.
| Клинические симптомы | Локализация | Всего | |||||
| Голова и шея | Верхние конечности | Нижние конечности | Туловище, таз, НПО | Смешанная | |||
| Боли | 11 (55,0 %) | 19 (82,6 %) | 40 (78,4 %) | 4 (40,0 %) | 5 (55,6 %) | 79 (71,8%) | |
| Опухолевидное образование | 20 (100 %) | 21 (91,3 %) | 42 (82,4 %) | 5 (71,4 %) | 7 (77,7 %) | 95 (86,4 %) | |
| Увеличение конечности в объеме | - | 19 (82,6 %) | 44 (86,3 %) | - | 6 (66,7 %) | 69 (83,1 %)* | |
| Удлинение конечности | - | - | 1 (2,0 %) | - | - | 1 (1,1 %)* | |
| Укорочение конечности | - | - | 2 (3,9 %) | - | - | 2 (2,4 %)* | |
| Нарушение функции конечности | - | 8 (34,8 %) | 9 (17,6 %) | - | 2 (22,2 %) | 19 (22,9 %)* | |
| Варикозные вены | - | 9 (39,1 %) | 24 (47,1 %) | - | 3 (33,3 %) | 36 (32,7 %) | |
| Выявление флеболитов при пальпации | 2 (10 %) | 4 (17,4 %) | 7 (13,7 %) | - | - | 13 (11,8 %) | |
| Капиллярный невус (ангиоматоз) | 5 (20,0 %) | 2 (8,7 %) | 16 (31,4 %) | 1 (14,3 %) | 3 (33,3 %) | 27 (24,5 %) | |
| Кровотечение в анамнезе | 1 | - | 2 (3,9 %) | 2 (28,6 %) | 2 (22,2 %) | 7 (6,4 %) | |
| Трофические расстройства | Гиперпигмен-тация | 7 (35 %) | 11 (47,8 %) | 19 (37,3 %) | 1 (14,3 %) | 2 (22,2 %) | 40 (36,4 %) |
| Трофическая язва | - | - | 6 (11,8 %) | - | - | 6 (5,5 %) | |
| ВСЕГО | 20 | 23 | 51 | 7 | 9 | 110 | |
* - данные рассчитаны для пациентов с поражением верхних и нижних конечностей
При лимфангиоматозе во всех случаях патологический процесс локализовался на нижних конечностях - локальное поражение отмечено у 2, распространенное - у 2 и диффузное - у 1 пациентки.
Основной жалобой было наличие припухлости в зоне поражения при локальном и распространенном процессе и увеличение всей конечности в объеме при диффузном поражении. После физических нагрузок и в вечернее время нагрузок припухлость усиливалась. Болевой синдром отсутствовал. В 3 случаях отмечались периодические воспалительные процессы в зоне поражения по тип целлюлита. Трофические расстройства (гиперпигментация) и лимфорея отмечались в 1 случае.
Методы исследования
При дуплексном сканировании, выполнявшимся на аппаратах “Acuson 128XP” и “GEL LOGIQ-9” (США), количественную оценку кровотока проводили как основании непосредственно измеряемых параметров, так и с помощью рассчитываемых индексов. К непосредственно измеряемым параметрам кровотока относились систолическая пиковая скорость, конечная диастолическая скорость. С помощью компьютерных программ рассчитывались индекс периферического сопротивления, систолодиастолический индекс, величина объёмной скорости кровотока.
Рентгеноконтрастное исследование сосудов выполнялось на установке GEM Integris-Allura фирмы PHILLIPS (Нидерланды). Артериографическое исследование выполнено у 84 больных с артериовенозной формой и у 6 - с венозной формой ангиодисплазии. Дистальная восходящая флебография выполнена у 4 пациентов с ВД.
У 61 больного (30,0 %) выполнена КТ (Philips CT Secura) с динамическим внутривенным контрастным усилением изображения с использованием неионного рентгеноконтрастного препарата Омнипак-350 («Никомед Амершем», Великобритания) с концентрацией 300-350 мг йода/мл. Методика заключалась в серийной томографии зоны интереса на 30-й сек, 1,3,5,7,10 минутах после болюсного введения в кубитальную вену контраста. На основании качественной оценки выбранной области интереса проводилось построение кривых “плотность-время”, по которым определялись оптимальные временные параметры введения препарата.
МРТ и МРА (без контрастного усиления или с контрастным усилением) проводились на магнитно-резонансном томографе PHILIPS GYROSCAN INTERA 1,0 (Германия) со сверхпроводящим магнитом (напряжённость магнитного поля 1,0 Тл) с использованием катушки Syn-body (1-4) в аксиальной, фронтальной и сагиттальной плоскостях. Исследования выполнялись по двум последовательно запускаемым программам с использованием контрастного средства и ручным стартом.
Для подавления МР-сигнала от структур, имеющих короткое Т1 (жировые структуры, метгемоглобин), использовался подготовительный импульс. Для контрастного усиления использовались парамагнитные комплексы гадолиния, такие как Gd-DTPA-BMA (Omniscan, Никомед Амершеaм, Великобритания) или Gd-DTPA (Magnevist, Шеринг, Германия).
МРТ была выполнена 51 пациенту, 23 - с артериовенозной и 28 – венозной формой ангиодисплазии, МРА проведена у 25 пациентов. Контрольная МРТ после проведенных оперативных вмешательств выполнена 19 пациентам.
Накожную ЛДФ (n=15) осуществляли с помощью лазерного анализатора капиллярного кровотока (ЛАКК-01) (НПО “ЛАЗМА”, РФ) с использованием базового световодного зонда для чрескожных исследований микроциркуляции (отделение функциональной диагностики НПЦ курортологии и восстановительной медицины, к.м.н. Кульчицкая Д.Б.). Результирующий параметр определял динамическую характеристику микроциркуляции крови – изменение потока крови в единицу времени в зондируемом объеме.
Цифровая ФПГ выполнялась на аппарате Vasoquant VQ1000 D-PPG (Elcat GmbH, Германия). Датчик размещался на уровне 10 см выше медиальной лодыжки. В положении сидя (при сгибании коленного сустава около 110 град) после начала акустических сигналов прибора пациент выполнял восемь последовательных сгибаний-разгибаний в голеностопном суставе. Для оценки данных ФПГ использовались два показателя: время венозного возврата To и мощность мышечно-венозной помпы Vo.
Статистическая обработка полученных данных выполнена на индивидуальном компьютере с помощью пакета прикладных программ Statistica for Windows v. 6.0, StatSoft Inc (США).
РЕЗУЛЬТАТЫ КЛИНИЧЕСКИХ И ИНСТРУМЕНТАЛЬНЫХ
МЕТОДОВ ИССЛЕДОВАНИЯ
Клиническое обследование. Характерный систоло-диастолический шум, свидетельствующий о наличии зоны прямого артериовенозного шунтирования, определялся в 95,5 % случаев АВД.
Обзорная рентгенография. При артериовенозной форме ангиодисплазии у четверти пациентов при наличии распространенного или диффузного поражения выявлено утолщение мягких тканей в исследуемой области. Рентгеносемиотика поражения костных структур характеризовалась наличием таких симптомов, как разрежение костной ткани, наличие кистовидных просветлений, субхондральный остеосклероз, остеогипертрофия, утолщение мягких тканей с нарушением дифференциации слоев, удлинение или укорочение конечностей.
Множественные флеболиты в мягких тканях при венозно-кавернозном ангиоматозе при рентгенографии выявлены у 32 % больных.
Ультразвуковое исследование. При исследовании ангиоархитектоники конечностей (верхних или нижних) у всех 57 пациентов при ДС регистрировалось увеличение диаметра магистральных артерий и вен с расширением их ветвей и притоков, повышение ЛСК и диастолической составляющей, снижение уровня периферического сопротивления. У всех обследованных пациентов была выявлена асимметрия диаметра приводящих артерий – резкое увеличение их диаметра на стороне поражения. Наиболее значимыми эти изменения были выражены при диффузных и распространенных формах заболевания (табл. 7-8).
Таблица 7.
Показатели ДС при артериовенозной форме ангиодисплазии верхних конечностей в зависимости от объема поражения
| | Подключ. артерия | Подмышечная артерия | Плечевая артерия | Локтевая артерия | Лучевая артерия | |
| Контроль (n=10) | ||||||
| Диаметр (мм) | 6,6 + 2,9 | 6,1 + 1,4 | 5,3 + 1,8 | 2,8 + 0,6 | 2,9 + 0,7 | |
| ЛСК (м/сек) | 0,69 + 0,15 | 0,67 + 0,2 | 0,56 + 0,14 | 0,50 + 0,13 | 0,46 + 0,11 | |
| ОСК (мл/мин) | 223 + 65 | 195 + 73 | 72 + 35 | 22 + 14 | 15 + 6,8 | |
| Диффузное поражение (n=6) | ||||||
| Диаметр (мм) | 10,6 + 3,9 | 9,1 + 3,4 | 7,4 + 2,9 | 3,4 + 1,3 | 3,1 + 0,8 | |
| ЛСК (м/сек) | 0,69 + 0,15 | 0,67 + 0,2 | 0,56 + 0,14 | 0,50 + 0,13 | 0,46 + 0,11 | |
| ОСК (мл/мин) | 1330 + 860* | 1006 + 720 * | 723 + 560* | 229 + 40* | 160 + 56* | |
* - различия между значениями достоверны по сравнению с группой контроля (p<0,01)
Таблица 8.
Показатели ДС при артериовенозной форме ангиодисплазии нижних конечностей в зависимости от объема поражения.
| | ОБА | ПБА | Подк. арт. | ЗББА | ПББА | |
| Контроль (n=10) | ||||||
| Диаметр (мм) | 10,2 + 2,1 | 5,4 + 1,3 | 7,6 + 2,3 | 2,7 + 0,2 | 3,2 + 0,7 | |
| ЛСК (м/сек) | 0,57 + 0,03 | 0,54 + 0,12 | 0,46 + 0,09 | 0,38 + 0,12 | 0,67 + 0,09 | |
| ОСК (мл/мин) | 362 + 134 | 244 + 57 | 111 + 51 | 20,3 + 12,0 | 11,5 + 4,9 | |
| Ограниченное поражение (n= 9) | ||||||
| Диаметр (мм) | 10,7 + 1,6 | 7,0 + 0,3 | 7,2 + 1,8 | 3,3 + 0,6 | 3,7 + 0,7 | |
| ЛСК (м/сек) | 1,1 + 0,4 | 1,0 + 0,31 | 0,7 + 0,26 | 1,0 + 0,3 | 0,85 + 0,2 | |
| ОСК (мл/мин) | 1246 + 614* | 750 + 127* | 618 + 390* | 214 + 191* | 220 + 177* | |
| Диффузное поражение (n=8) | ||||||
| Диаметр (мм) | 15,2 + 1,3 | 10,9 + 1,2 | 8,9 +1,5 | 4,1 + 0,7 | 3,9 + 0,6 | |
| ЛСК (м/сек) | 1,65 + 0,6* | 1,57 + 0,4 | 0,6 + 0,26 | 1,2 + 0,3 | 1,2 + 0,44 | |
| ОСК (мл/мин) | 7600 + 720* | 5300 + 540 * | 1800 + 230* | 354 + 97* | 287 + 113* | |
* - различия между значениями достоверны по сравнению с группой контроля (p<0,01)
Наибольшее значение при проведении ДС при АВД имеет определение объемной скорости кровотока – величины, количественно определяющей величину патологического сброса. Ее изменение отмечается в наиболее ранние временные сроки и на динамику этого показателя необходимо обращать внимание в процессе лечения.
Ангиоархитектоника при ВД отличается большой вариабельностью анатомического строения венозной системы. Мы можем одновременно констатировать наряду с гипоплазией и/или гипоплазией магистральных вен различной локализации (подвздошный, бедренно-подколенный, берцовый сегменты), наличие эмбриональных вен, атипичных перфорантных вен, варикозных изменений в бассейне большой и малой подкожных вен.
При венозно-кавернозном ангиоматозе независимо от глубины распространения ангиоматоза при ДС выявляются гипоэхогенные тонкостенные полости губчатой структуры. При компрессии датчиком в ячеистых полостях в режиме ЦДК регистрируется спонтанный кровоток, часто в кавернозных полостях определяются тромботические массы, указывающие на перенесенные ранее тромбозы лакун.
С помощью ультразвукового исследования у больных с венозно-кавернозным ангиоматозом возможно диагностировать в мягких тканях флеболиты, которые лоцируются в виде гиперэхогенных образований в мышечных структурах шаровидной или чечевицеобразной формы, дающих акустическую тень. Кавернозная трансформация мягких тканей, представлена ячеистыми полостями, диаметр которых находится в диапазоне от 1,8 мм до 4,5 мм. При глубокой локализации процесса только использование ЦДК позволяет выявить наличие ангиоматоза.
При лимфатических формах ангиодисплазий гемодинамически значимых изменений показателей гемодинамики по магистральным сосудам (как артериальным, так и венозным) не было отмечено ни в одном случае. Основное значение в диагностике имело УЗ-исследование мягких тканей в В-режиме. При этом на глубине до 1,0-2,5 см в подкожной клетчатке определялись ячеистые сотообразные структуры, сжимаемые датчиком. Эти структуры имели тонкие стенки и септальные перегородки. В режиме ЦДК эти гипо- и анэхоогенные структуры не были связаны с расположенными рядом сосудистыми структурами и не окрашивались, оставаясь гипоэхогенными.
Ангиография. Во всех случаях была получена точная информация об афферентных артериях. В 72,6 % случаев отмечалось выраженное расширение и извитость приводящих артерий с образованием множества патологически измененных (извитость, сужения и аневризматические расширения) ветвей. Эти неправильной формы сосуды в очагах ангиодисплазии образовывали сосудистые сплетения. При этом характерной чертой АВД являлось раннее контрастирование венозного русла, начинавшееся через 1 сек после начала введения контрастного вещества и заканчивавшееся через 3-4 сек, практически одновременно с контрастированием артерий. На ангиограмммах это выглядело как сплошной конгломерат патологических сосудов, на фоне которых мягкие ткани не определялись. Данные изменения соответствовали макрофистулезной форме поражения.
У 17 (20,2 %) пациентов расширение приводящих артерий и их ветвей было менее выражено по сравнению с вышеописанной картиной, или даже эти размеры соответствовали нормальным показателям. Однако, как и при макрофистулезной форме, отмечалась выраженная гиперваскуляризация в зоне поражения. Это соответствовало ангиографической картине при микрофистулезном поражении.
Компьютерная томография. При АВД при контрастировании отмечалось быстрое накопление контрастного вещества в зоне поражения и его ранее появление (одновременно с контрастированием артерий) в дренирующих венах. Все эти визуальные признаки обязательно соотносились с картиной контрастирования одноименных вен на противоположной “здоровой” стороне. На томограммах это было представлено множеством мелких узелковых образований, заполненных контрастным веществом и тонких полосок (ширина до 3 мм и длиной 3-5 мм), соответствующих расширенным сосудам. Плотность ангиоматозных узлов при контрастировании значительно повышалась, что позволило в 53,2 % наблюдений визуализировать один из главных питающих сосудов. Наличие в зоне поражения конгломерата патологически разно-направленных сосудов различного диаметра, формы и сечения, которые об-разовывали ячеистые, негомогенные образования в мышцах или подкожной клетчатки было выявлено во всех случаях выполненных исследований. Средняя плотность зоны поражения колебалась от 21 до 67 ед Н.
Выявленные на томограммах изменения в мышечной ткани позволили оценить степень ее поражения. Характерным признаком являлось уменьшение толщины мышечных пучков при общем утолщении мышцы (78,7% наблюдений).
Диагностическим признаком при венозных формах, в отличие от АВД, являлось накопление контрастного препарата в венозную фазу и частично (остатки контраста) в отсроченную фазу.
Динамическое контрастное усиление позволило получить еще более яркую КТ-картину за счет увеличения градиента плотностей патологических сосудов и окружающих тканей и создания “пестроты” плотностей.
При магнитно-резонансная томография (МРТ) в аксиальной, фронтальной и сагиттальной плоскостях на Т1- и Т2- взвешенных изображениях определялся диффузный конгломерат патологически извитых и расширенных сосудов с визуализацией склерозированной ткани между изменёнными сосудистыми структурами. При этом очень хорошая визуальная информация была получена о состоянии кожи, слизистых оболочек и прилежащей подкожной жировой клетчатки.
Поражение слизистых оболочек проявлялось их умеренным утолщением и повышением интенсивности сигнала на Т2-взвешенном изображении.
Локализация ангиоматоза в подкожно-жировой клетчатке характеризовалась умеренно гипоинтенсивным (42,1 %) или неоднородно гипоинтенсивным (57,8 %) сигналом на Т1-взвешенном изображении и гиперинтенсивным сигналом на Т2-взвешенном изображении по сравнению с сигналом от неизмененной клетчатки. Это свидетельствовало об имеющихся фиброзных изменениях в клетчатке.
При локализации патологического процесса в мышцах и подкожной клетчатке в 41,2 % наблюдений отсутствовала дифференциация поверхностной фасции. При этом множественные очаги выпадения МР-сигнала отмечались как на Т1-, так и на Т2-взвешенном изображении, эти изменения сочетались с визуализацией множественных лакун в области очага поражения.
Поражение мышечных массивов при АВД характеризовалось наличием множественных очагов выпадения МР-сигнала, имеющих округлую или продолговатую форму, и соответствующими извитым и аномально расширенным артериям на Т1- и Т2 взвешенном изображении. Параллельно на этом фоне визуализировались множественные лакуны различного диаметра (5-18 мм), имеющие неоднородно гиперинтенсивный МР-сигнал на Т2-взвешенном изображении и слабо гипоинтенсивный на Т1-взвешенном изображении (в сравнении с неизмененной мышечной тканью). Увеличение в размерах мышц было отмечено в 81 %, а нечеткость их контуров - в 54 % наблюдений.
Особую наглядность данное исследование давало в режиме STIR. При этом отмечалось неоднородное, слабой интенсивности повышение МР-сигнала от пораженных мышц. Гиперинтенсивные округлые образования при этом имели тенденцию к слиянию. Эта своеобразная “пестрота” поражения мышц и окружающих тканей была обусловлена разной степенью атрофии, дистрофии и дегенеративных изменений (жировое перерождение) мышечных волокон и различным диаметром сосудов, входивших в конгломерат.
Последовательность TSE позволяла сделать вывод об ускорении или замедлении кровотока в зоне поражения. Об ускорении свидетельствовали определяющиеся в данном режиме узелки (3-7 мм в диаметре) с резко сниженным сигналом. О наличии низкоскоростных сосудов говорили кистовидные образования с гиперинтенсивныс МР-сигналом на Т2-взвешенном изображении вокруг аномально расширенных сосудов в области ангиоматозного поражения. Использование режима 2D/TOF позволило оценить диаметр пораженных сосудов (артериальных и венозных).
Двух- и трехмерные изображения (3D/TOF) давали возможность более наглядно представить получаемую информацию, что делало получаемые при МРТ данные более доступными для интерпретации.
При МРА естественная контрастность при движении быстротекущей крови позволила получить изображение патологического клубка сосудов и питающих артерий без использования контраста. Некоторые неудачи МРА могут быть связаны с выраженным артериовенозным сбросом проксимальнее места исследования, в связи с чем в дистальных отделах сосудистого русла отмечается сниженное контрастирование сосудов.
Зона ангиоматоза при венозных формах АД на МРТ в 96,4 % случаев определялась как образование неправильной округлой формы, состоящее из конгломерата патологически извитых и расширенных сосудов (вен и венозных каверн) с довольно чёткими контурами.
МРА при венозных дисплазиях производилась в режиме 2D/PC (n=8) и 3D/TOF (n=5) без введения контрастного препарата. Во всех случаях визуализация артерий в артериальную фазу в зоне ангиоматоза отсутствовала.
Наличие тромботических включений в зоне венозных каверн и аневризматических изменений венозных сосудов проявлялось гиперинтенсивным сигналом на Т1-взвешенных изображениях и отсутствием МР-сигнала в режиме Т2-взвешенного изображения. При проведении МРА с контрастным усилением просвет многих вен выглядел нормальным. При выполненной дополнительно “время-пролетной” (TOF) МРА было подтверждено наличие тромботических масс.
При ЛДФ у пациентов с макрофистулезной формой АВД отмечены высокий тонус артериол 163 ± 15,0 % при норме 137,6 ± 33,6 %, застойные явления в венулярном отделе микроциркуляторного русла (AHF/CKO х 100 % - 92,7 % ± 10,17 при норме 46± 8,6 % и высокий базальный кровоток ПМ 6,5 ± 0,12 перф.ед. при норме 4,04 ± 0,36, что еще раз подтверждает наличие застойных явлений в венулярном звене. Также был установлен увеличенный показатель ACF/CKO х 100% и ACF/ПМ х 100%, но эти изменения были статистически недостоверны.
У пациентов с микрофистулезной формой отмечены высокий тонус артериол 166 ± 16,1 % , застойные явления в прекапилляном звене (ACF/CKO х 100% - 61,2 ± 9,1 % при норме 37,7 ± 8,4 %) и высокий базальный кровоток ПМ 9,5 ± 0,23 перф.ед. Наблюдалось увеличение показателя AHF/CKO х 100%, что предполагает наличие застойных явлений в венулярном звене микроциркуляторном русле. У этой категории больных установлено увеличение показателя ACF/ПМ х 100% -5 % ± 0,1 при норме 2,43 ± 0,3, что говорит об увеличении внутрисосудистого сопротивления (рис. 1).
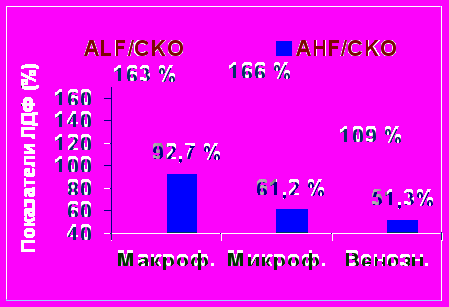
Рис. 1. Исходные показатели ЛДФ (ALF / СКO х 100 % и AHF / СКО х 100 %) у пациентов с макрофистулезной, микрофистулезной и венозной формой ангиодисплазий.
У большинства пациентов с венозной формой ангиодисплазии отмечены низкий тонус артериол 109 ± 15,0 %, застойные явления в прекапиллярном звене (ACF/CKOх100% -51,3 % ± 10,1 при норме 37,7 %) и высокий базальный кровоток ПМ 5,6 ± 0,12 перф.ед.
Методика ЛДФ нами использована как критерий эффективности компрессионного лечения (III класс компрессии) у больных с АВД и ВД нижних конечностей (n=10). После компрессионной терапии у всех больных установлена положительная динамика показателей ЛДФ-сигнала. Уменьшился тонус артериол с 165 ± 15,0 % до 125 ± 11,0 % (р < 0,05), показатель AHF/CKO х 100 % приблизился к нормальным значениям с 76,67 ± 10,17 % до 49 ± 5,8 % (р<0,05), базальный кровоток снизился с 7,5 ± 0,12 перф.ед. до 6,5 ± 0,16 перф.ед. (р<0,001). Данные показатели коррелировали с данными клинической картины, где основными оцениваемыми параметрами служили выраженность болевого и отечного синдромов, динамика трофических расстройств.
Сравнительная характеристика инструментальных методов в диагностике ангиодисплазий
Наиболее полную информацию о состоянии мягких тканей и в оценке патологического процесса с локализацией в костных структурах показала МРТ. Показатели диагностической чувствительности, специфичности и точности МРТ в этом разделе превосходили возможности ультразвукового исследования (рис. 2-3).
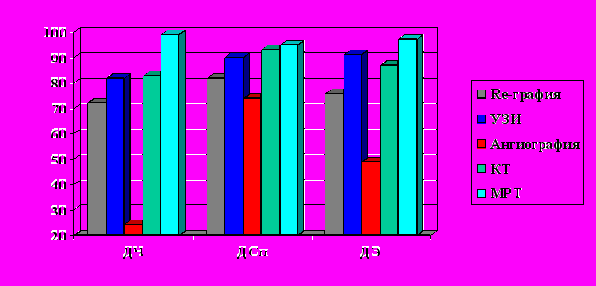
Сокращения к рис. 2-7. ДЧ – диагностическая чувствительность,
ДСп – диагностическая специфичность,
ДЭ – диагностическая эффективность (точность)
Рис. 2. Возможности инструментальных методов исследования при оценке поражения костной ткани ангиоматозным процессом.
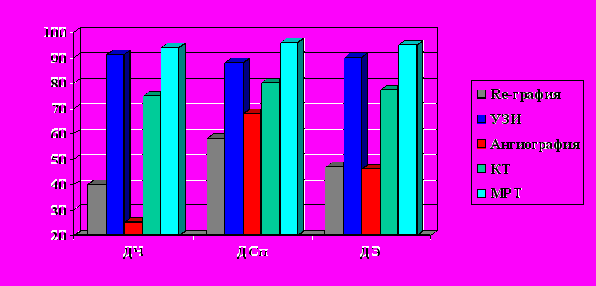
Рис. 3. Возможности инструментальных методов исследования при оценке поражения суставов ангиоматозным процессом.
Даже при достаточно выраженной клинической картине заболевания истинный объем поражения редко совпадал с внешними проявлениями. Среди инструментальных методов обследования наименьшими возможностями в диагностике зоны поражения обладала обзорная рентгенография, наибольшую информативность показали ультразвуковые методы и МРТ (рис. 4).
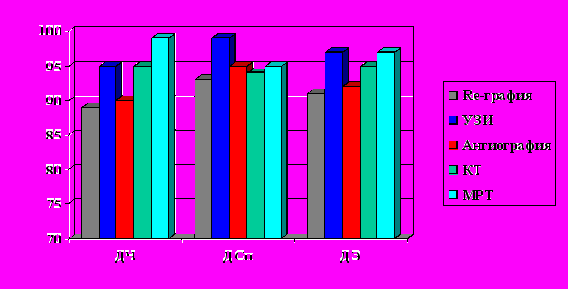
Рис. 4. Возможности инструментальных методов исследования при оценке величины и объема поражения ангиоматозом..
Судить о распространении ангиоматоза на те или иные анатомические структуры по данным клинического исследования или данных рентгенологическогоь исследования, было крайне затруднительно. Возможности ангиографии и флебографии не позволяли дифференцировать сами анатомические структуры – “мишени” нашего интереса. КТ и МРТ позволяли достаточно точно выявить принадлежность выявленных изменений к конкретному органу. МРТ с ее возможностью проведения реконструкций и построения изображения в различных плоскостях показала наилучшую способность определения связи ангиоматоза с окружающими тканями. МРТ обладала лучшими возможностями в диагностике эпифасциальных очагов поражения, особенно при невозможности по данным других методов диагностики дифференцировать фасциальные элементы. Диагностическая чувствительность МРТ составила при этом 97 %, специфичность – 96 %, эффективность – 96 % (рис. 5).
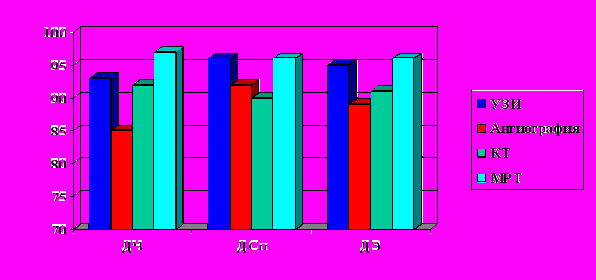
Рис. 5. Возможности инструментальных методов исследования при оценке вовлечения в патологический процесс различных анатомических образований.
С
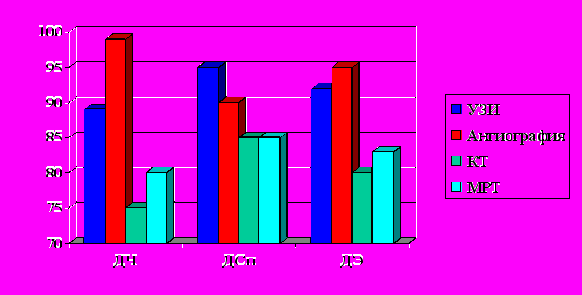 целью оценки сосудистого русла в зоне артериовенозного шунтирования по совокупности получаемых данных возможности КТ и МРТ значительно уступают ДС и рентгеноконтрастной ангиографии (рис. 6).
целью оценки сосудистого русла в зоне артериовенозного шунтирования по совокупности получаемых данных возможности КТ и МРТ значительно уступают ДС и рентгеноконтрастной ангиографии (рис. 6). Рис. 6. Возможности инструментальных методов исследования при выявлении зоны артериовенозного шунтирования.
П
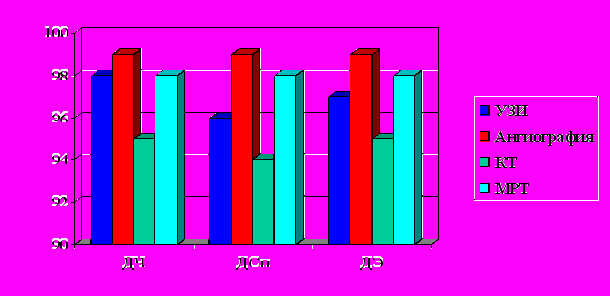 ри венозных дисплазиях проведение МР-ангиографии позволило нам исключить артериальный компонент в зоне ангиоматоза. Важную роль здесь играет МР-флебография, позволяющая по аналогии получить контрастирование путей оттока. Несмотря на высокие показатели чувствительности, специфичности и эффективности ангиографии, важным положительным моментом МР-томографических методов исследования возможность представления информации без применения контрастных препаратов (рис. 7).
ри венозных дисплазиях проведение МР-ангиографии позволило нам исключить артериальный компонент в зоне ангиоматоза. Важную роль здесь играет МР-флебография, позволяющая по аналогии получить контрастирование путей оттока. Несмотря на высокие показатели чувствительности, специфичности и эффективности ангиографии, важным положительным моментом МР-томографических методов исследования возможность представления информации без применения контрастных препаратов (рис. 7).Рис. 7. Возможности инструментальных методов исследования в оценке ангиоархитектоники венозных ангиодисплазий.
По своим показателям диагностической чувствительности, специфичности и эффективности современные неинвазивные методы исследования (ДС + МРТ), методы вплотную приближаются к возможностям “золотого стандарта” диагностики - рентгеноконтрастной ангиографии. Причем с использованием МРТ в ряде случаев питающие артерии с дренирующими венами можно визуализировать даже без применения контрастного вещества.
