Разработка биотехнологического процесса получения комплексного ферментного препарата пуллуланазы и использование его для крахмалопаточной промышленности
| Вид материала | Автореферат |
- Использование биологически-активной продукции биотехнологического происхождения для, 183.83kb.
- Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов,, 735.56kb.
- Его в место приобретения для получения полного возмещения его стоимости, 91.92kb.
- Разработка интегрированной системы менеджмента качества (iso 9001: 2000 и gmp) биотехнологического, 301.67kb.
- В статье авторы предлагают собственный опыт применении силденафила (Потенциале) с целью, 215.71kb.
- Использование компьютерных технологий для разработки моделей бизнес-процессов, 62.95kb.
- Б. А. Сентяков Официальные оппоненты: доктор технических наук, профессор, 327.36kb.
- Примерная программа наименование дисциплины история и методология научной агрономии, 170.2kb.
- Разработка биотехнологий получения иммобилизованных дрожжей и их применения в бродильных, 535.9kb.
- Вопросы комплексного государственного экзамена по специальности «Государственное, 67.64kb.
1 2
На правах рукописи
Кривова Ирина Анатольевна
Разработка биотехнологического процесса получения комплексного ферментного препарата пуллуланазы и использование его для крахмалопаточной промышленности.
Специальность: 03.00.04.- Биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2006г.
Работа выполнена на кафедре «Биотехнология» Государственного образовательного учреждения высшего профессионального образования «Московский Государственный Университет пищевых производств» (МГУПП)
Научный руководитель: доктор биологических наук, профессор
Бутова Светлана Николаевна
Официальные оппоненты: доктор биологических наук, профессор
Еремец Владимир Иванович
кандидат биологических наук, доцент
Шаненко Елена Феликсовна
Ведущая организация: ГНУ «Всероссийский научно-исследовательский институт пищевой биотехнологии» РАСХН (ГНУ ВНИИПБТ)
Защита состоится «15» декабря 2006 года в 10 часов на заседании Диссертационного совета К 212.148.01 Московского Государственного Университета пищевых производств» по адресу: 125080, Москва, Волоколамское шоссе, д.11,ауд. 53 ВК
Просим Вас принять участие в заседании диссертационного совета или прислать отзыв в двух экземплярах, заверенный печатью учреждения по адресу: 125080, Москва, Волоколамское шоссе, д.11, МГУПП, ученому секретарю Диссертационного совета К 212.148.01.
С диссертацией можно ознакомиться в библиотеке МГУПП
Автореферат разослан « 13 » ноября 2006г.
Ученый секретарь
Диссертационного совета, к.б.н. Ильина Н.А
Актуальность темы.
Нарушение структуры питания приводит к дефициту отдельных видов пищевых продуктов, например, таких как углеводы. В свою очередь это, вызывает необходимость организации и развития производства сахаристых веществ из крахмалосодержащего сырья и их отходов для обеспечения населения пищевыми заменителями сахара, такими как патока с высоким содержанием мальтозы и глюкозы. Такие патоки являются ценными пищевыми продуктами, более сладкими и менее вязкими по сравнению с обычной карамельной патокой. Они не гигроскопичны, не кристаллизуются при хранении, в связи с чем, пригодны для замены сахара в кондитерской, хлебопекарной, консервной, молочной и других отраслях промышленности.
Приоритетным направлением в области решения проблем обеспеченности пищевыми ресурсами народонаселения нашей планеты является внедрение в народное хозяйство экологически безопасных и экономически выгодных новых технологий. В связи с этим, перспективным представляется способ получения заменителей сахара путем ферментативного гидролиза с помощью амилолитического комплекса ферментов. Особая роль отводится ферменту пуллуланазе, которая гидролизует в пуллулане -1,6 связи, в результате возникают молекулы триоз, состоящих из трех остатков глюкоз. Важно отметить, что пуллуланазы расщепляют не только пуллулан, а также -1,6 связи в крахмале, предельных декстринах и гликогене. Это свойство пуллуланазы ценное и имеет большое практическое значение при получении сахаристых веществ на основе крахмала особенно при совместном действии -амилазы, - амилазы и глюкоамилазы, при этом не образуется продуктов кислой деструкции сахаров, а также продуктов их термического разложения, рН конечного продукта колеблется от 5,5 до 6,0.
Учитывая тот факт, что в нашей стране промышленного производства пуллуланазных препаратов нет, вопрос о поиске продуцентов внеклеточной пуллуланазы, разработке условий культивирования последнего, выделении фермента из культуральной жидкости, а также о возможности использования мультиэнзимных композиций ферментных препаратов пуллуланазы при биоконверсии
крахмалистого сырья с целью получения высокомальтозно-глюкозной патоки является весьма актуальным.
Цели и задачи исследования.
Целью настоящей работы являлся поиск активного продуцента внеклеточной пуллуланазы, разработка условий культивирования последнего, получение ферментного препарата, обладающего пуллуланазной активностью и последующее использования мультиэнзимных амилолитических композиций ферментных препаратов при деградации крахмалистого сырья для получения высокомальтозно- глюкозной патоки.
Для достижения данной цели были поставлены следующие задачи:
- скрининг микроорганизмов на их способность образовывать пуллуланазу;
- подбор оптимальной среды и режимов культивирования штамма – продуцента пуллуланазы;
- разработка оптимального способа хранения посевного материала микроорганизма-продуцента пуллуланазы;
- выделение и очистка внеклеточной пуллуланазы;
- исследование физико-химических свойств очищенного ферментного препарата пуллуланазы;
- использование амилолитического комплекса ферментов при деградации крахмалистого сырья для получения высокомальтозно – глюкозной патоки;
- разработка технологии получения высокомальтозно-глюкозной патоки из крахмалосодержащего сырья.
Научная новизна.
В представленной диссертационной работе научно обосновано и экспериментально доказано:
- по результам скрининга бактериальных культур, выделенных из различных почвенных образцов, найден продуцент пуллуланазы, изучены его культурально-физиологические особенности и определена видовая принадлежность – Micrococcus amylofaciens;
- оптимизированы условия питания и культивирования продуцента пуллуланзы;
- изучены условия выделения препарата внеклеточной пуллуланазы, хранения и очистки;
- на основании выявленных зависимостей выхода высокомальтозно- глюкозной
патоки от степени биоконверсии крахмалистого сырья впервые обоснован
оптимальный состав ферментативных систем амилолитического действия;
- разработана технология получения высокомальтозно-глюкозной патоки при
использовании мультиэнзимных композиций амилолитических ферментов;
Практическая значимость работы.
Проведенные исследования являлись основой для решения эколого-биологических задач по совершенствованию комплексной переработки различного крахмалосодержащего сырья и его отходов при использовании амилолитического комплекса ферментов микробного происхождения. Наряду с получением ценного продукта, а, именно, высокомальтозно-глюкозной патоки, нами одновременно решались вопросы снижения загрязнения окружающей среды отходами крахмалистого сырья и токсичными продуктами их деструкции:
- получен новый высокоактивный штамм – Micrococcus amylofaciens – продуцент пуллуланазы и разработана технология получения препарата пуллуланазы.
-разработана технологическая схема переработки растительного сырья, содержащего крахмал с целью получения высокомальтозной- глюкозной патоки;
- разработана стадия осахаривания сырья с использованием энзиматических комплексов;
- увеличен выход мальтозы по сравнению с традиционной технологией на 18,01,5%;
- улучшены разнообразные свойства и качественные характеристики паток. Результаты проделанной работы подтверждены в полупроизводственных условиях на установке опытного участка апробаций научных разработок при Центре “Биоинженерия” РАН.
Апробация работы.
Основные результаты диссертационной работы представлены в докладах и сообщениях:
-Научные конференции МГУПП 2004-2005 гг., г. Москва;
-Выставка-конкурс «Высокоэффективные пищевые технологии, методы и средства для их реализации», г. Москва, 2004г.
-Третья юбилейная международная конференция посвященная 75-летию МГУПП, Москва, МГУПП, 2005г.
-Третий съезд общества биотехнологов России, г. Москва, 2005 г.
-Научная конференция «Значение биотехнологии для здорового питания и решения медико-социальных проблем», г. Калиниград, 2005 г.
Публикации.
Основные положения и результаты диссертационной работы изложены в восьми печатных работах и тезисах.
Структура и объем диссертации.
Диссертация состоит из введения, обзора литературы, экспериментальной части, выводов, списка литературы, включающего 133 источника, приложений. Работа изложена на 200 страницах компьютерного текста и содержит таблиц 35 и 54 рисунка.
Содержание работы.
Во введении дано обоснование актуальности проблемы, сформулированы цель и задачи исследования, охарактеризована научная новизна и практическая значимость работы.
1.Обзор литературы
В обзоре литературы представлены данные о важной роли крахмала и продуктах его гидролиза в обмене веществ у растений, животных и человека, в основе питания и жизнедеятельности любого организма. Рассмотрен процесс гидролиза крахмала и производства его продуктов при использовании традиционного кислотного способа гидролиза и ферментативного. Указана важная роль ферментативного гидролиза с указанием значения фермента пуллуланазы при производстве высокомальтозно-глюкозной патоки. Обсуждаются вопросы расщепления крахмала и крахмалосодержащего сырья в свете представления действия ферментов, направленных на гидролиз разветвлений крахмала, где первостепенное значение имеет пуллуланаза. Рассмотрены современные представления о воздействии этого фермента на -1,6 связь амилопектина, что
дает возможность получения глюкозы амилолитическим комплексом ферментов. Проанализированы сведения о микроорганизмах- продуцентах пуллуланазы, условия выделения последней, механизме действия, хранении. Обсуждены перспективы использования пуллуланазы при получении сахаристых крахмалопродуктов с высоким содержпнием мальтозы и глюкозы.
2.Экспериментальная часть
Исследования и промышленные испытания проводились на кафедре “Биотехнология” ГОУ ВПО МГУПП, Московском Государственном Университете им. М. В. Ломоносова, Центре «Биоинженерия» РАН, ВНИИ крахмалопродуктов.
. 2.1. Материалы и методы исследования.
Объектами исследования было 187 культур микроорганизмов, выделенных из различных почвенных образцов. Идентификация видовой принадлежности микроорганизмов проводилась по тест системе API фирмы «Биомерье» (вioMERIEUX / France). Культивирование бактериальных культур осуществляли в аэробных условиях глубинной ферментацией. В качестве субстратов для изучения процессов ферментативного гидролиза использовали крахмалосодержащее сырье и его отходы. Биохимические и химические анализы крахмалосодержащего сырья проводили общепринятыми стандартными методами. Ферментативный гидролиз субстратов проводили с использованием фильтратов бактериальных культур, а также отечественных ферментных препаратов и зарубежных фирм “Ново”(Дания) и “Эндэ Индустриал Корпорэешн” (США). Активности культур определяли в фильтратах культур и в ферментативных препаратах по методикам, представленным в книге Полыгалиной Г.В., Чередниченко В.С., Римаревой Л.В. (2003). Очищенные препараты внеклеточной пуллуланазы получали путем диализа и фракционирования на колонках со смолой DEAE Toyopearl 650. составил
Патоку оценивали по общепринятым биохимическим показателям. Концентрацию редуцирующих веществ, образовавшихся в ходе ферментативной реакции, определяли методом Шомоди-Нельсона.
Достоверность экспериментальных данных подтверждена статистическими методами, в таблицах и на рисунках приведены результаты в виде средних значений, при этом величина доверительных интервалов средних арифметических значений параметров составила 1,0-1,5% при уровне значимости 0,5.
2.2. Результаты и их обсуждение.
2.2.1.Скрининг микроорганизмов на их способность образовывать пуллуланазу.
С целью отбора продуцентов пуллуланазы было обследовано 187 культур рода Bacillus, а именно представители следующих видов: B.mesentericus, B.circulans, B.subtilis, B.megaterium, B.macerans, B.stearothermophilus, B.brivis, B.licheniformis, B.thuriengiensis, B.polymyxa, B.coagulans и серия бактериальных культур, выделенная из различных почвенных образцов. Была осуществлена проверка всех культур на способность синтеза пуллуланазы. Критерием оценки при отборе продуцента служила декстринирующая способность (ДС), перспективными приняты те штаммы, которые давали более 30 % выхода от максимального значения ДС. По результатам было отобрано 6 культур рода Bacillus (табл.1), которые были предоставлены для исследования Институтом Биологии Уральского Научного Центра РАН и две бактериальные культуры, выделенная из различных почвенных образцов без идентификации видовой принадлежности. Наиболее активным являлся штамм 1-25, выделенная из почвенного образца, активность культуральной жидкости которого
Таблица1.
Скрининг бактериальных культур на способность синтезировать пуллуланазу.
| № п/п | Наименование культуры | Индекс штамма | ДС, % от max | № п/п | Наименование культуры | Индекс штамма | ДС, % от max |
| 1 | Бактериальная культура | 1-25 | 100 | 5. | Bacillus megaterium | 402 | 32 |
| 2 | Bacillus species | ИБ1131 | 45 | 6. | Bacillus species | ИБ1127 | 70 |
| 3 | Bacillus species | ИБ1128 | 50 | 7. | Бактериальная культура | 1-63 | 31 |
| 4 | Bacillus macerans | 697 | 45 | 8. | Bacillus species | ИБ1062 | 40 |
2,0-2,5 раза превышала пуллуланазную активность других штаммов. Для видовой идентификации штамма в своей работе мы использовали идентификационные системы фирмы «Биомерье» (вioMERIEUX / France) ,а именно: стрип API Staрh, стрип API 20 NE, стрип API 20 С AUX, стрип API 20 E. Каждый из вышеперечисленных стрипов содержит 20-25 тест, позволяющий идентифицировать культуры микроорганизмов, используя программное обеспечение поиска в базе данных по числовому профилю. Результаты проверки чистой культуры показали, что она представлена кокками и является грамположительной, дает положительную реакцию на каталазу, не образует стадию покоя - это дало основание предположить, что возможно данный микроорганизм может принадлежать родам Staphylococcus, Kocuria, Micrococcus. Использование стрипа API Staрh позволило идентифицировать штамм и определить основной таксон, как Micrococcus amylofaciens, при этом процент идентификации (%ИД) был равен 99,9.
Для поддержания чистой культуры Micrococcus amylofaciens в неизменном состояние исследовали условия хранения ее в лабораторных условиях, используя различные методы хранения: лиофилизацию, хранение под слоем вазелинового масла, хранение при низких температурах. Показано, что в лабораторных условиях продуцент пуллуланазы целесообразно хранить под слоем вазелинового масла с периодичностью пересева один раз в месяц.
2.2.2. Оптимизация состава ферментационной среды для культивирования Micrococcus amylofaciens.
Для обеспечения максимального синтеза ферментов, как правило, требуется оптимизация условий культивирования.
На первом этапе работы по изучению физиологии питания Micrococcus amylofaciens с целью оптимизации состава ферментационных сред изучено влияние природы крахмала и его количества на биосинтез фермента. Наилучшие результаты получены при использовании картофельного крахмала при содержании его в питательной среде – 1,3%. С этим уровнем крахмала в среде изучалось влияние источников неорганического азота на биосинтез: KNO3, NH4NO3, (NH4)2SO4, (NH4)2HPO4 , NH4Cl. Показано, что соли оказывают влияние на рост биомассы продуцента и накопление фермента. Наилучшие результаты в этой серии экспериментов достигнуты при добавлении в среду соли (NH4)2HPO4 . Увеличение пуллуланазной активности наблюдалось при добавлении в питательную среду совместно с неорганическими источниками азота органических, таких как казеин, пептон, кукурузный экстракт, глютен, экстракт солодовых ростков, БВК. При введении в среду 0,2% (NH4)2HPO4, 0,3% пептона и 0,3 % кукурузного экстракта отмечался наибольший биосинтез пуллуланазы. Введение в питательную среду некоторых ионов металлов оказывало положительное влияние на биосинтез фермента, особенно таких как К+ (K2HPO4 –0,2%) , Са2+ (CaCO3 –0,1%). Следует отметить, что соль K2HPO4 помимо ионов калия является источником и ионов фосфора (как и соль (NH4)2HPO4).
В связи с тем, что биодобавки, в частности кукурузный экстракт, способствуют биосинтезу пуллуланазы, исследовали влияние на биосинтез биологически активных веществ (биоса) более детально. В качестве биоса были апробированы: экстракт солодовых ростков (ЭСР), автолизат пивных осадочных дрожжей (АПОД), дрожжевой экстракт (ДЭ-пекарские дрожжи) и БВК. Результаты эксперимента представлены на рис.1. Анализ полученных данных показал, что дрожжевой экстракт в количестве 0,3% способствовал синтезу пуллуланазы, увеличивая выход на 24-25%.
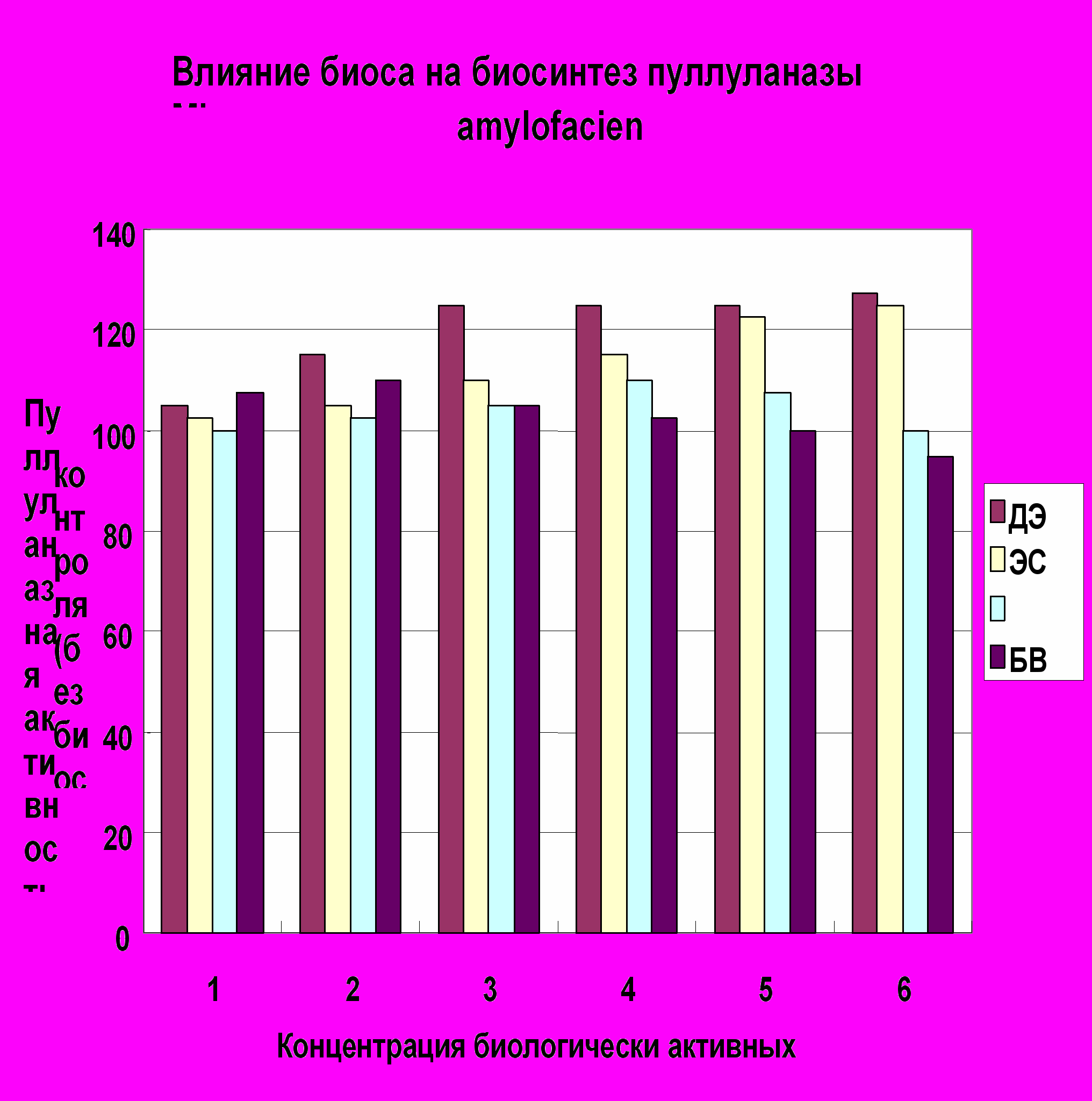
Таким образом, эксперименты по оптимизации состава питательной среды для глубинного выращивания Micrococcus amylofaciens позволили предложить среду следующего состава (%): картофельный крахмал – 1,3; К2 НРО 4 – 0,2; кукурузный экстракт –0,3; дрожжевой экстракт – 0,3; пептон – 0,3; СаСО3 – 0,1. Культивирование Micrococcus amylofaciens на разработанной питательной среде позволил увеличить продуктивность штамма в 3,2 раза, а уровень активности пуллуланазы сотавил 38,0 ед / см3 .
2.2.3.Подбор условий культивирования Micrococcus amylofaciens.
Априори наилучшие качества посевного материалы непосредственно связаны с экспоненциальной фазой развития микроорганизма, поэтому испытания по определению возраста посевного материала было проведено с культурой от 14 до 32 часов роста. На рис.2 представлены полученные результаты, из которых видно, что максимальная продуктивность микроорганизма наблюдается при возрасте 24-26 ч. В наших дальнейших исследованиях в качестве посевного материала использовалась 24-часовая глубинная культура Micrococcus amylofaciens. Оптимальная доза посевного материала согласно результатам эксперимента (рис.3) была определена как 0,9-1,1%.
Дальнейшим исследованием было показано, что длительность культивирования влияет на биосинтез пуллуланазы Micrococcus amylofacie. Выращивание культуры осуществляли в качалочных колбах и в ферментере вместимостью 5 дм3. Накопление в культуральной жидкости фермента начиналось с 30-го часа культивирования продуцента и достигало максимума в качалочных колбах на 70-72 ч роста микроорганизма , а в условиях ферментера на 48-54 рост культуры. Изучения влияния аэрации, температуры и рН на биосинтез пуллуланазы Micrococcus amylofacie осуществляли в условиях ферментера, компенсируя выпаренную влагу из культуральной жидкости добавлением стерильной воды на 36, 48 часы роста культуры (рис.4). Изменение уровня аэрации достигалось варьированием расхода подаваемого воздуха в ферментер от 5 до 60 дм3/дм3среды в час, что в свою очередь соответствовало 40 - 480 мгО2 /дм3 соответственно. Результаты опытов представлены на диаграмме, из которой видно, что наиболее благоприятный для биосинтеза режим аэрации был 30 дм3/дм3 среды в час, увеличение доли растворенного кислорода воздуха существенно не изменяло уровня накопления пуллуланазы . Было показано, что оптимальной температурой для роста и биосинтеза Micrococcus amylofaciens является 500С, а рН питательной среды наиболее благоприятный 7,0. Таким образом , максимальное накопление пуллуланазы Micrococcus amylofaciens происходит при

культивировании наоптимизированной питательной среде (см.выше), при аэрации 30 дм3/дм3 среды в час, температуре 500С , рН 7,0 на 48-54 часы роста и составляет 43,83,0 ед/см3, что в3,7 раза выше продуктивности исходного уровня синтеза фермента.
2.2.4. Выделение, очистка и физико-химические свойства препарата пуллуланазы.
2.2.4.1. Выделение и физико-химические свойства препарата пуллуланазы.
Рассматривая способность изучаемой культуры к биосинтезу ферментов в условиях, определенных предшествующими исследованиями, особое внимание было уделено амилолитическому комплексу. Было показано, что на биосинтез этой группы ферментов большое значение имеет рН ( рис.5).
Таким образом, максимальное накопление пуллуланазы происходит при рН 7,0, -амилазы при рН 4,5, глюкоамилазы при рН –6,8. Для получения препарата пуллуланазы нами была взята культуральная жидкость, обладающая максимальной активностью пуллуланазы. Осаждение фермента проводилось из фильтрата культуральной жидкости этиловым спиртом в соотношении 1:1,5 соответственно при температуре смешиваемых компонентов 40С.
| Пуллуланазная активность,ед/см3 - 1 | 40 35 30 25 20 15 10 | Амилазная активность, ед/см3 -2 | 4,0 3,5 3,0 2,5 2,0 1,5 1,0 0,5 | Глюкоамилазная активность, ед/см3-3 | 4,0 3,5 3,0 2,5 2,0 1,5 1,0 0,5 | | | | | | | | | | |
| | | | | | | | | | | ||||||
| | | | | | | | | | | ||||||
| | | | | | | | | | | ||||||
| | | | | | | | | | | ||||||
| | | | | | | | | | | ||||||
| | | | | | | | | | | ||||||
| | | | | | | | | | |
0 1 2 3 4 5 6 7 8 9 10
рН
Рис.5. Влияние рН среды на накопление ферментов Micrococcus amylofaciens.
Полученный согласно данной технологии препарат ферментов обладал пуллулазной, амилазной, глюкоамилазной активностями. Проведены исследования по субстратной специфичности препарата, результаты представлены в таблице 2.
Наибольшая пуллуланазная активность была при гидролизе пуллулана, на декстрине и амилопектине уровень активности на 30% меньше. Результаты по гидролизу крахмалов свидельствуют о приблизительно равном действии на них пуллуланазы. Рассматривая действия -амилазы на исследуемые субстраты, необходимо отметить отсутствие ее активности на пуллулане. Согласно данным литературы, пуллуланаза «работает» при температуре от30 до 900С. Нами проведены исследования активностей ферментативного комплекса Micrococcus amylofaciens в этом диапозоне
Таблица 2.
Гидролиз полисахаридных субстратов ферментным препаратом.
| №п/п | Полисахаридные субстраты | Ферментативная активность,ед/мг белка | ||
| Пуллуланазная, | Амилазная, | Глюкоамилазная, | ||
| 1 | Растворимый крахмал | 33,0 | 0,13 | 5,5 |
| 2 | Картофельный крахмал | 31,3 | 0,32 | 5,0 |
| 3 | Кукурузный крахмал | 31,0 | 0,39 | 5,8 |
| 4 | Рисовый крахмал | 33,0 | 0,14 | 6,6 |
| 5 | Амилопектин | 42,0 | 0,09 | 5,5 |
| 6. | Декстрин | 44,0 | 0.08 | 5,0 |
| 7. | Пуллулан | 62,0 | - | 6,0 |
| Пуллуланазная активность, ед/мг белка - 1 | 55 50 45 40 35 30 25 20 15 10 | Амилолитическая активность, ед/мг белка –2 | 0,20 0,19 0,18 0,17 0,15 0,14 0,13 0,12 0,11 0,10 | Глюкоамилазная активность, ед/мг белка – 3 | 6,0 5,9 5,8 5,7 5,6 5,5 5.4 5,3 5,2 5,1 | | | | | | | | | |
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | | ||||||
| | | | | | | | | |
0 30 40 50 60 70 80 Т0
Рис.5 .Влияние температуры на активность ферментативного комплекса.
(рис.5). С точки зрения экономии, в качестве субстрата при определении активности использовали растворимый крахмал. Исследования показали, что пуллуланаза сохраняет достаточно высокую активность в интервале температур от 50 до 80 0С, равную 38 3,5 ед/мг белка, для дальнейших испытаний ферментативного комплекса определена температура 600С.
Известно (Cha H.J et al,1998, Bertoldo C.,2004 и др.) , что различные ионы металла поразному влияют на активность ферментов амилолитического комплекса. Для изучения этого вопроса в инкубационную среду вносили одинаковое количество
ионов различных металлов, все используемые соли представляли собой хлориды, в ходе эксперимента определяли пуллуланазную, амилолитическую и глюкоамилазную активности. Полученные данные представлены в табл.3.
Таблица 3.
Влияние ионов металлов на активность ферментативного комплекса.
| №п/п | Ионы металлов | Ферментативные активности, % от контроля | ||
| Пуллуланазная | Амилазная | Глюкоамилазная | ||
| 1 | К+ | 93,1 | 171,8 | 99,1 |
| 2 | Na+ | 77,3 | 101,9 | 101,5 |
| 3 | Ca2+ | 105,5 | 263,1 | 102,4 |
| 4 | Mg2+ | 42,1 | 147,5 | 100,0 |
| 5 | Mn2+ | 48,3 | 120,4 | 103,4 |
| 6 | Co2+ | 45,5 | 181,5 | 101,5 |
| 7 | Cd2+ | 40,1 | 95,1 | 101,5 |
| 8 | Zn2+ | 114,0 | 130,0 | 103,4 |
| 9 | Al3+ | 0,0 | 167,1 | 98,0 |
| 10 | Контроль | 100,0 | 100,0 | 100,0 |
Как видно из таблицы наибольшая пуллуланазная активность наблюдается при добавлении к субстрату ионов Zn+2 ,Ca+2, ионы Al3+ полностью инактивировали фермент. Оставшиеся двухвалентные ионы металлов уменьшают пуллуланазную активность в 2- 2,5 раза. Ионы калия практически не влияли на действие фермента, а ионы натрия уменьшали активность на 25%.
На основании проведенных исследований было показано, что ферментативный комплекс, выделенный из фильтрата культуральной жидкости Micrococcus amylofaciens, обладал пуллуланазной, амилолитической и глюкоамилазной активностями, наилучшие результаты получены при гидролизе пуллулана, амилопектина, -декстрина и крахмала.
2.2.4.2. Очистка и физико-химические свойства препарата пуллуланазы.
Для более детального изучения свойств пуллуланазы нами был очищен и разделен комплекс ферментов, выделенный из фильтрата культуральной жидкости Micrococcus amylofaciens. Дальнейшая очистка фермента осуществлялась после диализа методом хроматографии с использованием смолы на ДЭАЭ Toyopearl 650 M, кооперативного механизма действия, включающего ионообменную хроматографию и гель фильтрацию, эксперименты проводили в МГУ им.М.В.Ломоносова , результаты представлены в табл.4.
Таблица 4.
