Разработка интегрированной системы менеджмента качества (iso 9001: 2000 и gmp) биотехнологического предприятия
| Вид материала | Автореферат |
- В. Н. Боровик руководитель проекта исм, начальник отдела менеджмента качества, доцент, 102.62kb.
- Сертификация системы менеджмента качества гост р исо 9001 (iso 9001), 28.16kb.
- Госстандарт россии, 1777.14kb.
- Iso 9001 Сертификат iso 9001, 23.99kb.
- Gost r certification System. Register of Quality Systems. Certification procedure, 830.31kb.
- Balanced Scorecard как инструмент стратегического менеджмента качества посредством, 289.23kb.
- Iso/CD2 9000 проект исо 9000: 2000 Системы менеджмента качества основы и словарь Содержание, 729.93kb.
- Программа повышения квалификации «Система менеджмента качества вуза (на примере угнту)», 134.04kb.
- Конспект лекций по теме "Построение систем качества", 647.28kb.
- Cols=2 gutter=113> государственный стандарт республики беларусь стб iso 9001-2009, 1683.15kb.
На правах рукописи
Цыганова Любовь Владимировна
РАЗРАБОТКА ИНТЕГРИРОВАННОЙ СИСТЕМЫ МЕНЕДЖМЕНТА КАЧЕСТВА (ISO 9001:2000 И GMP) БИОТЕХНОЛОГИЧЕСКОГО ПРЕДПРИЯТИЯ
Специальность 05.02.23 – Стандартизация и управление качеством продукции
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата технических наук
Москва – 2007
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Московский государственный университет пищевых производств» и ООО НБЦ «Фармбиомед»
| Научный руководитель: | | кандидат технических наук, доцент Тихомирова Ольга Ильинична |
| Официальные оппоненты: | | доктор технических наук, доцентМакеева Ирина АндреевнаГосударственное научное учреждение Всероссийский научно-исследовательский институт молочной промышленностикандидат биологических наук, доцентТиписева Ирина Андреевна Управляющая компания «Объединенный кондитер» |
| Ведущая организация: | | Государственное образовательное учреждение высшего профессионального образования «Российская Экономическая Академия им. Г.В. Плеханова» |
Защита состоится «____» ___________ 2007 г. в ____ часов в ауд. _____ на заседании Диссертационного Совета Д.212.148.04 в ГОУ ВПО «Московский государственный университет пищевых производств» по адресу: 125080, Москва, Волоколамское шоссе, д. 11., корп. III
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО МГУПП.
Отзыв на автореферат в двух экземплярах, заверенных печатью учреждения, просим направлять Ученому секретарю Совета.
Автореферат размещен на сайте www.mgupp.ru
Автореферат разослан «____» _________ 2007 г.
| Ученый секретарь Диссертационного Совета д.т.н., проф. | | Крюкова Е.В. |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
В современных рыночных условиях стабильная и успешная деятельность предприятия определяется рядом факторов, основным из которых является способность удовлетворения потребностей потребителя высококачественной и безопасной продукцией. Рациональное использование всего потенциала современного менеджмента, объединяющего мировой опыт, позволяет сохранить и укрепить рыночные позиции, опираясь в основном на собственные ресурсы. Внедряя международные стандарты на системы менеджмента, предприятия добиваются признания по отдельным аспектам своей деятельности, вместе с тем порождая несогласованность в управлении различными объектами внутри предприятия. В результате становится актуальной задача интегрирования создаваемых систем в единую систему менеджмента, которая направлена на максимальное достижение целей предприятия и выполнение сбалансированных требований всех заинтересованных сторон.
В настоящее время практикуется создание интегрированных систем менеджмента, основанных на системах менеджмента качества, экологического менеджмента, менеджмента профессиональной безопасности и здоровья, социального и этического менеджмента, однако наблюдается отсутствие единого концептуального подхода, а также недостаток методических рекомендаций в данной области, позволяющих внедрять интегрированные системы менеджмента на российских предприятиях.
Особый интерес представляет разработка интегрированных систем менеджмента, учитывающих специфические особенности предприятий конкретных отраслей промышленности, связанные с технологией производства, организацией должных условий выпуска продукции и обеспечения безопасности. Такие отраслевые модели систем менеджмента созданы для предприятий телекоммуникационной, автомобильной, авиакосмической, пищевой, нефтяной и газовой промышленности, но на сегодняшний день для фармацевтических и биотехнологических предприятий, которые характеризуются повышенной степенью потенциальной опасности выпускаемой продукции, такой системы не существует. В связи с этим актуальна необходимость создания интегрированной системы менеджмента, базирующейся на международных стандартах ISO серии 9000 и правилах GMP, а также учитывающей специфику фармацевтических и биотехнологических предприятий.
Цель и задачи исследования
Основная цель диссертационной работы состояла в создании интегрированной системы менеджмента качества биотехнологического предприятия, отражающей отраслевую специфику на основе международных стандартов ISO серии 9000 и правил GMP.
Для достижения поставленной цели в работе необходимо было решить следующие задачи:
- изучение современных подходов и методов, применяемых при создании и интеграции систем менеджмента;
- анализ и оценка результативности функционирования СМК ООО НБЦ «Фармбиомед» в рамках формирования стратегии развития;
- разработка алгоритма методики создания интегрированной системы менеджмента качества биотехнологического предприятия;
- анализ требований международного стандарта ISO 9001:2000 (ГОСТ Р ИСО 9001-2001) и правил GMP (ГОСТ Р 52249-2004) и определение степени их соответствия;
- выбор модели построения интегрированной системы менеджмента качества биотехнологического предприятия и выявление областей интегрирования систем GMP и СМК;
- композиционное проектирование процессов и формирование сети процессов интегрированной системы менеджмента качества;
- разработка системы документации, регламентирующей требования и порядок функционирования интегрированной системы менеджмента качества;
- создание методики проведения комбинированного аудита интегрированной системы менеджмента, отвечающей требованиям систем GMP и СМК.
Предмет и объект исследования
Предметом исследования являются теоретические и практические аспекты управления деятельностью предприятия, внедряющего интегрированную систему менеджмента качества на основе современных методов управления качеством с использованием системного анализа, процессного подхода, метода экспертных оценок, анализа сложившейся на предприятии производственной практики.
Объектом исследования является функционирующая СМК российского биотехнологического предприятия ООО НБЦ «Фармбиомед».
Научная новизна
- Разработана методика оценки результативности и постоянного улучшения СМК, позволяющая анализировать функционирование СМК и устанавливать пути ее улучшения.
- Установлена идеологическая близость подходов к созданию систем GMP и СМК и предложена методика создания интегрированной системы менеджмента качества биотехнологического предприятия
- Сформирована концептуальная модель интегрированной системы менеджмента качества, отражающая отраслевую специфику биотехнологического предприятия и базирующаяся на принципах стандартов ISO серии 9000 и правилах GMP.
- Предложен и обоснован механизм построения аддитивной модели интегрированной системы менеджмента качества биотехнологического предприятия.
- Установлены процессы интегрированной системы менеджмента качества и их взаимосвязи, необходимые для производства конкурентоспособной, эффективной и безопасной биотехнологической продукции.
- Разработана модель комплексной системы документации, объединяющая информационные потоки и обеспечивающая эффективное функционирование интегрированной системы менеджмента качества биотехнологического предприятия.
- Разработана методика, регламентирующая проведение комбинированного аудита интегрированной системы менеджмента качества.
Практическая значимость работы
- Разработана, задокументирована и внедрена «Процессная модель ООО НБЦ «Фармбиомед»», обобщающая всю информацию об идентифицированных и функционирующих на предприятии процессах.
- Апробирована и внедрена методика оценки результативности и постоянного улучшения СМК, применяемая для анализа функционирования СМК ООО НБЦ «Фармбиомед» и принятия управленческих решений, направленных на совершенствование деятельности предприятия.
- Установлены приоритеты развития СМК ООО НБЦ «Фармбиомед» с учетом требований заинтересованных сторон.
- Разработан и документально оформлен инновационный проект «Построения и внедрения интегрированной системы менеджмента качества ООО НБЦ «Фармбиомед»».
- На основе установленных областей интегрирования проведена декомпозиция процессов, предложена система измерения показателей результативности процессов, отвечающая профилю предприятия, и сформирована сеть процессов интегрированной системы менеджмента качества.
- Разработана структура и состав системы документации, устанавливающей требования к интегрированной системе менеджмента качества и регламентированной общесистемным стандартом предприятия СТП II.4-02-2006 «ИСМК. Управление документацией».
- Разработаны формы для документального оформления методики комбинированного аудита интегрированной системы менеджмента качества, в том числе контрольные листы для аудита процессов.
Апробация работы
Результаты работы обсуждались на второй Всероссийской научно-технической конференции-выставке с международным участием «Высокоэффективные пищевые технологии, методы и средства для их реализации» (Москва, МГУПБ, 2004 г.), на III Международной научной конференции студентов и молодых ученых «Живые системы и биологическая безопасность населения» (Москва, МГУПП, 2004 г.), на III Юбилейной международной выставке-конференции «Высокоэффективные пищевые технологии, методы и средства для их реализации» (Москва, МГУПП, 2005 г.), на IV международной конференции-выставке «Высокоэффективные пищевые технологии, методы и средства для их реализации» (Москва, МГУПП, 2006 г.).
Публикации
Основные положения и результаты диссертационной работы изложены в 12 печатных работах.
Структура и объем работы
Диссертация состоит из введения, 5 глав, заключения и основных выводов, библиографического списка, включающего 191 источник, из них 79 иностранных, и 6 приложений. Основная часть работы изложена на 167 страницах машинописного текста, включает 12 таблиц и 46 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении диссертации обоснована актуальность работы, определены цели и задачи исследования, сформулирована научная новизна и практическая значимость.
В первой главе проведен анализ теоретических основ создания современных систем менеджмента. Установлено, что для современного менеджмента характерно системное управление предприятием при лидирующей роли руководства с привлечением всего человеческого потенциала согласно стратегии, разработанной на основе анализа полной и достоверной информации, учитывающей требования потребителей.
Особое внимание уделено использованию системно-процессного моделирования при создании систем менеджмента, описанного в работах Б. Андерсена, В.И. Галеева, Е.П. Голубкова, В.Г. Елиферова, Т. Конти, В.В. Окрепилова, В.В. Репина, М.З. Свиткина, С. Привит и др. Проанализированы методические приемы построения сети процессов предприятия и приведены методы, используемые для структурированного графического описания процессов.
Подробно проанализировано многообразие существующих систем менеджмента, обобщающих в международных стандартах мировой опыт системного управления качеством, экологией, охраной труда и промышленной безопасностью, информационной безопасностью и безопасностью в цепочке поставок. Проведена их классификация в зависимости от объектов стандартизации в области менеджмента и области распространения систем (рис. 1). Представлена краткая характеристика каждой системы менеджмента, отражающая основные требования и цели внедрения.
Осознание необходимости продвигаться к интегрированным системам менеджмента имеет место сегодня не только на Западе, но и в России, о чем свидетельствуют публикации П. Коеверта, X.Д. Сеггези, С. Швейкарта, М.3. Свиткина, А.Б. Максакова и др. Целесообразность создания интегрированных систем менеджмента качества с учетом отраслевой специфики, в частности на основе ISO 9001:2001 и правил GMP подтверждается работами И.З. Аронова, К.А. Алымбекова и В.Г. Версана.
В работе представлены мотивы и преимущества создания ИСМ, факторы, влияющие на интеграцию систем менеджмента организации, уровни внедрения ИСМ, выделены основные направления формирования ИСМ.
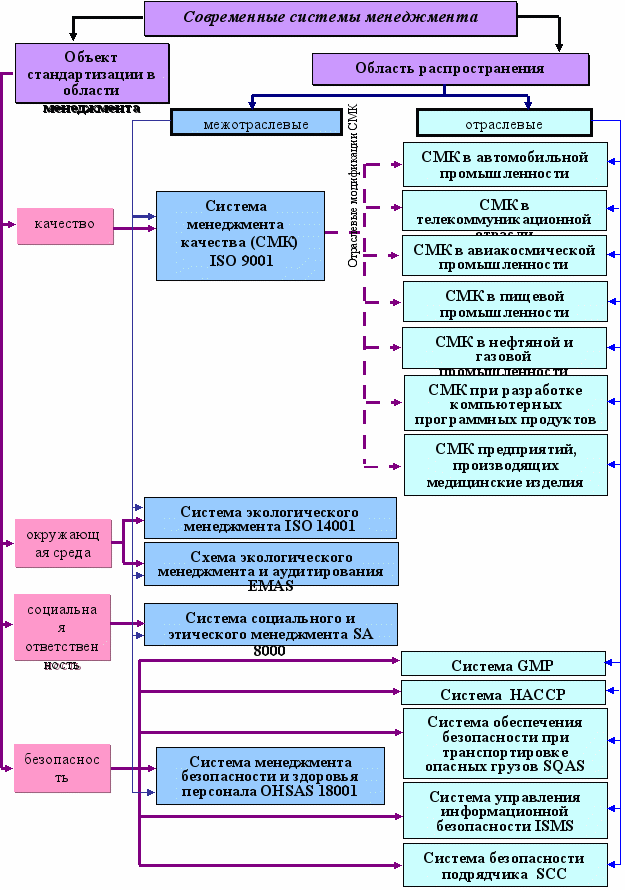
Рис.1. Современные системы менеджмента
Во второй главе представлено решение существующей проблемы оценки результативности функционирования системы менеджмента качества (СМК), приведены средства и методы определения результативности процессов и осуществлена разработка стратегических направлений развития предприятия на основе оценки результативности СМК ООО НБЦ «Фармбиомед».
Стандарты ISO серии 9000 не предлагают определенного механизма оценки результативности процессов и СМК в целом, поэтому вопросы, связанные с проблемой адекватной и объективной оценки СМК, приобретают большую практическую значимость. Для решения этой задачи была разработана методика оценки результативности и постоянного улучшения СМК (рис.2), согласно которой проводили систематический анализ СМК ООО НБЦ «Фармбиомед».
Данная методика содержит три логически взаимосвязанных этапа. Первый этап направлен на установление показателей результативности процессов СМК и отражает реализацию процессного подхода на предприятии; второй этап позволяет провести оценку результативности СМК; третий этап предусматривает определение направлений улучшения функционирования СМК.
Первый этап включает идентификацию и классификацию процессов СМК, создание адекватной сети процессов предприятия, а также определение системы показателей для количественной оценки результативности процессов и установление методов их измерения. Изучив работы отечественных и зарубежных специалистов в области качества по определению данных показателей и проанализировав сложившуюся практику работы предприятия, функционирования действующих в ООО НБЦ «Фармбиомед» процессов, были установлены показатели результативности для каждого процесса и определены их плановые значения. Следует отметить, что номенклатура показателей результативности может меняться в зависимости от специфики предприятия и направлений его деятельности. Далее для выбранных показателей были определены методы их измерения (табл.1). Результатом реализации этого этапа стало создание тематического документа «Процессная модель ООО НБЦ «Фармбиомед»», содержащего способы построения и описания действующих на предприятии процессов и включающего следующие основные разделы: основные характеристики процессов и подпроцессов СМК, карты процессов, сеть процессов и результативность процессов.
На втором этапе осуществляется мониторинг процессов, регистрация данных и расчет результативности СМК. Результаты мониторинга дают возможность получить данные о функционировании процесса, а также корректировать и улучшать процессы СМК. Для фиксирования с установленной периодичностью данных мониторинга был предложен Лист регистрации сводной информации о результативности СМК (табл.2). В ООО НБЦ «Фармбиомед» данные мониторинга, отражающие фактические значения показателей результативности процессов за текущее полугодие представлялись специалистами подразделений в Отдел управления качеством и фиксировались в предложенной форме.

Рис.2 Алгоритм методики оценки результативности и
постоянного улучшения СМК
Таблица 1
Результативность процессов СМК (фрагмент раздела 4 «Процессная модель ООО НБЦ «Фармбиомед»»)
| № п/п | Код процесса/ подпро цесса | Наименование процесса/ подпроцесса | Показатель результативности процесса/ подпроцесса | Формула расчета результативности | Метод измерения |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 8 | ВП-1 | Обеспечение и управление персоналом | |||
| 8.1 | ВП-1.1 | Набор персонала | Коэффициент укомплектованности | 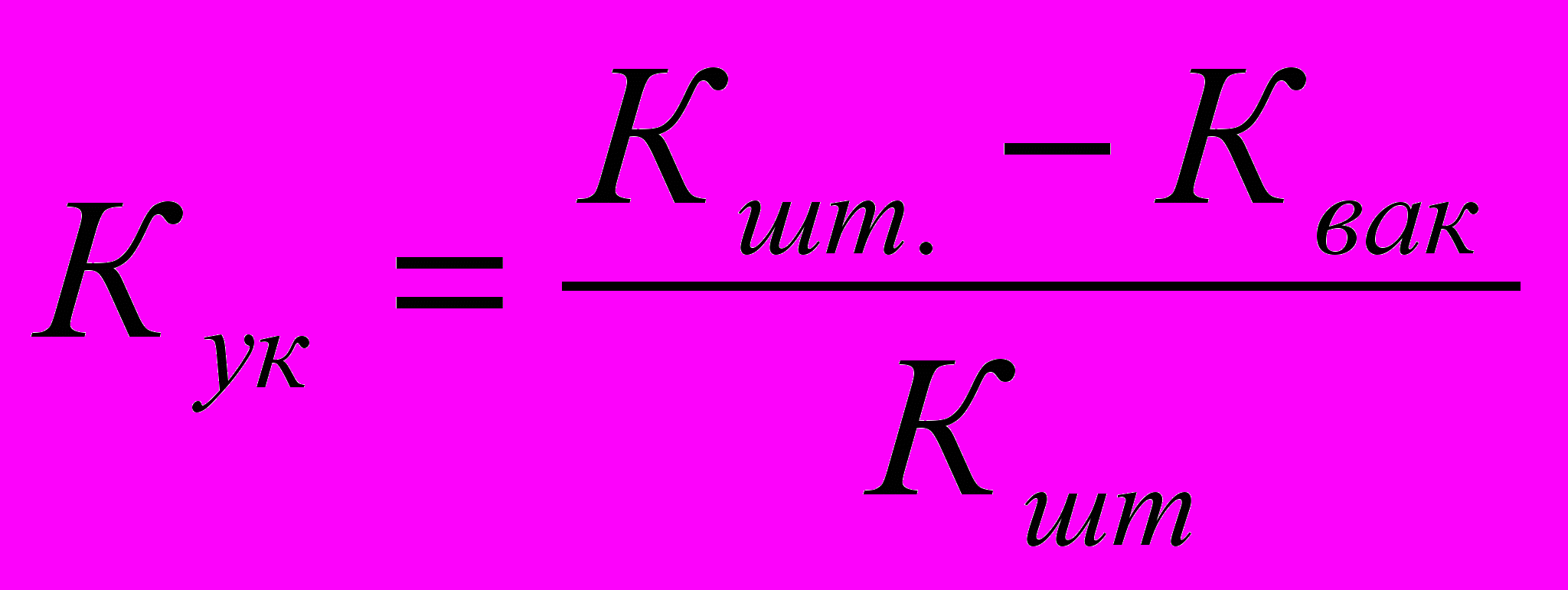 , ,Кук - коэффициент укомплектованности; Кшт. - количество штатных рабочих мест; Квак - количество вакансий | сравнения |
| 8.2 | ВП-1.2 | Обучение персонала | Коэффициент обеспечения квалификации персонала | 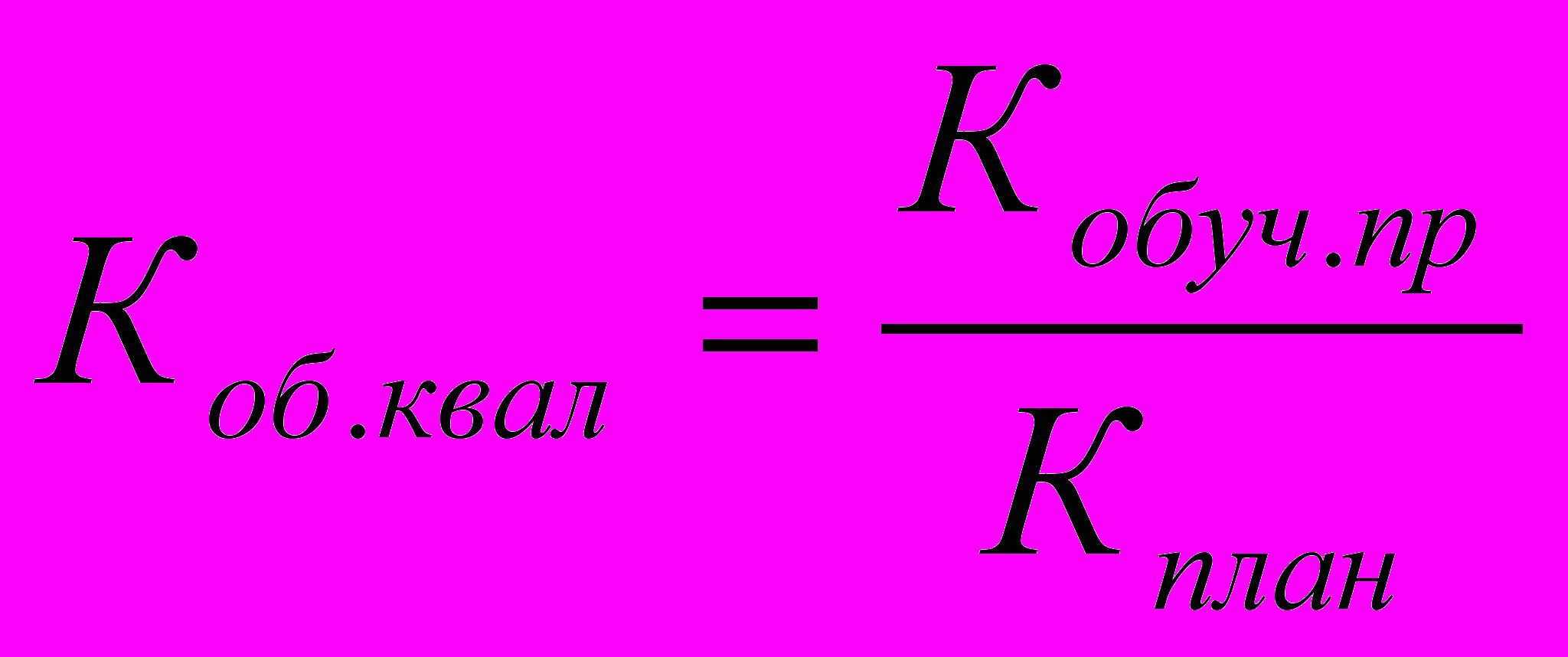 , где , гдеКоб.квал - коэффициент обеспечения квалификации персонала; Кобуч.пр. - количество шт. ед. персонала, прошедших обучение; Кплан – планируемое количество шт. ед. персонала для обучения | сравнения |
| 8.3 | ВП-1.3 | Внутреннее информирование | Коэффициент осведомленности персонала | 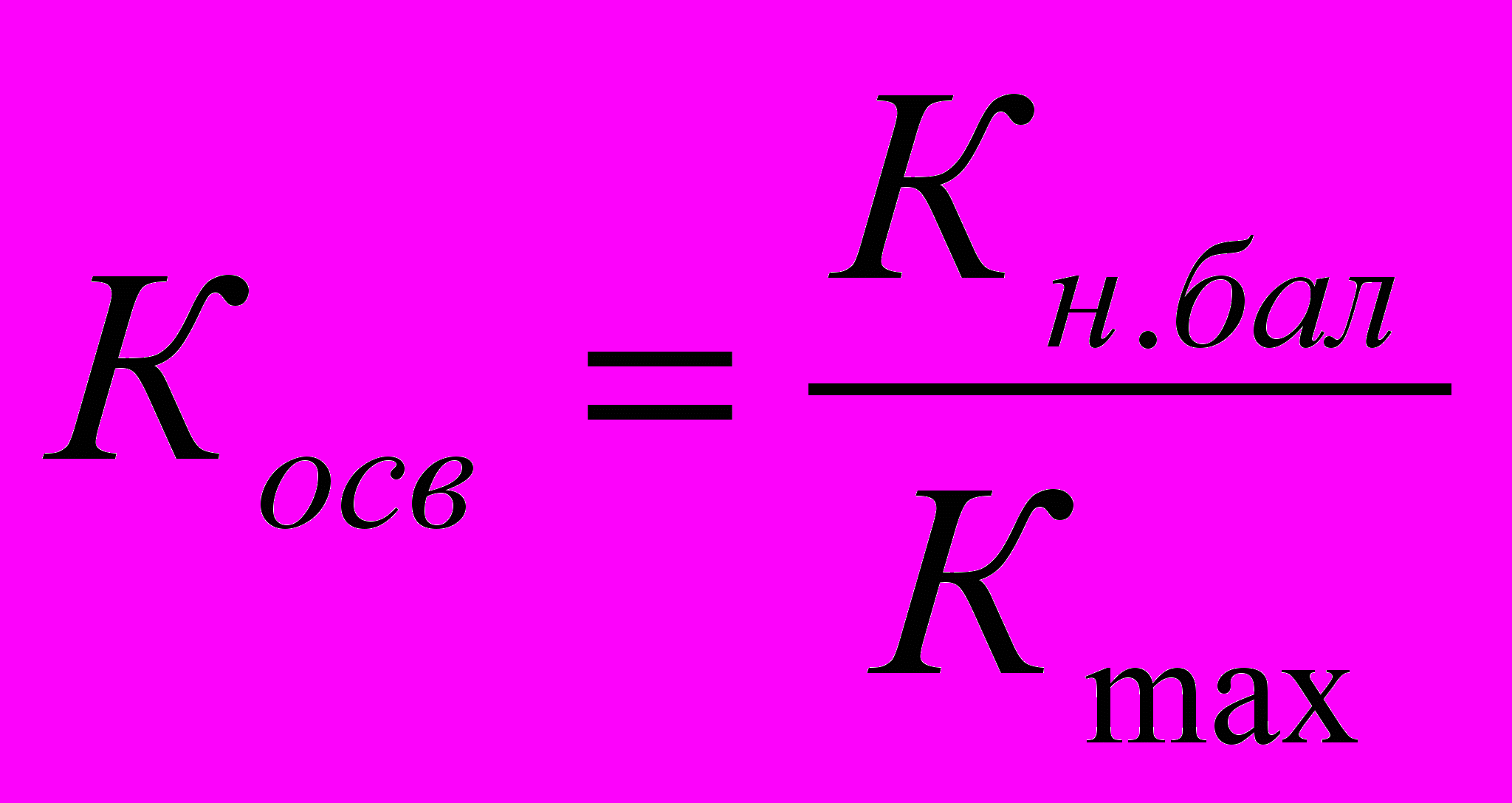 , где , гдеКосв – коэффициент осведомленности персонала; Кн.бал – количество набранных баллов; Кmax – максимально возможное количество баллов | экспертный |
| 8.4 | ВП-1.4 | Аттестация персонала | Коэффициент соблюдения периодичности аттестации | 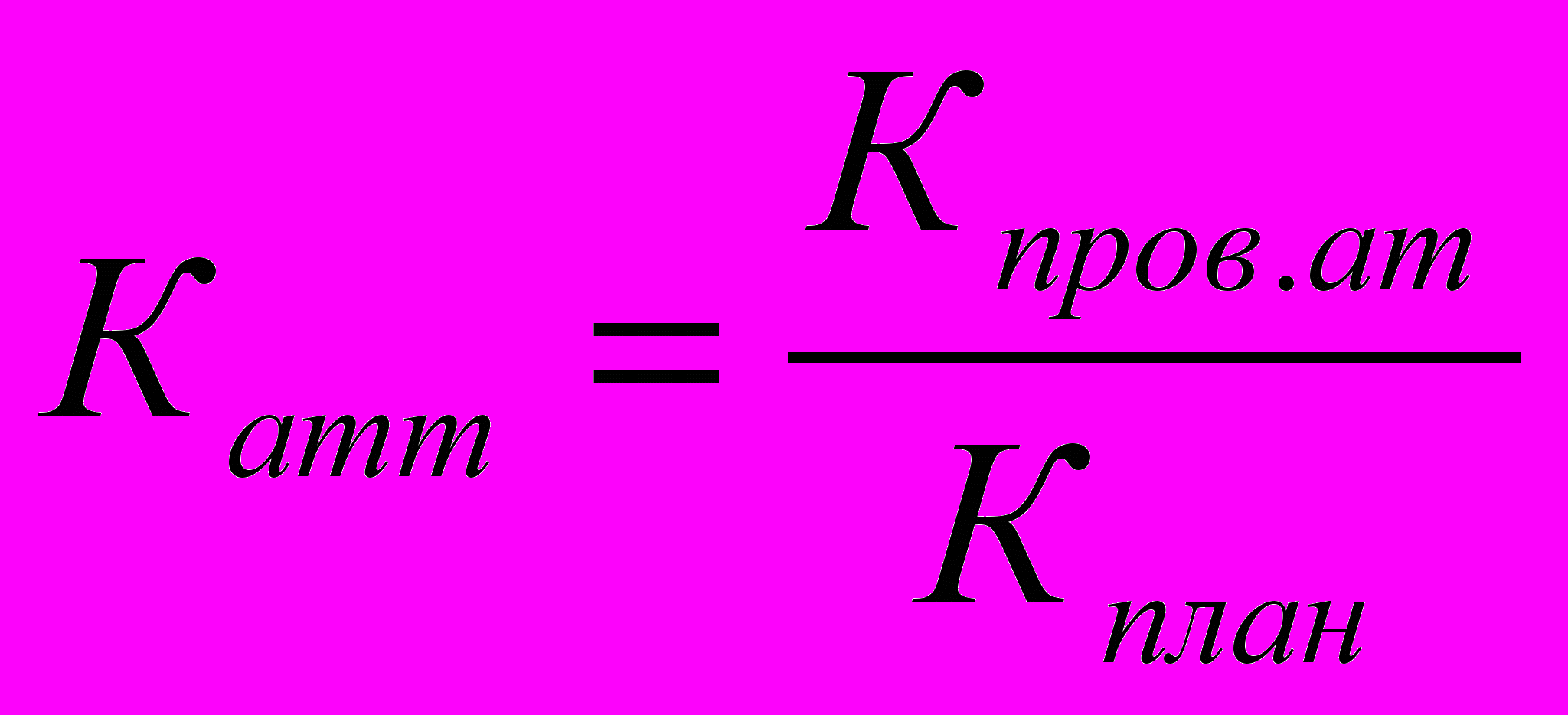 , где , гдеКатт – коэффициент соблюдения периодичности аттестации; Кпр.ат - количество проведенных аттестаций; Кплан – количество запланированных аттестаций | сравнения |
Таблица 2
Форма листа регистрации сводной информации о результативности СМК
| Код процесса/ подпроцесса | Наименование процесса/ подпроцесса | Значение показателя результативности | Значимость первичного показателя | Групповой показатель результативности процесса | Значимость группового показателя | ||
| плановое | фактическое | расчетное | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Сводный показатель результативности СМК | |||||||
На основе данных, полученных в ходе мониторинга, рассчитывали групповые показатели результативности процессов. Для подсчета групповых показателей δ использовали относительные первичные показатели результативности процессов ηio, «взвешенные» с учетом их значимости qi:

Коэффициенты значимости определяли экспертным путем, причем
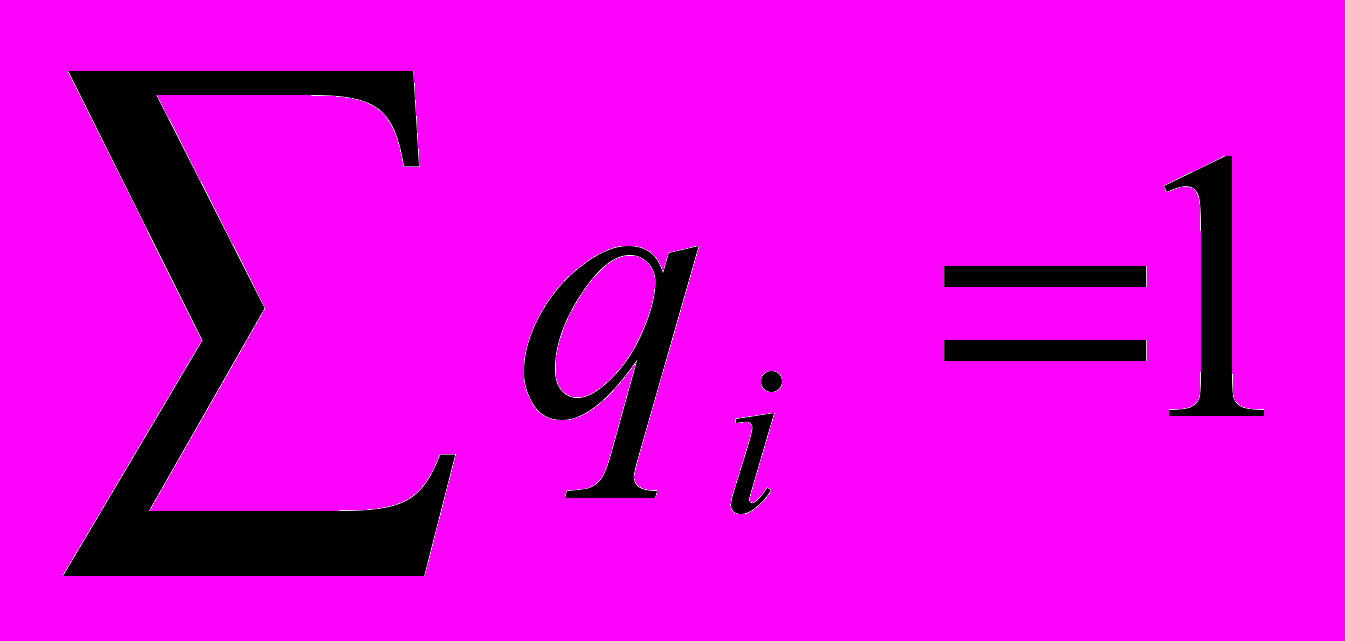 .
.Первичные показатели результативности процессов могут быть заданы количественно в соответствующих единицах измерения, процентах или баллах. В связи с разнородностью задаваемых первичных показателей результативности процессов их пересчитывали в относительные величины ηio путем сопоставления фактического значения первичного показателя в текущий момент времени ηiт к плановому значению этого показателя ηiп: ηio= ηiт/ ηiп.
Далее рассчитывали сводный показатель результативности СМК Θ на основе групповых показателей процессов, «взвешенных» с учетом их значимости qj:

На заключительном этапе методики осуществляется принятие решения по результатам оценки о возможности разработки мероприятий по улучшению, необходимости проведения корректирующих и предупреждающих действий или оперативного вмешательства. Все информационные потоки собираются в единый поток в Отделе управления качеством для документирования посредством формирования отчета о функционировании СМК.
Разработанная методика была внедрена и использована для оценки улучшения СМК в 2005 г. Проведенная согласно предложенной методики оценка результативности СМК во втором полугодии 2005 г. позволила установить, что индекс роста результативности СМК к первому полугодию 2005 г. составил Iсмк=R2/R1=1,041, что свидетельствует об имеющих место положительных изменениях на предприятии и возможности установления новых целей. На базе всестороннего анализа полученных данных и оценки функционирования СМК была сформирована стратегия развития предприятия (рис. 3), направленная на удовлетворение требований заинтересованных сторон. Одним из ключевых направлений стратегии развития предприятия была определена интеграция системы GMP в действующую СМК.
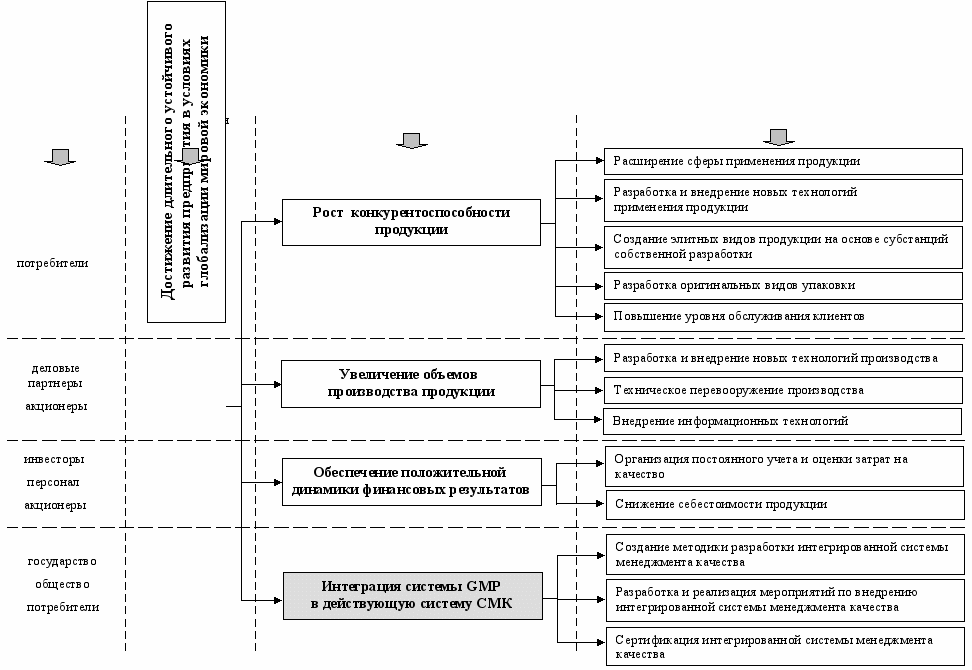
оперативные цели
долгосрочные цели
заинтересованные стороны
Рис. 3. Декомпозиция стратегии развития ООО НБЦ «Фармбиомед»
В третьей главе изложена методика создания интегрированной системы менеджмента качеством (ИСМК) на примере биотехнологического предприятия. Первоначально была установлена возможность создания ИСМК, отвечающей требованиям ISO 9001:2000 (ГОСТ Р ИСО 9001-2001) и правил GMP (ГОСТ Р 52249-2004), путем анализа структур стандартов. С целью разработки алгоритма создания ИСМК были проанализированы теоретические и практические аспекты построения и разработки систем СМК и GMP и установлено наличие основных аналогичных процедур, таких как: обследование предприятия для выявления его готовности к созданию рассматриваемых систем; разработка и внедрение документации; обучение персонала; проведение самоинспекции и сертификационного аудита. При построении алгоритма создания ИСМК был сформирован комплекс этапов, учитывающих специфику разработки и внедрения двух рассматриваемых систем (рис.4).
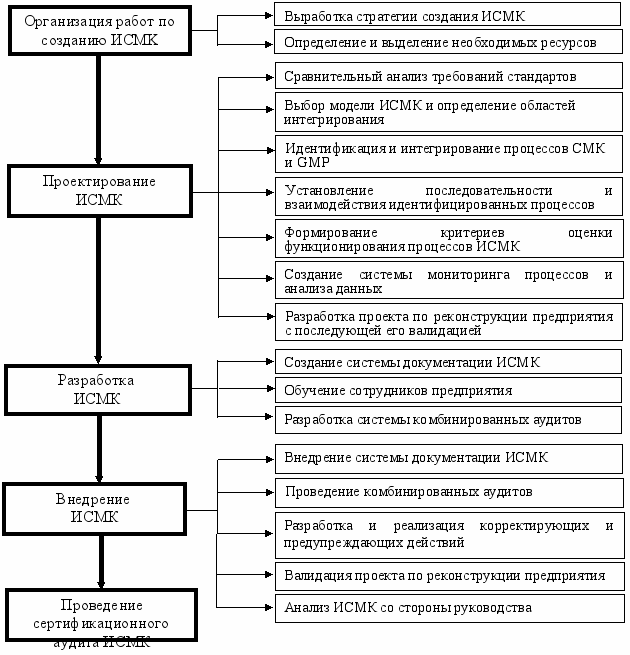
Рис. 4 Алгоритм методики создания ИСМК
Базируясь на отраженных в предложенном алгоритме подходах к созданию ИСМК, был разработан инновационный проект построения и внедрения ИСМК ООО НБЦ «Фармбиомед», содержащий цель и задачи, мотивы внедрения ИСМК и описание этапов реализации проекта.
Для осуществления интегрирования элементов систем GMP и СМК провели детальный сравнительный анализ требований стандартов ГОСТ Р ИСО 9001-2001 и ГОСТ Р 52249-2004, включающий оценку степени их соответствия, установлены перекрестные ссылки и построена диаграмма, позволяющая отразить сходство и различие отдельных элементов рассматриваемых стандартов (рис. 5).
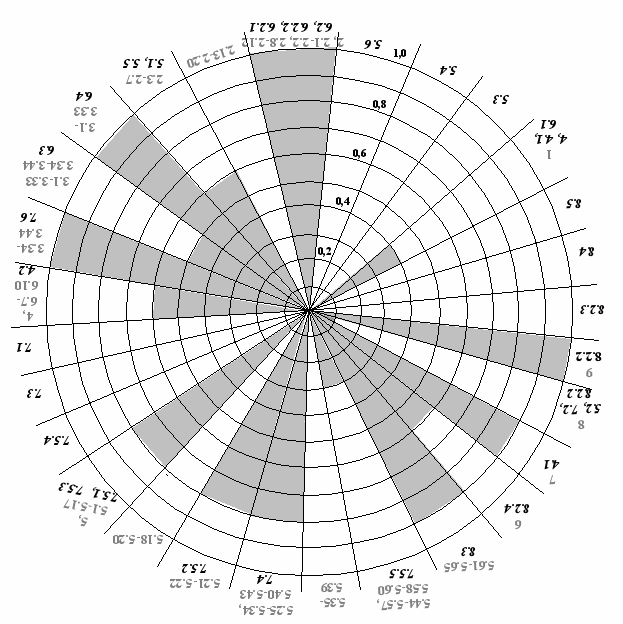
Рис. 5. Диаграмма оценки соответствия стандартов ГОСТ Р 52249-2004 и ГОСТ Р ИСО 9001-2001
Таким образом, объединению данных систем менеджмента в ИСМК способствует близость состава и структуры объектов стандартизации, совместимость ряда элементов и требований к ним.
Создание ИСМК предполагает формирование единой модели, основанной на фундаменте базовых подходов и принципов, заложенных в международных стандартах на менеджмент в рамках разных систем, путем органичного объединения их требований.
Основываясь на перекрестных ссылках и отраженных на диаграмме степенях соответствия требований стандартов, были сформулированы требования к ИСМК. С учетом сформулированных требований была сформирована концептуальная модель системы менеджмента, интегрирующая требования СМК и GMP (рис.6).
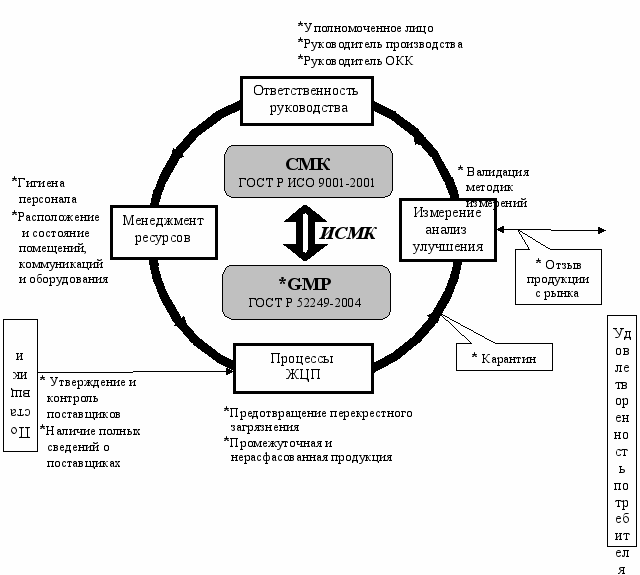
Рис. 6. Концептуальная модель системы менеджмента,
интегрирующая требования СМК и GMP
Выбор способа построения ИСМК осуществляется в зависимости от наличия или отсутствия функционирующей системы менеджмента на предприятии, особенностей систем менеджмента и их направленности на учет требований внешней среды. Учитывая сферу деятельности, размер предприятия ООО НБЦ «Фармбиомед», законодательные требования и имеющийся опыт в менеджменте, была выбрана аддитивная модель построения ИСМК, которая предусматривает слияние системы GMP с существующей и результативно функционирующей СМК, принятой за базовую систему. Для создания ИСМК был предложен механизм построения аддитивной модели, представленный на рис. 7.
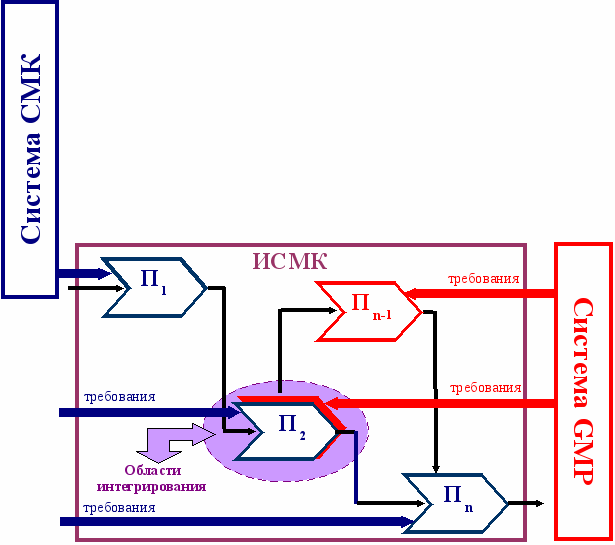
Рис.7. Механизм построения аддитивной модели ИСМК
Для реализации механизма построения аддитивной модели необходимо четко определить области интегрирования, представляющие собой совокупность требований рассматриваемых стандартов, характеризующихся наибольшей идеологической близостью. С использованием принципа совмещения элементов в работе установлены области интегрирования, приведенные на рис. 8.
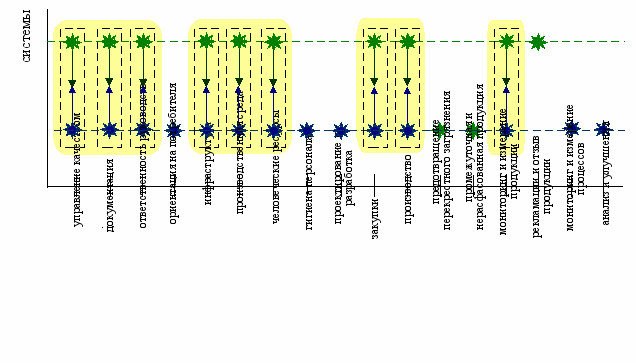
СМК
GMP
Рис. 8. Области интегрирования систем СМК и GMP
Одной из основных задач проектирования ИСМК является этап идентификации и интегрирования процессов СМК и GMP, с последующим установлением последовательности и взаимодействий идентифицированных процессов. В соответствии с установленными областями интегрирования был проведен анализ действующих в ООО НБЦ «Фармбиомед» процессов на предмет установления их статуса в ходе создания ИСМК (рис.9).
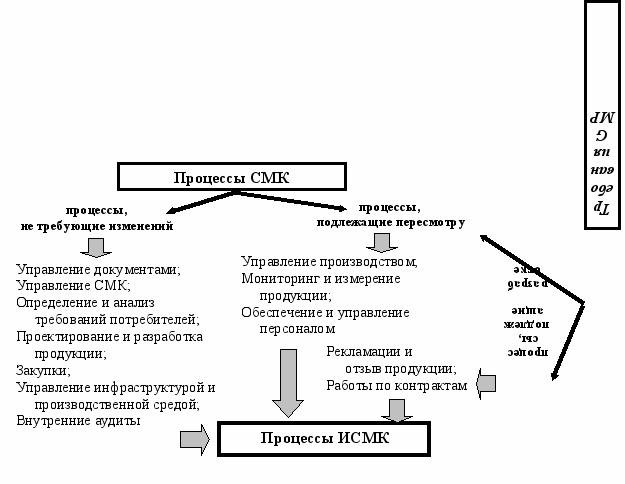
Рис. 9. Формирование состава процессов ИСМК
Для процессов, подлежащих пересмотру, была проведена поэтапная декомпозиция действовавших в рамках СМК процессов с учетом специфических требований системы GMP, которые необходимо учесть для полноценного функционирования ИСМК. Для вновь создаваемых процессов за базовые были приняты требования стандарта ГОСТ Р 52249-2004, который устанавливает подход к организации такого рода работ и регламентирует последовательность действий. Для процессов, имеющих статус «пересмотр» и «разработка», были также предложены критерии оценки их функционирования и методы измерения. В результате интегрирования процессов создана единая сеть системообразующих процессов, действующих в ИСМК (рис. 10).

Рис.10. Единая сеть системообразующих процессов ИСМК
Предложенная методика, основанная на слиянии требований систем СМК и GMP и построении системной модели, позволяет создать интегрированную систему менеджмента качества с учетом специфических отраслевых особенностей биотехнологических и фармацевтических предприятий.
Глава четвертая посвящена разработке системы документации ИСМК. Процесс создания и ведения документации считают одной из наиболее ответственных, трудоемких и сложных проблем при внедрении систем менеджмента. Система документации предназначена для регулирования двух ее составляющих: документирования и систематизации. Объем документации и степень ее детализации могут варьировать в зависимости от масштаба предприятия, вида его деятельности, сложности продукции, количества процессов, осуществляемых предприятием, и их взаимодействия, компетентности персонала, требований потребителей и заинтересованных сторон, а также глубины, до которой необходимо подтверждать выполнение требований системы менеджмента.
Для разработки системы документации ИСМК, прежде всего, были проанализированы требования стандартов ГОСТ Р ИСО 9001-2001 и ГОСТ Р 52249-2004, предъявляемые к документации. Проведенный анализ показал, с одной стороны, наличие идентичных требований к управлению документацией таких как: проверка адекватности, актуализация, идентификация, рассылка, обеспечение сохранности документов; но, с другой стороны, наличие существенных различий в составе документации. Поэтому главный акцент при разработке системы документации был сделан на формирование структуры и состава документации ИСМК.
Для построения единой системы документации ИСМК был осуществлен поуровневый анализ исходной структуры документации ООО НБЦ «Фармбиомед» с целью определения, классификации и систематизации всех необходимых для функционировании ИСМК документов, прослеживания их взаимосвязей и установления типа и состава документов, отражающих отраслевые требования в соответствии с правилами GMP.
К документам руководящего уровня, дающим комплексное описание ИСМК и устанавливающим управленческие решения по развитию и совершенствованию деятельности предприятия, отнесены политика в области качества, руководство по качеству, планы. Данный уровень должен претерпеть следующие изменения: в рамках разработки ИСМК следует переименовать политику в области качества и руководство по качеству соответственно в политику предприятия и руководство по менеджменту, а затем пересмотреть эти документы для обеспечения их соответствия целям и назначению системы GMP. Разработка и реализация планов предусматривается преимущественно требованиями стандарта ГОСТ Р ИСО 9001-2001, но план обучения персонала и план проведения внутренних аудитов необходимо составлять с учетом требований ГОСТ Р 52249-2004, а также к уже имеющимся в рамках действующей системы СМК планам добавить план по проведению валидации.
Документы методического уровня представляют собой организационно-техническую основу ИСМК, устанавливают нормативы, позволяющие регулировать деятельность предприятия и включают нормативные документы и документированные процедуры.
Нормативные документы, устанавливающие правила и характеристики, касающиеся определенных видов деятельности или их результатов, в рамках ИСМК представлены стандартами организации, техническими условиями и фармстатьями.
Документированные процедуры ИСМК содержат полное и глубокое описание процессов, действующих на предприятии, и подразделяются на общесистемные, устанавливающие требования общие для обеих систем, и специальные, реализующие требования конкретной системы. В ООО НБЦ «Фармбиомед» документированные процедуры представлены стандартами предприятия. В ходе детального анализа требований ГОСТ Р 52249-2004 была установлена необходимость разработки 7 общесистемных стандартов предприятия на базе действующих стандартов предприятия СМК с учетом особых требований GMP, и 5 специальных стандартов предприятия, описывающих виды деятельности и процессы, не предусмотренные требованиями ГОСТ Р ИСО 9001-2001, но обязательные для регламентации в ГОСТ Р 52249-2004.
Оперативный уровень документации обеспечивает наличие на предприятии регламентированных порядков осуществления отдельных видов деятельности. К документам этого уровня относятся промышленные регламенты, технологические инструкции, спецификации и при необходимости инструкции на отдельные операции.
В целях обеспечения соответствия данного уровня документации требованиям ИСМК ООО НБЦ «Фармбиомед» было предложено:
1. Разработать по всей номенклатуре выпускаемой продукции промышленные регламенты, а имеющиеся опытно-промышленные регламенты пересмотреть в соответствии с требованиями стандарта ГОСТ Р 52249-2004 при необходимости включая в них инструкции по упаковке, внутрипроизводственному контролю и контролю окружающей среды.
2. Разработать инструкции по отбору проб и проведению испытаний, а также инструкции по работе с лабораторными животными.
3. Разработать в соответствие с требованиями стандарта ГОСТ Р 52249-2004 спецификации на исходные и упаковочные материалы, а также на готовую продукцию.
Регистрационный уровень документации включает в себя документы, называемые записями, образующиеся при выполнении, мониторинге, анализе процессов, а также управлении ими и регламентированные стандартами предприятия. Записи – оперативные отчетные данные о качестве выполняемых работ. Сравнив состав такого рода документов, предусмотренный ГОСТ Р 52249-2004, с действующими в рамках СМК записями, была установлена необходимость в разработке 13 дополнительных форм записей, обязательных для эффективного функционирования ИСМК.
На базовом уровне документации в связи с внедрением ИСМК было рекомендовано пересмотреть положения о подразделениях и должностные инструкции с целью внесения обязанностей и ответственности, предусмотренных ГОСТ Р 52249-2004, а также расширить состав внешних нормативных документов, устанавливающих обязательных к выполнению требования с учетом двух систем СМК и GMP.
Сформированная система документации и ее функционирование отражено на рис. 11 и документально оформлено в разработанном общесистемном стандарте предприятия СТП II.4-02-2006 «ИСМК. Управление документацией».
Таким образом, комплексная система документации ИСМК представляет собой целостный и взаимосвязанный массив информации регламентирующего характера, пронизывающий все уровни управления предприятием и являющийся нормативно-организационной базой функционирования и постоянного улучшения его деятельности.
В пятой главе приведена методика проведения комбинированного аудита ИСМК. Возможность проведения комбинированного аудита подтверждается наличием требований к внутреннему аудиту в стандарте ГОСТ Р ИСО 9001-2001 и требований к самоинспекции - в ГОСТ Р 52249-2004, проведенный анализ которых демонстрирует их сходность.
На основе процедур внутреннего аудита и самоинспекции, регламентированных соответственно ГОСТ Р ИСО 19011-2003 и ГОСТ Р 52537-2006, с учетом особенностей, характерных каждой из них, был предложен следующий порядок проведения комбинированного аудита: планирование комбинированных аудитов, организация аудита, подготовка к аудиту, предварительное совещание, сбор свидетельств аудита, формирование выводов аудита, заключительное совещание, оформление отчета по аудиту, разработка и верификация корректирующих действий (рис. 12).
При планировании внутренних аудитов определяются конкретные области аудита, которые должны быть включены в проверку, в связи с чем возникает необходимость выбора: проведение аудита процессов или подразделений. С этой целью были проанализированы преимущества и недостатки этих двух подходов и предложено проводить комбинированные аудиты процессов в границах отдельных подразделений, причем в течение года должны быть проверены все идентифицированные на предприятия процессы ИСМК в каждом подразделении.
В ходе адаптации методики особое внимание было уделено документальному оформлению каждого этапа комбинированного аудита. С этой целью были разработаны следующие формы: программа и план комбинированного аудита, контрольные листы для аудитов процессов каждого подразделения согласно организационной структуре предприятия, бланки регистрации наблюдений аудита, акт по результатам аудита и план корректирующих и предупреждающих действий.
Проведение комбинированного аудита можно рассматривать как метод мониторинга и верификации функционирования ИСМК предприятия, позволяющий обнаружить и контролировать проблемы и обеспечить обратную связь для совершенствования ИСМК предприятия.
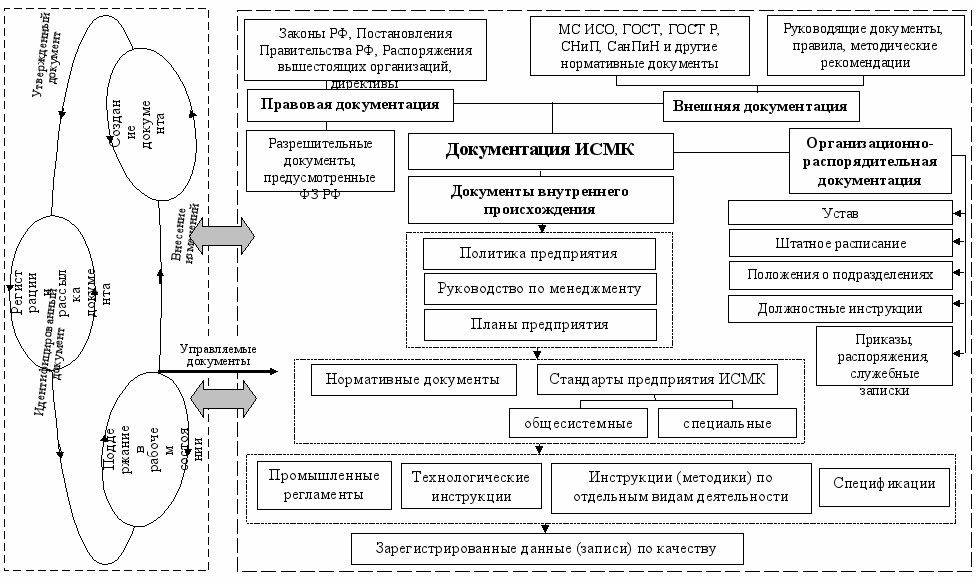
Рис.11. Система документации ИСМК
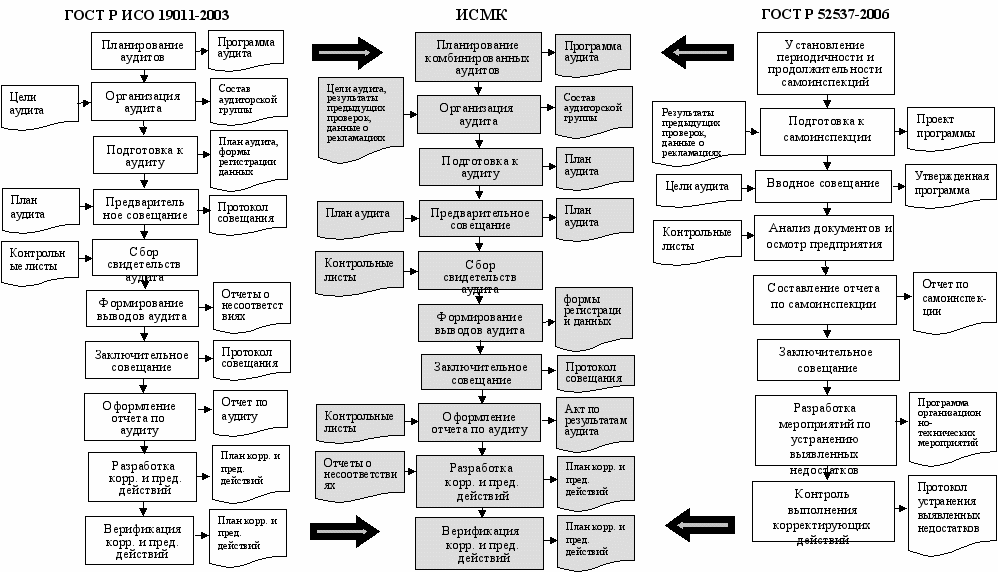
Рис. 12. Порядок проведения комбинированного аудита ИСМК
Преимуществом комбинированного аудита является значительное уменьшение временных, человеческих и денежных затрат на проведение аудита по сравнению с проведением двух параллельных аудитов систем СМК и GMP.
Реализация задачи создания интегрированной системы менеджмента качества позволит предприятию выйти на качественно новый уровень, отвечающий современным реалиям, обеспечивая создание конкурентоспособной продукции. Краткий анализ соотношений типовой трудоемкости работ по разработке и внедрению аддитивной модели ИСМК по сравнению с созданием параллельных систем показал целесообразность применения данного подхода, который позволяет снизить затраты на интегрирование системы GMP в действующую СМК ООО НБЦ «Фармбиомед» на 25%.
ВЫВОДЫ
1. На основе проведенного анализа тенденций развития современного менеджмента установлена целесообразность создания интегрированной системы менеджмента качества биотехнологического предприятия, отражающей отраслевую специфику.
2. Разработана и внедрена «Процессная модель ООО НБЦ «Фармбиомед»», позволяющая реализовать процессный и системный подходы и формализовать деятельность предприятия. Данная модель включает:
- номенклатуру процессов / подпроцессов и их основные характеристики;
- индивидуальные карты процессов;
- сеть процессов ООО НБЦ «Фармбиомед»;
- систему показателей для количественной оценки результативности процессов и методы измерения выбранных показателей;
3. Разработана и внедрена методика оценки результативности и постоянного улучшения СМК, на основе которой проведен анализ функционирования СМК ООО НБЦ «Фармбиомед», позволивший установить причинно-следственные связи между планируемыми и достигнутыми результатами.
4. Разработана стратегия развития ООО НБЦ «Фармбиомед» путем декомпозиции приоритетной задачи до уровней долгосрочных и оперативных целей с учетом требований заинтересованных сторон.
5. Проанализированы теоретические и практические аспекты создания систем GMP и СМК, предложена методика создания интегрированной системы менеджмента качества и разработан инновационный проект «Построение и внедрение ИСМК ООО НБЦ «Фармбиомед»», включающий цель, задачи, мотивы и описание этапов реализации проекта.
6. На основе анализа международного стандарта ISO 9001:2000 (ГОСТ Р ИСО 9001-2001) и правил GMP (ГОСТ Р 52249-2004) и установленных степеней совместимости требований предложена концептуальная модель ИСМК, отражающая отраслевую специфику биотехнологического предприятия.
7. Проведено композиционное проектирование процессов на основе выявленных областей интегрирования систем GMP и СМК и разработаны показатели результативности процессов и методы их измерения.
8. Сформирована сеть процессов ИСМК ООО НБЦ «Фармбиомед» согласно предложенному механизму построения аддитивной модели.
9. Проведен поуровневый анализ действующей системы документации СМК с учетом требований ГОСТ Р 52249-2004 и разработаны мероприятия по интегрированию документов.
10. Разработана комплексная система документации, отраженная в общесистемном стандарте предприятия СТП II.4-02-2006 «ИСМК. Управление документацией» и представляющая собой нормативно-организационную базу функционирования и постоянного улучшения ИСМК.
11. Разработана методика проведения комбинированного аудита ИСМК, позволяющая определять соответствие требованиям ГОСТ Р ИСО 9001-2001 и ГОСТ Р 52249-2004. Осуществлено документальное оформление системы комбинированного аудита.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Тихомирова О.И., Викторов А.В., Цыганова Л.В., Дриняев В.А. Реализация отдельных основополагающих принципов системы менеджмента качества на предприятии Научно-Биологический Центр «Фармбиомед» // В Сборнике докладов Всероссийской научно-технической конференции-выставки «Высокоэффективные пищевые технологии, методы и средства для их реализации». – М.: Издательский комплекс МГУПП, 2003. – С.70-73
- Тихомирова О.И., Цыганова Л.В. Интегрирование системы менеджмента качества с отраслевой системой GMP // В Сборнике научных трудов второй Всероссийской научно-технической конференции-выставки с международным участием «Высокоэффективные пищевые технологии, методы и средства для их реализации». Часть I. – М.: МГУПП, 2004. – С. 22-26.
- Тихомирова О.И., Цыганова Л.В. Интегрированные системы менеджмента – эффективный механизм сбалансированного удовлетворения потребностей всех заинтересованных сторон // Управление качеством. – 2006. – №2. – С.46-56.
- Тихомирова О.И., Цыганова Л.В. Методические указания к выполнению лабораторных работ по курсу «Аудит качества» – М.: Издательский комплекс МГУПП, 2006. – 32с.
- Тихомирова О.И., Цыганова Л.В. Современные системы менеджмента: тенденции развития // Управление качеством. – 2005. – №10. – С.20-30.
- Тихомиров И.А., Цыганова Л.В. Подходы к формированию сети процессов современного предприятия // Управление качеством. – 2007. – №2. – С.39-43
- Цыганова Л.В., Матисон В.А. Роль системы обучения персонала при внедрении системы GMP // Живые системы и биологическая безопасность населения: Материалы III Международной научной конференции студентов и молодых ученых. – М.: МГУПБ, 2004. – С.13-16.
- Цыганова Л.В., Тихомирова О.И. Подходы к организации комбинированного аудита // В Сборнике докладов IV международной конференции-выставки «Высокоэффективные пищевые технологии, методы и средства для их реализации». Часть III. – М.: МГУПП, 2006. – С.114-117.
- Цыганова Л.В., Тихомирова О.И. Реализация принципов системного и процессного подходов при создании интегрированной системы менеджмента // В Сборнике докладов молодых ученых МГУПП. III Юбилейная международная выставка-конференция «Высокоэффективные пищевые технологии, методы и средства для их реализации». Часть II. – М.: Издательский комплекс МГУПП, 2005. – С.161-165.
- Цыганова Л.В., Тихомирова О.И. Системно-процессный подход к созданию системы менеджмента предприятия // Управление качеством. – 2006. – №7. – С.21-28.
- Цыганова Л.В., Тихомирова О.И., Дриняев В.А. Комбинированный аудит интегрированной системы менеджмента фармпредприятия // Ремедиум. – 2006. – №12 (118). – С.51-54.
- Цыганова Л.В., Тихомирова О.И., Матисон В.А. Интегрированные системы менеджмента – современный инструмент обеспечения качества и безопасности // Пищевая промышленность. – 2006. – №11. – С.62-63.
SUMMARY
Working out of the quality management integrated system
(ISO 9001:2000 and GMP) of the biotechnological plant.
Tsyganova L.V.
By introducing new international standards into management systems most of enterprises obtain recognition of the market participants relative to separate aspects of their activity. At the same time the problems with enterprise units management arise very often.
The primary intent of this research is working out of the technical approaches aimed at creation of the quality management integrated system at the biotechnological plant, which reflects the branch specificity and is based on international standards ISO 9000 and GMP regulations.
The following objectives have been accomplished to reach this intent: analysis of the quality management system functioning; working out of the quality management integrated system principles; identification of the quality management integrated system processes and development of processes network; documentation structure arranging and development of the combined audit procedure.
The quality management integrated system creation will enable the enterprise to meet the present-day market requirements and to ensure the competitive goods production.
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
EMАS – Environmental Management- and Auditing Scheme (Схема экологического менеджмента и аудитирования)
GMP – Good Manufacturing Practice (Надлежащая производственная практика)
ISMS – Information Security Management System (Система управления информационной безопасности)
ISO – International Standardization Organization (Международная организация по стандартизации)
OHSAS – Occupational Health and Safety Assessment Series (Система менеджмента охраны здоровья и техники безопасности)
SA – Social Accountability (Система социального и этического менеджмента)
SCC – Safety Certificate Contractors (Система безопасности подрядчика)
SQAS – Safety Quality Assessment System (Система обеспечения безопасности при транспортировке опасных грузов)
НACCP – Hazard Analysis and Critical Control Point (Анализ рисков и критические контрольные точки)
ВП – вспомогательный процесс
ИСМ – интегрированная система менеджмента
ИСМК – интегрированная система менеджмента качества
корр. – корректирующие
НБЦ – научно-биологический центр
ОП – основный процесс
пред. – предупреждающие
ПУ – процесс управления
СМК – Система менеджмента качества
СТП – стандарт предприятия
шт. ед. – штатные единицы
I – индекс роста результативности системы менеджмента качества
q – коэффициент значимости показателя
δ – групповой показатель результативности процесса
ηio – относительный первичный показатель результативности
ηiп – плановое значение первичного показателя результативности
ηiт – фактическое значение первичного показателя результативности
Θ – сводный показатель результативности системы менеджмента качества
К – коэффициент результативности процесса
