Разработка биотехнологического процесса получения комплексного ферментного препарата пуллуланазы и использование его для крахмалопаточной промышленности
| Вид материала | Автореферат |
- Использование биологически-активной продукции биотехнологического происхождения для, 183.83kb.
- Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов,, 735.56kb.
- Его в место приобретения для получения полного возмещения его стоимости, 91.92kb.
- Разработка интегрированной системы менеджмента качества (iso 9001: 2000 и gmp) биотехнологического, 301.67kb.
- В статье авторы предлагают собственный опыт применении силденафила (Потенциале) с целью, 215.71kb.
- Использование компьютерных технологий для разработки моделей бизнес-процессов, 62.95kb.
- Б. А. Сентяков Официальные оппоненты: доктор технических наук, профессор, 327.36kb.
- Примерная программа наименование дисциплины история и методология научной агрономии, 170.2kb.
- Разработка биотехнологий получения иммобилизованных дрожжей и их применения в бродильных, 535.9kb.
- Вопросы комплексного государственного экзамена по специальности «Государственное, 67.64kb.
1 2
Очистка внеклеточной пуллуланазы Micrococcus amylofaciens.
| Стадии очистки | Общий объем, см3 | Общая активность, ед/см3 | Общий белок, мг | Удельная активность, ед/мг белка | Степень очистки |
| Фильтрация культуральной жидкости | 100,00 | 4100,00 | 3300,00 | 1,24 | --- |
| Осаждение фермента ( 1:1,5 С2 Н5 ОН) | 10,00 | 44,00 | 24,40 | 1,80 | 1,50 |
| Диализ | 7,00 | 88,90 | 14,00 | 6,35 | 5,29 |
| Хроматография * Смола ДЭАЭ - Toyopearl 650 M | 2,00 | 140,10 | 2,32 | 60,34 | 48,66 |
*кооперативный механизм действия, включающего ионообменную храматографию и гель-фильтрацию.
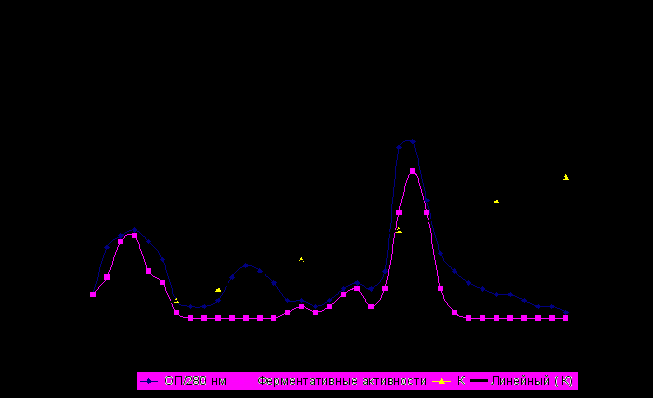
На колонку со смолой наносили 100мг высушенного препарата пуллуланазы, растворенного в 1 мл 0,1 М ацетат-аммонийного буфера рН 8,0. Элюцию помещенных на колонку белков проводили в градиенте NaCl от 0,15 до 1,0 М в том же буфере . На рис. 7 представлены результаты хроматографического разделения исследуемого препарата, которые свидетельствуют о получении трех белковых пиков с различной ферментативной активностью. Изучение свойств которых показало, что амилолитическая активность - амилазы обнаружена только во фракциях, не сорбировавшихся на смоле белков (пик 1), а интересующая нас активность пуллуланазы выявлена в пике 3 и предшествующему ему маленьком пике, находящемуся между 2 и 3 пиками.

На объединенной фракции было показано, наличие двух ферментов пуллуланазы кислой и щелочной , причем максимальная активность кислой
пуллуланазы наблюдалась при рН 5,5 и составила 43,2 ед/ мг белка, тогда как щелочная пуллуланаза имела активность 28 ед/ мг белка при рН 7,5.( рис.8)
При изучении устойчивости активности фермента при оптимальных условиях ведения гидролиза растворимого крахмала было показано, что стабильные результаты получены при длительности гидролиза 30 минут. Отмечено, что пуллуланаза больше всего проявляет свою активность при действии на пуллулан при температуре 600С, рН среды 5,5 в присутствии ионов Zn+2 .
2.2.5.Гидролиз крахмалосодержащего сырья ферментными препаратами.
Перспективным направлением в решении проблемы усовершенствования технологии и увеличения ассортимента мальтозных продуктов является поиск новых сочетаний катализаторов гидролиза крахмала, в качестве которых могут применяться ферментные препараты, получаемые путем микробного синтеза. Исходя из выше сказанного, были проведены исследования по подбору ферментных препаратов микробного происхождения, эффективных при гидролизе крахмалов.
2.2.5.1. Результаты исследования процесса разжижения крахмалов. Традиционно разжижение крахмала осуществляют кислотным способом, используя в качестве катализатора соляную кислоту, или проводят с использованием ячменного солода, ферментативный комплекс которого содержит
- амилазу. На рис. 9 представлены углеводные составы гидролизатов, при ГЭ субстрата 17,0 0,5%, полученный различными способами: кислотным и с использованием -амилазы и ячменного солода. Показано, что реакционная смесь содержит мало глюкозы, однако много мальтотреоз и мальтотетроз – объектов для действия пуллуланазы.
2.2.5.2. Исследования процесса осахаривания крахмала.
Принятая в настоящее время схема ферментативного осахаривания крахмала для получения гидролизатов заданного состава состоит из следующих стадий: приготовление крахмальной суспензии клейстеризация разжижение
(ферментативное) инактивация фермента осахаривание (ферментативное) инактивация фермента фильтрование обесцвечивание фильтрация
упаривание упаковка.. Целью нашего исследование было получение патоки для использования в кондитерской промышленности, содержащей значительные количество мальтозы, а глюкозы на уровне 10%. В связи с тем, что ячменная -амилаза у нас в стране не производится, в качестве перспективного фермента при разработке технологии мальтозных продуктов нами был выбран препарат -амилазы

из B.polymyxa, любезно предоставленный ВНИИ крахмалопродуктов (Коренево). Сравнение результатов использования для осахаривания крахмала препарата -амилазы из B.polymyxa и ячменной -амилазы показало, что за 24 ч гидролиза накапливалось в гидролизатах: ГЭ –48%, мальтоза – 45-47%, глюкоза 5-7%. Наибольшее накопление мальтозы происходит при дозировке фермента 1,0-1,5ед / г крахмала, причем при дальнейшем увеличение вносимого препарата до 2,5ед /г крахмала содержание мальтозы увеличивается на 1%. При исследовании состава гидролизатов, было показано, что наряду с мальтозой в них присутствуют высокомолекулярные декстрины, устойчивые по отношению к -амилазе. Следовательно препятствием для действия фермента с одной стороны является редуцирующий конец декстрина, а с другой -1,6-гликозидная связь. Дальнейшее превращение такого аномального декстрина возможно, когда в глубине его разорвана какая-либо -1,4-гликозидная связь. Исходя из представлений о механизме гидролиза крахмала -амилазой, можно предположить, что дальнейший
Таблица 5.
Состав гидролизатов при осахаривании разжиженного кукурузного крахмала - (1,5 ед/г крахмала) и - амилазой.
| - амилаза, ед/г крахмала | Состав гидролизата после осахаривания,%* | Скорость фильтрования, дм3/м2ч | Вязкость, мПа с | Цветность, ед.оптической плотности | ||||
| Глюкозный эквивалент | Глюкоза | Мальтоза | Три и тетрасахара | Декстрины | ||||
| - | 47,97 | 6,10 | 45,46 | 24,56 | 22,56 | 110,00 | 3,00 | 0,21 |
| 0,30 | 49,76 | 7,25 | 46,88 | 26,13 | 20,00 | 135,00 | 2,55 | 0,23 |
| 0,35 | 49,71 | 7,67 | 47,38 | 26,86 | 18,14 | 143,00 | 2,36 | 0,23 |
| 0,40 | 50,63 | 8,07 | 47,52 | 27,10 | 17,06 | 150,00 | 2,27 | 0,25 |
| 0,45 | 51,36 | 9,30 | 48,06 | 27,61 | 14,05 | 158,00 | 2,22 | 0,26 |
| 0,50 | 52,64 | 10,23 | 48,71 | 28,11 | 12,76 | 163,00 | 2,16 | 0,27 |
* другие углеводы до 100%.
гидролиз возможен при совместном действии - и - амилазы на стадии осахаривания, причем последний фермент будет выступать в роли синергетического фактора. При проведении эксперимента в контрольном образце после стадии разжижения -амилаза полностью инактивировалась и более не вносилась. В опытах -амилаза была представлена препаратом «Ликсамил 1200», в качестве субстрата использовался ферментативно разжиженный крахмал с ГЭ 15,3% и исходной концентрацией СВ 30%. . Вязкость крахмальных гидролизатов снижалась пропорционально степени расщепления крахмала, характеризуемой значением глюкозного эквивалента . В гидролизатах, в которые, помимо -амилазы, внесена была - амилаза вязкость снижалась быстрее, что свидетельствует об уменьшении содержания декстринов и более глубоком гидролизе крахмала -амилазой (табл.5). Наряду с этим было показано, что время введения - амилазы в реакционную смесь должно совпадать с временем введения -амилазы, т.к. после длительного воздействия -амилазы в гидролизатах накапливаются низкомолекулярные декстрины, а - амилаза проявляет сродство к высокомолекулярным олигосахаридам. При внесении в реакционную смесь - амилазы из расчета 0,3-0,45 ед/г крахмала, содержание мальтозы в гидролизатах увеличивается на 3,0-5,7%, в 1,2-1,5 раза увеличиваетсяскорость фильтрации, цветность возрастает незначительно. Увеличение концентрации - амилазы свыше 0,45 ед/г крахмала нежелательно, т.к. в этом случае содержание глюкозы в гидролизатах превышает 10%, а дополнительный расход фермента приводит к удорожанию продукта.
Т.о. была показана необходимость присутствия - амилазы на стадии осахаривания крахмалосодержащего сырья, что позволило исключить стадию инактивации фермента после стадии разжижение крахмала. А также рекомендовать для производства дробное внесение - амилазы, для стадии разжижения субстрата 60-70% регламентных количеств данного фермента, а на стадии осахаривания субстрата 30-40%, что в свою очередь, приводило к увеличению на 4,5% в среднем содержания мальтозы в гидролизатах.
2.2.6. Использование мультиэнзимных композиций ферментов для гидролиза крахмалов.
Согласно данным литературы (Cha H.,1998, Myers A.,2000 и др.) показано, что применение пуллуланазы при получении сахаристых крахмалопродуктов является перспективным. Так как нами был найден продуцент пуллуланазы и получен комплексный препарат данного фермента, последний был нами апробирован при ферментативном гидролизе крахмала . Осахаривание субстрата проводили -амилазой ( 1,5 ед/г крахмала) , -амилазой и - амилазой ( 1,5 ед/ г. крахмала : 0,2% препарата «Ликвамил 400»), -амилазой и препаратом пуллуланазы (1,5 ед/г.крахмала :1,0 ед/г. крахмала) . На рис. 9 приведены данные компонентного состава ферментативных гидролизатов по результатам осахаривания в течение 48 часов , при температуре 550С. Как видно, из полученных данных происходит увеличение выхода мальтозы в гидролизатах, а уровень глюкозы по результатам применения полученного нами ферментного препарата из Micrococcus amylofaciens остается практически неизменным. Для изучения влияния пуллуланазы на процесс гидролиза крахмала исследовали влияние дозы пуллулланазы на эффективность процесса. Концентрация пуллуланазы варьировала от 0,1 до 1,5 ед/ г крахмала, диапазон определялся согласно данным литературы и экономическими соображениями. В таблице 6 показана кинетика изменения углеводного состава
гидролизатов при различных дозировках пуллуланазы и длительности гидролиза.
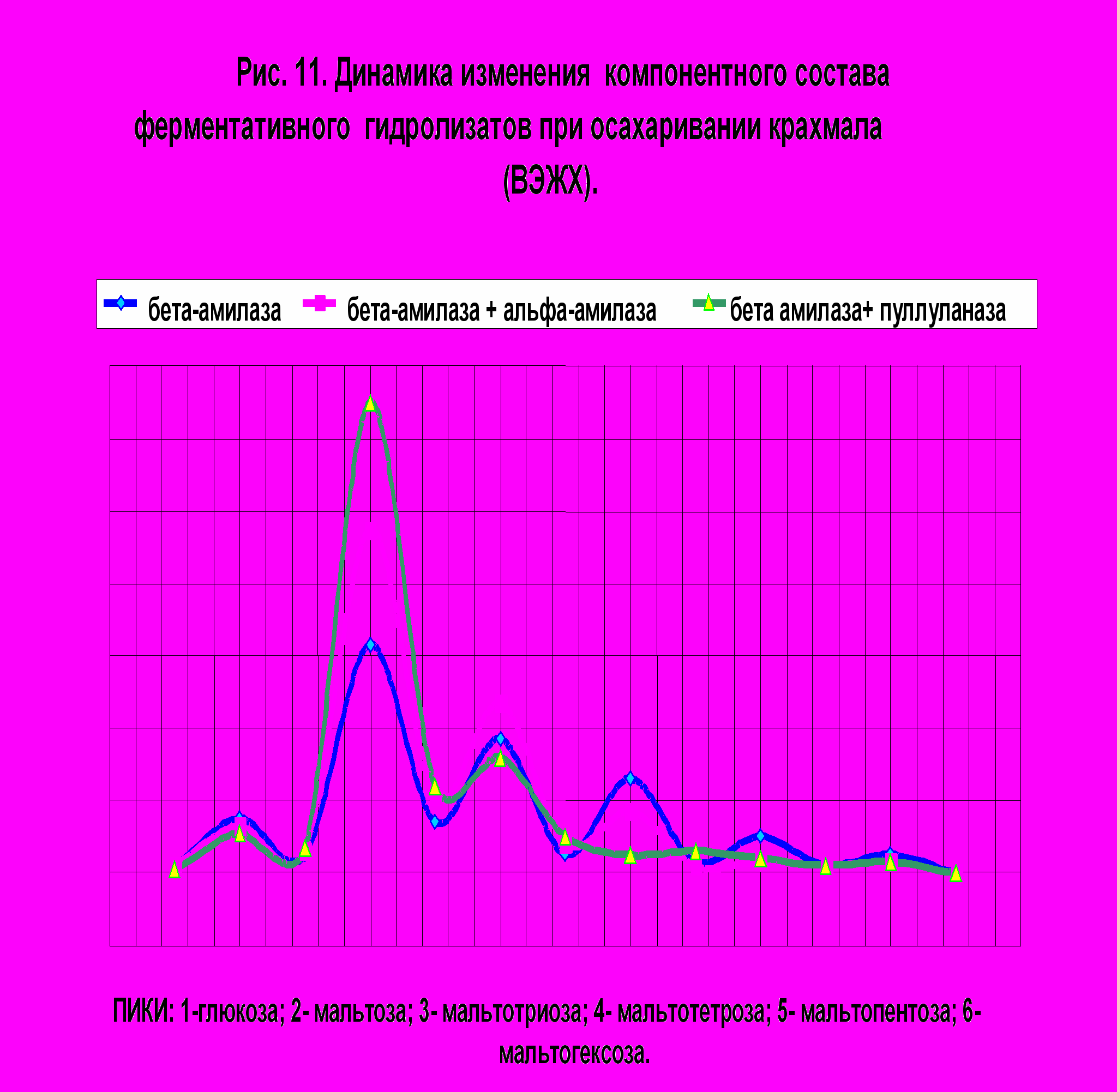
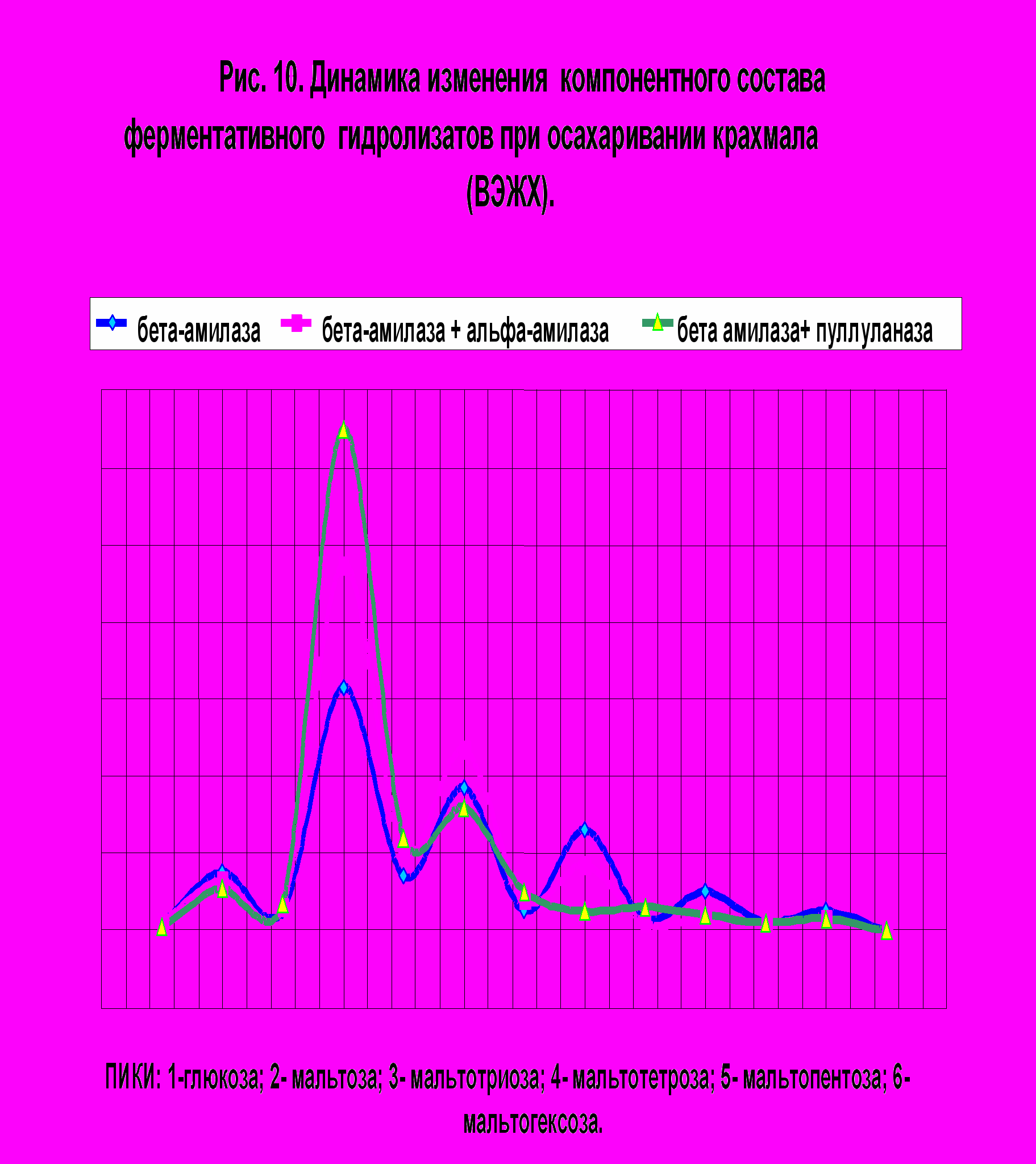
Длительность гидролиза составляла 48, 72 часа. Наилучшие результаты получены при введение в реакционную смесь наряду с -амилазой (1,5 ед/ г. крахмала) 1,5 ед/ г крахмала пуллуланазы при длительности 48 часов , т.к. увеличение продолжитель-
Таблица 6.
Состав гидролизатов при осахаривании крахмала -амилазой (1,5 ед/ г. крахмала) и пуллуланазой.
| Концентрация пуллуланазы, ед/г. крахмала | Состав гидролизатов,%* | |||||||
| ГЭ | Глюкоза | Мальтоза | Три и тетрасахара | |||||
| Длительность гидролиза,ч | ||||||||
| 48 | 72 | 48 | 72 | 48 | 72 | 48 | 72 | |
| Контроль,0 | 46,34 | 46,46 | 6,80 | 6,90 | 46,25 | 46,31 | 27,16 | 27,30 |
| 0,1 | 48,91 | 48,96 | 7,21 | 7,25 | 48,46 | 48,50 | 28,10 | 28,23 |
| 0,5 | 51,14 | 52,10 | 7,07 | 7,32 | 54,.90 | 54,97 | 29,24 | 29,32 |
| 1,0 | 53,18 | 53,45 | 7,30 | 7,52 | 56,50 | 56,80 | 30,05 | 30,24 |
| 1,5 | 54,43 | 55,20 | 7,33 | 7,62 | 58,51 | 58,80 | 31,37 | 31,53 |
*другие углеводы до 100%.
ности гидролиза до 72 часов давало незначительные изменения в углеводном составе гидролизатов.
Таким образом, применение пуллуланазы, полученной из фильтрата культуральной жидкости Micrococcus amylofaciens для осахаривания крахмала в сочетании с -амилазой из B.polymyxa позволяет повысить содержание мальтозы
в гидролизатах на 17-18 % по сравнению с осахариванием только одной -амилазой и на 10- 13% по сравнению с осахариванием -амилазой и -амилазой.Полученные результаты указывают на целесообразность использования пуллуланазы в крахмалопаточной промышленности.
2.2.7.Варианты технологии ферментативного гидролиза крахмала.
В настоящее время, с целью получения высокомальтозно-глюкозных сиропов используют ферментные препараты фирмы Ende Industries INS, такие как “Конверзим AMF-300» и «Глюкозим Л-100С+». Для сравнения эффективности полученного нами мультиэнзимного комплекса из Micrococcus amylofaciens использовали препарат «Глюкозим Л-100С+», который содержит пуллуланазу, а так же глюкоамилазу. т.е. набор ферментативного комплекса у двух исследуемых препаратов был аналогичен.
Гидролиз проводили в присутствии -амилазы из B.polymixa. Оптимальные концентрации совместного действия -амилазы и «Глюкозим Л-100С+» подобраны на 30% суспензии разжиженного крахмала при рН5,5: дозировка -амилазы составила 1,5 ед/г крахмала, «Глюкозим Л-100С+» - 0,3 ед/г крахмала. Осахаривание проводили при температуре 550С в течение 48 ч., увеличение длительности гидролиза практически не изменяла конечного результата. При сравнении полученных данных по гидролизу крахмала мультиэнзимным комплексом из Micrococcus amylofaciens и импортным ферментным препаратом установлено, что при рекомендованных дозировках накопление мальтозы в гидролизатах происходит практически на одинаковых уровнях (58,5% и 60,0 %) при одинаковой экспозиции гидролиза.
На основании полученных экспериментальных данных нами предложено две альтернативных технологии по осахариванию крахмала , фрагмент блок-схемы
| ВР 1.1. Прием крахмалосодержащего сырья | | ВР 1. Прием и хранение сырья, хим. реагентов |
| ВР 1.2. Прием и хранение ортофосфорной кислоты | | |
| ВР 1.3. Прием и хранение аммиачной воды | | |
| ВР2.1. Приготовление раствора каустической соды | | ВР 2.Подготовка и мойка оборудования |
| | | ВР3.Подготовка крахмалосодержащего сырья |
| | | ВР 4. Приготовление раствора ортофосфорной кислоты |
| | | ВР 5. Приготовление раствора Ферментных препаратов |
| ТП 1.1. Подготовка реактора к загрузке вода | | ТП1.Приготовление крахмалосодержащей суспензии (30-35%) |
| пар | | ТП2.Клейстеризация крахмалистого сырья (Т-1050С, -5 мин) |
| ВР1. Приготовление ферментных препаратов | | ТП3.Охлаждение крахмалистого сырья (80-850С) |
| “Ликвамил 400” –1500ед/кгс.крахмала, для стабилизации САСО3 | | ТП4.Разжижение крахмалистого сырья (80-850С, -2 ч.) |
| | | ТП 5. Термоинактивация -амилазы |
| ВР1. Приготовление ферментных препаратов | | ТП 6.Охлаждение (550С) |
| -амилазы из В. polymyxa 1,5 ед/г крахмала | | ТП7. Осахаривание крахмалистого сырья – Т-550С, рН 5,5 , - 48 ч. |
| | | |
| Пуллуланаза из Micrococcus amylofacie, 1,5 ед/г.крахмала | | ТП8.Осахаривание крахмалистого сырья – Т-550С, рН 5,5 , - 48 ч. |
| | | |
| «Глюкозим Л-100С+», 0,3 ед/г крахмала | | ТП8.Осахаривание крахмалистого сырья – Т-550С, рН 5,5 , - 48 ч. |
| | | |
| | | ТП9 Инактивация ферментных препаратов |
| | | ТП 10. Фильтрование сиропа |
| | | ТП 11. Обесцвечивание сиропа |
| Рис. Фрагмент блок-схемы технологического процесса получения глюкозо-мальтозных сиропов ( высокомальтозной патоки) |
Представлен на рис. Где, базируясь на полученных нами ранее результатах, исключена стадия инактивации -амилазы после разжижения крахмала и на стадии осахаривания рекомендованы к употреблению две альтернативные ферментативные композиции, позволившие увеличить выход мальтозы до 601,5%, что на 181,5% больше по сравнению с исходным уровнем, причем разработанная нами в данной работе ферментативная композиция противопоставлена импортной, которая является дорогостоящей.
Расчет экономической эффективности показал, что уменьшение энергозатрат и трудоемкости, за счет сокращения продолжительности процесса, а также экономия средств при использовании комплекса ферментных препаратов отечественного производства, при производстве высокомальтозно-глюкозных сиропов (высокомальтозных паток) позволяет снизить себестоимость на 4,7%, тем самым увеличить прибыль при использовании разработанной технологии на 2720 рублей на 1000т сырья (расчеты приведены в диссертационной работе в приложении №2).
3. Выводы.
1.Путем скрининга 187 прокариотных микроорганизмов из различных систематических групп найден продуцент, обладающий высокой биосинтетической способностью к образованию пуллуланазы. Определена видовая принадлежность микроорганизма с использованием международной системы API – Micrococcus amylofaciens.
2. Подобранные экспериментальным путем условия культивирования продуцента позволили увеличить продуктивность штамма в 3,2 раза , при этом уровень активности пуллуланазы составил 38,0 ед/ см3,для этого:
-разработаны эффективные методы поддержания штамма-продуцента;
-сконструированы новые питательные среды для культивирования и биосинтеза пуллуланазы;
-экспериментально обоснованы оптимальные параметры биосинтеза пуллуланазы
( рН среды, возраст, и доза посевного материала, длительность культивирования и аэрация), обеспечивающие максимум накопления фермента;
3.Разработаны методы выделения ферментного препарата пуллуланазы из фильтрата культуральной жидкости Micrococcus amylofaciens :
- определен спектр ферментативных активностей препарата, показано наличие амилолитической, пуллуланазной, глюкоамилазной активностей последнего;
- дана характеристика физико-химических свойств ферментного препарата.
4. Обоснована целесообразность применения мультиэнзимного биокатализа крахмала для повышения эффективности процесса гидролиза последнего, увеличен выход мальтозы до 60,01,5%, при уровне содержания глюкозы в сиропах до 10%.
Подобраны оптимальные условия гидролиза крахмала -амилазой из B.polymyxa ,препарата -амилазы, комплекса ферментов из Micrococcus amylofaciens
5. Усовершенствована традиционная технология производства высокомальтозных паток на основе ферментативного гидролиза крахмала:
- на основании экспериментальных данных исключена из традиционной технологии ферментативного гидролиза крахмалосодержащего сырья стадия инактивации ферментов после этапа разжижения крахмала;
- показана целесообразность сохранения -амилазы, вносимой на стадии разжижения крахмала, в процессе осахаривания;
- предложены альтернативные технологии осахаривания крахмала с использованием мультиэнзимного комплекса на основе Micrococcus amylofaciens и импортного препарата “Глюкозим Л-100С+”;
- определена экономическая эффективность предложений, позволившая снизить себестоимость получения высокомальтозных паток на 4,7%, тем самым увеличить прибыль при использовании разработанной технологии на 2720 рублей на 1000т сырья.
Список работ, опубликованных по материалам диссертации:
1.С.Н.Бутова, И.А.Кривова, Т.А.Ладур, И.В.Воробьева. Получение высокомальтозных сиропов из отходов крахмалистого сырья с использованием мультиэнзимных композиций препаратов амилолитического действия. // Сб.научных трудов «Микробные биокатализаторы и перспективы развития ферментных технологий в перерабатывающих отраслях АПК», М, Пищепроиздат, 2004, с.274-278.
2. А.Ю.Кривова, С.А.Ливинская, С.Н.Бутова, И.А.Кривова, Д.В.Горячев. Некоторые аспекты микробиологической безопасности эмульсионных продуктов. // Масла и жиры, 2006, №1 (59), с.13-16.
3.С.Н.Бутова, И.А.Кривова, Т.А.Ладур, И.В.Воробьева. Использование мультиэнзимных композиций для получения высокомальтозно-глюкозных сиропов. // Сб. докладов молодых ученых МГУПП, 2-ая Всероссийская науч.-технич. конференция – выставка «Высокоэффективные пищевые технологии, методы и средства для реализации», часть 2, М, 2004, с. 135-136.
4. И.А.Кривова, С.Н.Бутова. Использование пуллуланазы в конверсии растительного сырья. // Труды 5 ежегодной международной молодежной конференции ИБХФ РАН-Вузы «Биохимическая физика», М, 2005, с.315-316.
5. С.Н.Бутова, И.А.Кривова. Применение биотехнологии в производстве сахаристых продуктов. // Материалы третьего съезда Общества биотехнологов России им. Ю.А.Овчинникова, М, 2005, с.143-144.
6. С.Н.Бутова, И.А.Кривова. Пуллуланаза - фермент расщепляющий растительное сырье, используемое в пищевой промышленности. // Сб. докладов молодых ученых МГУПП, Всероссийская науч.-технич. конференция – выставка, М, 2005, с.24-25.
7.И.А.Кривова, С.Н.Бутова. Пуллуланаза - необходимая составляющая мультиэнзимной композиции препаратов амилолитического действия, в производстве сахаристых продуктов. // Сб. научных трудов «Микробные биокатализаторы для перерабатывающих отраслей АПК», М, 2006 , с.197-201.
8. И.А.Кривова, С.Н.Бутова, Т.А.Ладур Выделение и изучение внеклеточной пуллуланазы Micrococcus amylofaciens. // Хранение и переработка сельхозсырья, 2006, №1, с.24-26.
Печать офсетная. Тираж 100 экз. Заказ
Фирма «Простатор»
Москва,ул.Палиха,2а, тел. 250-92-06.
