Факторы риска и контроль вирусных инфекций после трансплантации гемопоэтических стволовых клеток у детей 14. 01. 21 гематология и переливание крови 14. 01. 08 педиатрия
| Вид материала | Автореферат |
- Аллогенная трансплантация гемопоэтических стволовых клеток в лечении врожденных и приобретенных, 1375.99kb.
- Молекулярно-генетическая диагностика и дифференцированная терапия гистиоцитарных пролиферативных, 1448.67kb.
- Красняков Владимир Кириллович Совершенствование донорства крови и ее компонентов, 921.41kb.
- Прямое переливание крови (методические рекомендации), 154.15kb.
- Использование стволовой клетки крови в медицине, 228.92kb.
- Тематический план лекций курса по выбору, 52.05kb.
- Оптимизация инновационных технологий трансфузионного пособия пациентам регионального, 1245.79kb.
- Неопухолевые лимфаденопатии. 14. 00. 29 гематология и переливание крови, 1061.02kb.
- Обеспечение качества получения и клинического применения компонентов крови в субъекте, 404.49kb.
- Рабочая учебная программа по дисциплине Гематология Для специальности, 174.73kb.
Факторы риска и особенности течения аденовирусной инфекции после аллогенной ТГСК
Одной из наиболее тяжелых задач являлась проблема анализа особенностей течения АДВ у пациентов после ТГСК. Сложность проблемы состояла в отсутствии возможностей проведения количественного ПЦР анализа АДВ. Кроме того, учитывая высокую чувствительность метода ПЦР, положительный результат исследования мог свидетельствовать о контаминации исследуемого материала. В связи с этим интерпретация результатов была значительно осложнена.
Учитывая противоречивость некоторых данных, за достоверные позитивные результаты были приняты результаты, подтвержденные повторным вирусологическим исследованием, а также лабораторные данные, свидетельствующие о наличии АДВ в нескольких различных исследуемых средах.
В анализируемую группу включено 163 случая ТГСК; частота активации АДВ при этом составила 28,2% (46 из 163 случаев ТГСК). Особенности локализации АДВ, выявленные при лабораторных исследованиях представлены в табл. 7. Кумулятивная вероятность при этом составила 0,29+0,036.
Таблица 7. Особенности локализации АДВ, выявленные при лабораторном мониторинге
| Вид ТГСК | кровь | кровь+моча | Кровь+стул | кровь+стул+моча | стул | стул+моча | Всего |
| Нерод. ТГСК | 2 | 1 | 15 | 5 | 1 | 4 | 28 |
| Родств. ТГСК | 0 | 0 | 3 | 2 | 2 | 0 | 8 |
| Гапло ТГСК | 1 | 0 | 6 | 1 | 1 | 1 | 10 |
| Всего | 3 | 1 | 24 | 8 | 4 | 5 | 46 |
Примечание: положительными считались результаты, выявленные при неоднократных повторных вирусологических исследованиях.
При анализе частоты реактивации инфекции в зависимости от вида ТГСК были получены следующие результаты: наибольшая частота обнаружения АДВ была выявлена при гаплоидентичной ТГСК – 50% (10 из 20 случаев ТГСК); при ТГСК от неродственного донора этот показатель составил 31,8% (28 из 88 случаев ТГСК); при родственной ТГСК – 14,5% (8 из 55 ТГСК) (рис. 7).
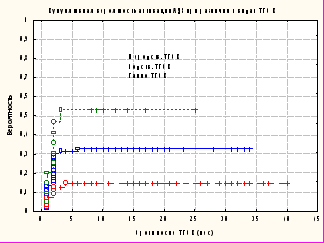
Рисунок 7. Кумулятивная вероятность активации АДВ при различных видах ТГСК: неродственная ТГСК – 0,33+0,052 (n=88); родственная ТГСК – 0,15+0,048 (n=55); гаплоидентичная ТГСК –0,53+0,118 (n=20).
Также был проведен анализ частоты активации АДВ в зависимости от тяжести острой РТПХ. При отсутствии клинически значимых признаков острой РТПХ АДВ обнаруживался в 21,7% случаев (21 из 97 ТГСК). Напротив, при острой РТПХ 2-4 степени АДВ был выявлен в 37,9% случаев (25 из 66 ТГСК). Кумулятивная вероятность в первом случае составила 0,22+0,043, во втором – 0,39+0,061. Различия между группами были статистически достоверными (р=0,014).
При использовании КМ в качестве источника ГСК для трансплантации АДВ был выявлен в 25,5% случаев (26 из 102 ТГСК); при применении ПСКК – в 22,6% (7 из 31). Кумулятивная вероятность в первом случае составила 0,26+0,044, во втором – 0,23+0,075 (р=0,69).
Данных о наличии достоверных различий в частоте выявления АДВ при сравнении пациентов, трансплантированных КМ и неманипулированными стволовыми клетками получено не было (р=0,69). Также как и при анализе ЦМВ отсутствие различий между различными источниками ГСК можно объяснить наибольшей частотой развития тяжелой РТПХ и необходимостью проведения высокоинтенсивной иммуносурессивной терапии при использовании ПСКК.
Кумулятивная БСВ составила 0,46+0,080 у пациентов после активации АДВ и 0,65+0,57 – при отсутствии признаков АДВ (рис. 8). Различия в кумулятивной вероятности БСВ в исследуемых группах были статистически достоверными (р=0,016).
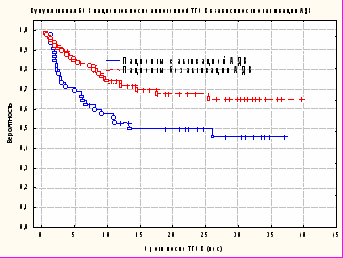
Рисунок 8. Вероятность БСВ при наличии (n=45) и отсутствии (n=112) признаков АДВ у пациентов после аллогенной ТГСК (р=0,016).
Полученные нами результаты не являются неожиданными, однако невозможность применения количественной методики ПЦР для диагностики виремии безусловно осложняло ситуацию, в противном случае разделение пациентов по группам риска могло быть более отчетливым. Тем не менее, как показали наши результаты, качественная ПЦР может быть использована с целью вирусологического контроля, но это требует более дифференцированного подхода к выбору тактики ведения пациента с учетом его клинической симптоматики и других факторов риска.
Снижение БСВ у пациентов после выявления АДВ в нашем исследовании является аргументом в пользу возможно более пристального внимания к проблеме АДВ инфекции, которая в ряде случаев может являться ко-инфекцией или выступать контекстом в комбинации с другими просттрансплантационными проблемами (например, РТПХ и т.д).
Геморрагический цистит. Роль ВК-вирусной инфекции. Другие предрасполагающие факторы
Перед тем как выяснить роль ВК-вирусной инфекции в развитии поражения уротелия мы оценили общую частоту развития геморрагических циститов (ГЦ) в исследуемой популяции. В данный анализ были включены 163 случая ТГСК. В результате частота развития ГЦ в общем пуле больных составила 25,77% (42 из 163 случаев ТГСК).
Был также проведен анализ частоты развития ГЦ в зависимости от вида ТГСК. Наибольшая частота развития ГЦ зарегистрирована при гаплоидентичной ТГСК, где она составила 45,0% (9 из 20 пациентов). При неродственной ТГСК частота развития данного осложнения составляла 25% (22 из 88 пациентов), а при родственной ТГСК – 20% (11 из 55 пациентов).
Распределение эпизодов развития ГЦ в зависимости от сроков после ТГСК проиллюстрировано на рис. 9.
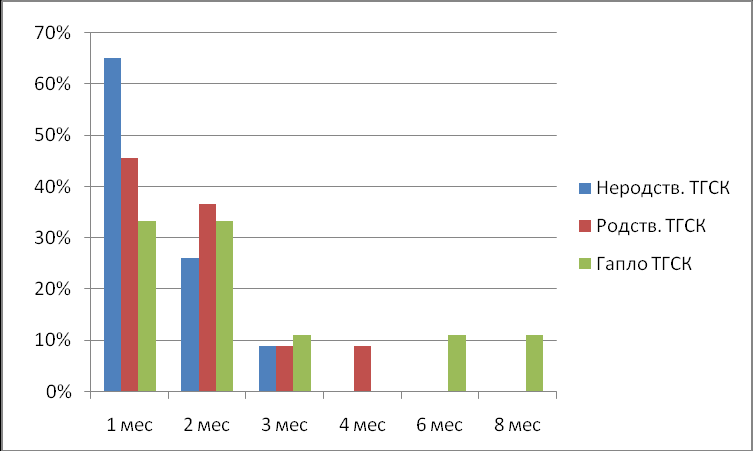
Рисунок 9. Частота геморрагических циститов (в %) в зависимости от сроков после трансплантации при различных вариантах ТГСК (количество пациентов при каждом варианте ТГСК принято за 100%).
Наибольшая частота развития ГЦ приходится на первые месяцы после ТГСК. Поздние сроки возникновения ГЦ были характерны преимущественно для реципиентов гаплоидентичных ГСК, что также вероятнее всего имеет подоплеку в виде вирусных осложнений на фоне длительной иммунореконституции.
Появление клиники ГЦ являлось основанием для проведения вирусологического исследования мочи пациента на наличие ВК-вируса методом ПЦР. У 33 (78,6%) из 42 пациентов ВК-вирус был обнаружен. Результаты количественной оценки ВК-вирурии представлены в табл. 8.
Данные об уровне вирурии, полученные в нашем исследовании, позволяют поставить под сомнение роль ВК-вируса, как изолированного фактора в развитии геморрагического цистита у пациентов после ТГСК в связи с тем, что у 9 пациентов с ГЦ ВК вирус не был обнаружен, а у 19 пациентов титр ВК-вируса был чрезвычайно низкий, то есть недостаточный для того, чтобы оказать повреждающий эффект на уротелий. В связи с этим мы оценили другие факторы риска развития геморрагического цистита у наших пациентов.
Таблица 8. Количество копий ВК-вируса у пациентов с ГЦ при различных видах ТГСК
| Кол-во копий ВК вируса в 1 мл мочи (х 106/мл) | Вид ТГСК | ВСЕГО | ||
| Неродств. | Родств. | Гапло | ||
| 0 | 4 | 3 | 2 | 9 |
| < 1 х 106/мл | 10 | 5 | 4 | 19 |
| от 1,5 х 106/мл до 50 х 106/мл | 6 | 3 | 2 | 11 |
| > 5000 х 106/мл | 2 | 0 | 1 | 3 |
| Всего | 22 | 11 | 9 | 43 |
При анализе режимов кондиционирования у пациентов с ГЦ выявлено, что у 41 из 42 больных были выполнены высокоинтенсивные миелоаблативные режимы. В частности у 25 пациентов базовым миелоаблативным препаратом был Бусульфан, у 8 больных – Треосульфан, у четырех – Мельфалан, одному пациенту для достижения максимальной миелоаблации было выполнено тотальное облучение тела (ТОТ) в дозе 12 Грей. Кроме того, у 14 пациентов был использован Циклофосфамид. Только у одного из 42 пациентов (пациент с АА) был проведен режим кондиционирования с редуцированной интенсивностью (Флюдарабин + АТГАМ) в связи с использованием в качестве донора однояйцевого близнеца.
При оценке частоты развития ГЦ в наиболее многочисленных нозологических группах были получены следующие результаты: из 27 пациентов с АА данное осложнение было зарегистрировано у 4 больных (14,8%); из 47 больных с ОМЛ – 19 (40,4%) пациентов имели ГЦ, а из 26 пациентов с ОЛЛ – только 9 (34,6%) пациентов.
Таким образом, нами были выявлены закономерности, позволяющие подтвердить роль миелоаблативных режимов кондиционирования в развитии данного осложнения. Кроме того, несмотря на показанную роль циклофосфамида в развитии ГЦ, мы показали, что она не является ведущей. Мы показали, что сочетание циклофосфамида с другими компонентами миелоаблативных режимов кондиционирования приводит к значительному увеличению частоты развития ГЦ.
Роль РТПХ в развитии ГЦ до сих пор вызывает множество споров. Мы также проанализировали частоту развития ГЦ в зависимости от тяжести острой РТПХ. Из 64 пациентов с острой РТПХ (2-4 ст.) явления ГЦ наблюдались у 19 (29,7%); в тоже время при отсутствии клинически значимой РТПХ данная проблема была выявлена у 23 (24,4%) из 94 больных (р=0,585). Вероятность развития ГЦ составила 0,31+0,06 при острой РТПХ 2-4 ст. и 0,27+0,05 при острой РТПХ 0-1 ст. (рис. 10). Эта находка является чрезвычайно важной, так как до этого наша клиническая группа также придерживалась версии о том, что РТПХ относится к одному из ключевых факторов риска.
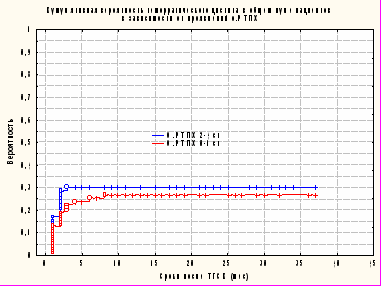
Рисунок 10. Кумулятивная вероятность развития геморрагического цистита у пациентов после аллогенной ТГСК при наличии/отсутствии клинически значимых признаков острой РТПХ (р=0,53): острая РТПХ 0-1 ст.- n=64 ; острая РТПХ 2-4 ст. – n=94.
Мы провели анализ частоты развития ГЦ в зависимости от частоты реактивации ЦМВ и АДВ после ТГСК.
У 25 (33,3%) из 75 пациентов, имевших лабораторные признаки ЦМВ виремии, были отмечены клинические признаки ГЦ (кумулятивная вероятность составила 0,34+0,055); в тоже время из 76 пациентов, у которых ЦМВ виремия не выявлялась, только 14 (18,4%) пациентов имели ГЦ (кумулятивная вероятность - 0,19+0,046). Различия между исследуемыми группами были статистически достоверными (р=0,047).
У 17 (39,0%) из 46 пациентов, имевших лабораторные признаки АДВ, отмечалась клиника ГЦ (кумулятивная вероятность составила 0,39+0,076); в тоже время из 117 пациентов, у которых АДВ не выявлялся, только 25 (21,2%) пациентов имели ГЦ (кумулятивная вероятность - 0,22+0,038). Различия между исследуемыми группами были статистически достоверными (р=0,049). Только у двоих пациентов с ГЦ и отсутствием признаков ВК-вирурии не было выявлено ни АДВ, ни ЦМВ.
Таким образом, наши результаты являются веским аргументом для того, чтобы переосмыслить тактику ведения пациентов с ГЦ после ТГСК. Своевременное проведение вирусологического исследования на АДВ и ЦМВ может быть необходимым у пациентов с данным осложнением для своевременного начала адекватной терапии.
Мы проанализировали вероятность БСВ в зависимости от наличия/отсутствия ГЦ у пациентов после ТГСК. Вероятность БСВ в первой группе составила 0,36+0,079, а во второй группе – 0,67+0,056. Различия между группами были статистически достоверные (р=0,0001) (рис. 11).
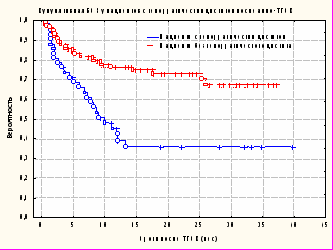
Рисунок 11. Вероятность БСВ в зависимости от наличия клинических признаков геморрагического цистита в сравнении с группой без данной клинической симптоматики.
В связи с достоверно низкой БСВ у пациентов с ГЦ мы попытались выяснить особенности влияния таких факторов риска, как ЦМВ, АДВ и острая РТПХ, на БСВ у пациентов с ГЦ. Для этого был проведен двухфакторный анализ с использованием каждого из вышеперечисленных факторов.
При анализе БСВ у пациентов с ГЦ в зависимости от ЦМВ- и АДВ-статуса не было получено статистически значимых различий между группами больных, имевших и не имевших диагностированную виремию после ТГСК (p=0,61 и р=0,73, соответственно), то есть эти факторы не влияют на выживаемость пациентов, даже несмотря на полученные доказательства корреляции между развитием виремии и вероятностью ГЦ.
При сравнении кумулятивной вероятности БСВ в зависимости от тяжести острой РТПХ у пациентов с ГЦ было показано, что уровень БСВ был значительно ниже у больных с острой РТПХ 2-4 степени по сравнению с пациентами, имевшими острую РТПХ 0-1 степени (р=0,028). При исследовании аналогичных показателей в отдельно взятой группе пациентов после неродственной ТГСК достоверность результатов была еще более высокая (р=0,006).
Таким образом, результаты, полученные при двухфактором анализе, свидетельствуют о том, что у пациентов с ГЦ прогноз заболевания во многом зависит от тяжести острой РТПХ. По всей видимости, на выживаемость пациентов с ГЦ влияет не сама тяжелая острая РТПХ, а другие инфекции, возникающие на фоне РТПХ (и терапии проводимой по поводу РТПХ), в число которых попадают и различные вирусные инфекции, отражением тяжести течения которых могут быть и всевозможные клинические нарушения, в том числе и ГЦ после ТГСК.
Факторы риска и особенности течения инфекции, вызванной вирусом герпеса 6 типа
Рутинный мониторинг вируса герпеса 6 типа (HHV6) не проводился. Скрининг (ПЦР крови или иного материала) осуществлялся, как правило, при рефрактерных к иммуносупрессивной терапии клинических признаках, характерных для острой РТПХ, или в контексте вирусологического исследования материала при иных осложнениях у реципиентов ГСК.
HHV6 был выявлен при 22 (12,6%) из 175 ТГСК. Особенности частоты выявления HHV6 в зависимости от вида ТГСК представлены в табл. 9.
Таблица 9. Частота выявления HHV6 при различных видах ТГСК
| | ТГСК от неродственного донора | ТГСК от родственного донора | Гапло-ТГСК | Всего |
| Всего ТГСК | 92 | 58 | 25 | 175 |
| Пациенты с HHV6 (%) | 14 (15,2%) | 5 (8,6%) | 3 (12%) | 22 (12,6%) |
У 13 пациентов HHV6 был выявлен исключительно из крови; у 1 пациента – в мазке из зева; в 1 случае HHV6 выявлялся одновременно из стула и зева; в 2 случаях – одновременно из крови и биоптата слизистой тонкого кишечника; в одном случае HHV6 выявлялся из крови, ликвора и биоптата слизистой желудка. Отсутствие возможности постановки количественной ПЦР реакции осложнило ситуацию с интерпретацией некоторых результатов. В частности, нельзя исключить, что выявление HHV6 методом ПЦР из биоптатов или иных сред могло быть связано с контаминацией исследуемого материала кровью.
В 63,6% случаев (n=14) у 22 пациентов с лабораторными признаками HHV6 имели место значимые клинические и гистологические признаки острой РТПХ (2-4 ст.). Напротив, при отсутствии лабораторных данных о наличии HHV6 (153 случая ТГСК) признаки клинически значимой острой РТПХ выявлялись в 34,6% случаев (53 ТГСК). Различия между группами являлись статистически достоверными (p=0,017).
При анализе кумулятивной БСВ (метод Каплан-Майер) статистически значимых различий в группах выявлено не было (р=0,55): к концу периода наблюдения вероятность БСВ в группе с HHV6 составила 0,62+0,129; во второй группе – 0,59+0,050 (рис. 12).

Рисунок 12. Кумулятивная БСВ в группах пациентов с выявленным HHV6 и без выявленного HHV6.
Учитывая полученную корреляцию между частотой развития HHV6 и острой клинически значимой РТПХ, а также отсутствие достоверных данных о влиянии HHV6 на БСВ, был проведен двухфакторный анализ с целью выяснения особенностей влияния HHV6 у пациентов с острой РТПХ на БСВ. Пациенты с клинически значимой острой РТПХ (n=62) были разделены на две группы – пациенты с лабораторными признаками HHV6 (n=14) и пациенты без лабораторных признаков HHV6 (n=48). Статистически значимых различий в вероятности БСВ между группами также получено не было (р=0,20), так как у пациентов с HHV6 она составила 0,65+0,165, а при отсутствии HHV6 – 0,58+0,074.
Таким образом, учитывая полученные данные, вопрос о необходимости проведения специфической вирусостатической терапии и рутинного скриннинга в отношении HHV6 в виде качественной ПЦР по-прежнему не является актуальным. Возможно, что проведение крупных рандомизированных исследований поможет детально разобраться в проблеме. Не исключено, что вариантом выяснения значения HHV6 у пациентов после ТГСК является проведение исследований с количественным мониторингом ПЦР HHV6.
Факторы риска и особенности течения других вирусных инфекций
Так же как и в случае с HHV6 рутинного скрининга для выявления остальных вирусов не проводилось. Поводом для проведения вирусологических исследований являлась клиническая картина, которая могла соответствовать клинике соответствующего вирусного осложнения (заболевания). Данные о частоте выявления различных вирусов представлены в табл. 10.
Таблица 10. Частота выявления некоторых вирусов при различных видах аллогенной ТГСК
| | ТГСК от неродственного донора | ТГСК от родственного донора | ТГСК от гаплоид. донора | Всего |
| Количество ТГСК | 92 | 58 | 25 | 175 |
| Кол-во пациентов с риновирусом (%) | 6 (6,5%) | 2 (3,4%) | 4 (16%) | 12 (6,9%) |
| Кол-во пациентов с HSV I (%) | 8 (8,7%) | 1 (1,7%) | 2 (8%) | 11 (6,3%) |
| Кол-во пациентов с RSV (%) | 0 | 0 | 1(4%) | 1 (0,6%) |
| Кол-во пациентов с коронавирусом (%) | 6 (6,5%) | 0 | 2 (8%) | 8 (4,6%) |
| Кол-во пациентов с парагриппом (%) | 3 (3,3%) | 1 (1,7%) | 2 (8%) | 6 (3,4%) |
| Кол-во пациентов с норавирусом (%) | 0 | 0 | 1(4%) | 1 (0,6%) |
| Кол-во пациентов с VZV (%) | 2 (2,2%) | 0 | 0 | 2 (1,2%) |
Наиболее часто выявляемым среди оставшихся респираторных вирусов был риновирус, который был верифицирован у 6,9% пациентов. Каждый раз поводом для проведения исследования была та или иная клиническая картина, которая могла соответствовать вирусному поражению респираторного тракта. Достаточно высокая частота обнаружения данного патогена может стать аргументом для тщательного лабораторного контроля данного возбудителя у реципиентов ГСК.
Несколько реже выявлялись другие респираторные вирусы: коронавирус (4,6%); вирус парагриппа (3,4%); RSV выявлен лишь у одного пациента после гаплоидентичной ТГСК (0,6%). К редко выявляемым вирусам в нашем исследовании следует отнести и, неоднократно верифицированный у одного пациента после гаплоидентичной ТГСК, норавирус (0,6%), ставший причиной тяжелого энтероколита.
Учитывая полученные нами данные, следует отметить, что пациенты после гаплоидентичной ТГСК были наиболее часто подвержены тем или иным вирусным осложнениям. С этой группой может конкурировать группа больных после неродственной ТГСК. Возвращаясь к проблеме описанных выше инфекций, хочется заметить, что, несмотря на то, что единственный фатальный случай был связан с развитием у пациента коронавирусной инфекции, любая другая инфекция может быть жизнеугрожающей у пациента после ТГСК.
