Факторы риска и контроль вирусных инфекций после трансплантации гемопоэтических стволовых клеток у детей 14. 01. 21 гематология и переливание крови 14. 01. 08 педиатрия
| Вид материала | Автореферат |
- Аллогенная трансплантация гемопоэтических стволовых клеток в лечении врожденных и приобретенных, 1375.99kb.
- Молекулярно-генетическая диагностика и дифференцированная терапия гистиоцитарных пролиферативных, 1448.67kb.
- Красняков Владимир Кириллович Совершенствование донорства крови и ее компонентов, 921.41kb.
- Прямое переливание крови (методические рекомендации), 154.15kb.
- Использование стволовой клетки крови в медицине, 228.92kb.
- Тематический план лекций курса по выбору, 52.05kb.
- Оптимизация инновационных технологий трансфузионного пособия пациентам регионального, 1245.79kb.
- Неопухолевые лимфаденопатии. 14. 00. 29 гематология и переливание крови, 1061.02kb.
- Обеспечение качества получения и клинического применения компонентов крови в субъекте, 404.49kb.
- Рабочая учебная программа по дисциплине Гематология Для специальности, 174.73kb.
Частота вирусных инфекции у реципиентов аллогенной ТГСК
В нашем исследовании спектр вирусных инфекций, выявленных у пациентов после аллогенной ТГСК, был представлен целым рядом патогенов: ЦМВ, ЭБВ, АДВ, HHV6, а также другими более редкими инфекциями, такими как парагрипп, риновирус, коронавирус и др. (табл. 6).
Таблица 6. Частота развития вирусных инфекций у реципиентов аллогенной ТГСК
| Вирусная инфекция | Частота развития инфекции |
| ЦМВ | 51,8% |
| ЭБВ | 26,9% |
| АДВ | 28,2% |
| ННV6 | 12,6% |
| Риновирус | 6,9% |
| HSV I | 6,3% |
| RSV | 0,6% |
| Коронавирус | 4,6% |
| Парагрипп | 3,4% |
| Норавирус | 0,6% |
| VZV | 1,2% |
Во всех случаях ранний срок после ТГСК был ассоциирован с наибольшей вероятностью развития инфекций. В частности, у 69% пациентов реактивация ЦМВ была выявлена в первый месяц после трансплантации, а частота развития ЭБВ была максимальной в первые 2 месяца (30,3% и 37,2% соответственно). Однако, как показал анализ наших результатов, вероятность развития любой из выявленных инфекций сохранялась не менее 1 года после выполненной ТГСК, что особенно было характерно для пациентов после гаплоидентичной трансплантации.
Факторы риска и особенности течения цитомегаловирусной инфекции после аллогенной ТГСК
Анализ частоты реактивации ЦМВ был произведен при 168 аллогенных ТГСК (неродственная ТГСК – n= 90; родственная ТГСК – n=56; гаплоидентичная ТГСК – n=22). Реактивация ЦМВ зарегистрирована при 87 (51,8%) из 168 ТГСК. При неродственной ТГСК реактивация ЦМВ выявлена в 53 (58,9%) из 90 ТГСК; при родственной ТГСК – в 21 (37,5%) из 56 случаев; при гаплоидентичной ТГСК – в 13 (59,1%) из 22 случаев (р=0,032).
Данная ситуация является отражением особенностей различных видов ТГСК и целым рядом факторов, обуславливающих реактивацию ЦМВ в отдельных клинических ситуациях. К ним относятся: интенсивность иммуноаблативной терапии, тяжесть острой РТПХ, Т-клеточная деплеция трансплантата, особенности иммунореконституции и целый ряд других проблем.
Наиболее угрожаемым периодом реактивации ЦМВ во всех исследуемых группах являлся первый месяц после проведенной ТГСК (рис. 1). Максимальным сроком после ТГСК, когда был зарегистрирован первичный эпизод реактивации ЦМВ стал 12 месяц после ТГСК; на этом сроке реактивация ЦМВ зарегистрирована у одного пациента после гаплоидентичной ТГСК, что можно объяснить особенностями и длительностью иммунореконституции, характерной для реципиентов Т-деплетированных ГСК.
Вероятность реактивации инфекции отличалась в различных исследуемых группах. Наименьшая кумулятивная вероятность реактивации ЦМВ была зарегистрирована в группе пациентов после родственной ТГСК; она составила 0,38 + 0,066. В группах пациентов после гаплоидентичной и неродственной ТГСК кумулятивная вероятность реактивации ЦМВ составила 0,66 + 0,110 и 0,60 + 0,052 соответственно. Статистически достоверных различий в кумулятивной вероятности развития ЦМВ между пациентами после гаплоидентичной и неродственной ТГСК выявлено не было (p=0,492).
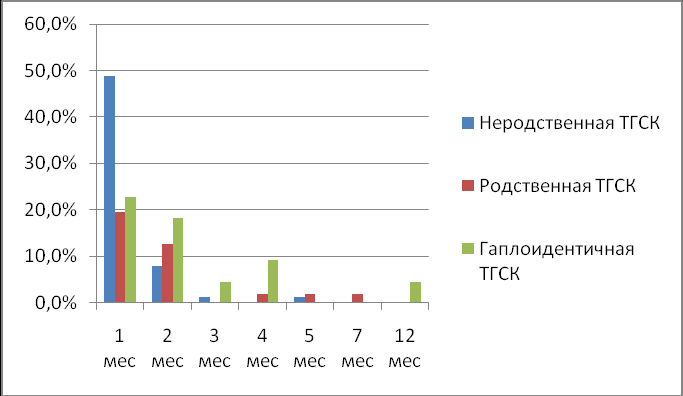
Рисунок 1. Частота первой реактивации ЦМВ в зависимости от сроков после трансплантации при различных вариантах ТГСК (количество пациентов при каждом варианте ТГСК принято за 100%).
Наличие или отсутствие ЦМВ-виремии в общем пуле пациентов не повлияло на показатели бессобытийной выживаемости (БСВ). Частота развития события в группе пациентов, имевших реактивацию ЦМВ, составила 34,2% (28 из 82 пациентов); в группе больных, не развивших ЦМВ-виремию, этот показатель был равен 34,7% (26 из 75 пациентов).
Вероятность БСВ не отличалась в исследуемых группах (р=0,92) и составила 0,61 + 0,058 в группе пациентов, имевших ЦМВ-виремию после ТГСК; в группе больных, не развивших ЦМВ-виремию показатель вероятности БСВ составил 0,57 + 0,071 (рис. 2).
Тот факт, что реактивация ЦМВ у пациентов не повлияла на частоту и вероятность БСВ, является весьма оптимистичным и вероятнее всего может свидетельствовать об эффективной тактике упреждающей терапии, подкрепленной правильным использованием современных диагностических методов (в том числе ПЦР в режиме «реального времени»), которые применялись в нашей работе. В последнее время в значительной степени возросло количество ТГСК от альтернативного донора. Само по себе решение о начале программы по проведению неродственной ТГСК или внедрение в практику методов Т-клеточной деплеции не может основываться исключительно на опыте и энтузиазме. Именно современная эффективная лабораторная диагностическая база является одним из важных составляющих успеха ТГСК.
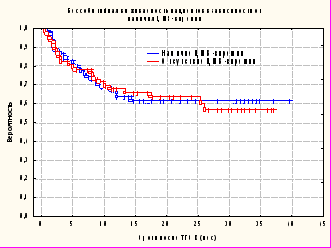
Рисунок 2. Вероятность бессобытийной выживаемости у пациентов имевших реактивацию ЦМВ (n=82) в сравнении с пациентами не имевшими ЦМВ-виремию (n=75).
В работе был проведен анализ особенностей развития ЦМВ инфекции и показатели выживаемости пациентов после неродственной ТГСК от ЦМВ-серопозитивного и ЦМВ-серонегативного донора. К сожалению, деление пациентов на подгруппы с разными их собственными ЦМВ-статусами было невозможным, так как более 90% пациентов перед ТГСК получали трансфузии компонентов крови и обнаружение в крови антител к ЦМВ могло быть связано с циркуляцией в крови пациента донорских ЦМВ IgG. В связи с этим достоверность серологического скрининга у пациентов была сомнительна. Учитывая данную ситуацию, пациенты были разделены только на две группы, отличающиеся только по ЦМВ-серологическому статусу доноров ГСК.
Всего проанализирован 31 случай неродственной ТГСК от ЦМВ-серопозитивного донора и 50 случаев неродственной ТГСК от ЦМВ-серонегативного донора. Реактивация ЦМВ в первой группе была зарегистрирована у 16 (51,6%) из 31 пациентов на сроках 14-61 (m=20) день после ТГСК, во второй – у 34 (68%) из 50 пациентов на сроках 8-144 (m=19,5) дней (p=0,215). У 5 (10%) пациентов, трансплантированных от ЦМВ-серонегативного донора позднее была верифицирована ЦМВ-пневмония, ставшая причиной летального исхода во всех пяти случаях (диагноз подтвержден при исследовании аутопсийного материала). При неродственной ТГСК от ЦМВ-позитивного донора в 2 (6,4%) случаях также была выявлена ЦМВ-пневмония, подтвержденная гистологически после выполнения биопсии легкого.
При анализе БСВ у пациентов после неродственной ТГСК в зависимости от серологического ЦМВ-статуса донора не было получено достоверных различий (р=0,56) (рис. 3).
Таким образом, можно предполагать, что, несмотря на отсутствие различий в частоте реактивации, частота и тяжесть висцеральных ЦМВ-инфекций (в частности, ЦМВ-пневмонии) дают все основания подразумевать о том, что ЦМВ-серонегативный статус донора является серьезным предрасполагающим фактором.
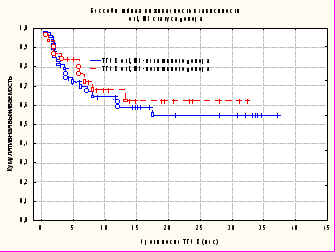
Рисунок 3. Кумулятивная бессобытийная выживаемость пациентов после неродственной ТГСК от ЦМВ-серопозитивного донора (0,63+0,09; n=31) и ЦМВ-серонегативного (0,54+0,08; n=50) донора (р=0,56).
К сожалению максимально эффективных способов профилактики развития тяжелой ЦМВ инфекции до настоящего времени не существует. В качестве одного из способов контроля ЦМВ мы использовали профилактический курс ганцикловира во время кондиционирования перед ТГСК у пациентов с ЦМВ-серонегативным донором (n=33). У 17 пациентов с аналогичным донором терапии ганцикловиром не проводилось. В результате у 23 (69,70%) из 33 пациентов получавших ганцикловир перед ТГСК отмечалась реактивация ЦМВ; во второй группе (без ганцикловира) реактивация ЦМВ выявлена у 11 (64,71%) из 17 больных (р=0,969). Кумулятивная вероятность также была схожа в группах и составляла 0,704+0,08 для пациентов, получавших ганцикловир и 0,697+0,13 для пациентов не получавших ганцикловир (рис. 4). Таким образом, отсутствие эффективности такой терапии является аргументом для ее исключения из протокола проведения ТГСК, что позволит уменьшить финансовые затраты и снизит вероятность фармакологической токсичности.
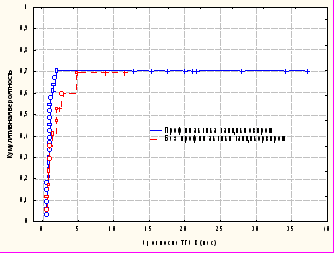
Рисунок 4. Кумулятивная вероятность реактивации ЦМВ у пациентов, трансплантированных от ЦМВ-негативного неродственного донора, получавших (n=33) и не получавших ганцикловир (n=17) в качестве профилактики перед ТГСК (p=0,399).
Одной из серьезных проблем, способствующих развитию ЦМВ инфекции после ТГСК от неродственного донора, является РТПХ. Естественно, что в контексте проблемы ЦМВ инфекции при РТПХ подразумевают не только иммуносуперссивный эффект данного осложнения, но проводимая терапия, направленная на высокоинтенсивную иммуноаблацию. В группе пациентов с острой РТПХ 0-1 степени реактивация ЦМВ была выявлена в 45 случаях (46,4%) из 97; в группе больных, развивших РТПХ >2 ст., реактивация ЦМВ выявлена в 41 случае (58,6%) из 70 (р=0,168).
Кумулятивная вероятность реактивации ЦМВ у пациентов с острой РТПХ >2 ст. составила 0,60+0,06; тот же показатель в группе с острой РТПХ 0-1 ст. был равен 0,48+0,05. Различия между группами оказались статистически достоверными (р=0,045).
Анализ значимости терапии глюкокортикоидами у реципиентов ГСК нельзя не исследовать отдельно от проблемы РТПХ, так как такая терапия у пациентов после ТГСК, если быть точным, является одним из факторов в структуре проблемы тяжелой РТПХ. Тем не менее, мы предприняли попытку проведения обособленного анализа для определения значимости терапии глюкокортикоидами, разделив пациентов на группы, состоящие из больных, получавших глюкокортикоиды длительностью более и менее 1 месяца. Анализ вероятности реактивации ЦМВ был проведен при 167 ТГСК, из которых в 56 случаях пациенты получали глюкокортикоиды более 1 месяца, а в 111 случаях менее 1 месяца. Вероятность реактивации ЦМВ в первой группе пациентов составила 0,64+0,068; во второй группе этот показатель оказался равным 0,48+0,049 Различия в вероятности реактивации между группами оказались статистически достоверными (p=0,021).
Если сравнить полученные данные о вероятности реактивации ЦМВ в зависимости от длительности использования глюкокортикоидов с показателями вероятности реактивации ЦМВ в зависимости от тяжести острой РТПХ становится понятным, что полученные результаты абсолютно логичны. Практически полная идентичность вероятности реактивации при тяжелой острой РТПХ 2-4 степени (0,60+0,061) с вероятностью реактивации при длительном курсе глюкокортикоидов (0,64+0,068) дают основание предполагать то, что данные факторы риска не могут рассматриваться как изолированные (p=0,55).
Одним из наиболее серьезных осложнений, связанных с ЦМВ, является пневмония. Мы тоже получили данные, подтверждающие серьезность ЦМВ-пневмонии для реципиента ТГСК, так как вероятность летального исхода в нашем исследовании составила 69%, что имеет некоторое сходство с результатами других исследований. Во всех случаях при подозрении на наличие у пациента ЦМВ-пневмонии, помимо специфических вирусостатических препаратов, проводилась терапия высокими дозами ВВИГ. ЦМВ-пневмония при неродственной ТГСК выявлена в 7 из 92 случаев (7,6%). В 5 из этих 7 случаев именно она стала причиной летального исхода в данной группе. При родственной ТГСК ЦМВ-пневмония была подтверждена в 3 (5,2%) из 58 случаях и стала причиной летальных исходов у двух пациентов. Наибольшая частота развития ЦМВ-пневмонии была зафиксирована при гаплоидентичной ТГСК (в 3 [12%] из 25 ТГСК), ставшая причиной летального исхода 2 пациентов. В связи c серьезностью ситуации существует обоснованная необходимость дальнейшей отработки подходов для своевременного выявления и раннего начала терапии ЦМВ-пневмонии. Сложностью в контроле как ЦМВ пневмонии, так и любой другой висцеральной ЦМВ инфекции является то, что в подавляющем большинстве случаев, выявляемый при систематическом лабораторном контроле уровень ЦМВ виремии может не коррелировать с клиническими проявлениями инфекции. Риск развития того или иного висцерального поражения, обусловленного ЦМВ, одинаково высок при любом количестве ДНК ЦМВ, выявленном при ПЦР диагностике. В отдельных случаях клиническая симптоматика может даже существенно опережать появление ЦМВ виремии. В связи с этим даже при самом раннем начале упреждающей терапии, основанной на выявлении минимального количества копий вируса, нельзя быть однозначно уверенным в отсутствии у пациента ЦМВ-заболевания.
К сожалению, результаты, демонстрирующие ЦМВ-природу других висцерльных поражений (таких как энтероколиты, циститы и т.д) в данной группе пациентов недоступны в связи с отсутствием корректных лабораторных данных, а также в связи с противоречивостью полученных результатов. В частности, выявление ЦМВ в стуле (или даже верификация возбудителя в слизистой кишечника), как правило, сочеталась с другими вирусологичесими находками, а также с гистологическими данными, свидетельствующими о наличии РТПХ.
Перед анализом влияния хронической РТПХ мы проанализировали частоту возникновения первой (впервые выявленной) реактивации ЦМВ на поздних сроках, то есть после +100 дня от ТГСК. По нашим данным реактивации ЦМВ на поздних сроках произошла только у 6 пациентов: 3 (4,6%) из 64 пациентов после ТГСК от родственного донора; 3 (16,7%) из 16 пациентов после ТГСК от гаплоидентичного донора; ни одного случая поздней впервые выявленной реактивации у 76 пациентов после неродственной ТГСК выявлено не было. У 2 из 6 пациентов, реактивировавших ЦМВ впервые после +100 дня от ТГСК, ЦМВ виремия была выявлена на фоне течения хронической РТПХ.
При анализе частоты развития ЦМВ-пневмонии на фоне хронической РТПХ было показано, что данное осложнений (доказанное после выполнения биопсии легкого) развилось у 2 (9,5%) из 21 пациентов при ТГСК от неродственного донора; при гаплоидентичной ТГСК хроническая РТПХ зарегистрирована лишь у одного пациента, у которого впоследствии также была верифицирована ЦМВ-пневмония; при ТГСК от родственного донора ЦМВ-пневмонии на фоне течения хронической РТПХ не было диагностировано ни у одного из 13 пациентов.
Анализ частоты реактивации ЦМВ в зависимости от источника ГСК был проведен исключительно у пациентов после ТГСК с использованием КМ и ПСКК. Так как ТГСК пуповинной крови была проведена только у девяти пациентов, анализ частоты реактивации инфекции в этой группе являлся нецелесообразным из-за предполагаемой некорректной интерпретации полученных результатов. В исследуемый пул пациентов также не были включены больные после гаплоидентичной ТГСК в связи с применением у этих больных СD34+селекции или деплеции Т-клеток (или их субпопулляций), что коренным образом влияло на клеточные характеристики трансплантата. В исследуемую группу попали 137 пациентов, из которых у 33 больных проводилась трансплантация ПСКК, а у 104 – трансплантация КМ. В первой подгруппе реактивация ЦМВ была зафиксирована у 14 (42,4%) больных, во второй – у 58 (55,8%) пациентов. Кумулятивная вероятность реактивации ЦМВ при трансплантации ПСКК составила 0,43+0,08, а при трансплантации КМ - 0,58 + 0,05 (p=0,21).
В настоящее время по-прежнему нет убедительных данных, однозначно свидетельствующих о преимуществе того или иного источника ГСК для трансплантации. Противоречивость этой проблемы можно проанализировать с нескольких позиций. С одной стороны, более короткие сроки приживления трансплантата и иммунореконституции при применении ПСКК должны быть аргументом в пользу снижения вероятности ЦМВ при применении ПСКК. Особенности клеточных характеристик трансплантата ПСКК также являются предпосылкой для более ранней Т-клеточной реконституции, что безусловно должно способствовать восстановлению противовирусного ответа на более ранних сроках после ТГСК. Однако, преимущества Г-КСФ-стимулированных неманипулированных ПСКК перед костным мозгом в скорости приживления и восстановления иммунного ответа нивелируются увеличением риска развития тяжелой острой РТПХ, что особенно характерно для пациентов после неродственной ТГСК, что является потенциальным фактором, повышающим вероятность развития вирусных осложнений. В связи с вышеизложенным, отсутствие достоверных преимуществ при применении ПСКК или КМ является понятными.
Подводя итоги анализа ЦМВ при ТГСК можно думать о том, что существует целый ряд факторов, предрасполагающих к развитию ЦМВ у пациентов. К ним относятся вид ТГСК, тяжесть РТПХ, продолжительность и интенсивность иммуносупрессивной терапии, ЦМВ-серологический статус донора и реципиента, и т.д. Понимание их значимости в отношении развития ЦМВ инфекции является чрезвычайно важным и позволяет клиницисту взвешенно и аргументировано подходить к решению проблемы контроля ЦМВ инфекции у реципиентов аллогенных ГСК.
Факторы риска и особенности течения Эпштейн-Барр вирусной инфекции и ее осложнений у пациентов после ТГСК
Анализ частоты реактивации ЭБВ был проведен на основании данных полученных при проведении 160 аллогенных ТГСК (неродственная ТГСК – n= 88; родственная ТГСК – n=53; гаплоидентичная ТГСК – n=19). Реактивация ЭБВ была зарегистрирована в 43 (26,9%) из 160 случаев. При неродственной ТГСК реактивация ЭБВ была выявлена в 32 (36,4%) из 88 случаев; при родственной ТГСК – в 9 (17,0%) из 53 случаев; при гаплоидентичной ТГСК – в 2 (10,5%) из 19 случаев (р=0,010).
Сроки распределения частоты развития ЭБВ виремии в зависимости от времени после ТГСК свидетельствуют о наибольшем риске в первую очередь первых 2 месяцев после трансплантации (рис. 5). В дальнейшем наблюдается уменьшения вероятности виремии, однако актуальность проблемы остается в течение первого года после ТГСК.

Рисунок 5. Частота первой (впервые выявленной) реактивации ЭБВ в зависимости от сроков после трансплантации при различных вариантах ТГСК (количество пациентов при каждом варианте ТГСК принято за 100%).
На данном рисунке не представлена ТГСК от гаплоидентичного донора в связи с чрезвычайно малым количеством пациентов, у которых была зарегистрирована реактивация ЭБВ (n=2).
Вероятность реактивации инфекции отличалась в исследуемых группах (рис. 6). Наименьшая кумулятивная вероятность реактивации ЭБВ была зарегистрирована в группе пациентов после гаплоидентичной ТГСК; она составила 0,14 + 0,091. В группах пациентов после родственной и неродственной ТГСК кумулятивная вероятность реактивации ЭБВ составила 0,18 + 0,056 и 0,40 + 0,055 соответственно. Различия в исследуемых группах являлись статистически достоверными (p=0,004).
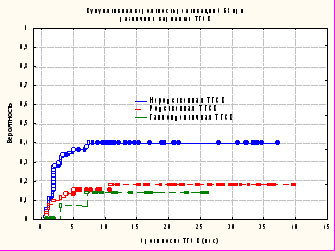
Рисунок 6. Вероятность реактивации ЭБВ при различных вариантах ТГСК (p=0,004): неродственная ТГСК – n= 88; родственная ТГСК – n=53; гаплоидентичная ТГСК – n=19.
Хотя частота развития ЭБВ-ПТЛЗ не являлась чрезвычайно высокой (4,57%) и отличалась в группах с различными видами ТГСК. Всего было выявлено 8 случаев ЭБВ-ПТЛЗ. Наибольшее количество случаев ЭБВ-ПТЛЗ было зарегистрировано при неродственной ТГСК (7,6%), причем у 3 пациентов оно стала причиной летального исхода. В одном случае была выявлена генерализованная крупноклеточная анапластическая лимфома с поражением печени, легких и ЦНС, в другом – лимфома ЦНС, в третьем – генерализованная лимфома с поражением печени. При родственной ТГСК только в 1 (1,9%) из 58 случаев ТГСК зарегистрировано развитие ЭБВ-ПТЛЗ (положительный эффект на терапию ритуксимабом). У больных после гаплоидентичной ТГСК ЭБВ-ПТЛЗ выявлено не было.
Таким образом, именно пациент после неродственной ТГСК является наиболее подходящей мишенью для ЭБВ. Связано это в первую очередь с тем, что интенсивность иммуносупрессивной терапии, направленной на профилактику и лечение острой РТПХ, в том числе препаратов, направленных на угнетение Т-клеточного лимфоцитарного звена, бывает существенно выше у реципиентов неродственных ГСК.
Невысокая частота реактивации ЭБВ, а также отсутствие данных о развитии ЭБВ-ПТЛЗ при гаплоидентичной ТГСК противоречит данным ряда исследований, декларирующих наибольшую частоту ЭБВ именно при этом варианте ТГСК. Принято считать, что, реципиент гаплоидентичных ГСК, как правило, имеет максимальное количество факторов риска, провоцирующих развитие ЭБВ: Т-клеточная деплеция, длительная Т-клеточная реконституция. Тем не менее, в нашем исследовании проблема ЭБВ после гаплоидентичной ТГСК являлась второстепенной, что очевидно является результатом используемого нами метода дополнительной В-клеточной деплеции (иммуномагнитная деплеция CD3+CD19+ или CD4+CD8+CD19+, а также применение ритуксимаба), используемых при подготовке гаплоидентичного трансплантата.
В одном случае развитие ЭБВ-ПТЛЗ было выявлено на фоне полного отсутствия лабораторных признаков виремии. В одном случае развитие ЭБВ-ПТЛЗ с поражением ЦНС сопровождалось минимальным количеством копий ДНК ЭБВ в крови (1160 коп/мл) на фоне значительного количества ДНК-ЭБВ в ликворе (>500000 коп/мл). Вероятность отсутствия корреляции между уровнем виремии и развитием ЭБВ-ПТЛЗ является поводом для более внимательного отношения к проблеме.
Развитие у пациента ЭБВ-ПТЛЗ являлось основанием для начала терапии ритуксимабом. Однако эффективность ритуксимаба была выявлена только в 3 случаях из 8. В двух случаях после констатации рефрактерности к ритуксимабу была начата полихимиотерапия, которая оказалась эффективной у обоих пациентов. Несмотря на то, что проведение полихимиотерапии и клеточной терапии в такой ситуации было продемонстрировано нами на единичных наблюдениях, выполнимость и эффективность такого подхода является аргументом для его дальнейшего изучения и внедрения в клиническую практику.
Применение ритуксимаба в качестве упреждающей терапии при реактивации ЭБВ оказалось весьма эффективной опцией. В связи с вероятностью развития ЭБВ-ПТЛЗ даже при невысокой виремии у пациентов высокого риска развития данного осложнения можно рекомендовать начало терапии ритуксимабом уже при вирусной нагрузке > 1000 коп/мл. В остальных случаях возможен дифференцированный подход после тщательного анализа состояния пациента и оценки факторов риска развития ПТЛЗ.
Анализ частоты и вероятности реактивации ЭБВ в зависимости от источника ГСК, также как и в случае с ЦМВ инфекцией, был проведен в группах пациентов после родственной и неродственной ТГСК (без учета гаплоидентичной ТГСК). Было продемонстрировано, что наибольшую вероятность имеют пациенты после ТГСК с использованием КМ (0,37 + 0,052) в качестве источника ГСК, в то время как у реципиентов ПСКК она составила 0,22 + 0,075 (р=0,21).
Мы проанализировали также частоту развития ЭБВ виремии в зависимости от тяжести острой РТПХ. У 97 пациентов с острой РТПХ 0-1 степени реактивация ЭБВ была выявлена у 14 (14,3%) пациентов; у 63 больных с острой РТПХ 2-4 степени реактивация ЭБВ отмечалась в 23 (35,9%) случаях. Различия между группами являлись статистически достоверными (р=0,015). Кумулятивная вероятность активации ЭБВ у пациентов после аллогенной ТГСК при отсутствии клинически значимых признаков острой РТПХ составила 0,22+0,042, а при острой РТПХ 2-4 степени – 0,39+0,062.
Наличие или отсутствие ЭБВ-виремии в общем пуле пациентов существенно не повлияло на частоту и вероятность БСВ. Частота развития событий в группе пациентов, имевших реактивацию ЭБВ, составила 37,2% (16 из 43 пациентов); в группе больных у которых не было зарегистрировано ЭБВ-виремии этот показатель составил 33,3% (38 из 114 пациентов). Кумулятивная вероятность БСВ статистически значимо не отличалась в исследуемых группах (р=0,66) и составила 0,56 + 0,087 в группе пациентов, имевших ЭБВ-виремию после ТГСК; в группе больных без ЭБВ-виремии кумулятивная вероятность БСВ составила 0,60 + 0,054. Полученные данные по БСВ дают основание предполагать, что ЭБВ виремия не является значимым провокационным фактором. Возможно, что правильный мониторинг и своевременная упреждающая терапия ритуксимабом в качестве препарата первой линии является адекватной тактикой, позволяющей контролировать ЭБВ реактивацию у пациентов.
