Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
Глава 22. ТРАНСПОРТ ГАЗОВ КРОВЬЮ И КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ. Г. Тевс
22.1. Структура и свойства гемоглобина
Строение молекулы гемоглобина
Одна из важнейших функций крови состоит в переносе поглощаемого в легких кислорода к органам и тканям, а также в удалении образующегося в них диоксида углерода и переносе его в легкие. Ключевую роль во всех этих процессах играют эритроциты. Эти клетки содержат красный пигмент крови -гемоглобин, способный соединяться с кислородом в капиллярах легких и высвобождать его в капиллярах тканей. Кроме того, гемоглобин способен связывать некоторое количество диоксида углерода, образующегося в процессе клеточного метаболизма, и высвобождать его в легких. В связи с этим гемоглобин играет важнейшую роль в переносе дыхательных газов.
Гемоглобин относится к классу белков-хромопротеинов. Его молекула состоит из четырех полипептидных цепей, с каждой из которых нековалентно связана особая пигментная группа—гем. Молекулярная масса гемоглобина составляет около 64500, а каждой из его субъединиц-16000 [2, 7, 18].
Пигментные группы гемоглобина. В состав молекулы гемоглобина входят четыре одинаковые гемовые группы. Гем представляет собой протопорфирин, содержащий центрально расположенный ион двухвалентного железа. Молекула протопорфирина состоит из четырех пиррольных колец, связанных метиновыми мостиками; к кольцам присоединены боковые цепи характерного строения (рис. 22.1). Ключевую роль в активности гемоглобина играет ион железа, расположенный в центре молекулы протопорфирина. Соединение с этим ионом посредством двух координационных связей и двух связей, образовавшихся вследствие замещения водорода, превращает протопорфирин в гем. Структура гема целиком расположена в одной плоскости. В процессе переноса кислорода гемоглобином молекула О2 обратимо связывается с гемом, при этом валентность железа не изменяется.
Присоединяя кислород, гемоглобин (Hb) превращается в оксигемоглобин (НЬО2). Чтобы подчеркнуть тот факт, что валентность железа при этом связывании не меняется, реакцию называют не окислением, а оксигенацией; обратный процесс называется дезоксигенацией. Когда хотят специально отметить, что гемоглобин не связан с кислородом, его называют дезоксигемоглобином.
Гем может подвергаться не только оксигенации, но и истинному окислению. При этом железо становится из двухвалентного трехвалентным (рис. 22.2). Окисленный гем называется гематином (метгемом), а вся полипептидная молекула в целомметгемоглобином. В крови человека метгемоглобин содержится в незначительных количествах, но при некоторых заболеваниях и отравлениях определенными ядами его содержание возрастает. Опасность таких состояний заключается в том, что окисленный гемоглобин не способен переносить кислород к тканям.
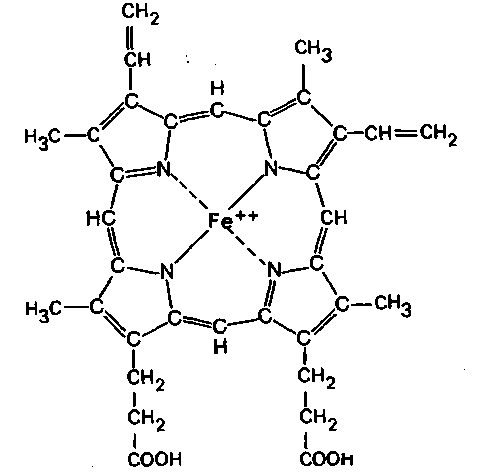 |
| Рис. 22.1. Строение гема |
606 ЧАСТЬ VI. ДЫХАНИЕ
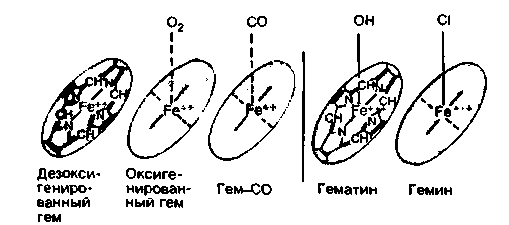 |
| Рис. 22.2. Соединения, образуемые гемом (железо двухвалентное) и окисленным гемом (железо трехвалентное). Протопорфириновые кольца лежат в одной плоскости (красные диски на рис. 22.3) |
Белковый компонент гемоглобина. Большая часть молекулы гемоглобина, состоящей примерно из 10000 атомов, приходится на долю белкового компонента. Этот компонент состоит из четырех отдельных полипептидных цепей, в состав каждой из которых входит более 140 аминокислотных остатков. Путем химического анализа установлены аминокислотные последовательности полипептидных цепей гемоглобина. В последние годы при помощи рентгеноструктурного анализа было установлено пространственное расположение этих цепей [26, 27]. На рис. 22.3 изображена модель молекулы гемоглобина, созданная на основе результатов указанных исследований. Она состоит из двух симметричных «светлых» цепей, тесно переплетенных с двумя симметричными «темными» цепями. Вся молекула имеет приблизительно сферическую форму. Гемовые группы, изображенные в виде красных дисков, располагаются в нишах вблизи поверхности. В гемоглобине взрослого человека (НbА) светлые субъ-
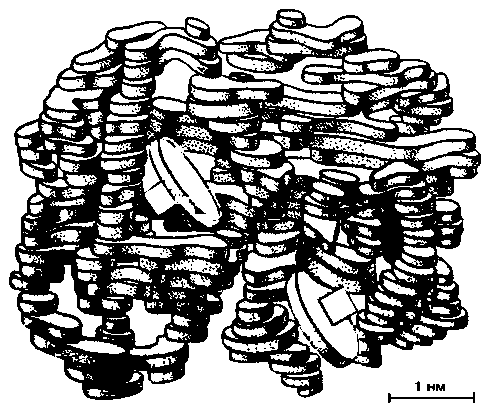 |
| Рис. 22.3. Пространственная модель молекулы гемоглобина (по Перутцу [26, 27]) |
единицы, каждая из которых содержит 141 аминокислотный остаток, называются а-цепями. а темные субъединицы (по 146 аминокислотных остатков)ß-цепями. В составе фетального гемоглобина (HbF) вместо ß-цепей имеются две так называемые γ-цепи, отличающиеся по аминокислотной последовательности. Вскоре после рождения HbF заменяется на НbА [2].
Поглощение света гемоглобином
Поглощение света и цвет гемоглобина. Цвет растворенного вещества, не испускающего световые лучи, зависит от его способности поглощать падающий свет в той или иной части спектра видимого света. Как правило, каждое вещество поглощает свет лишь в определенной области спектра, тогда как свет других длин волн проходит через это вещество почти беспрепятственно. Цвет раствора вещества определяется спектральным составом прошедшего через него света.
Красный цвет растворов гемоглобина (и, следовательно, крови) обусловлен тем, что это вещество относительно сильно поглощает коротковолновый свет, т. е. в синей области спектра, а большую часть длинноволнового (красного) света пропускает.
При исследовании света, прошедшего через раствор оксигенированного гемоглобина, с помощью спектроскопа можно обнаружить не только полосу поглощения в синей области спектра (полосу Соре), но также две характерные темные полосы (полосы поглощения) в желтой и желто-зеленой областях спектра с максимумами при длинах волн 577 и 541 нм [11].
Дезоксигемоглобин несколько интенсивнее, чем оксигемоглобин, поглощает длинноволновые лучи и менее интенсивно - коротковолновые. В связи с этим венозная кровь выглядит темнее и имеет красный цвет с синеватым оттенком. При спектроскопическом исследовании выявляется одна широкая полоса поглощения в желто-зеленой части спектра с максимумом при длине волны 555 нм.
Спектрфотометрия. Для количественного анализа абсорбционных свойств окрашенного раствора используют спектрофотометры. В этих приборах видимый свет разлагается в спектр при помощи призмы или дифракционной решетки, а затем свет очень узкой области длин волн (так называемый монохроматический свет) проходит через исследуемый раствор. Поглощение света зависит от длины волны и от свойств раствора. Для определения соотношения между интенсивностью падающего (I0) и прошедшего (I) света используется фотоэлемент. Отношение I/I0 называется пропусканием, а отношение (I0 — I)/I0 - поглощением. Полный спектр поглощения раствора получают путем последовательного измерения этих величин для разных длин волн.
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 607
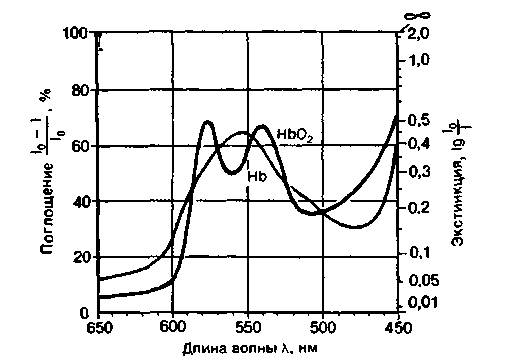 |
| Рис. 22.4. Спектры поглощения оксигемоглобина (НbО2) и дезоксигемоглобина (Hb). По оси ординат слева-коэффициент поглощения, справа -экстинкция |
Спектры поглощения. На рис. 22.4 изображены спектры поглощения оксигемоглобина н дезоксигемоглобина. Тем участкам спектра, в которых при спектроскопии обнаруживаются темные полосы, соответствуют максимумы на кривой поглощения. Для оксигемоглобина характерны два таких максимума, а для гемоглобина - один, занимающий положение между ними. Из рисунка видно, что эти максимумы приходятся на те же длины волн, что и полосы поглощения.
Точки пересечения обеих кривых поглощения, или так называемые изобестические точки, соответствуют длинам волн, при которых растворы равной концентрации Hb и НbО2 пропускают свет в одинаковой степени. Если длина волны световых лучей соответствует изобестической точке, то поглощение их гемоглобином не зависит от степени его оксигенации. Монохроматический свет такой длины волны используют в тех случаях, когда необходимо определить концентрацию гемоглобина, не подвергая его химическим модификациям (см. ниже). Если же спектрофотометрию используют для измерения насыщения гемоглобина кислородом, то, напротив, выбирают свет с такой длиной волны, при которой разница между коэффициентами поглощения оксигемоглобина и дезоксигемоглобина максимальна, т. е. 600, 577, 470 нм и т. д. (см. рис. 22.4).
Закон Ламберта-Бэра. В качестве количественной характеристики поглощения света часто используют также экстинкцию (Е) (на рис. 22.4 отложена по правой оси ординат):
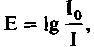 О)
О)где I0-интенсивность падающего света, а I- интенсивность прошедшего света. Экстинкцию удобно использовать в связи с тем, что она прямо про-
порциональна концентрации растворенного вещества С:
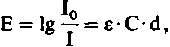 (2)
(2)где d-толщина слоя раствора, а ε - коэффициент экстинкции (величина, постоянная для каждого вещества). Линейная зависимость между экстинкцией, концентрацией и толщиной слоя раствора называется законом Ламберта-Бэра. Этот закон справедлив только для монохроматического света.
Содержание гемоглобина в крови; среднее содержание гемоглобина в эритроците
Нормальные показатели. Содержание гемоглобина в крови человека составляет в среднем 158 г/л (15.8 г/дл) у мужчин и 140 г/л (14 г/дл) у женщин. Как и практически любые биологические показатели, эта величина претерпевает определенные колебания даже у здоровых людей. Пределы колебаний определяют путем построения частотного распределения значений для большого числа людей (рис. 22.5).
С возрастом содержание гемоглобина в крови заметно меняется. В крови новорожденного оно составляет 200 г/л. причем возможны значительные индивидуальные колебания (рис. 22.5). В течение первого года жизни содержание гемоглобина снижается примерно до 115 г/л, а затем постепенно возрастает до уровня, характерного для взрослых.
Высокое содержание гемоглобина в крови наблюдается не только у плода, но также у лиц, длительное время живущих в условиях высокогорья (с. 714). И в том и в другом случае повышение содержания гемоглобина необходимо для того, чтобы обеспечить нормальное снабжение тканей кислородом при пониженном парциальном давлении этого газа.
Уменьшение содержания гемоглобина по сравнению с нормальным уровнем называется анемией. Как правило, диагноз анемия ставят в том случае, если содержание гемоглобина меньше 130 г/л у мужчин и 120 г/л у женщин.
Измерение содержания гемоглобина. Для измерения содержания гемоглобина существует много методов, в том числе: 1) определение количества связанного О2 (1 г Hb может присоединить до 1,36 мл О2); 2) анализ уровня железа в крови (содержание железа в гемоглобине составляет 0,34%); 3) колориметрия (сравнение цвета крови с цветом стандартного раствора); 4) измерение экстинкции (спектрофотометрия). При проведении рутинных определений уровня гемоглобина отдают предпочтение последнему методу, так как при использова-
6C8 ЧАСТЬ VI. ДЫХАНИЕ
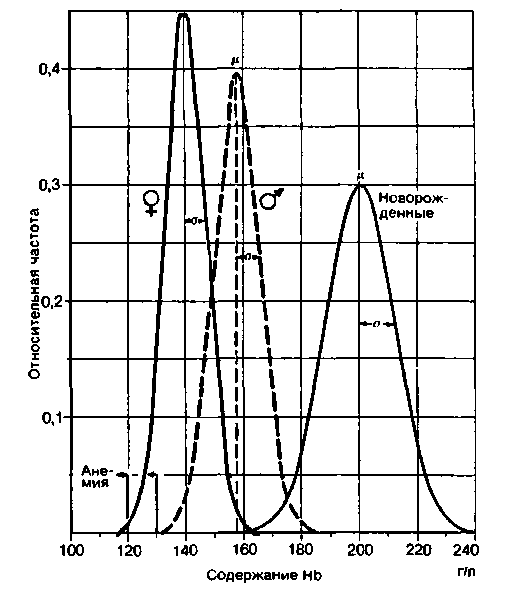 |
| Рис. 22.5. Частотное распределение концентраций гемоглобина у взрослых мужчин (  ), взрослых женщин ( ), взрослых женщин (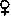 ) и новорожденных. По оси ординат - относительная частота встречаемости, по оси абсцисс - содержание гемоглобина; μ среднее значение (медиана), σ-стандартное отклонение (величина, характеризующая разброс значений; соответствует расстоянию от медианы кривой нормального распределения до значения, соответствующего наиболее крутому участку этой кривой) ) и новорожденных. По оси ординат - относительная частота встречаемости, по оси абсцисс - содержание гемоглобина; μ среднее значение (медиана), σ-стандартное отклонение (величина, характеризующая разброс значений; соответствует расстоянию от медианы кривой нормального распределения до значения, соответствующего наиболее крутому участку этой кривой) |
нии первых двух способов необходима сложная аппаратура, а метод колориметрии неточен.
Спектрофотометрический анализ. Принцип метода состоит в определении содержания Hb в крови по экстинкции монохроматического света. Поскольку растворенный гемоглобин нестабилен, а экстинкция зависит от степени оксигенации, его необходимо предварительно перевести в стабильную форму.
Спектрофотометрические измерения содержания гемоглобина производят следующим образом. Кровь набирают в капиллярную пипетку и затем смешивают с раствором, содержащим калий железосинеродистый (K3[Fe(CN)6]), цианистый калий (KCN) и бикарбонат натрия (NaHCO3). Под действием этих веществ эритроциты разрушаются, и гемоглобин превращается в цианметгемоглобин HbCN (содержащий трехвалентное железо), способный сохраняться в течение нескольких недель. При спектрофотометрии раствор цианметгемоглобина освещают монохроматическим светом с длиной волны 546 нм и определяют экстинкцию Е. Зная коэффициент экстинкции ε и толщину слоя раствора d, можно, исходя из закона
Ламберта-Бэра [уравнение (2)], определить концентрацию раствора С непосредственно по величине экстинкции Е. Чаще предпочитают, однако, предварительно откалибровать шкалу экстинкции при помощи стандартного раствора. В настоящее время цианметгемоглобиновый метод считается наиболее точным из общепринятых способов измерения содержания гемоглобина [32].
Среднее содержание гемоглобина в эритроците.
Важным диагностическим показателем, позволяющим оценить эритропоэз и провести дифференциальную диагностику различных форм анемии, служит среднее содержание гемоглобина в одном эритроците (СГЭ) (по международной классификации-mean corpuscular hemoglobin, MCH). Эта величина отражает абсолютное количество гемоглобина, содержащееся в среднем в одном эритроците. Ее находят путем деления количества гемоглобина в определенном объеме крови на число эритроцитов в том же объеме.
Приведем пример расчета СГЭ. У здорового мужчины в 1 л крови содержится 158 г Hb и 5,1 млн ∙ 106 эритроцитов (1 л = 106 мкл). СГЭ равно отношению этих величин:
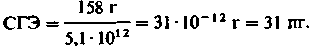
Такая же величина СГЭ характерна и для здоровых женшин:
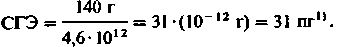
Эритроциты с нормальным содержанием гемоглобина (26-36 пг) называют нормохромнымн. Если СГЭ патологически снижено, то эритроциты называют гипохромными, а если оно повышено - гиперхромными. Эти же термины употребляют и для обозначения различных форм анемии. Так, когда образование гемоглобина снижается в результате недостатка железа, содержание гемоглобина в расчете на эритроцит падает, и возникает гипохромная анемия. При других разновидностях анемии (например, пернициозной анемии) нарушается образование красных кровяных телец в костном мозгу, и в крови появляются деформированные эритроциты с высоким содержанием гемоглобина. В этом случае речь идет о гиперхромной анемии. После значительной кровопотери СГЭ сначала не изменяется (нормохромная анемия), а в последующем вследствие избыточной продукции эритроцитов содержание гемоглобина в них падает (гипохромная анемия).
Связь между различными параметрами эритроцитов.
При оценке состояния эритроцитов, производимой в диагностических целях, обычно измеряют три показателя -число эритроцитов Э (мкл), содержание гемоглобина в крови Hb (г/л) и гематокрит (ГК). Исходя из этих трех показателей, можно вывести еще три величины - среднее содержание гемоглобина в эритроците (СГЭ), среднюю концентрацию гемоглобина в эритроците (КГЭ) (по меж-
1
 ) Приведены данные для Центральной Европы; для популяции Северной Америки СГЭ = 29 пг (по Уинтробу).
) Приведены данные для Центральной Европы; для популяции Северной Америки СГЭ = 29 пг (по Уинтробу).ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 609
дународной классификации-meam corpuscular hemoglobin concentration, MCHC) и средний объем эритроцитов (ОЭ)Взаимосвязь между всеми этими показателями видна из их названий. Приведем схему этой взаимосвязи:
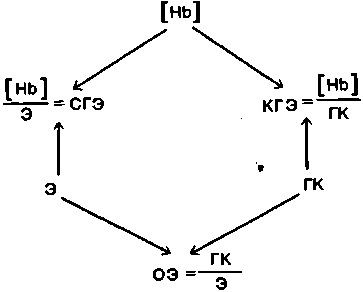
Так, если Э = 5 · 106 ∙ мкл-1, [Hb] = 150 г/л, ПС = 0,45, то остальные три показателя составляют: СГЭ = 30 пг, КГЭ = 333г/л, а ОЭ = 0,09 10~6 мкл = 90 фл (фемтолитров) = 90 мкм3 (перевод одних единиц в другие приведен на с. 845).
