Н. Н. Алипова, канд биол наук О. В. Левашова и канд биол наук М. С. Морозовой под редакцией акад. П. Г. Костюка москва «мир» 1996 ббк 28. 903 Ф50
| Вид материала | Документы |
- Приглашение и программа разнообразие почв и биоты северной и центральной азии, 521.14kb.
- М. А. Ляшко доц., канд физ мат наук; Т. Н. Смотрова доц., канд, 2299.13kb.
- Современные направления развития физической культуры, спорта и туризма, 4493.6kb.
- Отчет о проведении Международной научной конференции-семинара «Современные методы психологии», 97.76kb.
- Образовательная программа дошкольного образования Москва «Просвещение», 5670.3kb.
- Пособие для врачей и среднего медицинского персонала Минск, 5480.63kb.
- Ббк 63. 3(0) Н72, 4378.93kb.
- Тезисы докладов, 4290.75kb.
- Строительные нормы и правила нагрузки и воздействия сниП 01. 07-85* министерство строительства, 1162.86kb.
- Ббк 63. 3(0) Н72, 5546.58kb.
22.3. Перенос СО2 кровью
Формы транспорта СО2
Диоксид углерода (СО2, углекислый газ)-конечный продукт окислительного метаболизма в клетках - переносится с кровью к легким и удаляется через них во внешнюю среду. Подобно кислороду, диоксид углерода может переноситься как в физически растворенном виде, так и в составе химических соединений. Химическое связывание СО2 - более сложный процесс по сравнению со связыванием кислорода. Это обусловлено тем, что механизм, отвечающий за транспорт СО2, должен одновременно обеспечивать поддержание постоянства кислотно-щелочного равновесия крови и тем самым внутренней среды организма в целом.
Связывание СО2 [15]. Напряжение СО2 в артериальной крови, поступающей в тканевые капилляры, составляет 40 мм рт. ст. (5,3 кПа). В клетках же, расположенных около этих капилляров, напряжение СО2 значительно выше, так как углекислый газ постоянно образуется в процессе метаболизма. В связи с этим физически растворенный СО2 диффундирует по градиенту напряжения из тканей в капилляры. Здесь некоторое количество углекислого газа остается в растворенном состоянии, но большая часть СО2 претерпевает ряд химических превращений (рис. 22.9). Прежде всего происходит гидратация молекул СО2 с образованием угольной кислоты, сразу же диссоциирующей на ион бикарбоната и протон:
 (9)
(9)В плазме крови эта реакция протекает очень медленно; в эритроците же она ускорена примерно в 10 тыс. раз. Это связано с действием фермента карбоангидразы [6, 24]. Поскольку этот фермент
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 615
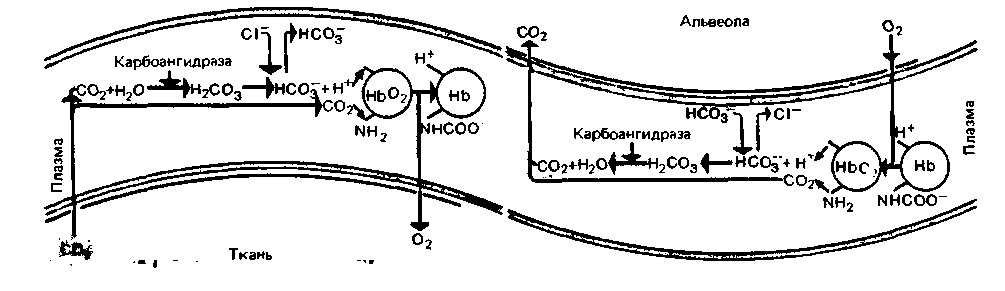 |
| Рис. 22.9. Химические реакции, происходящие и эритроцитах при газообмене в тканях (слева) и легких (справа) |
присутствует только в эритроцитах, практически все молекулы СО2, участвующие в реакции гидратации, должны сначала проникнуть в эритроциты.
Накопление в эритроците НСО3− приводит к тому, что между его внутренней средой и плазмой крови создается диффузионный градиент. Ионы НСО3− могут двигаться по этому градиенту лишь в том случае, если при этом не нарушается равновесное распределение электрических зарядов. Поэтому одновременно с выходом каждого иона НСО3− должен происходить либо выход из эритроцита одного катиона, либо вход одного аниона. Поскольку мембрана эритроцита практически непроницаема для катионов, но сравнительно легко пропускает небольшие анионы, в обмен на НСО3− в эритроцит поступают ионы С1~. Этот обменный процесс называют хлоридным сдвигом (сдвигом Хамбургера).
По мере поступления СО2 в эритроците образуются не только ионы НСО3−, но также ионы Η +. Однако это не приводит к значительным сдвигам pH внутри эритроцита, что обусловлено, в частности, особыми свойствами гемоглобина. Это вещество, будучи амфолитом, обладает значительной буферной емкостью. Кроме того, восстановленный гемоглобин обладает более слабыми кислотными свойствами, чем оксигемоглобин, поэтому он может присоединять дополнительное количество ионов Η + (с. 619).
СО2 может связываться также путем непосредственного присоединения к аминогруппам белкового компонента гемоглобина. При этом образуется остаток карбаминовой кислоты (карбамат):
 (10)
(10)Гемоглобин, связанный с СО2, называется карбаминогемоглобином (или упрощенно карбогемоглобином).
Все эти химические реакции и взаимосвязи между ними представлены на рис. 22.9. В левой части этого рисунка показаны процессы, происходящие
в тканевых капиллярах при поступлении СО2 в кровь. В правой части изображены реакции, протекающие при высвобождении СО2 в легких; видно, что направление всех реакций здесь противоположное.
Роль разных форм СО2 в газообмене. В крови, поступающей к тканям, напряжение СО2 составляет 40 ммрт. ст. Проходя через них, кровь насыщается углекислым газом, и напряжение его в оттекающей из тканей крови достигает в среднем 46 мм рт. ст. При этом 1 л крови поглощает примерно 1.8 ммоль СО2. Около 12% этого количества остается в физически растворенном виде или в форме недиссоциированной угольной кислоты (Н2СО3), 11% образует карбаминовое соединение с гемоглобином, 27% транспортируется в виде бикарбоната в эритроцитах, а остальное количество-около 50%-растворено в виде НСО3− в плазме. При прохождении крови через легкие СО2 высвобождается из этих четырех форм в таком же соотношении.
Сатурационные кривые CO2 1)
Зависимость содержания СО2 от его напряжения.
Общее содержание диоксида углерода в крови складывается из концентраций физически растворенного СО2 и форм химически связанного СО2 - угольной кислоты, карбамата и бикарбоната. Большая часть
1
 ) В оригинале эти кривые называются «кривые диссоциации СО 2», и это название достаточно часто встречается в литературе. В то же время оно неверно и затрудняет понимание процессов переноса СО2 (особенно для студентов, которым в основном и предназначено настоящее пособие), так как СО2 ни на что не диссоциирует. Поскольку же данные кривые отражают насыщение крови СО2 при различных значениях его парциального давления, мы используем термин «сатурационные кривые» (saturatio насыщение), предложенный нами в переводе книги Дж. Уэста «Физиология дыхания. Основы» (М.: Мир. 1988). Этот же термин можно использовать для описания кривых насыщения крови кислородом, когда по вертикальной оси отложено не насыщение кислородом гемоглобина, а объемное содержание О2 в крови.- Прим. перев.
) В оригинале эти кривые называются «кривые диссоциации СО 2», и это название достаточно часто встречается в литературе. В то же время оно неверно и затрудняет понимание процессов переноса СО2 (особенно для студентов, которым в основном и предназначено настоящее пособие), так как СО2 ни на что не диссоциирует. Поскольку же данные кривые отражают насыщение крови СО2 при различных значениях его парциального давления, мы используем термин «сатурационные кривые» (saturatio насыщение), предложенный нами в переводе книги Дж. Уэста «Физиология дыхания. Основы» (М.: Мир. 1988). Этот же термин можно использовать для описания кривых насыщения крови кислородом, когда по вертикальной оси отложено не насыщение кислородом гемоглобина, а объемное содержание О2 в крови.- Прим. перев.616 ЧАСТЬ VI. ДЫХАНИЕ
СО2 присутствует внутри и вне эритроцитов в форме бикарбоната. При повышении Рсо2 содержание всех этих форм СО2 увеличивается.
Связь между концентрацией в крови и парциальным давлением СО2 описывается сатурацнонпой кривой, сходной с кривой диссоциации оксигемоглобина. На рис. 22.11 приведены такие кривые для оксигенированной и дезоксигенированной крови. Разница между этими двумя кривыми обусловлена тем, что оксигемоглобин обладает более выраженными кислотными свойствами, чем дезоксигемоглобин, и может поэтому удалять меньше ионов Н+ из раствора за счет их присоединения. Соответственно, чем ниже содержание оксигемоглобина, тем выше степень диссоциации угольной кислоты-процесса, необходимого для непрерывного поглощения СО2. Кроме того, дезоксигемоглобин более активно, чем оксигемоглобин, связывает СО2 с образованием карбогемоглобина [6, 20]. Зависимость связывания СО2 от степени оксигенации гемоглобина называют эффектом Христиансена Дугласа Холдейна или кратко эффектом Холдейна.
Существует принципиальная разница между сатурационными кривыми связывания СО2 и кривыми диссоциации оксигемоглобина. Кривые диссоциации НbО2 асимптотически приближаются к максимуму, а связывание СО2 не достигает насыщения. По мере увеличения парциального давления СО2 количество связанного СО2 постоянно возрастает, так как образование бикарбоната в крови практически не лимитировано. Поэтому по оси ординат на графиках связывания СО2 отложены не проценты насыщения, а единицы концентрации (мл СО2/мл крови или ммоль/л).
Сатурационные кривые СО2 (рис. 22.10) приложимы только к крови с нормальным кислотнощелочным равновесием. В условиях метаболического алкалоза либо ацидоза они существенно сдвигаются (рис. 22.16).
Физиологическое значение эффекта Христиансена-Дугласа Холдейна. При рассмотрении процессов поступления СО2 в кровь из тканей и его высвобождения в легких следует помнить о том, что эти процессы происходят одновременно с обменом О2. Изменения в насыщении гемоглобина кислородом влияют на связывание СО2 кровью и тем самым на его обмен.
К тканевым капиллярам обычно притекает полностью оксигенированная кровь (точка а на рис. 22.10). По мере того как кровь проходит через капилляры и кислород выходит из нее в ткани, способность крови поглощать СО2 увеличивается. Таким образом, эффект Христиансена-Дугласа Холдейна способствует поглощению СО2 кровью в тканях.
В легких происходят обратные процессы. В ре-
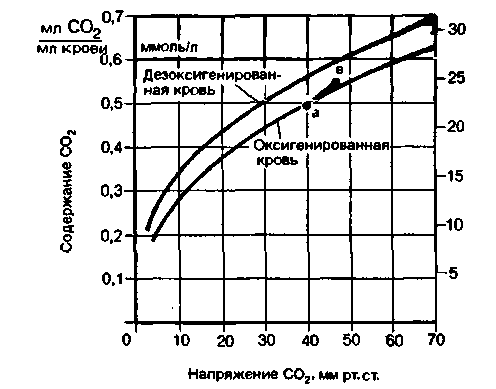 |
| Рис. 22.10. Кривые содержания СО2 в оксигенированной и дезоксигенированной крови. Красная кривая («эффективная кривая связывания СО2»), соединяющая точки а (артериальная кровь) и в (венозная кровь), отражает фактический газообмен |
зультате того, что в кровь поступает кислород, ее сродство к углекислому газу снижается, и тем самым облегчается диффузия СО2 в альвеолы. Происходящие при этом изменения соответствуют сдвигу от точки в до точки а на красной кривой (рис. 22.10). Эта кривая, отражающая процессы обмена СО2 в легких и тканях, называется эффективной сатурационной кривой СО2. Итак, мы убедились в том, что как при поступлении СО2 в кровь из тканей, так и при выделении его в легких эффект Христиансена-Дугласа-Холдейна способствует диффузионному обмену этого газа.
22.4. Кислотно-щелочное равновесие крови
pH крови
Кислоты и основания. Согласно определению Бренстеда, кислотами называют такие вещества, которые в растворах отдают ионы водорода (доноры протонов), а основаниями-вещества, связывающие эти ионы (акцепторы протонов). Подобное определение оказалось особенно плодотворным в области биологических наук. Рассмотрим с этих позиций реакцию диссоциации
 (11)
(11)При протекании этой реакции в прямом направлении (слева направо) НА представляет собой кислоту. Когда эта реакция в определенных условиях осуществляется в обратном направлении, анион А− является по определению основанием (он связывает
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 617
ионы водорода). А в данном случае называют сопряженным основанием. Между реакциями диссоциации и ассоциации существует равновесие, подчиняющееся закону действующих масс. В случае сильных кислот, например HCl, равновесие в реакции (11) значительно смещено вправо. Если же НА представляет собой слабую кислоту, то диссоциация происходит не полностью. Степень ее зависит от константы равновесия (рис. 22.11).
Показатель pH. Кислотность или щелочность раствора зависит от содержания в нем свободных ионов водорода. Показателем этого содержания служит величина pH. По определению pH представляет собой отрицательный десятичный логарифм молярной концентрации ионов Н+:
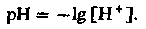 (12)
(12)Таким образом, если pH 7 (нейтральная реакция среды), то концентрация ионов Н+ [Н+] равна 10−7 моль/л. При увеличении кислотности раствора его pH снижается.
Показатель pH был вначале предложен для технических целей, однако оказалось, что он имеет особое значение для живых объектов. Дело в том, что электрохимический потенциал ионов пропорционален не их концентрации, а логарифму этой концентрации. В связи с этим можно предполагать, что степень возбуждения рецепторов, участвующих в поддержании кислотно-щелочного равновесия в организме человека или животного, пропорциональна не концентрации ионов Н+, а величине pH.
Измерение pH. pH раствора можно определить либо при помощи индикаторов, либо электрометрически. Боль-
 |
| Рис. 22.11. Зависимость степени диссоциации слабой кислоты от pH. рК'-отрицательный логарифм константы равновесия К'. Для получения подобных буферных кривых к раствору последовательно добавляют кратные количества Н+ или ОН− и измеряют pH после каждой добавки |
шинство индикаторов представляет собой очень слабые кислоты или основания, диссоциирующие при определенных значениях pH и изменяющие при этом свой цвет. Для более точного и непрерывного измерения pH широко применяется электрометрическая регистрация (прибор pH-метр) с помощью стеклянного электрода. Такой электрод обычно имеет шарообразно расширенный конец из специального стекла, пропускающего ионы Н+. Внутри электрод заполнен буферным раствором. При погружении электрода в раствор по две стороны стеклянной мембраны создается разность потенциалов, величина которой в соответствии с уравнением Нернста (с. 13) зависит от pH исследуемого раствора. Эта разность потенциалов фиксируется с помощью неполяризующегося электрода. В настоящее время в pH-метрах используют простые в обращении датчики, в которых измерительный электрод и электрод сравнения заключены в единую оболочку. После усиления электрический сигнал подается на шкалу или электронное табло. Перед началом измерения прибор должен быть откалиброван при помощи стандартных буферных растворов.
Постоянство pH артериальной крови. pH артериальной крови человека (при 37°С) колеблется в пределах от 7,37 до 7,43, составляя в среднем 7,40. Необходимо уточнить, что эти значения характерны для плазмы крови (стеклянный электрод, погруженный в кровь, соприкасается именно с плазмой). В эритроците величину pH измерить трудно. Как было установлено, внутри эритроцита она составляет примерно 7,2-7,3, т. е. отличается от pH плазмы. Как правило, термин «pH крови» относится к pH плазмы.
Характерная для крови человека слабощелочная реакция поддерживается в очень узких пределах, несмотря на постоянно изменяющееся поступление в кровь кислых продуктов метаболизма. Такое постоянство чрезвычайно важно для правильного протекания обменных процессов в клетках, так как деятельность всех ферментов, участвующих в метаболизме, зависит от pH. При патологических сдвигах pH крови активность разных ферментов изменяется в разной степени, и в результате точное взаимодействие между реакциями обмена может нарушиться. В регуляции кислотно-щелочного равновесия (т. е. в поддержании постоянства pH крови) участвует несколько механизмов. К ним относятся буферные свойства крови, газообмен в легких и выделительная функция почек.
Буферные свойства крови
Общее понятие о буферных системах. Прежде всего необходимо вспомнить, что реакции диссоциации слабой кислоты НА на ионы водорода Н+ и сопряженное основание А− подчиняются закону действующих масс. Кинетику таких реакций описывает уравнение
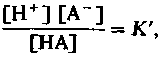 (13)
(13)618 ЧАСТЬ VI. ДЫХАНИЕ
где величины, приведенные в квадратных скобках,молярные концентрации веществ, участвующих в реакции; К'-константа равновесия, или диссоциации (знак ' означает, что данная величина вычислена с учетом особых параметров раствора, например ионной силы). Если содержание ионов Н+ повышается, то для сохранения равновесия в соответствии с законом действующих масс должна увеличиваться и концентрация недиссоциированной кислоты. Это означает, что степень диссоциации кислоты несколько уменьшается, и происходит связывание свободных ионов Н + , добавленных в раствор. В результате pH изменяется меньше, чем следовало бы ожидать, исходя из количества добавленных ионов Н + . Столь же незначительные сдвиги pH происходят и при снижении [Н+]. Нивелировка влияния добавленных в раствор ионов Н* или ОН~ называется буферным эффектом.
Для количественной оценки буферного эффекта можно прологарифмировать уравнение (13) и взять отрицательные логарифмы всех величин:
(И)
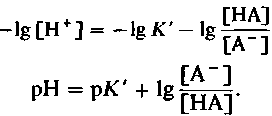 (15)
(15)Подобное уравнение для буферных систем, выведенное из закона действующих масс, называется уравнением Гендерсона-Гассельбальха. Величина рК', так же как и К',-константа, характеризующая свойства системы (рК'= —lg К'). Уравнение (15) можно представить в следующем виде:
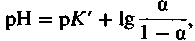 (16)
(16)где
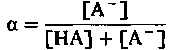
Величина а, называемая степенью диссоциации, равна отношению концентрации сопряженного основания [А−] к сумме концентраций кислоты и основания ([НА] + [А−]). Кривая, представленная на рис. 22.11, отражает зависимость между степенью диссоциации α и pH буферного раствора. Из этой кривой видно, что степень диссоциации может изменяться лишь в ограниченных пределах pH, равных рК' ±2. Буферные свойства раствора проявляются лишь в этих пределах pH.
Показателем способности системы, состоящей из слабой кислоты и сопряженного основания, создавать буферный эффект служит буферная емкость величина, равная соотношению между количеством ионов Η + или ОН−, добавленных в раствор, и изменением pH. Буферная емкость наиболее высока в области крутого наклона буферной кривой и мак-
симальна при pH = рК' (рис. 20.11). Таким образом, буферная емкость раствора зависит от его концентрации и от разницы между ρ Η и рК' этого раствора.
Бикарбонатный буфер. Из имеющихся в крови буферных систем рассмотрим прежде всего бикарбонатную систему. Она включает относительно слабую угольную кислоту, образующуюся при гидратации СО2, и бикарбонат в качестве сопряженного основания:
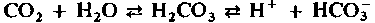 • (Π)
• (Π)Уравнение Гендерсона-Гассельбальха для суммарной реакции имеет следующий вид:
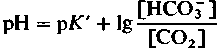 (18)
(18)Величину [СО2] можно заменить величиной напряжения СО2 (РСо ):
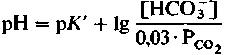 (19)
(19)Размерность коэффициента 0,03 - это ммоль x л−1 x мм рт.ст.−1, поэтому его можно использовать лишь тогда, когда [HCO3−] выражена в единицах ммоль/л, а РCO2 - в мм рт.ст.
При ионной силе плазмы рК' составляет 6,1. Казалось бы. при таком различии между рК' и pH крови (7,4) емкость бикарбонатного буфера должна быть невелика. Однако на самом деле бикарбонатная система играет большую роль в создании общей буферной емкости крови, так как буферный эффект этой системы существенно увеличивается благодаря ее тесной связи с дыханием. Механизмы, направленные на поддержание напряжения СО2 в артериальной крови (40 мм рт. ст.), способствуют созданию высокой концентрации НСО3− в плазме (24 ммоль/л). Иными словами, регулируя напряжение СО2 в крови, дыхательная система обеспечивает высокое содержание компонентов буферной системы. Кроме того, органы дыхания вместе с бикарбонатным буфером образуют «открытую систему», в которой напряжение СО2 (а следовательно, и pH крови) может регулироваться путем изменения вентиляции легких.
Фосфатный буфер. В фосфатной буферной системе, образованной неорганическими фосфатами крови, роль кислоты играет одноосновный фосфат Н2РО4− , а роль сопряженного основания-двухосновный фосфат НРО24−. Величина рК' фосфатного буфера (6,8) сравнительно близка к pH крови, однако емкость данного буфера невелика по причине низкого содержания фосфата в крови.
Белковый буфер. Буферные свойства белков кро-
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 619
ви обусловлены способностью аминокислот ионизироваться. Концевые карбокси- и аминогруппы белковых цепей играют в этом отношении незначительную роль, так как таких групп мало и их рК' существенно отличаются от pH крови. Значительно больший вклад в создание буферной емкости белковой системы вносят боковые группы, способные ионизироваться, и особенно имидазольное кольцо гистидина. К буферным белкам относятся как белки плазмы (в частности, альбумин), так и содержащийся в эритроцитах гемоглобин. На долю последнего приходится большая часть буферной емкости белковой системы, что связано как со значительной концентрацией гемоглобина, так и с относительно высоким содержанием в нем гистидина.
Особенно наглядно роль гемоглобина в создании буферной емкости крови можно показать, если сравнить сдвиги pH в ллазме и цельной крови, вызываемые одинаковыми изменениями напряжения СО2. Результаты такого сравнения удобно представить в виде графика зависимости pH от [HCO3− ], на который нанесены кривые для постоянного напряжения СО2, рассчитанные в соответствии с уравнением Гендерсона-Гассельбальха [уравнение (19)]. Измерив при разных значениях напряжения СО2 pH и содержание HCO3− в плазме и в цельной крови, где происходит обмен ионов между плазмой и эритроцитами, строят так называемые равновесные кривые СО2 для изолированной плазмы и цельной крови (рис. 22.12). Чем круче наклон кривой для цельной крови, тем больший вклад вносит в буферную емкость крови гемоглобин, и чем больше угол наклона кривой буферной емкости, тем меньше изменения pH при данном увеличении или уменьшении напряжения СО2 .
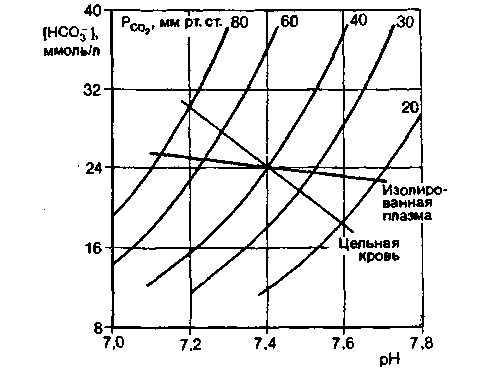 |
| Рис. 22.12. Равновесные кривые СО2 для изолированной плазмы и цельной крови. По оси ординат -содержание в плазме бикарбоната, по оси абсцисс pH. Приведены также кривые для постоянного напряжения СО2. Поскольку в цельной крови между плазмой и эритроцитами происходит обмен ионами, буферная емкость плазмы добавляется к буферной емкости гемоглобина и наклон соответствующей равновесной кривой становится круче |
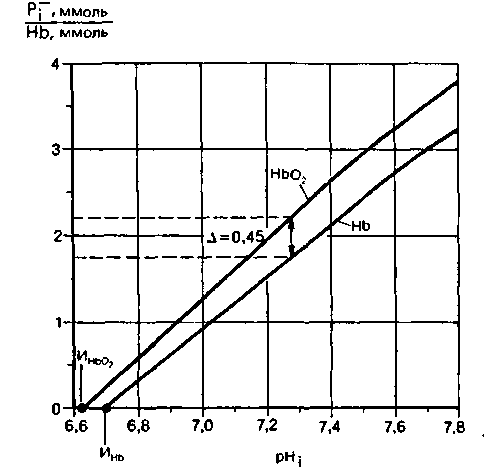 |
| Рис. 22.13. Буферные кривые для недиффундирующих буферных систем эритроцита на основе гемоглобина (при незначительном участии АТР и 2,3-ДФГ) (по [19] с изменениями). По оси ординат-отношение содержания недиффундирующих буферных анионов Pi к содержанию гемоглобина; по оси абсцисс-pH внутри эритроцита. ИHbO2 и ИHb изоэлектрические точки. Благодаря тому что буферная кривая для Hb смещена вправо относительно буферной кривой для НbО2. при полной деэоксигенации гемоглобина 1 ммоль Hb может дополнительно связывать 0,45 ммоль Н+ без изменения ρΗ внутри эритроцита |
Гемоглобин играет также важную роль в буферной емкости крови благодаря изменению его кислотных свойств при оксигенации и дезоксигенации. Эта зависимость выражена на рис. 22.13, где приведены буферные кривые (кривые титрования) для недиффундирующих буферных систем эритроцита на основе гемоглобина в оксигенированном и дезоксигенированном состояниях. Видно, что в физиологическом диапазоне pH оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Такая разница обусловлена главным образом влиянием кислорода, связанного с железом, на связывание Н + соседними имидазольными группами гистидина. Благодаря этому влиянию гемоглобин, освобождая в тканях кислород, приобретает большую способность к связыванию ионов Η+, образующихся при одновременном поглощении СО2. При поглощении кислорода кровью в легких происходят обратные процессы. Таким образом, обмен О2 усиливает буферный эффект гемоглобина.
Буферные основания. Буферные свойства крови обусловлены суммарным эффектом всех анионных
620 ЧАСТЬ VI. ДЫХАНИЕ
групп слабых кислот; важнейшими из них являются бикарбонат и анионные группы белков («протеинаты»). Все эти анионы, обладающие буферными эффектами, называют буферными основаниями (по международной номенклатуре-buffer bases, BB) [10].
На рис. 22.14 приведены концентрации различных ионов в плазме, эритроцитах и цельной крови человека (для артериальной крови). Высота столбиков пропорциональна концентрации ионов. Верхняя часть столбиков, относящихся к анионам, соответствует буферным основаниям (темно-красный цвет), а нижняя часть-всем анионам сильных кислот (кроме Сl−), не обладающих буферными свойствами, таким как SO42− и органические анионы (обозначенные вместе Х~). Из рисунка видно, что в плазме основную часть буферных оснований составляют ионы НСО3− , а в эритроцитах-протеинаты. В цельной крови более чем 1/3 всех анионов обладают буферным действием.
Концентрация буферных оснований в артериальной крови составляет примерно 48 ммоль/л. Очень важно, что эта величина не изменяется при сдвигах напряжения СО2. Рассмотрим причины такого постоянства. Предположим, например, что напряжение СО2 возрастает. При этом образуются равные количества Н+ и HCO3−. Ионы Н+ почти полностью связываются протеинатами, переходящими при этом в недиссоциированную форму. В результате концентрация протеинатов снижается настолько, насколько увеличивается концентрация бикарбоната (рис. 22.15).
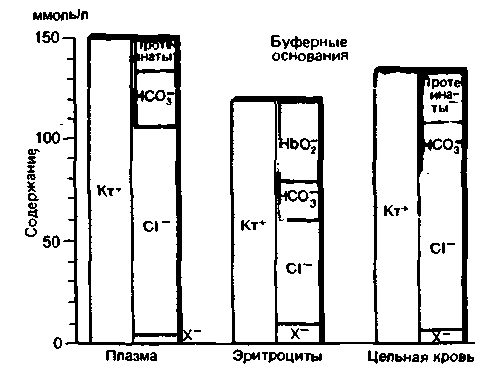 |
| Рис. 22.14. Содержание ионов в плазме, эритроцитах и цельной крови. К буферным основаниям относятся анионы буферных систем (темно-красный столбик); фосфаты не изображены, так как их содержание очень низко. Х− - анионы всех сильных кислот, не обладающих буферными свойствами, за исключением Cl−; Kt+ -суммарная концентрация катионов |
 |
| Рис. 22.15. Зависимость концентраций протеинатов и бикарбоната от РСO2 . Суммарное содержание двух буферных оснований остается постоянным (в норме48 ммоль/л) |
Подобные концентрационные сдвиги в буферных системах не взаимоуравновешиваются полностью, так как некоторые протоны остаются в свободной форме, изменяя тем самым pH. Так, если PCO2 возрастает от 40 до 50 мм рт. ст., то pH внутри эритроцитов снижается на 0,06, а в плазме- на 0,1. Это означает, что концентрация ионов Н+ увеличивается примерно на 10−5 ммоль/л. Однако этот сдвиг очень мал и не влияет на характер графика, приведенного на рис. 22.15.
Поскольку суммарная концентрация буферных оснований крови не зависит от РCO2 , по ней можно судить о сдвигах кислотно-щелочного равновесия, вызванных увеличением или уменьшением содержания нелетучих кислот в крови. Отклонение концентрации буферных оснований от нормального уровня (48 ммоль/л) называется избытком оснований (по международной номенклатуре-base excess, BE). Таким образом, в норме BE по определению равен нулю. При патологическом увеличении содержания буферных оснований BE становится положительным, а при снижении - отрицательным. В последнем случае можно использовать термин «дефицит оснований», так как выражение «отрицательный избыток оснований» с семантической точки зрения бессмысленно.
Механизмы регуляции pH
Вклад дыхательной системы. Одна из функций дыхательной системы состоит в удалении СО2 - конечного продукта метаболизма, образующегося в больших количествах. В состоянии покоя организм выделяет 230 мл СО2/мин, или около 15 тыс. ммоль в сутки. В то же время при удалении из крови «летучего» ангидрида угольной кислоты в ней исчезает примерно эквивалентное число ионов Н + . Таким образом, дыхание играет чрезвычайно
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 621
важную роль в поддержании кислотно-щелочного равновесия.
Особое значение для компенсации сдвигов в кислотно-щелочном равновесии имеет регуляция дыхания. Так, если в результате нарушений обмена кислотность крови увеличивается, то повышение содержания Н+ приводит к возрастанию легочной вентиляции (гипервентиляции); при этом молекулы СО2, образующиеся в реакции HCO3− + Н+ → Н2СО3 → → Н2О + СО2, выводятся в большом количестве, и pH возвращается к нормальному уровню. Напротив, увеличение содержания оснований сопровождается гиповентиляцией; в результате напряжение СО2 и концентрация ионов Н+ возрастают, и сдвиг реакции крови в щелочную сторону частично или полностью компенсируется.
Роль почек. Кроме легких в регуляции кислотнощелочного равновесия участвуют почки. Их функция состоит в удалении нелетучих кислот, главным образом серной кислоты. Почки должны удалять в сутки 40-60 ммоль ионов Н + , накапливающихся за счет образования нелетучих кислот. Если содержание таких кислот возрастает, то при нормальном функционировании почек выделение Н+ с мочой может значительно увеличиваться. В результате pH крови возвращается к нормальному уровню. Напротив, при повышении pH выведение почками Н + уменьшается, что также способствует поддержанию кислотно-щелочного равновесия.
Процесс выделения ионов Η + осуществляется в почечных канальцах при взаимодействии канальцевого фильтрата, клеток канальцев и капиллярной крови. В канальцевой моче большая часть ионов Н+ связывается с НРО24− и ΝΗ3, и лишь небольшое их количество выделяется с мочой в виде свободных протонов. Происходящие при этом химические превращения и обменные процессы приводят к обратному поступлению ионов HCO3− в кровь.
Ацидоз и алкалоз. При ряде патологических состояний в крови накапливаются такие большие количества кислот или оснований, что описанные выше регуляторные механизмы (буферные системы крови, дыхательная и выделительная системы) уже не могут поддерживать pH на постоянном уровне. В зависимости от того, в какую сторону изменяется реакция крови, различают два типа нарушений кислотно-щелочного равновесия. Понижение pH крови по сравнению с нормальным уровнем (pH < 7,37) называется ацидозом, а повышение (pH > 7,43)алкалозом. Каждый из этих двух типов подразделяется еще на несколько разновидностей в зависимости от причины сдвига pH. Такие сдвиги могут наступать при изменениях вентиляции легких (поражения легких могут сопровождаться увеличением напряжения СО2 в крови, а гипервентиляция приводит к снижению этого напряжения). Подобные состояния называют дыхательным (респираторным)
ацидозом или алкалозом. При нарушениях обмена веществ (например, при сахарном диабете) в крови могут накапливаться нелетучие кислоты; напротив, поступление в кровь оснований или потеря HCl (при рвоте) могут сопровождаться уменьшением содержания этих кислот. Такие состояния называют метаболическим ацидозом или алкалозом. Поскольку pH крови может изменяться также при поражениях почек, сдвиги кислотно-щелочного равновесия, обусловленные почечными или обменными нарушениями, объединяют под названием нереспираторный ацидоз или алкалоз.
Критерии первичных нарушений кислотно-щелочного равновесия. Признаками, позволяющими отличить респираторные нарушения кислотно-щелочного равновесия от нереспираторных, служат напряжение СО2 (РCO2 ) в крови и избыток оснований (BE). Для респираторных нарушений характерно повышение или понижение РCO2 без предварительного изменения концентрации буферных оснований (BE = 0). Напротив, при нереспираторных нарушениях РCO2 вначале не изменяется, тогда как BE сдвигается в ту или иную сторону. Если содержание нелетучих кислот в крови повышается (метаболический ацидоз), то эти кислоты связывают некоторое количество буферных оснований (наступает дефицит оснований); при понижении же содержания
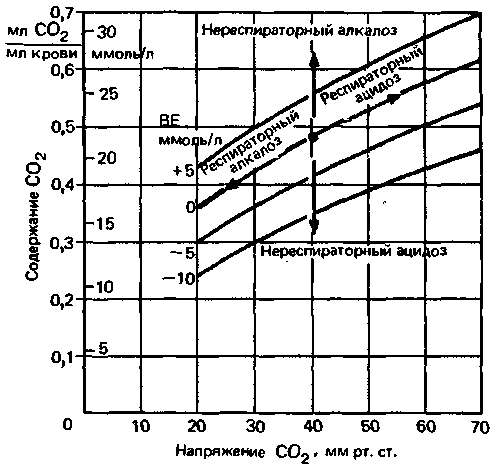 |
| Рис. 22.16. Сатурационные кривые С02 для различных значений избытка оснований (BE). Нереспираторные (метаболические) нарушения кислотно-щелочного равновесия приводят к сдвигу этих кривых и вследствие этого к существенным изменениям общего содержания С02 в крови. При нарушениях дыхания зависимость содержания С02 от его парциального давления описывается кривой для случая BE = 0 |
622 ЧАСТЬ VI. ДЫХАНИЕ
этих кислот (метаболическом алкалозе) концентрация буферных оснований возрастает (положительный BE).
Нереспираторные нарушения оказывают заметное влияние на содержание СО2 в крови, так как они связаны с изменениями [HCO3−]. Этот эффект хорошо иллюстрируют сатурациониые кривые СО2 для разных значений избытка оснований (BE) (рис. 22.16). В случае нереспираторного ацидоза (дефицит оснований) кривая сдвигается в сторону уменьшения содержания СО2, а при нереспираторном алкалозе в противоположную сторону. Напротив, при респираторном нарушении не происходит предварительного изменения формы или положения сатураиионной кривой СО2.
Отличительные признаки четырех типов нарушений кислотно-щелочного равновесия суммированы на рис. 22.17. По оси ординат отложен избыток оснований, а по оси абсцисс - pH. Приведены кривые для постоянных значений напряжения СО2. Нормальные диапазоны pH, BE и РCO2 ограничены красными линиями. Таким образом, области слева от белой вертикальной полосы соответствуют ацидозу, а справа - алкалозу. Красные полосы помечены в соответствии с типом респираторных и нереспираторных нарушений (типы указаны). Причину и тип нарушения кислотно-щелочного равновесия в конкретном случае можно определить, найдя точку, соответствующую значениям BE и pH. Так, если
 |
| Рис. 22.17. Схема первичных нарушений кислотно-щелочного равновесия и путей их компенсации. Красные линии ограничивают нормальные пределы BE, pH и РСO2. Заштрихованная область соответствует нормальному кислотно-щелочному равновесию; стрелки с буквой а указывают первичные нарушения кислотно-щелочного равновесия; стрелки с буквой б-включение компенсаторных механизмов |
(в артериальной крови) BE = 0 ммоль/л. а РCO2 = = 60 ммрт. ст., то это респираторный ацидоз; если же BE =—15 ммоль/л, а РCO2 = 40 мм рт. ст., то это указывает на метаболический (точнее, нереспираторный) ацидоз.
Компенсация первичных нарушении кислотно-щелочного равновесия. Во многих случаях первичные нарушения кислотно-щелочного равновесия могут быть более или менее быстро скомпенсированы, т. е. в ответ на изменения pH в ту или иную сторону включаются механизмы, восстанавливающие нормальное значение этого параметра (или хотя бы уменьшающие сдвиг). Все эти механизмы уже были нами рассмотрены (с. 621):
- Первичные нереспираторные нарушения кислотно-щелочного равновесия компенсируются за счет изменения вентиляции легких. В случае же, если они обусловлены метаболическими причинами, дополнительно включаются почечные механизмы компенсации.
- Первичные респираторные нарушения компенсируются почечными механизмами, направленными на изменение выделения Н+ или задержки НСО3−.
Все эти варианты проиллюстрированы на рис. 22.17. Рассмотрим прежде всего первичный нереспираторнын ацидоз (стрелка 1а). По мере накопления в крови нелетучих кислот содержание буферных оснований снижается, и pH падает. Уменьшение pH приводит к гипервентиляции, вследствие чего напряжение СО2 в крови уменьшается. Этот компенсаторный эффект отражен на схеме (стрелка 1б). Если в результате снижения РCO2 pH крови возвращается к нормальному уровню, то можно говорить о полностью компенсированном нереспираторном ацидозе. Если же, несмотря на уменьшение РCO2 , pH остается пониженным, то имеет место не полностью (частично) компенсированный нереспираторный ацидоз. При нереспираторном алкалозе (стрелка 2а) увеличение содержания буферных оснований компенсируется за счет увеличения РCO2 , вызванного гиповентиляцией (стрелка 2б). Однако степень снижения вентиляции в этом случае лимитируется потребностью организма в кислороде, поэтому такая компенсация обычно бывает неполной. При первичном респираторном ацидозе (стрелка 3а), обусловленном, например, нарушениями функции легких, повышается напряжение СО2 в крови. В ответ на это спустя определенный латентный период включается почечный механизм задержки оснований. В результате содержание буферных оснований в крови повышается, и pH возвращается к нормальному уровню (стрелка 3б). Напротив, при первичном респираторном алкалозе (стрелка 4а), характеризующемся понижением РCO2 , восстановление нормальной величины pH происходит за счет компенса-
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 623
торного снижения содержания буферных оснований (стрелка 46).
Оценка кислотно-щелочного равновесия
Диагностические критерии. Оценка кислотно-щелочного равновесия имеет большое значение в клинической практике. Для такой оценки необходимо измерить ряд показателей, позволяющих выявить у больного ацидоз либо алкалоз и судить о том, является ли он респираторным или нереспираторным. Заключение о состоянии кислотно-щелочного равновесия позволяет выбрать правильное лечение [4, 5, 8, 10]. Необходимо измерить следующие показатели артериальной крови.
- pH. По величине pH можно судить о том, является содержание ионов Η + в крови нормальным (pH 7,37-7,43) или сдвинуто в ту либо иную сторону. В то же время нормальное значение pH еще не позволяет с уверенностью говорить об отсутствии нарушения кислотно-щелочного равновесия, так как в этом случае нельзя исключить компенсированный ацидоз либо алкалоз.
- РСО2 . Повышение или снижение напряжения СО2 по сравнению с его нормальным уровнем (35-45 мм рт. ст.) служит признаком респираторного нарушения кислотно-щелочного равновесия.
- Избыток оснований (BE). По величине BE можно сделать вывод о наличии нереспираторного нарушения кислотно-щелочного равновесия. Изменения этой величины (норма от —2,5 до + 2,5 ммоль/л) непосредственно отражают снижение или увеличение содержания нелетучих кислот в крови.
4. Стандартный бикарбонат. В качестве показателя нереспираториого нарушения кислотно-щелочного равновесия иногда используют так называемый «стандартный бикарбонат». Эта величина соответствует содержанию бикарбоната в плазме крови, полностью насыщенной кислородом и уравновешенной с газовой смесью (РСО2 = = 40 мм рт. ст.) при 37 oC. В норме «стандартный бикарбонат» равен 24 ммолъ/л. Этот показатель не отражает буферный эффект белков, поэтому он сравнительно малоинформативен.
В табл. 22.3 приведена сводка первичных и вторичных изменений трех основных параметров, по совокупности которых можно сделать окончательное заключение о состоянии кислотно-щелочного равновесия.
Методы оценки кислотно-щелочного равновесия.
Общепризнанным методом оценки кислотно-щелочного равновесия служит методом Аструпа. при котором одновременно с показателями этого равновесия в крови определяют напряжение СО2 [10]. Прежде всего две порции исследуемой крови приводят в равновесие с двумя газовыми смесями из-
| Таблица 22.3. Изменения основных параметров кислотно-щелочного равновесия при его нарушениях. Двойные стрелки - направления первичных сдвигов; тонкие стрелки-направления вторичных компенсаторных сдвигов (  -повышение; -повышение;  снижение) снижение) | |||
| | pH | BE | 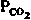 |
| Нереспираторный ацидоз Нереспираторный алкалоз Респираторный ацидоз Респираторный алкалоз |  |  |  |
в
 естного состава, различающимися по парциальному давлению СО2. Измеряют pH в каждой порции крови. При этом получают два набора значений pH и РСО2 и наносят их в виде двух точек на предварительно построенный график (рис. 22.18). Прямая, проходящая через две точки (А и Б), отражает состояние кислотно-щелочного равновесия крови. Затем измеряют pH артериальной крови
естного состава, различающимися по парциальному давлению СО2. Измеряют pH в каждой порции крови. При этом получают два набора значений pH и РСО2 и наносят их в виде двух точек на предварительно построенный график (рис. 22.18). Прямая, проходящая через две точки (А и Б), отражает состояние кислотно-щелочного равновесия крови. Затем измеряют pH артериальной крови 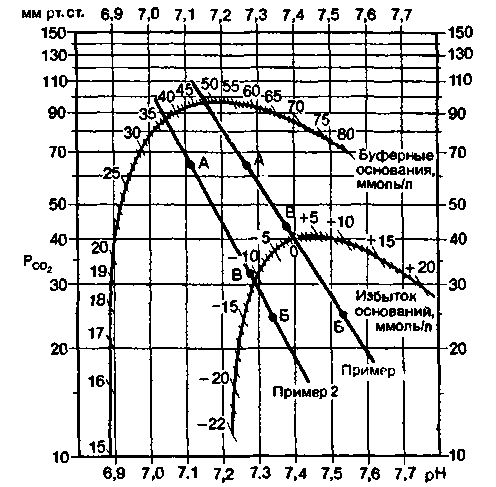 |
| Рис. 22.18. Номограмма для определения напряжения С02 и оценки кислотно-щелочного равновесия по методу Аструпа [10]. Координаты точек А и Б определяют путем измерения pH крови, уравновешенной с газовыми смесями, значения РCO2 в которых известны. На прямой, соединяющей две эти точки, находят точку В, соответствующую фактическому pH крови. По проекции точки В на ось ординат находят фактическое значение Рсо2 . Для определения величины BE продолжают прямую АБ до пересечения со шкалой избытка оснований. Пример 1 (красная прямая): РСО2 = 44 мм рт. ст., pH 7,37. BE = 0 ммоль/л; диагноз-нормальное кислотно-щелочное равновесие. Пример 2 (черная прямая): Рсо2 = = 32 мм рт. ст., pH 7.28, BE = — 11 ммоль/л; диагнозчастично компенсированный нереспираторный ацидоз |
624 ЧАСТЬ VI. ДЫХАНИЕ
больного и находят на полученной прямой точку, соответствующую измеренной величине pH (В). По проекции этой точки на ось ординат узнают фактическое напряжение С02 в крови. По точкам пересечения прямой с соответствующими осями определяют концентрацию буферных оснований и избыток оснований. Так, красная прямая на рис. 22.18 соответствует нормальному состоянию кислотно-щелочного равновесия, а черная-нереспираторному ацидозу (BE =—ll ммоль/л), частично компенсированному за счет снижения напряжения СО2 (РCO2 = = 32 мм рт. ст.; точка В на черной кривой).
В последнее время появилась возможность непосредственно измерять напряжение СО2 в небольшом объеме крови при помощи полярографических электродов (с. 593). Поскольку, имея значения РCO2 и pH, можно определить BE (третий показатель, используемый при оценке кислотно-щелочного равновесия), при этом способе не требуется уравновешивать кровь с газовой смесью [28]. На рис. 22.19 приведены номограммы для определения BE по величинам pH и РCO2 .
Порядок работы с этими номограммами состоит в следующем. На шкалах РCO2 и pH находят точки,
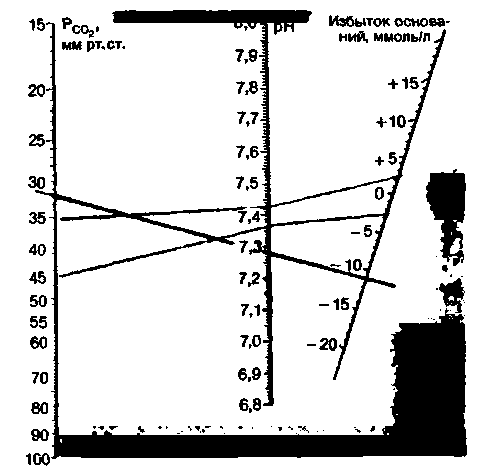 |
| Рис. 22.19. Номограмма для определения BE при непосредственном измерении РСO2 и pH. По шкалам Рс02 и pH находят точки, соответствующие измеренным значениям этих показателей. Через эти точки проводят прямую до пересечения с правой шкалой; в точке пересечения читают величину BE крови. Красные линии соответствуют пределам нормального кислотно-щелочного равновесия. Пример (черная прямая): Рсс,2 = = 32 мм рт. ст., pH 7,28; отсюда BE = —11 ммоль/л. Диагноз-частично компенсированный нереспираторный ацидоз [29] |
соответствующие измеренным значениям этих показателей. Через эти точки проводят прямую линию и по точке ее пересечения со шкалой BE определяют избыток оснований. Так, в примере, приведенном на рис. 22.19, РCO2 =32 мм рт. ст. и pH 7,28; отсюда BE = — 11 ммоль/л. Следовательно, у больного имеет место частично компенсированный нереспираторный ацидоз (как в примере 2 на рис. 22.18).
22.5. Литература
Учебники и руководства
- Antonini Е., Brunori M. Hemoglobin and myoglobin in their reactions with ligands. Amsterdam. North Holland, 1971.
- Baumann R., Bartels Η., Bauer С. Blood oxygen transport. In: Fahri L. E., Tenney S. M. (eds.). Handbook of Physiology, Sect. 3: The Respiratory System, Vol. IV. Bethesda. Amer. Physiol. Soc, 1987.
- Coburn R. F., Forman H. J. Carbon monoxide toxicity. In: Fahri L. K, Tenney S. M. (eds.). Handbook of Physiolofy, Sect. 3: The Respiratory System, Vol. IV. Bethesda. Amer. Physiol. Soc, 1987.
- Hills A. G. Acid-base balance: chemistry, physiology, pathophysiology. Baltimore. Williams and Wilkens, 1973.
- Kildberg P. Clinical acid-base physiology. Baltimore. Williams and Wilkens, 1968.
- Klocke R. A. Carbon dioxide transport. In: Fahri L. E., Tenney S. M. (eds.). Handbook of Physiology, Sect. 3. The Respiratory System, Vol. IV. Bethesda. Amer. Physiol. Soc, 1987.
- Lungo L. O. Respiratory gas exchange in the placenta. In: Fahri L. E., Tenney S. M. (eds.). Handbook of Physiology, Sect. 3. The Respiratory System, Vol. IV. Betehesda, Amer Physiol. Soc, 1987.
- Masoro E. J., Siegel P. D. Acid-base regulation. Its physiology and pathophysiology. Philadelphia-London-Toronto. Saunders, 1971.
- Severinghaus J. W. Blood gas concentrations. In: Handbook of Physiology, Respiration II. Washington, Amer. Physiol. Soc, 1965.
- Siggaard-Andersen O. The acid-base status of the blood. Copenhagen. Munksgaard, 1974.
- Weissbluth M. Hemoglobin: Cooperativity and electronic properties. Berlin-Heidelberg- New York. Springer, 1974.
12 WoodS.C. Lenfant С Phylogeny of the gas-exchange system: red cell function. In: Fahri L. E.. Tenney S. M. (eds.). Handbook of Physiology, Sect. 3. The Respiratory System, Vol. IV. Bethesda. Amer Physiol. Soc, 1987.
Оригинальные статьи и обзоры
- Adair G. S. The hemoglobin system. VI. The oxygen dissociation curve of hemoglobin. J. Biol. Chem., 63, 529 (1925).
- Bauer С On the respiratory function of haemoglobin. Rev. Physiol. Biochem. Pharmacol., 70, 1 (1974).
- Bauer C, Gros G., Bartels Η. (eds.). Biophysics and physiology of carbon dioxide. Berlin-Heidelberg-New York. Springer, 1980.
- Benesch R.E., Benesch R. Yu, C.I. The oxygenation of hemoglobin in the presence of 2,3-diphosphoglycerate. Effect of temperature, pH, ionic strenght and hemoglobin concentration. Biochemistry, 8, 2567 (1969).
- Braunitzer G. The molecular weight of human haemoglobin. Bibl. heamat. (Basel), 18, 59 (1964).
- Braunitzer G., Hilse K., RudloffV., Hilschman N. The hemoglobins. Adv. Protein. Chem., 19, 1 (1964).
ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 625
- Brodda К. Zur Theorie des Saure-Basen-Haushaltes von menschlichem Blut. Akadem. Wiss. Lit. Mainz; Wesbaden. Steiner, 1975.
- Christiansen J., Douglas С £?., Haidane J. S. The absorption and dissociation of carbon dioxide by human blood. J. Physiol., XLVIII, 244 (1914).
- Fischer W.M., Vogel H.R., Thews G. O2 and CO2 exchange in the human placenta. In: Lubbers D.-W., Luftll.C., Thews G., Witzlet Ε. Oxygen transport in blood and tissue. Stuttgart. Thieme, 1968.
- Kilmartin J. V, Rossi-Bernardi L. Interactions of hemoglobin with hydrogen ions, carbon dioxide, and organic phosphates. Physiol. Rev., 53, 836 (1973).
- King E. J., Gilchrist M. Determination of haemoglobin by a cyanhaematin method. Lancet. II, 201 (1947).
- Maren Т.Н. Carbonic anhydrase: Chemistry, physiology, and inhibition. Physiol. Rev., 47, 595 (1967).
- Merlet-Benichau E., Sinet M., Blayo M. C. Gaudebout С Oxyden-combining capacity in dog. In vitro and in vivo determination. Respir. Physiol., 21, 87 (1974).
- Perutz M. F. The hemoglobin molecule. Proc. Roy. Soc, B, 173, 113(1969).
- Perutz M. F. Stereochemistry of cooperative effects in haemoglobin, Nature, 228, 726 (1970).
- Thews G. Ein Nomogramm fur die O2-Abhängigkeit des Säure-Basen-Status im menschlichen Blut. Pflügers Arch, ges. Physiol., 296, 212 (1967).
- Thews G. (ed.). Nomogramme zum Säure-Basen-Status des Blutes und zum Atemgastransport. Berlin-Heidelberg-New York. Springer, 1971.
