Биологические основы создания пробиотиков направленного действия для медицины, сельского хозяйства и перерабатывающей промышленности 03. 00. 07 микробиология
| Вид материала | Автореферат |
- Доклад представлен субъектом бюджетного планирования департаментом сельского хозяйства, 907.28kb.
- Предварительная программа Геленджик 2011, 162.16kb.
- Министерство сельского хозяйства Российской Федерации, 304.33kb.
- экономическая эффективность технического обслуживания, 975.83kb.
- ru/lib/evolution, 1461.52kb.
- Департамент сельского хозяйства и перерабатывающей промышленности краснодарского края, 455.69kb.
- Инструменты реформирования институционально-хозяйственной подсистемы птицеводства апк, 366.24kb.
- Николаева Людмила Васильевна, заведующий складом запасных частей и материалов открытого, 53.63kb.
- Уважаемые Сокто Бальжинимаевич, Алексей Геннадьевич, 337.46kb.
- Предприятия сельского хозяйства и перерабатывающей промышленности; научно-исследовательские, 36.56kb.
Исследование состава биосурфактантов, продуцируемых молочнокислыми бактериями и их антимикробная, противоопухолевая и противолучевая активности
Выделение липидов из молочнокислых бактерий проводили по методу Кейтса.
С помощью стандартного фосфованилинового реактива и эталонного раствора (Lachema) установлено, что в 1 грамме сухой биомассы молочнокислых бактерий содержится от 5,7 до 13,4 мг общих липидов. Содержание триглицеридов, определенных по реакции с метилацетатом и аммониевыми солями – желтый 3,5-диметил-1,4-дигидролутидин (Lachema), составляет от 1,6 до 3,0 мг на 1 г сухой биомассы.
Методом тонкослойной хроматографии на силуфоле с использованием качественных реакций выявлено наличие в исследуемых штаммах молочнокислых бактерий (L. plantarum, L. brevis, L. salivarius, L. curvatus, L. acidophilus) основных классов биосурфактантов: нейтральные липиды, фосфолипиды и гликолипиды, липопептиды.
Установлена зависимость количественного содержания липидов и их качественного состава в биомассе и культуральной жидкости бактерий от соотношения углерода и азота в питательной среде. У большинства молочнокислых бактерий при уменьшении вдвое содержания азота происходит увеличение количества общих липидов в биомассе, в то время как в культуральной жидкости содержание их уменьшается. Так, например, в 1 г сухой биомассы L. brevis содержится общих липидов 7,34 мг при выращивании культуры на среде с соотношением углерода и азота 1:1, при соотношении 1:2 – 8,43, а при 1:0,5 – 9,96 мг. При этом в липидах первого варианта содержится 10,9% триглицеридов, второго – 3,4%, третьего – 4%,содержание углеводов – 8,2-4,6 – 4,0%, соответственно. В культуральной жидкости данного штамма содержится общих липидов 6,4 мг/л, 4,1 мг/л и 3,4 мг/л при соотношении углерода и азота 1:1, 1:2 и 1:0,5, соответственно. Данные липиды не содержат триглицериды, количество углеводов по вариантам составляет 5,3; 14,5; 21,9%, соответственно.
Установлено, что увеличение фосфора в питательной среде в два раза приводит к снижению содержания общих липидов в биомассе штаммов L. brevis, L. salivarius, L. acidophilus, P. shermanii 5.Так у L. acidophilus при соотношении углерода и фосфора 1:1 содержание липидов составило 3,20 мг/г сухой биомассы, а при 1:2 – 1,48 мг/г, у штамма L. brevis – при соотношении углерода и фосфора 1:2 происходило уменьшение липидов с 3,22мг/г (при соотношении углерода и фосфора 1:1) до 0,90 мг/г, у L. salivarius с 4,46 до 3,52 мг/г, у P. shermanii 5 – с 6,08 до 2,91 мг/г. При уменьшении вдвое содержания фосфора в среде происходит также снижение липидов в биомассе бактерий, но не столь значительное.
У остальных штаммов изменение содержания фосфора в питательной среде привело к незначительным колебаниям в содержании липидов.
При увеличении фосфора в составе среды отмечено уменьшение процентного содержания триглицеридов в составе липидов из биомассы.
У большинства исследуемых штаммов отмечена тенденция к более низкому накоплению липидов при исключении из питательной среды мясного и дрожжевого экстрактов.
Не выявлена зависимость содержания липопептидов в биомассе и культуральной жидкости от наличия в составе питательной среды мясного и дрожжевого экстракта. Во всех вариантах выявлены липопептиды с Rf 0,94, активные в отношении E. coli, реже – S. aureus. У штамма L. curvatus и L. acidophilus липопептиды не установлены.
Таким образом, с помощью варьрования состава питательной среды можно изменять количественный и качественный состав сурфактантов молочнокислых и пропионовокислых бактерий. Эти сведения могут быть использованы при создании пробиотиков направленного действия.
При исследовании антагонистической активности установлено, что более широким спектром антимикробной активности обладают сурфактанты из культуральной жидкости. Все исследуемые сурфактанты обладали активностью в отношении Mycobacterium B-5 – от 1,75 до 0,13мг/мл, E. coli - от 1,7 до 0,13мг/мл. В отношении S. aureus активность проявили сурфактанты из L. plantarum 2 (0,76мг/мл), L. cellobiosus (0,13мг/мл), L. brevis (0,50мг/мл) и L. plantarum 8 (13мг/мл); в отношении Salmonella sp. – L. cellobiosus (1,0мг/мл), L. plantarum 8 (0,33мг/мл); в отношении P. multocida и K. pneumoniae – L. plantarum 2, L. acidophilus, L. curvatus и L. cellobiosus (0,13мг/мл), P. shermanii 5 (0,1мг/мл); в отношении Phomopsis sp. активность выявлена у сурфактантов из L. plantarum 2(0,76). Установлена противогрибковая активность у сурфактантов L. plantarum 2 в отношении C. albicans (70,3мг/мл), из L. acidophilus и L. curvatus в отношении C. albicans, F. vasinfectum (0,13мг/мл) и A. niger(0,14мг/мл), из L. cellobiosus в отношении C. albicans (0,05мг/мл) и A. niger (1,0мг/мл), из L. brevis в отношении A. niger (1,0мг/мл), из P. shermanii 5 – в отношении C. albicans (0,1мг/мл) и A. niger (1,0мг/мл).
В антимикробных комплексах молочнокислых бактерий с помощью газовой хроматографии выявлены производные пиразина и пиперазина, жирные кислоты и их производные.
О способности исследуемых культур и продуцируемых ими сурфактантов подавлять опухолеподобный рост судили по отсутствию вторичных колоний, уменьшению их числа и размеров у гриба F. bulbigenum var.blasticola – модели противоопухолевого роста.
Выявлена умеренная способность подавлять опухолевоподобный рост у нативной культуры L. plantarum 8 , высокая – у P. shermanii 5, L. cellobiosus и L. brevis, а также у сурфактантов из культуральной жидкости L. cellobiosus и биомассы L. brevis, что дает основание для испытания их противоопухолевой активности на животных. Сурфактанты из культуральной жидкости L. brevis, культуральной жидкости и биомассы P. shermanii 5 такой активностью не обладают. Противоопухолевую активность сурфактантов из культуральной жидкости и биомассы L. plantarum и биомассы L. cellobiosus определить не удалось из-за наличия у них антифунгальной активности к применяемому тесту.
Противолучевую активность молочнокислых и пропионовокислых бактерий определяли на тест-культуре E.coli, облученной УФ-лучами.
Установлено, что высокой противолучевой активностью обладают культуры L. brevis, L. cellobiosus и P. shermanii 5. Сурфактанты из биомассы L. brevis в количестве 0,5% способствовали сохранению после облучения 11,0×106 жизнеспособных клеток по сравнению с контролем 13×102, из L. brevis – 53×105 из P. shermanii 5 – 31,0×105. Сурфактанты из культуральной жидкости имели в 3 раза больший защитный эффект при облучении по сравнению с таковыми из биомассы. Нативная культура L. cellobiosus имеет наибольший защитный эффект при концентрации ее в среде 5% – 30,0×108 клеток/мл по сравнению с контролем 13,0×102. Содержание E. coli до облучения было 68,0×109. Бесклеточная культуральная жидкость данной культуры молочнокислых бактерий имела тот же эффект. Под воздействием 2% нативной культуры L. brevis число выживших клеток составило 20,0×109, культуральной жидкости – 45,0×108. Остальные исследованные культуры обладают значительно меньшей противолучевой активностью.
Для определения реактивирующего эффекта в суспензию облученных клеток E.coli добавляли 1% нативной культуры или ее супернатанта, выдерживали 30 минут, затем определяли количество жизнеспособных клеток. Установлено, что под воздействием 5% нативных культур L. brevis, L. cellobiosus и P. shermanii 5 происходит повышение числа бактериальных клеток с 2,0×103 до 3,0×109. Ассоциация из L. brevis, L. plantarum 2 и P. shermanii 5 восстанавливает жизнеспособность облученной культуры до исходного уровня – 3,0×1010.
Таким образом, в исследуемых штаммах молочнокислых бактерий (L. plantarum, L. brevis, L. salivarius, L. curvatus, L. acidophilus) выявлено наличие основных классов биосурфактантов, количественный и качественный состав которых зависит от состава питательной среды. Установлено, что более широким спектром антимикробной активности обладают сурфактанты из культуральной жидкости.
У всех исследованных культур в той или иной степени определена способность подавлять опухолеподобный рост.
У молочнокислых и пропионовокислых бактерий установлен защитный и реактивирующий эффект при облучении клеток E. coli УФ-светом. С практической точки зрения важным является факт установления не только профилактического (прединкубация), но и лечебного (постинкубация) действия нативных культур и некоторых продуцируемых ими сурфактантов.
Биологические основы создания комплексных биопрепаратов для профилактики и лечения социально значимых инфекций
В составе комплексных пробиотических препаратов наряду с молочнокислыми бактериями часто используют пребиотики, витамины, аминокислоты, лекарственные растения, однако при этом не учитывают их влияние на рост, адгезивную способность и резистентность к антибиотикам патогенных, условно-патоганных и пробиотических микроорганизмов.
Поэтому в задачу исследования входило изучение влияния пребиотиков, аминокислот, витаминов и лекарственных растений на биологическую активность патогенных, условно-патоганных и пробиотических микроорганизмов.
В процессе исследования выявлены фруктоолигосахариды и пектины, избирательно стимулирующие рост, резистентность к антибиотикам и антимикробную активность молочнокислых бактерий и отобранных нами ассоциаций, но не повышающих активность возбудителей болезни. Это лактулоза и подсолнечный пектин. Так, при использовании лактулозы в питательной среде отмечено стимулирование роста молочнокислых, пропионовокислых бактерий и их ассоциаций, за исключением штамма Б-3 (рисунок 7) и задержка роста ряда патегенных и условно-патогенных микроорганизмов (рисунок 8).
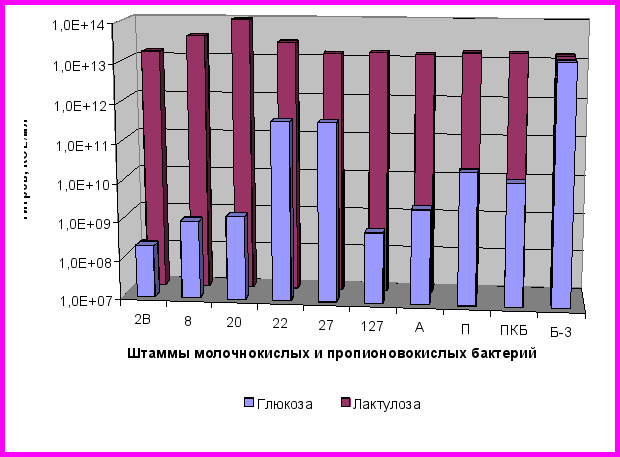
Рисунок 7 – Титры молочнокислых и пропионовокислых
бактерий и ассоциаций при росте на средах с глюкозой и лактулозой
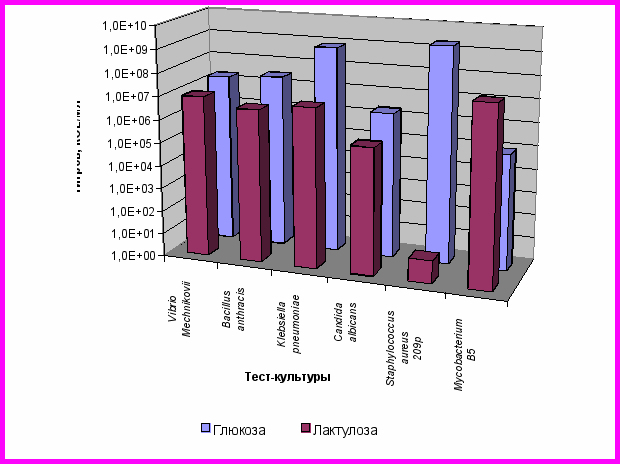
Рисунок 8 – Титры патогенных и условно-патогенных
микроорганизмов при росте на глюкозе и лактулозе
При использовании лактулозы происходит также изменение резистентности патогенных и условно-патогенных микроорганизмов к антибиотикам. Повышение устойчивости к антибиоткам произошло у вакцины Мечникова - к цефазолину и левомицетину. Снижение резистентности ко всем испытанным антибиотикам на среде с лактулозой отмечено у C. albicans, к антибиотикам гентамицину, ципрофлоксацину и линкомицину – у вакцины Ценковского, к левомицетину, ципрофлоксацину и линкомицину – у K. pneumoniae 444.
Установлено, что на подсолнечном пектине не растут патогенные и условно-патогенные микроорганизмы, но наблюдается активный рост молочнокислых и пропионовокислых бактерий. При использовании свекольного и яблочного пектинов повышается резистентность условно-патогенных и патогенных микроорганизмов к антибиотикам.
Результаты по определению антимикробной активности лекарственных растений, собранных в Алматинской области, а также приобретенных в аптеках города показали, что наиболее широким спектром действия по отношению к использованным тест-культурам обладают зверобой, розмарин, корни ревеня и солодки.
Установлено, что экстракты многих лекарственных растений влияют на резистентность патогенных и условно-патогенных микроорганизмов к антибиотикам. Например, водный экстракт зверобоя сухого повышает устойчивость клинического штамма S. аureus 12 к бисептолу, левомицетину и ципрофлоксацину. Отмечено также понижение резистентности этого штамма к бисептолу и ципрофлоксацину под влиянием спиртового экстракта розмарина и к левомицетину под воздействием спиртового экстракта из корня зверобоя сухого. Это необходимо учитывать при применении растений с лечебной целью.
Установлено, что витамины и аминокислоты по-разному влияют на отдельные патогенные, условно-патогенные и пробиотические микроорганизмы. Они могут стимулировать рост одних микроорганизмов и ингибировать других. Так, стимулирование роста под действием комплекса витаминов, состоящего из витамина В12 и фолиевой кислоты, выявлено у всех тест-культур, особенно у C. albicans, K. pneumoniae 444 , а также Е. соli.
Аминокислоты оказывают меньшее стимулирующее действие на рост патогенных и условно-патогенных микроорганизмов, чем витамины. Многие из них ингибируют рост тесг-микроорганизмов. Наибольшее ингибирующее воздействие оказывают аспарагиновая кислота и цистеин.
Показано, что испытанные витамины и аминокислоты не оказывают существенного влияния на адгезивную способность большинства тест-культур, но изменяют их резистентность к антибиотикам. Причем часто повышается резистентность к антибиотикам у патогенных и условно-патогенных микроорганизмов и снижается у пробиотических микроорганизмов.
На устойчивость тест-культур к антибиотикам витамины В1, В12, С, фолиевая кислота не оказывали существенного влияния. Комплекс витаминов, состоящий из витамина В12 и фолиевой кислоты, повышал устойчивость C. albicans к нистатину.
При добавке в питательные среды испытанных аминокислот выявлено изменение резистентности к антибиотикам у ряда штаммов молочнокислых бактерий, патогенных и условно-патогенных микроорганизмов. Например, повышение резистентности к линкомицину произошло у S. gallinarum под влиянием цистеина, треонина и аспарагиновой кислоты, у E. coli – цистеина, понижение – у ряда штаммов молочнокислых бактерий при использовании тирозина.
Полученные результаты использованы при подборе компонентного состава комплексных пробиотиков.
На основе проведенных исследований по отбору штаммов молочнокислых бактерий с широким спектром антимикробной активности, изучению ее природы и механизма действия на патогены, выявлению влияния пребиотиков, биологически активных веществ и лекарственных растений на биологическую активность патогенных, условно-патогенных и пробиотических микроорганизмов разработаны основные принципы создания пробиотиков направленного действия.
