Биологические основы создания пробиотиков направленного действия для медицины, сельского хозяйства и перерабатывающей промышленности 03. 00. 07 микробиология
| Вид материала | Автореферат |
- Доклад представлен субъектом бюджетного планирования департаментом сельского хозяйства, 907.28kb.
- Предварительная программа Геленджик 2011, 162.16kb.
- Министерство сельского хозяйства Российской Федерации, 304.33kb.
- экономическая эффективность технического обслуживания, 975.83kb.
- ru/lib/evolution, 1461.52kb.
- Департамент сельского хозяйства и перерабатывающей промышленности краснодарского края, 455.69kb.
- Инструменты реформирования институционально-хозяйственной подсистемы птицеводства апк, 366.24kb.
- Николаева Людмила Васильевна, заведующий складом запасных частей и материалов открытого, 53.63kb.
- Уважаемые Сокто Бальжинимаевич, Алексей Геннадьевич, 337.46kb.
- Предприятия сельского хозяйства и перерабатывающей промышленности; научно-исследовательские, 36.56kb.
Исследование антагонистической активности молочнокислых бактерий к вновь выделенным клиническим штаммам сальмонелл и колибактерий
У штаммов молочнокислых бактерий, отобранных ранее для создания пробиотиков против кишечной инфекции, проверена антагонистическая активность к вновь выделенным клиническим штаммам сальмонелл и колибактерий от больных птиц и свиней, полученным из КазНИВИ (Salmonella typhimurium К, Escherichia coli К) и в РГП НИИ проблем биологической безопасности КН МОН РК (S. typhimurium О, E. сoli О, S. gallinarum).
Установлено, что культура L. plantarum 25м не проявила антагонизма ни к одному из вновь выделенных клинических штаммов сальмонелл и колибактерий, а L. cremoris 21, S. salivarius 26с, L. brevis 8н, S. faecium 14в, L. fermentum 15 – лишь к одному тесту, хотя к ранее выделенным патогенам они проявляют более высокую активность.
Хорошую антагонистическую активность к взятым в опыт тест-культурам проявили L. cellobiosus 58н, L. cellobiosus 20, L. plantarum 1н, L. brevis Б-3, L. casei 7. Из данных культур было составлено 15 различных ассоциаций. Наибольшую антагонистическую активность проявили 2 ассоциации. Первая ассоциация, состоящая из L. brevis, L. plantarum и Propionibacterium shermanii 5 в равных соотношениях, имела зоны подавления роста S. gallinarum O – 200,5 мм, S. typhimurium О – 200,3 мм, S. typhimurium К – 210,8 мм, E. coli О – 17,50,3 мм, E. coli К – 170,6 мм. Другая ассоциация (№12), состоящая из L. cellobiosus 20 и L. plantarum 1 при соотношении штаммов 1,5:0,5, давала зоны подавления роста E.coli О – 200,5 мм, E.coli К – 200,3 мм, S. typhimurium К – 200,8 мм, S.typhimurium О – 19,50,5 мм, S. gallinarum – 18,50,6 мм. Активность обеих ассоциаций превосходит таковую у монокультур.
Таким образом, проведенные исследования показали необходимость постоянного контроля активности штаммов-антагонистов и ассоциаций к вновь выделенным патогенам.
Электронно-микроскопические исследования характера ингибирования роста сальмонелл лактобактериями
Исследовали изменение ультраструктуры клеток сальмонелл под влиянием нативных культур L. casei и S. salivarius, а также антибиотических веществ, продуцируемых ими.
Антибиотические компоненты экстрагировали ацетоном из биомассы, затем разделяли на активные компоненты с помощью хроматографии в системе хлороформ – метанол (10:1) с последующей биоавтографией в отношении S. typhimurium.
Электронно-микроскопические исследования показали, что S. typhimurium представляет собой короткие палочки с закругленными концами длиной 1-3 мкм, диаметром 0,5-0,8 мкм, имеют от 8 до 14 жгутиков, расположенных вокруг клетки. Капсул и спор не образует. Цитоплазма клеток гранулярная (рисунок 1).
Деление клеток осуществляется простой перетяжкой с образованием равномерных дочерних клеток.
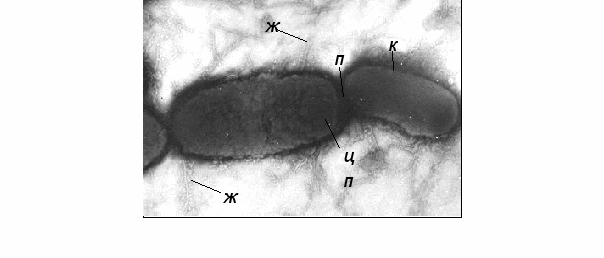
Ж – жгутики; К – клеточная стенка;
ЦП – цитоплазматическая мембрана;
П – перетяжка. Увеличение 36000
Рисунок 1 – Исходная куьтура S. typhimurium 51
Под воздействием S. salivarius на начальных этапах происходит изменение формы сальмонелл. Просматривается гранулярный состав цитоплазмы, имеются зоны просветления, образуются осмофильные тяжи. Встречаются филаментозные формы сальмонелл с ядром.
Под воздействием антибиотического вещества, выделенного из S. salivarius, клетки сальмонелл претерпевают более глубокие изменения, которые начинаются с разрушения клеточной стенки без изменения структуры цитоплазмы. В цитоплазме хорошо просматривается гранулярный состав, а по центру нуклеоид. В дальнейшем клетки сальмонелл приобретают неправильную форму, становятся более вытянутыми, начинается их лизис (рисунок 2).
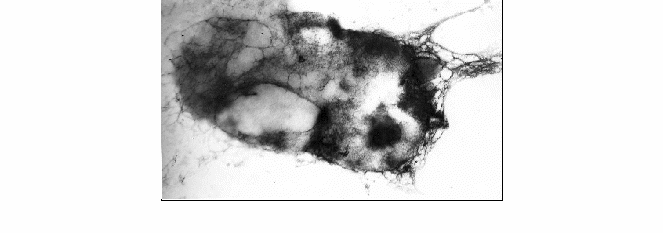
Увеличение 55000
Рисунок 2 – Лизированные клетки сальмонелл
Культура L. casei оказывает более сильное воздействие на клетки сальмонелл по сравнению с S. salivarius. У сальмонелл разрушаются клеточные стенки, обрывки которых видны в поле зрения микроскопа. Изменяется структура цитоплазмы. Из мелкогранулярной она переходит в глыбчатую. Начинается гранулярный распад, который происходит более интенсивно под воздействием антибиотического вещества, выделенного из L. casei (рисунок 3).
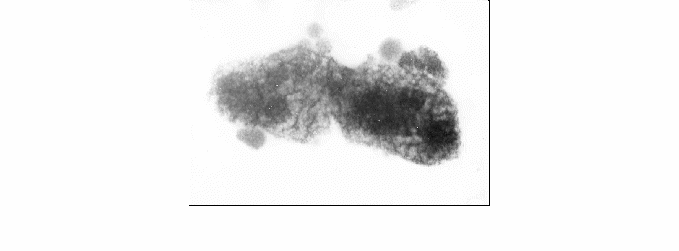
Увеличение 98300
Рисунок 3 – Гранулярный распад клеток сальмонелл под воздействием антибиотического вещества, выделенного из L. casei
В эксперименте под воздействием вещества, выделенного из L. сasei, наблюдалось превращение палочковидных клеток сальмонелл в сферические формы.
Под воздействием левомицетина повреждения сальмонелл также начинаются с клеточной стенки с последующим лизисом культуры (рисунок 4). Однако в этом случае повреждается не вся клеточная стенка, как в случае с лактобактериями, а определенный ее участок, с которого начинается лизис.
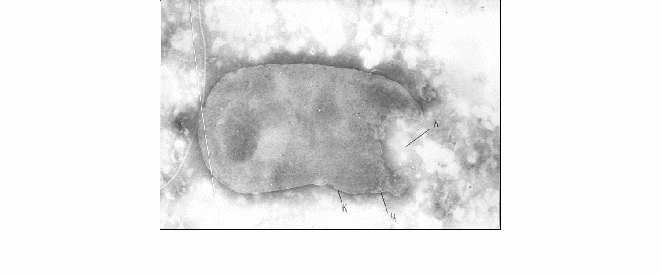
К – клеточная стенка; Ц – цитоплазматическая мембрана;
Л – последствия лизиса. Увеличение 112304
Рисунок 4 – Изменение клеток сальмонелл под воздействием левомицетина
Таким образом, вышеизложенное позволяет прийти к выводу, что под воздействием антибактериальных веществ S. salivarius и L. casei происходят глубокие структурные изменения клеток сальмонелл вплоть до их лизиса.
Изучение компонентного состава антимикробных комплексов из культуральной жидкости и биомассы лактобактерий и ассоциации
С помощью колоночной хроматографии с использованием Kieselgel 60 Merch проведено разделение на фракции спиртовых концентратов, полученных путем экстракции культуральной жидкости молочнокислых бактерий бутанолом с последующим его упариванием. Всего получено по 28 фракций, элюированных с колонки системой растворителей хлороформ-бензол-метанол (30:20:7), и по 7 фракций – 30%-ным этанолом в 0,5%-ной уксусной кислоте.
Установлено, что у штамма L. plantarum 2В наиболее активными фракциями являются с 14 по18, которые в отношении сальмонелл дают зоны подавления роста более 40 мм, а в отношении E.coli от 30 мм у фракции №14 до 40 мм – у №18. Не выявлено антагонистической активности во фракциях №№ 1, 6, 7, 11, 25, 26, 27. Фракции №№ 2, 22, и 28 проявили активность лишь в отношении сальмонелл, а № 32 – E.coli.
У штамма L.brevis B-3/21 наиболее активными являются фракции с 14 по 20, которые подавляют рост Salmonella в зонах 30, 34, 30, 32, 32, 32, 26 и 20 мм, соответственно, а E.coli – свыше 40 мм. Слабоактивными являются фракции №№3-5, 8, 23-26, дающие зоны подавления роста сальмонелл и эшерихий в пределах 10-15 мм. Фракции с 31 по 35 не подавляют рост сальмонелл, а рост E. coli задерживают в пределах 9-10 мм. Не обладают антагонистической активностью фракции 1, 2, 6, 7, 27, 28.
Активные фракции, выделенные из культуральной жидкости L. plantarum 2B и L. brevis B-3/21, были разделены на компоненты с помощью тонкослойной хроматографии на силуфоле с последующей биоавтографией в отношении S. gallinarum и E. coli.
При исследовании проб на газовом хроматографе установлено, что активные фракции, элюированные с колонки системой растворителей хлороформ-бензол-метанол, представлены в основном жирными кислотами и их производными, по качественному и количественному составу которых штаммы молочнокислых бактерий значительно отличаются между собой. Так, у штамма L. plantarum 2B в самых активных компонентах из фракций 15 и 16 выявлено содержание до 61,0%, молочной кислоты, а также ее производных – этиллактата (29,0%) и метиллактата (5,0%). Кроме того, в небольших количествах определены пирроло-(1,2)-пиперазин-3,6-дион (0,4%), пальмитиновая кислота (0,2%) и ее этиловый эфир (0,1%) (рисунок 5).
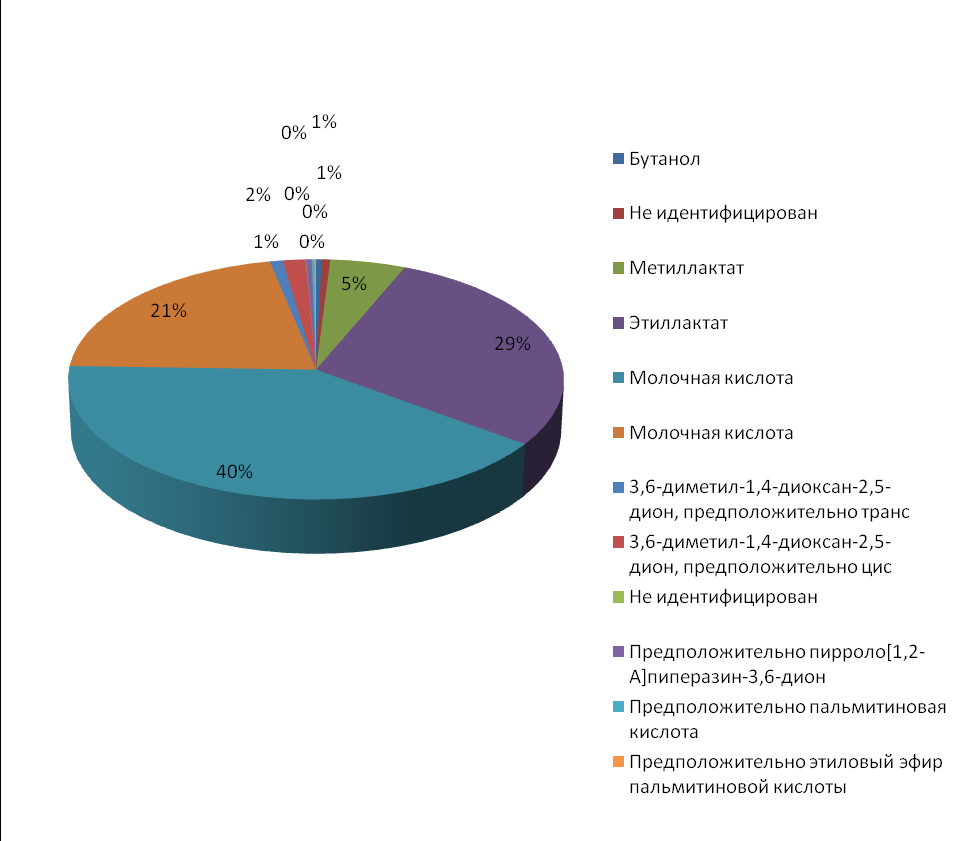
Рисунок 5 – Химический состав пробы L. plantarum 2B из фракций №15, 16
У штамма L. brevis B-3/21 в самом активном объединенном образце с Rf 0,24-0,25 (фракции 15, 16) в преобладающем количестве содержится молочная кислота (85,8%), а также этилформиат (2,6%), докозановая (бегеновая) кислота (2,4%), эйкозановая (арахидиновая) кислота (1,8%), генейкозановая (1,1%), гептадекановая кислота (1,0%), пирроло(1,2-А)-пиперазин-1,4-дион (0,8%), октадекановая (стеариновая) и нонадекановая кислоты (по 0,6%), 3,6-диметил-1,4-диоксан-2,5-дион цис (0,7%) и 3,6-диметил-1,4-диоксан-2,5-дион транс (0,3%), дибутилфталат (0,4%), трикозановая кислота (0,3%) (рисунок 6).
 Рисунок 6 – Химический состав пробы L. brevis B-3/21 из фракций №15, 16 с Rf 0,24-0,25
Рисунок 6 – Химический состав пробы L. brevis B-3/21 из фракций №15, 16 с Rf 0,24-0,25Определена активность отдельных компонентов, выявленных в антибиотических комплексах молочнокислых бактерий. Всего исследовано 49 соединений, среди которых жирные кислоты и их производные, пептиды. Из них в той или иной степени активностью обладали 32 соединения.
В отношении S.gallinarum активными в данной концентрации оказались 9 соединений: линоленовая, пальмитиновая, изобутириковая, а-амино-н-бутириковая кислоты (500 мкг/мл), пирроло-(1,2)-пиперазин-1,4-дион-3-этил (4000 мкг/мл), олеиновая кислота, метиловый эфир тридекановой кислоты, тирозин (5000 мкг/мл) и 3,6-диметил-1,4-диоксан-2,5-дион (250 мкг/мл). Изобутириковая кислота при концентрации 50 мкг/мл снижает адгезивную способность сальмонелл до 1-2-3 степени по сравнению с 3-4 степенью в контроле. Сальмонеллы теряют адгезивную способность при содержании в питательной среде 250 мкг/мл олеиновой, изобутириковой и линоленовой кислот, а также 3,6-диметил-1,4-диоксан-2,5-диона.
Молочная кислота угнетает рост сальмонелл только при концентрации ее в среде 8% (80000 мкг/мл). При этом происходит уменьшение ДНК-азной активности почти в два раза. Угнетение роста сальмонелл показано также при наличии в питательной среде 0,1% (1000 мкг/мл) пропионовой кислоты со значительным снижением ДНК-азной активности и потерей адгезивной способности.
В отношении E.coli антагонистическую активность проявили олеиновая, линоленовая, пальмитиновая, пропионовая, капроновая кислоты, этиловый эфир пальмитиновой кислоты, метиловый эфир тридекановой кислоты в концентрации 5000 мкг/мл, пирроло-(1,2А)-пиперазин-1,4-дион-3-этил – в концентрации 4000 мкг/мл, лигноцериковая, фенилуксусная кислоты – в концентрации 500 мкг/мл. Полная потеря адгезивной и гемолитической активности у E.coli происходит при содержании в среде 500 мкг/мл олеиновой, изобутириковой и линоленовой кислот, а также 3,6-диметил-1,4-диоксан-диона.
Молочная кислота угнетает рост E.coli при содержании ее в среде 8% значительно меньше, чем S.gallinarum. При этом изменения ДНК-азной активности, в отличие от S.gallinarum, не происходит.
Установлено, что угнетение роста колибактерий происходит также под воздействием от 1000 до 100 мкг/мл пропионовой кислоты. В опыте у культуры снизились гемолитическая активность в 10 раз и степень адгезии с 3-4 до 2-3.
Активность в отношении Listeria sp. проявили 5 компонентов, в отношении A.niger – 6 компонентов, P. multicida – 24, C. albicans – 7 компонетов.
Таким образом, взятые в опыт жирные кислоты и их производные подавляют рост исследованных тест-культур в концентрациях 250-5000 мкг/мл, молочная кислота – 80000 мкг/мл. Общие концентраты из молочнокислых бактерий, содержащие жирные кислоты и их производные, обладают антагонистической активностью в отношении S. gallinarum S. aureus в дозе 0,5 мкг/мл, E.coli – 100 мкг/мл.
С помощью электрофореза в полиакриламидном геле в препарате, полученном из биомассы L. plantarum 2B с использованием трис-буфера, выявлено 5 белковых фракций с молекулярной массой от 32 до 67 кД. В биомассе L.brevis B-3/21 установлено также 5 белковых фракций с молекулярной массой от 20,00 до 67,00. Наиболее четко выражены фракции с молекулярной массой 65 кДа. В биомассе P. shermanii 5 обнаружены те же фракции, что у штамма В-3/21, но фракция с молекулярной массой 65 кДа выражена слабо. В биомассе ассоциации №6 выявлено до 16 компонентов в пределах от 35 до 97 кДа. Наибольшие концентрации компонентов находятся в области 30 кДа. В препаратах из биомассы P. shermanii 5, L.brevis B-3/21 и ассоциации установлена антагонистическая активность в отношении сальмонелл и кишечной палочки.
Более высокая антагонистическая активность определена в препаратах, полученных из культуральных жидкостей монокультур и ассоциации путем экстракции активных веществ хлороформом. Суммарная антимикробная активность белковых фракций исследованных лактобактерий находилась в пределах от 16000 до 1,6 мкг/мл.
Одним из факторов, определяющих антагонистическую активность молочнокислых бактерий, может быть их способность продуцировать лизоцим. В связи с этим нами испытаны на наличие лизоцимной активности 22 штамма молочнокислых бактерий, обладающих широким спектром антимикробной активности. Лизоцимную активность определяли чашечным методом с использованием тест-культуры M. luteus. Результаты учитывали по зонам лизиса вокруг микроколоний исследуемых культур.
Из 22 исследуемых штаммов молочнокислых бактерий лизоцимной активностью обладают 18 штаммов, т.е. 82% от общего их количества. Наибольшая лизоцимная активность определена у L. acidophilus 27w (16±0,8мм), L. homochiochii 172 (15±0,3мм), L. plantarum 53Н (13,7±0,5мм), L. fermentum 10 (13,5±0.8мм), L. casei 173а, S. lactis 94, S. salivarius 3g (по 12±0,5мм). Не проявили лизоцимную активность штаммы L. casei 139, L. plantarum 164 , L. cellobiosus 58Н и L. acidophilus-В.
По результатам исследований сделано заключение, что антимикробная активность исследованных пробиотических микроорганизмов обусловлена жирными кислотами и их производными, относящимися к группе ПАВ (биосурфактантам), веществами белковой природы и антилизоцимной активностью. Установлено, что антимикробная активность белковых фракций (от 1,6 до 16000 мкг/мл) значительно ниже таковой небелковых фракций (от 0,05 до 500 мкг/мл), по качественному и количественному составу которых штаммы значительно отличаются друг от друга (особенно по содержанию ароматических кислот), хотя и имеют сходные компоненты.
Взятые в опыт отдельные жирные кислоты и их производные, выявленные в антимикробных комплексах бактерий, подавляют рост исследованных тест-культур в концентрациях 250-5000 мкг/мл, молочная кислота - 80000 мкг/мл. Следует отметить, что общие концентраты из молочнокислых бактерий, содержащие жирные кислоты и их производные, обладают антагонистической активностью в отношении S.gallinarum и S.aureus в дозе 0,5 мкг/мл, E.coli – 100 мкг/мл. Это свидетельствует о более высокой антимикробной активности сочетаний исследуемых компонентов по сравнению с индивидуальными.
