Высокопроизводительные процессы электроосаждения никеля и сплава никель-фосфор из электролитов, содержащих карбоновые кислоты 05. 17. 03. Технология электрохимических процессов и защита от коррозии
| Вид материала | Автореферат |
- Катодные процессы на силицидах металлов триады железа в кислых электролитах 05. 17., 237.17kb.
- Локальная коррозия оборудования из нержавеющих сталей при эксплуатации установок переработки, 371.28kb.
- Состояние структуры, электрохимическое поведение и магнитные свойства наноструктурируемых, 327.79kb.
- Нестационарные процессы деградации в щелочных аккумуляторах, закономерности и технологические, 585.56kb.
- Электрохимическое получение наноразмерных pt/c катализаторов для твердополимерных топливных, 944.18kb.
- Выделение серебра из концентрированных хлоридных растворов 05. 17. 03 Технология электрохимических, 229.4kb.
- Получение оптически селективных и чёрных оксидных плёнок на алюминии и его сплавах, 222.41kb.
- Лекция Нуклеиновые кислоты. Атф нуклеиновые кислоты, 119.07kb.
- “Сварка никеля”, 308.75kb.
- Компания «Norilsk Nickel Investments Ltd.», являющаяся дочерней компанией ОАО «гмк, 74.09kb.
На правах рукописи
ЦУПАК ТАТЬЯНА ЕВГЕНЬЕВНА
ВЫСОКОПРОИЗВОДИТЕЛЬНЫЕ ПРОЦЕССЫ
ЭЛЕКТРООСАЖДЕНИЯ НИКЕЛЯ И СПЛАВА НИКЕЛЬ-ФОСФОР
ИЗ ЭЛЕКТРОЛИТОВ, СОДЕРЖАЩИХ КАРБОНОВЫЕ КИСЛОТЫ
05.17.03. – Технология электрохимических процессов
и защита от коррозии
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора технических наук
МОСКВА – 2008
Работа выполнена в Российском химико-технологическом университете
(до 1992 г. - Московском химико-технологическом институте) им. Д.И. Менделеева
на кафедре технологии электрохимических производств
Официальные оппоненты:
Доктор технических наук, профессор Ваграмян Тигран Ашотович
Доктор технических наук, профессор Виноградов Станислав Николаевич
Доктор химических наук,
старший научный сотрудник Маслий Александр Иванович
Ведущая организация: Казанский государственный
технологический университет
Защита состоится __________________________2008 г.
на заседании диссертационного совета Д 212.204.06
в РХТУ им. Д.И. Менделеева (125047, Москва, Миусская пл., д.9)
в ______________________________ в _______часов.
С диссертацией можно ознакомиться в Информационно-библиотечном
центре РХТУ им. Д.И. Менделеева.
Автореферат разослан____________________2008 г.
Ученый секретарь
диссертационного совета Новиков В.Т.
Общая характеристика работы
Актуальность проблемы. Процесс никелирования является одним из наиболее распространенных в гальванотехнике, что объясняется сочетанием ценных физико-химических свойств электрохимически осажденного никеля.
Большое внимание уделяется получению осадков никеля с заданными функциональными свойствами. Так, электронная техника предъявляет специфический комплекс требований к никелевым покрытиям и электролитам никелирования. Наряду с обычными требованиями к покрытию – наличию декоративного внешнего вида, хорошей равномерности осадка по профилю детали, хорошего сцепления с основой, беспористости – появляются и другие требования, а именно – пластичности и малых внутренних напряжений, обусловленные применением последующих операций гибки, вырубки, обжима, завальцовки, маркировки в процессе сборки изделий и их присоединения к схемам, а также требования паяемости без использования активных флюсов.
В последнее время возрастает интерес к сплавам на основе никеля, имеющими более широкий спектр свойств, чем никель. Перспективными материалами являются сплавы никеля с фосфором, отличающиеся повышенными микротвердостью, износостойкостью и коррозионными свойствами.
Процесс электроосаждения никеля (и композиций на его основе), продолжая оставаться одним из основных в гальванотехнике, имеет ряд недостатков. Прежде всего это низкая скорость нанесения покрытия при высокой концентрации солей никеля в растворе. Так в наиболее распространенных сульфатно-хлоридных электролитах с добавкой борной кислоты (электролиты типа Уоттса) при концентрации никеля в растворе 100-150 г/л рекомендуется использовать лишь небольшие катодные плотности тока от 2 до 7 А/дм2. С одной стороны это увеличивает продолжительность процесса, с другой – приводит к повышенному уносу токсичных ионов никеля в промывные воды.
Как правило, максимальное значение применяемой катодной плотности тока при электроосаждении металлов (т.е. допустимая плотность тока iдоп) определяется предельной плотностью тока диффузии (iпр.д). Однако в случае никелирования iдоп ограничивается не столько резким понижением поверхностной концентрации никельсодержащих компонентов, сколько повышением рНS прикатодного слоя (в результате выделения совместно с никелем водорода) вплоть до величины рНГ.О образования гидроксида и основных солей никеля. Последние, включаясь в катодный осадок, приводят к получению никелевых покрытий неудовлетворительного качества. В результате реальная плотность тока при никелировании оказывается гораздо меньше, чем iпр.д.
Одним из перспективных способов решения задачи интенсификации процесса и улучшения качества покрытия является замена в электролитах никелирования борной кислоты на более эффективные буферирующие вещества, поддерживающие стабильное значение рН как в объеме электролита, так и в прикатодном слое. В соответствии с теорией буферных растворов такую роль могут выполнять слабые карбоновые кислоты с рК 3,5-5,5. Карбоновые кислоты перспективны не только в качестве буферных добавок, но и как потенциальные вещества, образующие комплексы с ионами никеля.
Комплексообразование при катодном выделении металлов традиционно применяется для регулирования как скоростей стадий разряда и кристаллизации, так и качества и состава катодного осадка. Можно ожидать, что и в случае никелирования в присутствии карбоновых кислот комплексообразование будет в этом отношении перспективным.
Электролиты никелирования традиционно не содержат «индифферентных» солей и поэтому роль миграции в массопереносе может быть существенной. Поэтому представлялось интересным рассмотреть вопрос об использовании миграционных эффектов для интенсификации процесса нанесения покрытий.
Таким образом, разработка принципиально новых электролитов с пониженным содержанием солей никеля, обеспечивающих высокое качество покрытия без уменьшения скорости его нанесения, является перспективным направлением создания малоотходных, эколого-экономически целесообразных технологий.
Диссертационная работа выполнена в соответствии с планом НИР АН СССР по направлению «Коррозия и защита металлов» на 1980-1985гг. (Раздел 2.7.4.1) и на 1986-1990гг. (Раздел 2.7.3.1), планом НИР РХТУ (в рамках ЕЗ-Н Минобразования РФ) на 2000-2004гг, а также по программе INTAS Program, Project №93-2493 (1994-1995г) и грантам Минобразования РФ ТОО-9.4-1184 (2001-2002гг) и Т02-09.4-2273, (2003-2004гг).
Цель работы. Разработка процессов нанесения покрытий никелем и сплавом никель-фосфор из электролитов с пониженной концентрацией основных компонентов и характеризующихся высокой скоростью электроосаждения, стабильностью при эксплуатации, а также позволяющих получать покрытия с заданными функциональными свойствами.
Для достижения поставленной цели необходимо решение следующих задач:
- Исследование буферных свойств электролитов никелирования, содержащих в своем составе в качестве буферирующих веществ некоторые карбоновые кислоты (муравьиную, уксусную, янтарную, глутаровую, адипиновую, аминоуксусную).
- Развитие метода оценки транспортных свойств рассматриваемых электролитов применительно к процессам катодного выделения металлов из комплексных электролитов как в отсутствие параллельной реакции выделения водорода (модельные системы), так и при совместном выделении металла и водорода.
- Теоретическое обоснование и разработка новых составов высокоэффективных, низкоконцентрированных электролитов никелирования. Исследование физико-химических свойств покрытий с целью рекомендаций по их применению.
- Разработка электролитов для электроосаждения сплава никель-фосфор. Выявление закономерностей и факторов, влияющих на совместное выделение никеля, фосфора и водорода. Исследования физико-химических свойств сплава и установление взаимосвязи между ними и фазовым составом сплава.
Научная новизна. Впервые получены следующие результаты:
- Экспериментально обоснована целесообразность использования карбоновых кислот и их солей с никелем в качестве основных электролитов для нанесения покрытий из этого металла и его сплавов с фосфором.
- Установлено, что электролиты на основе солей никеля с карбоновыми кислотами обладают улучшенными транспортными свойствами. Показано, что ускорения массопереноса никельсодержащих компонентов можно объяснить влиянием комплексообразования на эффекты миграции и явлением экзальтации тока по никелю при совместном с никелем выделении водорода с участием молекул карбоновых кислот.
- Установлено, что предложенные электролиты обладают повышенной стабильностью рН прикатодного слоя. Показано, что это связано не только с высокими буферными свойствами растворов карбоновых кислот, но и с эффектами экзальтации, обусловленными взаимным положительным влиянием потоков никель- и водородсодержащих частиц.
- Исследованы физико-химические свойства осадков никеля и сплава никель-фосфор, полученных из электролитов, содержащих соли никеля с карбоновыми кислотами и показано, что они имеют ряд преимуществ перед осадками, полученными из традиционных электролитов, а именно: повышенные значения микротвердости, износостойкости, предела прочности, относительного удлинения, пластичности, защитной способности, а также – пониженные внутренние напряжения и электросопротивление.
Практическая значимость и реализация результатов работы. Выявление закономерностей влияния карбоновых кислот и их солей с никелем на интенсификацию стадии массопереноса позволило разработать высокоэффективные электролиты, из которых получены покрытия со следующими свойствами:
- никелевые покрытия с пониженными внутренними напряжениями (сульфатно-хлоридные с одной из буферных добавок: янтарной, адипиновой кислотами, ацетатом никеля, введенными вместо борной кислоты; авт. свид. №281986 и №508564);
- никелевые покрытия с повышенной микротвердостью, высокой прочностью, низкими внутренними напряжениями, высокими пластичностью и защитной способностью, низким удельным электросопротивлением, паяемые неактивными флюсами, с пониженным количеством включенного водорода (ацетатно-хлоридные электролиты с аналитической концентрацией никеля 0,1-0,3 М);
- никелевые покрытия с повышенным содержанием серы (от 0,06 до 0,1 мас.%), обуславливающим высокую электрохимическую активность никеля и возможность применения его в качестве непассивирующегося анода в процессах никелирования (ацетатно-хлоридные и сульфатно-ацетатно-хлоридные электролиты с добавками сахарина и бутин-2-диола-1,4; патент №2132889);
- блестящие никелевые покрытия с низкими внутренними напряжениями и высокой защитной способностью (ацетатно-хлоридные электролиты с концентрацией ацетата никеля 0,1-0,3 М, подкисленные HCl, и сульфатно-ацетатно-хлоридные электролиты c добавками сахарина и бутин-2-диола-1,4);
- сплав никель-фосфор (содержание фосфора от 5 до 6 мас.%) с высокой микротвердостью, которая после термообработки (образование фаз Ni и Ni3P) сопоставима с микротвердостью хрома, полученного из растворов на основе Cr(VI) (ацетатно-хлоридный электролит с добавками гипофосфита натрия и сахарина);
- сплав никель-фосфор (содержание фосфора около 6 мас.%), полученный в режиме двухимпульсного электролиза, износостойкость которого после термообработки сопоставима с износостойкостью хромового покрытия при малых нагрузках и превосходит ее при высоких нагрузках (ацетатно-хлоридный электролит с концентрацией никеля 0,3 М и гипофосфитом натрия);
- сплав никель-фосфор (содержание фосфора около 15 мас.%) – пересыщенный рентгеноаморфный твердый раствор фосфора в никеле, после термообработки превращающийся в фазу фосфида никеля Ni3P (сульфатно-сукцинатно-хлоридный электролит с гипофосфитом натрия).
Разработанные технологические процессы внедрены на заводах:
- технологический процесс нанесения износостойких покрытий сплавом никель-фосфор взамен процесса хромирования из растворов на основе Cr(VI) (Ульяновский машиностроительный завод им. Володарского; завод «Вперед», г. Москва; завод «Алай», г. Кызыл-Кия);
- технологический процесс нанесения защитно-декоративных никелевых покрытий (Элементный завод, г. Елец; завод «Плутон», г. Москва; ПО «Светотехника», г. Москва; завод МОМЗ, Московская обл.; завод 50-летия СССР, г. Фрязино; завод «Светлана», г. Ленинград; завод «Маяк», г. Севастополь; завод «Мегом», г. Витебск);
- технологический процесс получения пластичных никелевых покрытий внедрен в НИИ Часпром, г.Москва и прошел промышленную проверку (НИИ «Радиокомпонент», г.Москва; Дербентский трансформаторный завод; НПК «Энергия»).
Полупромышленные испытания прошли технологические процессы нанесения никелевых покрытий (НИИТ Автопром, г. Москва).
Разработанные электролиты внедрены в учебный процесс кафедры ТЭП РХТУ (лекции, лабораторный практикум); опубликованы в учебниках и учебных пособиях по прикладной электрохимии.
Предложенные подходы к интенсификации процессов электроосаждения никеля и сплава никель-фосфор могут быть использованы при разработке технологических процессов нанесения покрытий другими металлами и сплавами.
На защиту выносятся:
- Экспериментальные результаты, свидетельствующие о стабильности рН как в объеме электролита, так и в прикатодном слое в предлагаемых растворах солей никеля с карбоновыми кислотами. Объяснения этих эффектов на основе теории экзальтации, а также с учетом высоких буферных свойств электролитов.
- Экспериментальные результаты, свидетельствующие о повышенных транспортных свойствах исследованных электролитов в отсутствие индифферентных электролитов. Объяснение эффектов, приводящих к ускорению массопереноса в электролитах, содержащих комплексные катионы никеля с анионами карбоновых кислот.
- Экспериментальные данные, свидетельствующие о повышенных физико-химических свойствах катодных покрытий, а также их объяснение.
- Разработанные на основе указанных выше исследований процессы нанесения покрытий никелем и сплавом никель-фосфор.
Личный вклад автора. Вклад автора в работы, выполненные в соавторстве (см. список публикаций) состоял в проведении экспериментальных исследований, анализе и обобщении данных литературы по теме работы, формировании направления исследования, постановке задач, выборе направления их решения, проведении экспериментальных исследований, анализе и интерпретации полученных результатов, формулировании выводов. В экспериментальной части работы под руководством автора участвовали также сотрудники В.Н. Дахов и Л.С. Лукашова и аспиранты кафедры ТЭП МХТИ. Математические расчеты выполнены Л.И. Шураевой (ИХТТ, СО АН), а их анализ и интерпретация проведены автором совместно с Р.Ю. Беком (ИХТТ, СО АН). Рентгеноструктурные исследования выполнены под руководством Ю.Д.Гамбурга (ИФХ АН).
Апробация работы. Основные положения работы докладывались и обсуждались на: I, II и III Международных конгрессах «Защита-92, 95, 98» (Москва); I Международной конференции по электрохимии (Египет, Луксор, 1996); AESF SUR/Fin (США, 2006, 2007); Международных коллоквиумах ВТШ (ГДР, Ильменау.1966, 1977, 1983, 1986); V Международной конференции «Методы кибернетики хим.-технол. проц.» (Казань, 1999); 3-й и 4-й Международной конференции «Покрытия и обработка поверхности» (Москва, 2001, 2006, 2007); Международном 6 и 7-м Фрумкинском симпозиуме (Москва, 1995, 2000); Всесоюзных межвузовских конференциях «Гальванотехника» (Казань, 1981, 1984, 1985, 1987, 1999); 8-й Всесоюзной конференции по электрохимии (Черновцы, 1988); Всероссийских научно-технич. конференциях «Гальванотехника и обработка поверхности (Москва, 1996, 2001, 2002, 2006); семинарах, проводимых Московским (1967, 1977, 1982, 1984, 1988, 1989, 1990), Ленинградским (1987, 1989, 1992), Пензенским (1976, 1983, 1984, 1987, 1988, 1992, 2000), Кировским (1997, 1991), Харьковским (1987), Куйбышевским (1982, 1990) домами научно-технической пропаганды.
Публикации. По теме диссертационной работы опубликовано 155 печатных работ, в том числе: 97 статей (из них 56 – по перечню ВАК), 54 тезиса докладов, 3 авторских свидетельства СССР на изобретения и 1 патент РФ.
Структура и объем диссертационной работы. Диссертация состоит из введения и 5 глав: обзора литературы, методической части, 3-х глав экспериментальной части, выводов, списка литературы из наименований и приложения.
Диссертация изложена на стр., содержит рис., таблиц.
Основное содержание диссертационной работы
Во введении обоснована актуальность темы диссертации, сформулированы цель и основные положения, характеризующие научную новизну и практическое значение работы, которые выносятся на защиту.
Глава 1. Обзор литературы по электроосаждению никеля и сплава никель-фосфор. Рассмотрены методы интенсификации электроосаждения металлов применительно к процессу никелирования. Приводятся данные по электроосаждению никеля из растворов с пониженным содержанием металла («разбавленные» электролиты). Отмечается, что в настоящее время для достижения приемлемых катодных плотностей тока, обеспечивающих требуемое качество покрытий, применяются электролиты с повышенным содержанием солей никеля и добавкой борной кислоты. Сведения об использовании электродиффузионных эффектов для интенсификации процесса никелирования и стабилизации рНS прикатодного слоя отсутствуют. Рассмотрены электролиты, механизм электроосаждения сплава никель-фосфор, влияние различных факторов на химический состав сплава.
Глава 2. Методы исследования. Описаны методы экспериментальных исследований, применяемые приборы и оборудование. Анализ электролитов проводили методами: трилонометрическим (никель), аргентометрическим (хлорид-ион), потенциометрическим (рН, гипофосфит- и фосфит-ион, хлорид-ион с использованием ионоселективного электрода).
Измерение рНS прикатодного слоя проводили с использованием микростеклянного электрода по методике А.Л. Ротиняна и Т.М. Овчинниковой.
Катодные поляризационные кривые снимали в потенциодинамическом (2 мВ/с), потенциостатическом и гальваностатическом режимах на Pt «салазках», вращающихся дисковом и цилиндрическом электродах. Анодные поляризационные кривые (2-4 мВ/с) – на цилиндрическом Ni электроде. Потенциостат П-5848.
Содержание фосфора в сплаве никель – фосфор определяли методами: фотометрическим, атомно-эмиссионным спектральным, микрорентгеноспектральным; посторонних примесей (водорода, кислорода, углерода) в покрытиях – на соответствующих приборах Leco, водорода в никеле – также методом вакуумной экстракции. Содержание серы в никеле – титрометрическим и методом искровой масс-спектроскопии. Химический состав поверхностных слоев никелевых покрытий – методом РФЭС. Фазовый состав сплава – рентгеноструктурным (дифрактометры ДРОН-2 и Philips) и дериватографическим методами. Исследование морфологии никеля и сплава – с помощью растрового электронного микроскопа. Рентгенодифрактометрические исследования осадков никеля проводили на дифрактометре ДРОН-2 с обработкой по специальной программе. Шероховатость поверхности покрытий изучали с помощью профилогрофа-профилометра Калибр-201.
Физико-механические свойства покрытий никеля и сплава исследовали методами «гибкого катода» (внутренние напряжения), «навивки» (пластичность), а также с использованием разрывной машины (предел прочности, относительное удлинение), машины трения (износостойкость), прибора ПМТ-3 (микротвердость).
Ускоренные коррозионные исследования проводили в камерах влажности и солевого тумана и методом И.Л. Розенфельда.
Приведены методы численных и аналитических расчетов равновесных и поверхностных концентраций компонентов электролитов никелирования.
Глава 3. Транспортные свойства электролитов никелирования на основе солей никеля с карбоновыми кислотами. Рассмотрены современные представления о массопереносе в электрохимических системах без учета влияния комплексообразования на подвод к электроду реагентов и отвод продуктов реакции, исходя из модели диффузионного слоя Нернста. Приводятся математические выражения, учитывающие диффузионно-миграционные эффекты при протекании в растворе одной или нескольких параллельных катодных электрохимических реакций (Ю.И. Харкац), а также (с учетом комплексообразования) при анодном растворении металлов (С.Х. Айтьян, А.Д. Давыдов, Б.Н. Кабанов).
Далее приводятся результаты исследования автора по влиянию комплексообразования на диффузионно-миграционный перенос компонентов раствора при катодном выделении металлов.
Изменение концентрации металлосодержащих частиц в прикатодном слое
Комплексообразование накладывает на закономерности электродиффузионных процессов дополнительные ограничения, отражающие требования поддержания в любой точке приэлектродного слоя такого сочетания ионов металла М и лиганда L, которое соответствует константе равновесия комплексного иона MLm. Предполагается, что протекание электродной реакции не нарушает равновесия образования комплекса в приэлектродном слое. Возникающие при этом эффекты можно проиллюстрировать на примере раствора, состоящего из соли n-зарядного металла Mn+ и однозарядного аниона L–, образующих комплексный катион [MLm]n m, где m – координационное число. Предполагается, что константа образования катионного комплекса настолько велика, что концентрацией «свободных» ионов металла можно пренебречь. Обозначим концентрацию комплексных катионов через Ск, а концентрацию «свободных» ионов лиганда через Са. Уравнения диффузионно-миграционного массопереноса к катоду по металлосодержащим частицам:
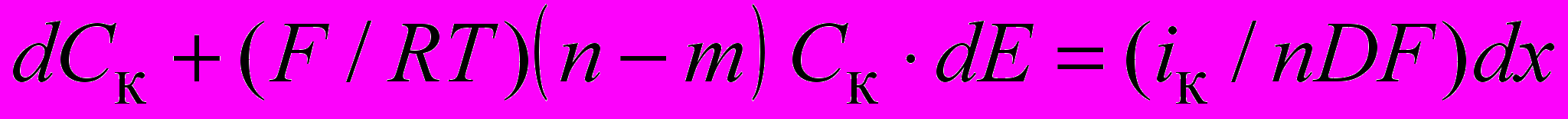 , (1)
, (1)и по частицам лиганда:
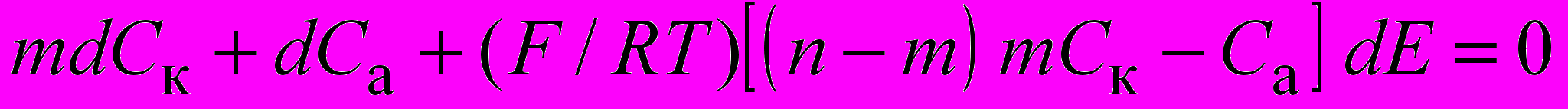 , (2)
, (2)при условии, что коэффициенты диффузии ( D) равны друг другу. Уравнение электронейтральности: (n – m)Ск = Сa. (3)
Умножив все члены уравнения (1) на (m – 1) и вычтя из результата уравнение (2), преобразованное с учетом условия электронейтральности к виду:
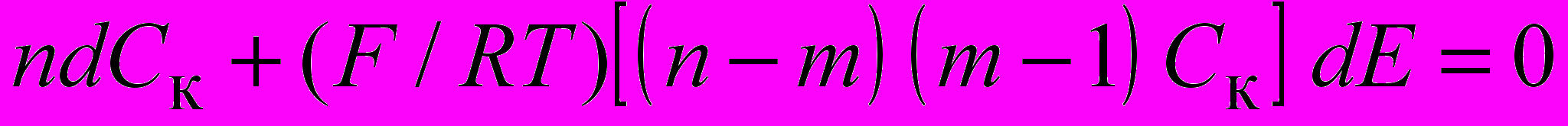 , (4)
, (4)получим уравнение для градиента концентрации комплексных ионов в диффузионном слое:
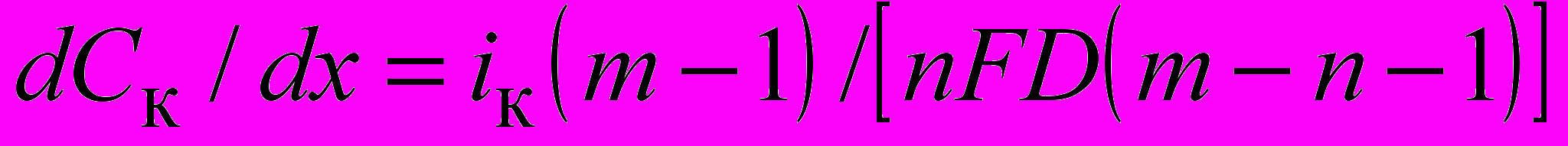 . (5)
. (5)Анализ уравнения (5) приводит к следующим выводам. Если m = 1, т.е. комплексный катион имеет в своем составе один лиганд [ML]n–1, то градиент концентрации таких катионов в приэлектродном слое отсутствует при любых плотностях тока, поэтому отсутствует и явление предельного тока. Массоперенос осуществляется только миграцией.
Если диссоциация соли MLm при ее растворении приводит к образованию не только комплексных катионов (Ск≡С1) , но и нейтральных комплексов (С2) и «свободных» ионов Мn+ (С3), то аналогичные выкладки, например, для системы ML2 (раствора ацетата никеля) приводят к следующему уравнению диффузионно-миграционного переноса:
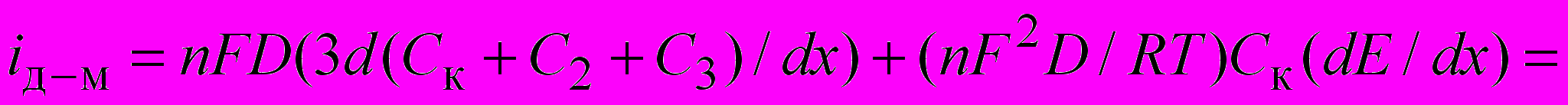
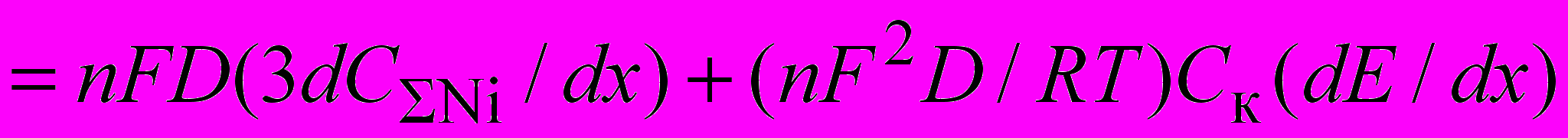 , (6)
, (6)Из уравнения (6) следует, что кроме предсказываемого теорией (для электролита типа 2-1 в отсутствие фона) утроения предельного тока, рассчитанного с учетом суммарной концентрации всех металлосодержащих частиц (1-й член уравнения), есть дополнительный эффект, пропорциональный концентрации катионных комплексов ск и градиенту потенциала в диффузионном слое (2-й член уравнения).
Правильность этих выводов подтверждают результаты экспериментальных исследований. Так, на примере растворов CdCl2, где при диссоциации образуется катионный комплекс [CdCl]+ и ионы Cd2+ и Cl–, расчеты показали, что iд-м составляет 11 А/дм2 при общей концентрации ионов кадмия 0,1 М (при расчетах принималось, что D 10–5 см2с–1, эф 10–2 см). Расчетное значение предельного диффузионного тока при тех же величинах D и эф, но в отсутствие влияния миграции (т.е. при избытке постороннего электролита) для 0,1 М раствора составляет величину
 1,93 А/дм2.
1,93 А/дм2.Сопоставление двух приведенных выше расчетных значений iпр показывает, что эффект миграции приводит к пятикратному увеличению предельного тока. Для системы, состоящей из двухзарядных катионов и однозарядных анионов, но без комплексообразования, теория предсказывает только трехкратное увеличение предельного тока в отсутствие фона. Таким образом, комплексообразование в этом случае приводит дополнительно примерно к удвоению скорости массопереноса.
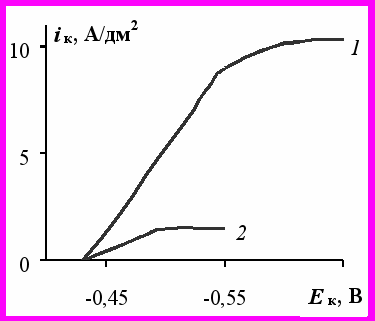
Результаты расчета были сопоставлены с экспериментальными данными (рис.1). В присутствии избытка фона значение iпр составляет около 1,7 А/дм2 (кр.2), в отсутствие же фона – 10,5 А/дм2 (кр.1). Отношения предельных токов, определенных с учетом влияния миграции и при избытке постороннего электролита, равны 11/1,93 = 5,7 (расчет) и 10,5/1,7 = 6,18 (эксперимент), что говорит об их удовлетворительном согласии.
А
 налогичные выводы были получены при сравнении результатов расчета с экспериментами для растворов Cd(CH3COO)2 и ZnF2.
налогичные выводы были получены при сравнении результатов расчета с экспериментами для растворов Cd(CH3COO)2 и ZnF2.Т
Рис.1. Потенциодинамические (1 мВ/с) катодные поляризационные кривые электроосаждения Cd из 0,1 М CdCl2 при 20ºС: в отсутствие фона (кр.1); фон 0,5 М Na2SO4 (кр.2)
аким образом, при комплексообразовании с возникновением положительно заряженных комплексов двухзарядных металлов с отрицательно заряженными лигандами [МL]+ имеет место ускорение массопереноса.
Далее в диссертации приведены результаты экспериментальных исследований, подтверждающих положительное влияние комплексообразования на массоперенос в электролитах никелирования. Это заключение рассмотрим на примере сопоставления результатов расчета и эксперимента для формиатного электролита никелирования. Здесь наряду с комплексообразованием надо учитывать влияние совместного выделения водорода. При электроосаждении никеля из электролитов на основе формиата никеля обнаружена значительная интенсификация процесса. При концентрации солей никеля 0,2 М были получены компактные осадки никеля вплоть до iк 40 А/дм2. Для выяснения причин, вызывающих возможность достижения таких высоких плотностей тока iдоп, были проведены аналитические и численные расчеты.
Согласно литературным данным в этой системе присутствуют комплексы [NiL]+ ( C1) (L– анион муравьиной кислоты), [HL] (C2) (муравьиная кислота) и ионы Ni2+ (C3), L– (C4), Н+ (C5). Примем, что коэффициент диффузии D не зависит от концентрации и одинаков для всех компонентов раствора.
Уравнения массопереноса для системы с выделением водорода, должны учитывать в процессе выделения водорода участие муравьиной кислоты (C6) и ионов Н+ (C5). Принимая, что участием ионов Н+ (C5) в переносе водородсодержащих частиц можно пренебречь из-за малой степени диссоциации муравьиной кислоты, имеем уравнение:
для никельсодержащих частиц:
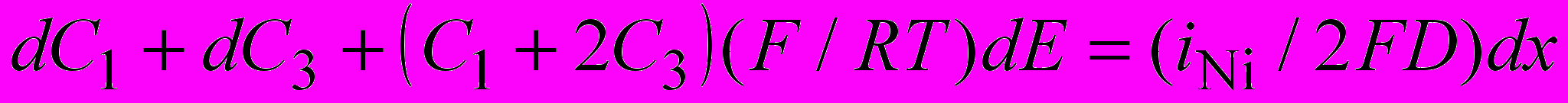 , (7)
, (7)для водородсодержащих частиц:
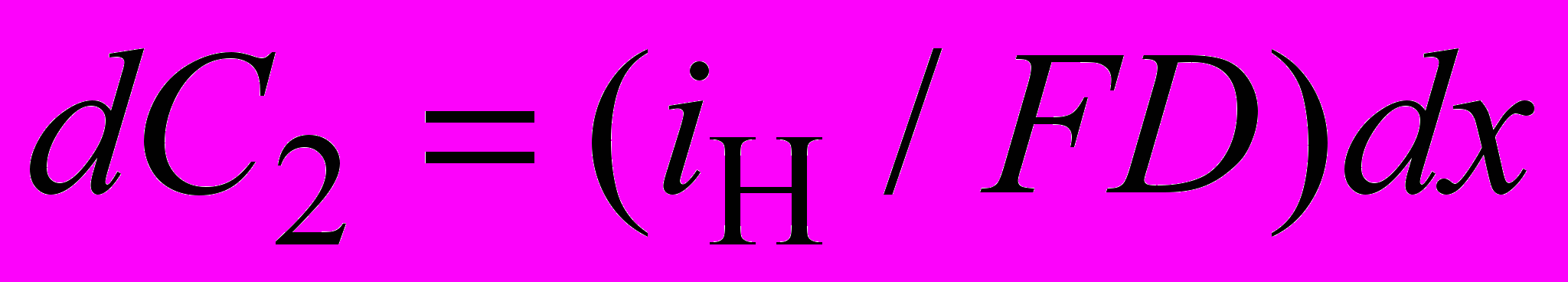 , (8)
, (8)и для формиатсодержащих частиц:
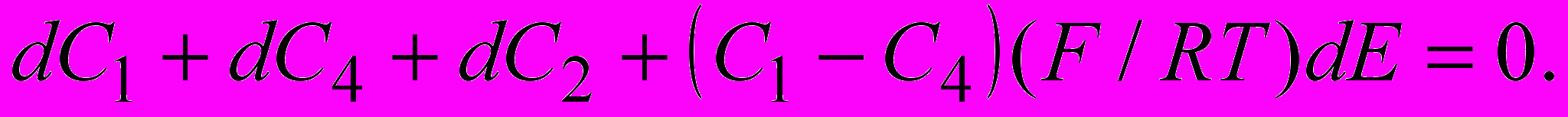 (9)
(9)Условие локальной электронейтральности раствора:
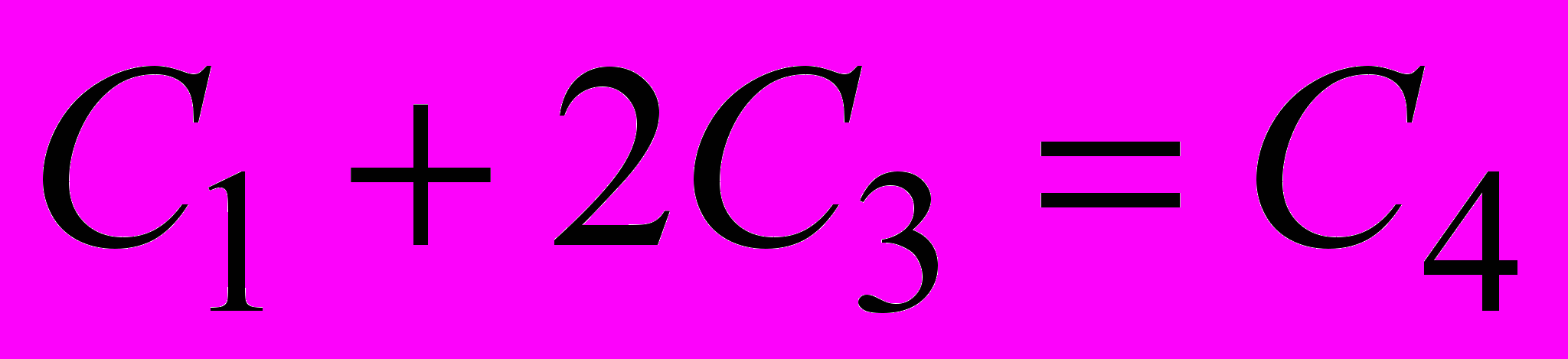 . (10)
. (10)После преобразований, аналогичных приведенным выше имеем уравнение:
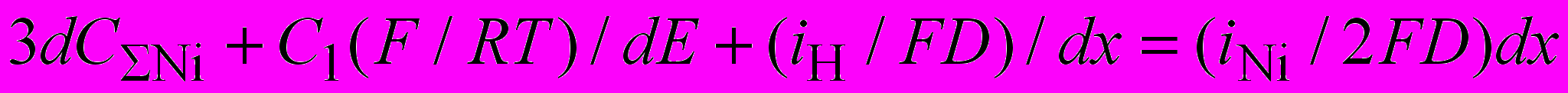 . (11)
. (11)Уравнение (11) отличается от уравнения (6) тем, что содержит диффузионный член для НСООН (dC2). Это указывает на влияние потока муравьиной кислоты на предельный ток никеля. В отсутствие фона влияние совместного выделения водорода зависит от равновесного состава раствора. Если концентрацией [NiL]+ можно пренебречь, то влияние выделения водорода можно описать в терминах теории экзальтации предельного тока по никелю (z2+), вызванному разрядом нейтральных молекул НСООН с выделением водорода и высвобождением аниона НСОО–(z–), когда ток экзальтации
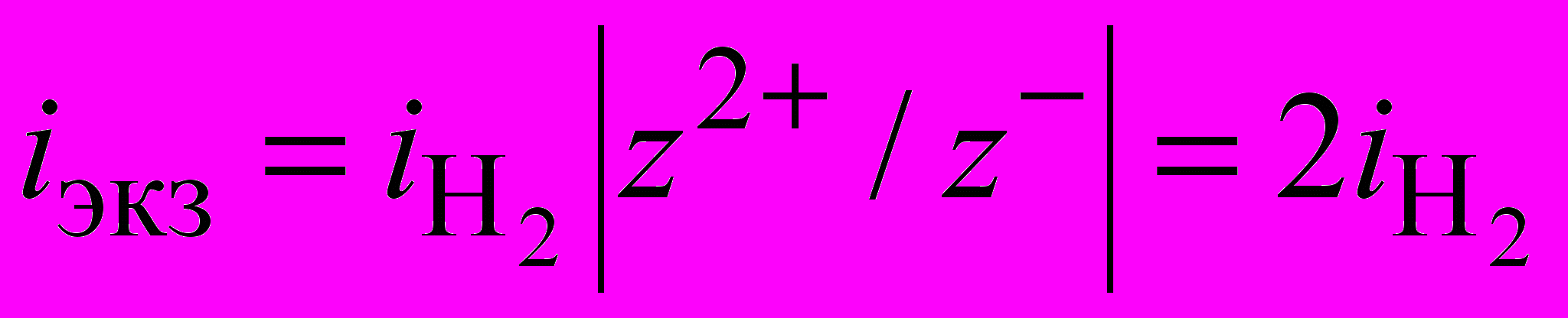 , т.е. предельный ток по никелю увеличивается на удвоенную величину тока по водороду. Действительно в этом случае после интегрирования уравнения (11) получим для предельного тока:
, т.е. предельный ток по никелю увеличивается на удвоенную величину тока по водороду. Действительно в этом случае после интегрирования уравнения (11) получим для предельного тока: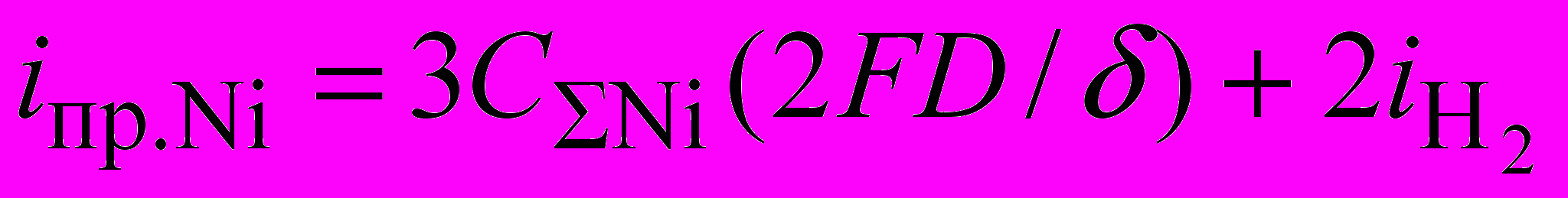 . (12)
. (12)С появлением в растворе комплексов [NiL]+ влияние тока по водороду на предельный диффузионно-миграционный ток по никелю возрастает еще более сильно в связи с появлением в уравнении (11) члена
 . Его роль увеличивается как с ростом концентрации C1 (т.е. константы образования) комплексных катионов [NiL]+, так и с ростом плотности тока по водороду, поскольку при этом увеличивается падение потенциала в диффузионном слое Eдиф.сл.
. Его роль увеличивается как с ростом концентрации C1 (т.е. константы образования) комплексных катионов [NiL]+, так и с ростом плотности тока по водороду, поскольку при этом увеличивается падение потенциала в диффузионном слое Eдиф.сл.Аналогичные выводы были получены при сопоставлении результатов аналитических вычислений и численных расчетов для формиатно-хлоридных, ацетатных и ацетатно-хлоридных электролитов. На примере последнего показана роль взаимного влияния потоков никель- и водородсодержащих частиц на массоперенос к катоду (рис.2). Если никель выделяется в отсутствие выделения Н2 (рис.2а), то суммарная поверхностная концентрация никельсодержащих частиц падает до 0,03 М и в приэлектродном слое присутствуют практически только ионы Ni2+. С увеличением
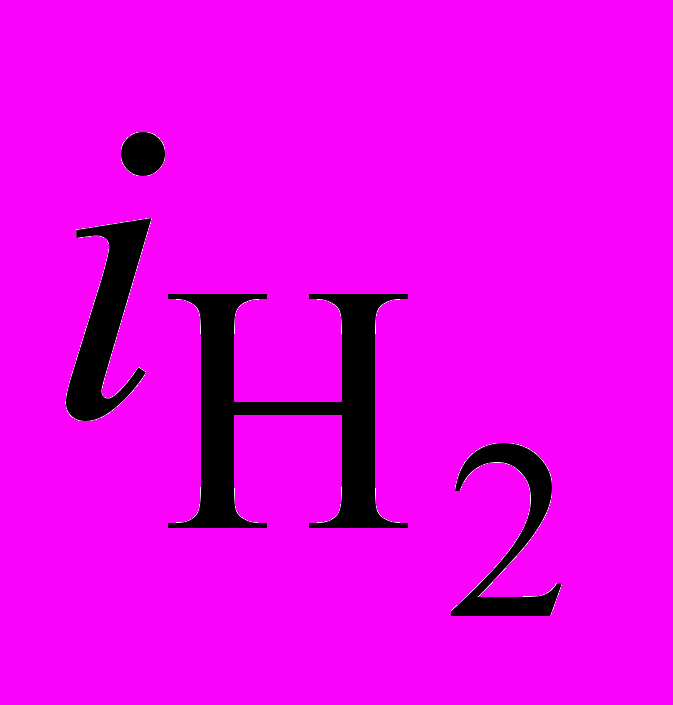 происходит повышение CS,Ni, а при скорости выделения Н2 более 4 А/дм2 CS,Ni > C0,Ni и перенос никельсодержащих частиц осуществляется против градиента концентраций под действием миграции. При этом значительно возрастает доля комплексного катиона [NiAc]+ в прикатодном слое (по расчету).
происходит повышение CS,Ni, а при скорости выделения Н2 более 4 А/дм2 CS,Ni > C0,Ni и перенос никельсодержащих частиц осуществляется против градиента концентраций под действием миграции. При этом значительно возрастает доля комплексного катиона [NiAc]+ в прикатодном слое (по расчету).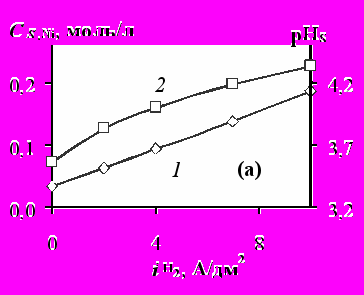
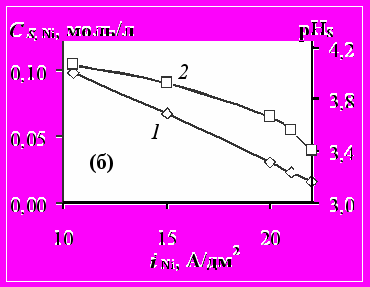
Рис. 2 Влияние парциальных скоростей выделения водорода (а) и никеля (б) на суммарную поверхностную концентрацию никельсодержащих частиц (кр.1) и рНS (кр.2) в 0,1 М ацетатно-хлоридном электролите при iNi 10 А/дм2 (а) и
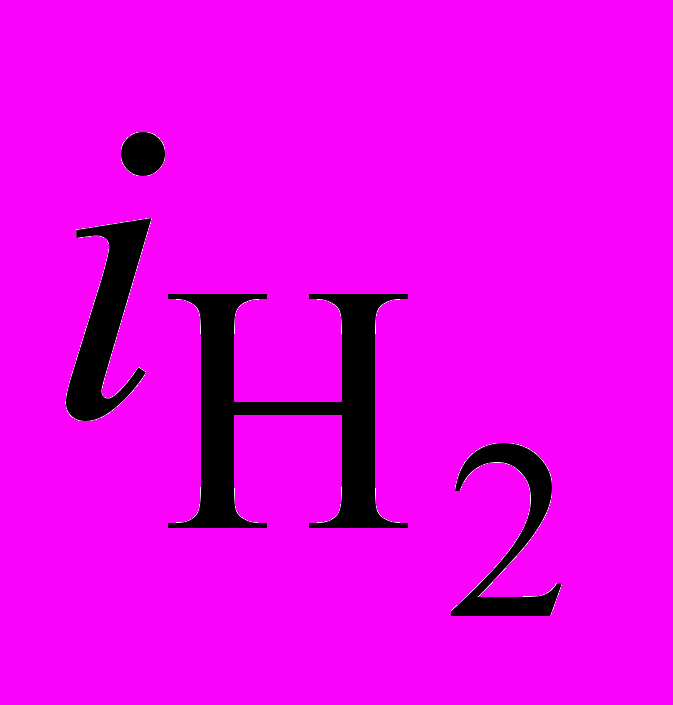 4,5 А/дм2 (б). Температуре 50°С, рН0 4,0, δэф 0,8∙10-2 см
4,5 А/дм2 (б). Температуре 50°С, рН0 4,0, δэф 0,8∙10-2 см