Катодные процессы на силицидах металлов триады железа в кислых электролитах 05. 17. 03 Технология электрохимических процессов и защита от коррозии
| Вид материала | Автореферат диссертации |
- Иванов Е. С. Ингибиторы коррозии металлов в кислых средах: Справочник, 73.76kb.
- Локальная коррозия оборудования из нержавеющих сталей при эксплуатации установок переработки, 371.28kb.
- Высокопроизводительные процессы электроосаждения никеля и сплава никель-фосфор из электролитов,, 468.58kb.
- Состояние структуры, электрохимическое поведение и магнитные свойства наноструктурируемых, 327.79kb.
- «Вызов», 86.73kb.
- Нестационарные процессы деградации в щелочных аккумуляторах, закономерности и технологические, 585.56kb.
- Задачи : Определить, как влияет температура воды на ржавление железа. Узнать скорость, 89.72kb.
- Выделение серебра из концентрированных хлоридных растворов 05. 17. 03 Технология электрохимических, 229.4kb.
- Электрохимическое получение наноразмерных pt/c катализаторов для твердополимерных топливных, 944.18kb.
- Урок в 9-м классе по теме "Коррозия", 149.58kb.
На правах рукописи
Поврозник Владимир Сергеевич
КАТОДНЫЕ ПРОЦЕССЫ НА СИЛИЦИДАХ МЕТАЛЛОВ ТРИАДЫ ЖЕЛЕЗА В КИСЛЫХ ЭЛЕКТРОЛИТАХ
05.17.03 – Технология электрохимических процессов и защита от коррозии
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Пермь – 2007
Работа выполнена на кафедре физической химии Пермского государственного университета
| Научный руководитель: | доктор химических наук Шеин Анатолий Борисович |
| Официальные оппоненты: | доктор химических наук Плетнев Михаил Андреевич кандидат химических наук, старший научный сотрудник Кичигин Владимир Иванович |
Ведущая организация: Институт технической химии УрО РАН
Защита состоится 28 мая 2007г. в 15.00 час. на заседании диссертационного совета Д 212.189.04 по химическим наукам в Пермском государственном университете по адресу: 614990, г. Пермь, ул. Букирева, 15.
С диссертацией можно ознакомится в научной библиотеке Пермского государственного университета.
Автореферат разослан «____» апреля 2007г.
Ученый секретарь диссертационного совета И. В. Петухов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. В машиностроении задача снижения вредного воздействия водорода на физико-механические свойства металлов и сплавов может быть решена при условии значительного углубления наших знаний, прежде всего, по вопросам теории и экспериментального изучения механизма и кинетики реакции выделения водорода на различных металлах и их соединениях. В то же время актуальной остается и проблема снижения экономических потерь от коррозии металлов и материалов при их эксплуатации в агрессивных кислых средах. Научно-обоснованный поиск новых электродных материалов различного функционального назначения является одним из эффективных направлений в данной области. Перспективными в этом плане оказываются металлоподобные соединения различного состава, многие из которых обладают уникально высокой коррозионной стойкостью и низким перенапряжением водорода. Силициды, обладая важными технологическими свойствами, находят также самостоятельное применение в некоторых новых областях современной техники. Силициды представляют значительный интерес как прямозонные полупроводники в оптоэлектронике, являются важнейшими продуктами ферросплавных производств, широко используются при легировании сталей, для изготовления кислотоупорных изделий, применяются в качестве источников альфа-излучения в альфа-протон-рентгеновских спектрометрах (APXS) и т.д. Особенно перспективным представляется использование силицидов переходных металлов при массовом производстве термогенераторов из-за их высокого КПД, дешевизны исходных компонентов и т.д. Это могут быть генераторы для катодной защиты газо- и нефтепроводов от коррозии, бытовые автономные термоэлектрические источники и т.д. Легирование металлов кремнием существенно повышает их химическое сопротивление, особенно в кислых окислительных средах. Вместе с тем, в ряде исследований было обнаружено, что коррозионная стойкость систем Ме-Si в значительной мере зависит от содержания Si и состава агрессивной среды.
Цель работы: определение основных закономерностей кинетики катодного выделения водорода на силицидах металлов группы железа и составляющих их компонентах в кислых электролитах различного состава и оценка влияния внешних и внутренних факторов на реакцию выделения водорода.
Задачи работы:
- Выполнить комплексное исследование реакции выделения водорода на силицидах металлов группы железа и составляющих их компонентах в растворе серной кислоты.
- Оценить влияние на катодное поведение силицидов металлов подгруппы железа в сернокислом электролите некоторых внешних факторов, таких как, pH раствора, температуры и деаэрации электролита, добавок поверхностно-активных органических веществ и галоидных ионов.
- Определить влияние внутренних факторов – количественного соотношения компонентов в силициде, способа изготовления электродов, влияние неметаллического компонента, анодной обработки поверхности силицидов с различным содержанием металлического и кремневого компонента на кинетику катодного выделения водорода в кислых электролитах.
Научная новизна. Впервые проведено систематическое исследование кинетики катодного выделения водорода на силицидах металлов группы железа в кислых электролитах различного состава. Установлены основные закономерности катодного процесса в зависимости от состава силицида и способа изготовления электрода. Определено влияние внешних факторов на реакцию выделения водорода на силицидах металлов триады железа.
Практическая значимость работы. Результаты исследований могут быть использованы работниками исследовательских лабораторий промышленных предприятий для разработки новых катодных материалов с высокой коррозионной стойкостью и низким перенапряжением выделения водорода. Их целесообразно использовать для прогнозирования коррозионного поведения металлоподобных соединений в кислых электролитах в зависимости от внешних и внутренних факторов, а также в процессе разработки и чтения специальных курсов по вопросам коррозии металлов и металлоподобных соединений и электрохимии студентам высших учебных заведений естественно-научных и технических специальностей.
Автор защищает:
– экспериментальные данные о закономерностях реакции выделения водорода на силицидах металлов группы железа и эвтектических сплавах на их основе в растворе серной кислоты;
– особенности реакции катодного выделения водорода на силицидах металлов подгруппы железа в кислых сульфатных растворах при влиянии добавок галоидных ионов, температуры и деаэрации электролита, pH раствора;
– влияние способа изготовления электрода и анодной обработки поверхности на скорость катодной реакции;
– результаты влияния различного количественного соотношения компонентов в силициде и влияние неметаллического компонента на кинетические характеристики реакции выделения водорода.
Апробация работы. Основные положения, результаты и выводы диссертационной работы были представлены на: Международной научной конференции «Молодежь и химия», Красноярск, 2002 и 2004гг.; научной конференции молодых ученых, студентов и аспирантов, Пермь, 2002г.; на X научно-технической конференции «Проблемы химии и химической технологии», Тамбов, 2003г.; научно-практической конференции «Теория и практика электрохимических технологий. Современное состояние и перспективы развития», УПИ, Екатеринбург, 2003г.; на VIX Российской научной конференции «Проблемы теоретической и экспериментальной химии», Екатеринбург, 2004 и 2006гг.; Всероссийской научной конференции молодых ученых и студентов «Современное состояние и приоритеты развития фундаментальных наук в регионах», Краснодар, 2004 и 2006гг.; Всероссийской конференции «Химия твердого тела и функциональные материалы», Екатеринбург, 2004г.; на XLIII Международной научной студенческой конференции «Студент и научно-технический прогресс», Новосибирск, 2005 и 2006гг.; Международной конференции молодых ученых по фундаментальным наукам «Ломоносов-2006», Москва, 2006г.; второй международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности», Санкт-Петербург, 2006г.; III Всероссийской конференции «Физико-Химические процессы в конденсированном состоянии и на межфазных границах» («ФАГРАН-2006»), Воронеж, 2006г.
Публикации. Содержание диссертации опубликовано в 22 печатных работах, в том числе в изданиях, рекомендованных ВАК РФ для публикации материалов диссертаций.
Объем работы. Диссертация содержит 172 страницы машинописного текста, в том числе 103 рисунка, 8 таблиц и состоит из введения, четырех глав и выводов. Список цитированных источников включает 149 наименований работ отечественных и зарубежных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении показана актуальность выбранной темы, сформулированы цели и задачи исследования, его научная новизна и практическая значимость. Представлены положения, выносимые на защиту.
В первой главе рассмотрены и обобщены литературные данные о физико-химических характеристиках исследуемых силицидов металлов подгруппы железа. Проведен обзор катодного поведения индивидуальных компонентов силицидов в кислой среде. Рассмотрено влияние состава электролита и температуры на реакцию катодного выделения водорода. Проанализированы основные механизмы процессов выделения водорода на металлах и полупроводниках в кислом электролите. Рассмотрены имеющиеся данные, касающиеся электрохимического поведения сплавов металлов с кремнием в кислых средах.
Во второй главе описаны методы получения и подготовки исследуемых образцов и методы экспериментального исследования.
Материалами для исследований служили монокристаллы силицидов металлов группы железа, а также компоненты, входящие в их состав (Fe, Co, Ni, Si). Для приготовления электродов использовали высокочистые материалы: полупроводниковый зонноочищенный кремний КПЗ-1 (99.99 масс.% Si) и электролитические железо, кобальт и никель. Базовой установкой для получения силицидов служила печь для промышленного выращивания кристаллов «Редмед-8». Направленная кристаллизация осуществлялась методом Чохральского с использованием монокристаллических затравок. Образцы изготовлены в лаборатории «Кристалл» Уральского государственного технического университета. В работе использовался также порошковый электрод, приготовленный горячим прессованием мелкодисперсного порошка моносилицида никеля.
Электроды вырезали электроискровым способом на специальных станках типа «Spark». Образцы помещали в специально изготовленные тефлоновые держатели, оставляя неизолированной только рабочую поверхность электродов. Перед экспериментом подготовку исследуемой поверхности проводили в следующей последовательности: механическое шлифование на тонких шкурках с последовательным уменьшением размера зерна, промывание дистиллированной водой, обезжиривание спиртом, промывание бидистиллятом и ополаскивание рабочим раствором.
В качестве рабочих использовали 0,05 М и 0,5 М растворы серной кислоты. Раствор кислоты готовили на дважды перегнанной с KMnO4 дистиллированной воде (бидистилляте) из реактива марки «Х.Ч.». Перед каждым опытом электрод катодно активировали для восстановления оксидных пленок на поверхности при катодном токе (ik) 1 мА/см2 в течение 20 минут. Деаэрацию проводили продуванием электролита в ячейке инертным газом – аргоном в течение не менее одного часа. Значение температуры раствора варьировали в диапазоне 20-600 C с помощью термостата «UTU 2». Галоидные ионы вводились в раствор серной кислоты в виде соответствующих солей калия марки «Х.Ч.».
Поляризационные измерения проводили на потенциостате ПИ-50-1 с выдержкой при каждом значении потенциала в течение 1 минуты. Исследования проводили в стандартной электрохимической ячейке ЯСЭ-2 с разделенными катодным и анодным пространствами. В качестве электрода сравнения использовали хлорсеребряный электрод, вспомогательный электрод – платиновый. Все значения потенциалов Е в работе приведены относительно хлорсеребряного электрода.
Рентгеновские фотоэлектронные спектры получены на спектрометре ЭС-2401 с Mg анодом. Вакуум в камере анализатора 10-5 Па. Калибровку спектрометра осуществляли по линии Au4f7/2 – 84.0 эВ. Значение энергии связи (Есв.) линии С1s-электронов в алкильной группе принимали равным 285.0 эВ. Точность определения положения линий – 0,2 эВ. Относительная погрешность количественного анализа – 10%. Микроструктуру поверхности образцов исследовали на сканирующем электронном микроскопе Amray-180 с приставкой для локального микроанализа.
Третья глава посвящена результатам систематического исследования внешних факторов на катодный процесс на силицидах железа, кобальта и никеля различного состава и составляющих их компонентах в кислых растворах различного состава.
На рис.1 и 2 представлены характерные катодные поляризационные кривые (КПК) металлов группы железа и их моносилицидов в сернокислом электролите с добавками галоидных ионов (на примере кобальта и его моносилицида CoSi). Полученные результаты показывают, что на чистых металлах галоидные ионы при изученных концентрациях, как правило, снижают скорость катодного процесса. Наиболее сильное снижение величин iк вызывают I- - ионы.
На силицидах металлов все исследуемые добавки также снижают значения iк, следовательно, уменьшают скорость реакции выделения
водорода. При этом, в случае силицидов практически всегда по степени торможения катодного процесса галоидные ионы образуют ряд: Cl- < Br-< I-. С увеличением концентрации галоидных ионов эффект торможения, как правило, тоже возрастает. Так, на силициде кобальта CoSi добавки Cl-, Br- и I- - ионов при СHal- = 10-1 М уменьшают iк (при E = – 0.6 В), соответственно, в 2.24; 2.51 и 7.89 раза.
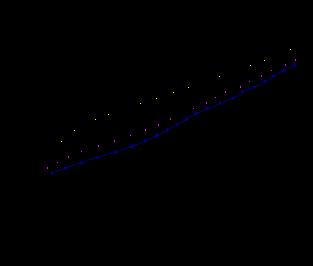
Рис.1. КПК, полученные на Co в растворе 0.5М H2SO4 с добавками галоидных ионов (СHal- = 0.01 М):
1 – H2SO4; 2 – H2SO4 + KCl;
3 – H2SO4 + KBr; 4 – H2SO4 + KI

Рис.2. КПК, полученные на CoSi в растворе 0.5 М H2SO4 с добавками галоидных ионов (СHal- = 0.01 М):
1 – H2SO4; 2 – H2SO4 + KCl;
3 – H2SO4 + KBr; 4 – H2SO4 + KI
В то же время на кремнии ингибирующее действие галоидных ионов на скорость р.в.в. незначительно. Так, на Si добавки Cl-, Br- и I- ионов при СHal- = 10-1 М практически не изменяют iк по сравнению с чистым электролитом (рис.3). В электролите без добавок iк (при E = – 0.6 В) для Si составляет 0.045 мА/см2 , а в присутствии Cl-, Br- и I- - ионов ik = 0.044; 0.040 и 0.044 мА/см2 соответственно.
Полученные результаты указывают на то, что ингибирующий эффект галоидных ионов проявляется в основном на атомах металлов в подрешетке силицида. На атомах кремния в силициде кинетика катодного процесса, очевидно, практически не изменяется, как не изменяется она на самом кремнии. На это же указывает и тот факт, что степень влияния галоидных ионов заметно уменьшается на высших силицидах (MeSi2). Так, тормозящее действие Наl--ионов на FeSi2 значительно меньше, чем на FeSi .
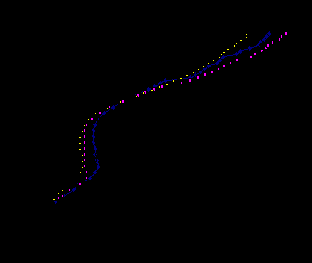
Рис. 3. КПК, полученные на Si в растворе 0.5 М H2SO4 с добавками галоидных ионов (СHal- = 0.1 М):
1 – H2SO4; 2 – H2SO4 + KCl;
3 – H2SO4 + KBr; 4 – H2SO4 + KI.
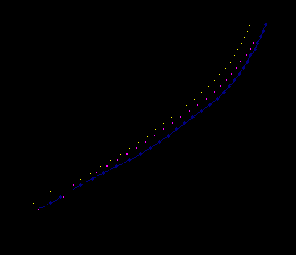
Рис. 4. КПК, полученные на FeSi в растворе 0.5 М H2SO4 с добавками галоидных ионов (СHal- = 0.01 М):
1 – H2SO4; 2 – H2SO4 + KCl;
3 – H2SO4 + KBr; 4 – H2SO4 + KI.
Максимальным тормозящим действием в катодном процессе, как на металлах, так и на силицидах, как правило, обладают I- - ионы. И для металлов Fe, Co, Ni, и для моносилицидов (рис.4) при СHal- = 10-2 М тормозящее действие галоидных ионов на скорость р.в.в. увеличивается в ряду: Cl-< Br- < I-. Однако для силицидов оно выражено гораздо слабее. При увеличении концентрации Hal- - ионов до СHaI- = 10-1 М разница в ингибирующем действии Cl-, Br- и I- - ионов на р.в.в. уменьшается, особенно для моносилицидов металлов.
Таким образом, полученные результаты позволяют предположить, что в кислом электролите присутствие галоидных ионов вызывает уменьшение энергии связи Me – H и увеличение перенапряжения р.в.в.
При E = -0.6 В скорость р.в.в. на никеле в чистой кислоте выше, чем на кобальте и железе (ik=5,62; 3,63 и 1,78 мА/см2 соответственно). В случае силицидов наибольшая скорость р.в.в. наблюдается на CoSi (ik=6,31; 1,26 и 0,14 мА/см2 для CoSi, NiSi и FeSi соответственно). Из полученных результатов видно, что катодный процесс на силицидах железа и никеля замедляется по сравнению с чистыми металлами (в 12,7 и 4,5 раза соответственно), а на силициде кобальта, напротив, ускоряется в 1,74 раза по сравнению с чистым кобальтом. Последнее указывает на электрокатализ процесса выделения водорода на CoSi по сравнению с Co. Порядки катодной реакции для моносилицидов железа и никеля
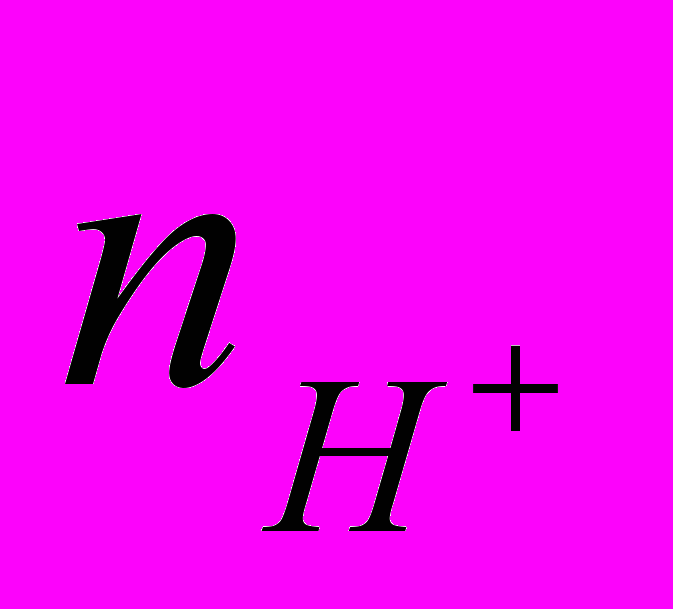 < 1 (
< 1 (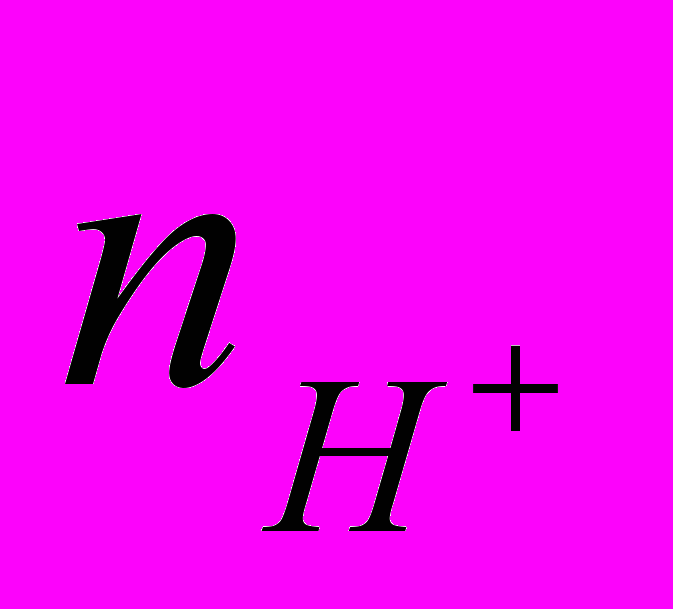 = 0.43 и 0.69 для FeSi и NiSi соответственно) и они ниже по сравнению с величинами для чистых металлов (1.05 и 0.86 для Fe и Ni), что указывает на определенную роль атомов кремния. Установлено, что на атомах кобальта в соединении реакция выделения водорода облегчается по сравнению с атомами этого же металла в своей собственной фазе. Значения порядков реакции и тафелевских коэффициентов наклона дают основания предполагать, что р.в.в. протекает по механизму замедленный разряд – электрохимическая десорбция.
= 0.43 и 0.69 для FeSi и NiSi соответственно) и они ниже по сравнению с величинами для чистых металлов (1.05 и 0.86 для Fe и Ni), что указывает на определенную роль атомов кремния. Установлено, что на атомах кобальта в соединении реакция выделения водорода облегчается по сравнению с атомами этого же металла в своей собственной фазе. Значения порядков реакции и тафелевских коэффициентов наклона дают основания предполагать, что р.в.в. протекает по механизму замедленный разряд – электрохимическая десорбция.Результаты исследования органических добавок: тетрабутиламмоний бромида (ТБАБ) и триметилтеллуроний иодида (ТМТИ) показывают, что их влияние на катодный процесс так же реализуется в основном, через атомы металлического компонента силицидов. На это указывают сходные кинетические параметры катодного процесса на металлах и низших силицидах. Более слабое действие ПАВ на высшие силициды и кремний, по-видимому, связано с их худшей адсорбируемостью на атомах неметалла.
Нами было исследовано влияние температуры и процесса деаэрации на скорость р.в.в. Значения температуры варьировали в диапазоне 20 - 600 С.
Из полученных результатов видно, что повышение температуры ускоряет выделение водорода, о чем свидетельствует рост плотности катодного тока iк. На металлах группы железа (Fe, Co, Ni) величина iк возрастает в 2.8, 2.4 и 2.0 раза соответственно для Fe, Co и Ni при повышении температуры сернокислого электролита с 20 до 400 С. При этом Тафелевы коэффициенты bк практически не изменяются с ростом температуры. Последнее указывает на то, что с увеличением температуры раствора электролита изменяется лишь кинетика катодного процесса, но не его механизм.
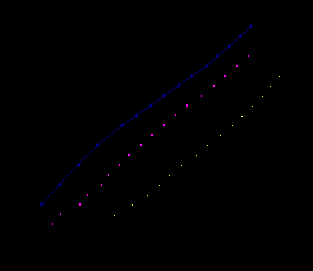
Рис. 5. КПК на Fe в 0.5 М H2SO4:
1 - t = 20°C; 2-t = 40°C;3 - t = 60°С.
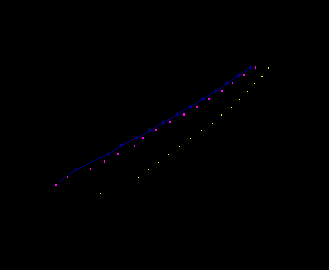
Рис. 6. КПК на FeSi в 0.5 М H2SO4:
1 - t = 20°C;2-t = 40°C; 3 - t = 60°С.
Результаты, полученные при рассмотрении влияния температуры на скорость р.в.в. на силицидах показывают, что увеличение температуры сернокислого электролита также приводит к ускорению катодного процесса. При этом, если на металлах при повышении температуры на 200 С плотность тока возрастает в 2 – 2,8 раза, то на силицидах тоже фиксируется рост плотности тока, но величина этого роста зависит от состава силицида. Для высших силицидов железа рост плотности тока более значителен (5-9 раз), чем для силицидов железа с меньшим содержанием кремния. Так, на силициде FeSi2 увеличение температуры раствора на 200 С приводит к ускорению р.в.в. при малой катодной поляризации и практически не влияет на iк при Ек ≤ -0,8. А на моносилициде железа FeSi повышение температуры электролита на 200 С приводит к незначительному росту скорости р.в.в. (в 1,4 раза). Для силицидов кобальта наблюдается обратная картина. Повышение температуры более сильно сказывается на увеличении iк для низших силицидов кобальта, чем для высших силицидов.
Для определения влияния растворенного в воде кислорода на р.в.в. были получены поляризационные кривые в деаэрированном растворе электролита на силицидах металлов подгруппы железа и их компонентах.
Установлено, что деаэрация раствора 0.5 М H2SO4 приводит к увеличению скорости р.в.в. на силицидах металлов за счет удаления растворенного в электролите кислорода, способствующего образованию на поверхности электрода оксидной пленки SiO2, которая в свою очередь (за счет барьерных свойств) понижает скорость катодного процесса на силицидах металлов различного состава. Тафелевы наклоны для металлов практически не изменяются при деаэрации раствора электролита, что, вероятно, свидетельствует о влиянии деаэрации только на кинетику процесса выделения водорода.
В четвертой главе, показано влияние некоторых внутренних факторов на катодный процесс. На примере систем Co – Si и Fe – Si рассмотрено влияние состава электрода на процесс выделения водорода в сернокислом электролите.
Результаты исследования катодного процесса в 0.5 М H2SO4 на силицидах Co2Si, CoSi, CoSi2, эвтектическом сплаве CoSi2 – Si приведены на рис.7 и 8. Катодные поляризационные кривые чистого Co и его силицидов Co2Si и CoSi практически совпадают, а при высоких катодных потенциалах р.в.в. на этих силицидах даже ускоряется по сравнению с чистым металлом.
При повышении содержания Si (CoSi2) кинетика процесса во многом определяется большим количеством кремния и КПК CoSi2 напоминает по форме КПК чистого Si. Скорость р.в.в. на высших силицидах резко уменьшается. Так, iк при Е = – 0.6 В составляет 1.48; 2.82; 2.14; 0.25 и 0.17 мA/см2 для Со, Со2Si, CoSi, CoSi2, CoSi2 – Si соответственно. Увеличение гетерогенности системы и рост содержания кремния (электрод СоSi2 – Si) c одной стороны (при малых Ек) приводит к ещё большему замедлению р.в.в., но с другой стороны (при увеличении Ек) величины iк для CoSi2 и CoSi2 – Si сближаются. Очевидно, следует учитывать не только количественные соотношения компонентов, но и гетерогенность поверхности электрода.
Как видно из результатов, при повышении содержания кремния потенциал коррозии силицидов кобальта сдвигается в положительную сторону. Исключение составляет силицид Co2Si, у которого Екор более отрицателен, чем
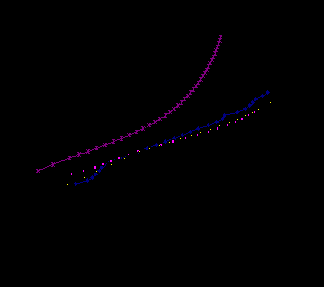
Рис. 7. КПК, полученные на силицидах кобальта при t =200С в растворе 0.5М H2SO4: 1 – Со; 2 – Со2Si; 3 – CoSi;
4 – CoSi2; 5 – CoSi2 –Si.

Рис. 8. КПК, полученные силицидах кобальта при t =400С в растворе 0.5М H2SO4: 1 – Со; 2 – Со2Si;
3 – CoSi;4 – CoSi2; 5 – Si.
у чистого Со. Для низших силицидов кобальта характерны более низкие значения bк (в сравнении с чистым Со) и более высокие значения скорости катодного процесса (большие значения iк при Е = – 0.6 В), что говорит о более лёгком протекании катодного процесса на данных материалах, то есть об электрокаталитическом эффекте на низших силицидах в р.в.в. Данные закономерности для силицидов кобальта различного состава не изменяются при повышении температуры до 400 C и 600 C, а также при деаэрации раствора аргоном.
При изучении катодного процесса на силицидах железа (FeSi, FeSi2, FeSi2–Si ) в 0.5 М H2SO4 было получено (рис. 9, 10), что с ростом содержания кремния в силициде скорость р.в.в. уменьшается по сравнению с чистым железом в 22.5; 74.1 и 104.7 раза для FeSi, FeSi2 и FeSi2–Si, соответственно.
Эти различия еще более возрастают при повышении температуры. Тафелев наклон bk, как правило, с увеличением содержания кремния в силициде увеличивается как при t = 200 C, так и при 400 C. При увеличении содержания кремния в образце потенциал коррозии силицидов железа сдвигается в более положительную область.
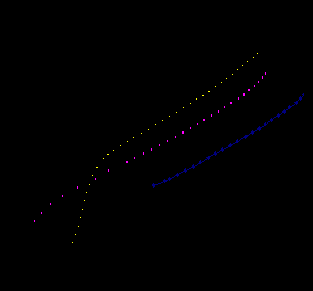 Рис. 9. КПК, полученные на силицидах железа при t = 20 0С в растворе 0.5 М H2SO4: 1 – Fe;
Рис. 9. КПК, полученные на силицидах железа при t = 20 0С в растворе 0.5 М H2SO4: 1 – Fe; 2 – FeSi; 3 – FeSi2; 4 – FeSi2 – Si.
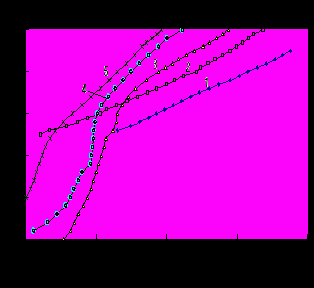
Рис. 10. КПК, полученные на силицидах железа при t = 40 0С в растворе 0.5 М H2SO4: 1 – Fe; 2 – FeSi; 3 – FeSi2;4 – FeSi2 – Si; 5 – Si.
Таким образом, установлено, что при повышении содержания кремния скорость р.в.в. резко уменьшается. Но на низших силицидах кобальта (Co2Si, CoSi), в отличие от силицидов железа, наблюдается электрокаталитический эффект по отношению к р.в.в. Данные закономерности не изменяются при повышении температуры электролита до 400 С. В то же время, ускорение р.в.в. при данной температуре более значительно для высших силицидов железа, чем для низших.
Практически во всем диапазоне исследованных потенциалов катодные токи на порошковом NiSi заметно (более чем на порядок величины плотности катодного тока ik) выше, чем на литом образце. Такой рост катодного тока нельзя связать только с увеличением истинной площади поверхности пористого электрода. Следует отметить увеличение Тафелевского коэффициента для порошкового NiSi (bk = 0,166 В) по сравнению с литым NiSi (bk = 0,151 В).
При изменении природы неметаллической компоненты образца (замены Si на Ge) изменяется кинетика выделения водорода. Скорость р.в.в. в растворе 0,5 М H2SO4 при E=const больше в 13,1 раза на FeGe2 , чем на FeSi2. В этом случае потенциал коррозии Eкор. смещается в отрицательную сторону. Действие галоидных ионов, ускоряющих выделение водорода на FeGe2, усиливается в ряду Cl-< Br- < I-. При увеличении концентрации галоидных ионов наблюдается увеличение скорости р.в.в.
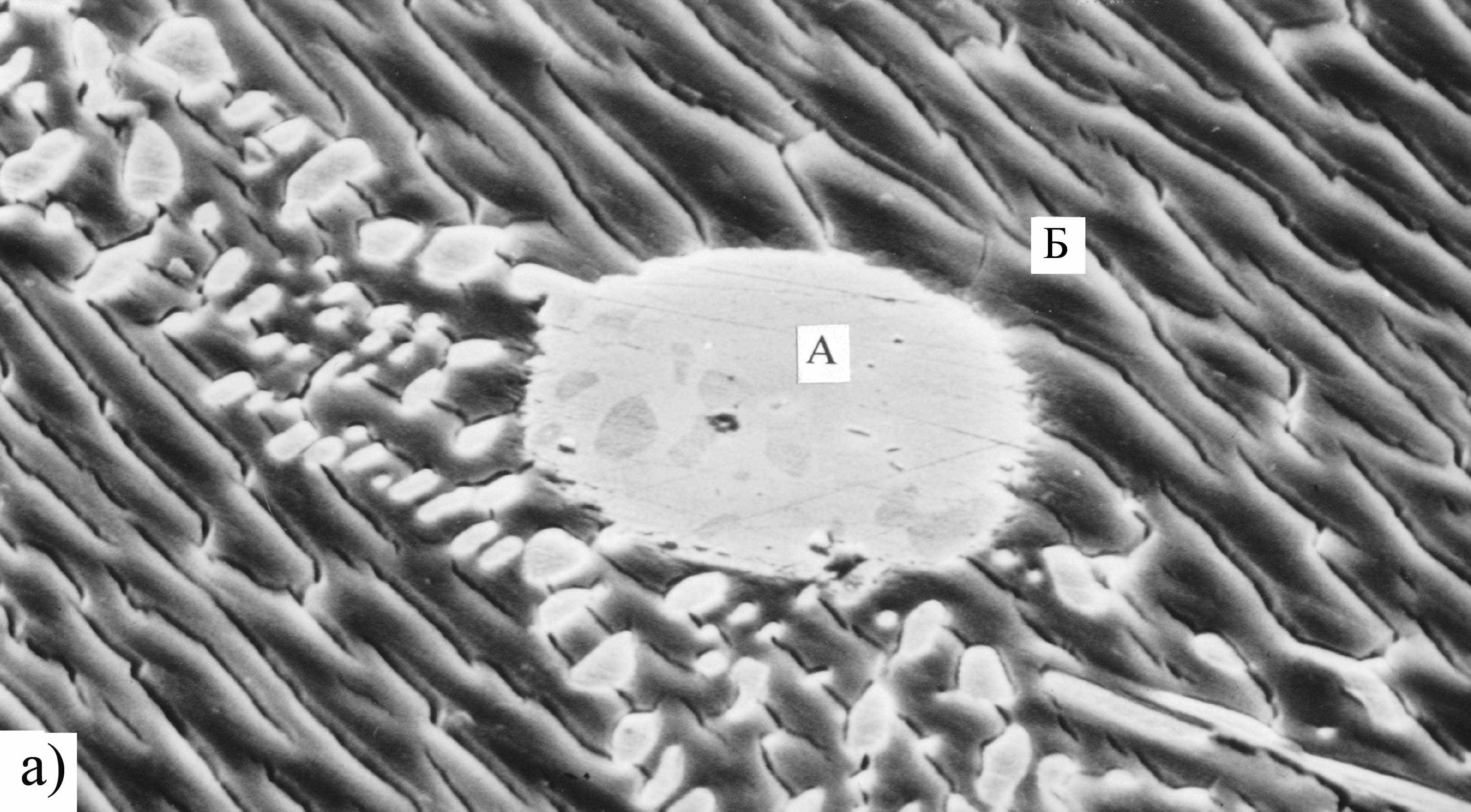
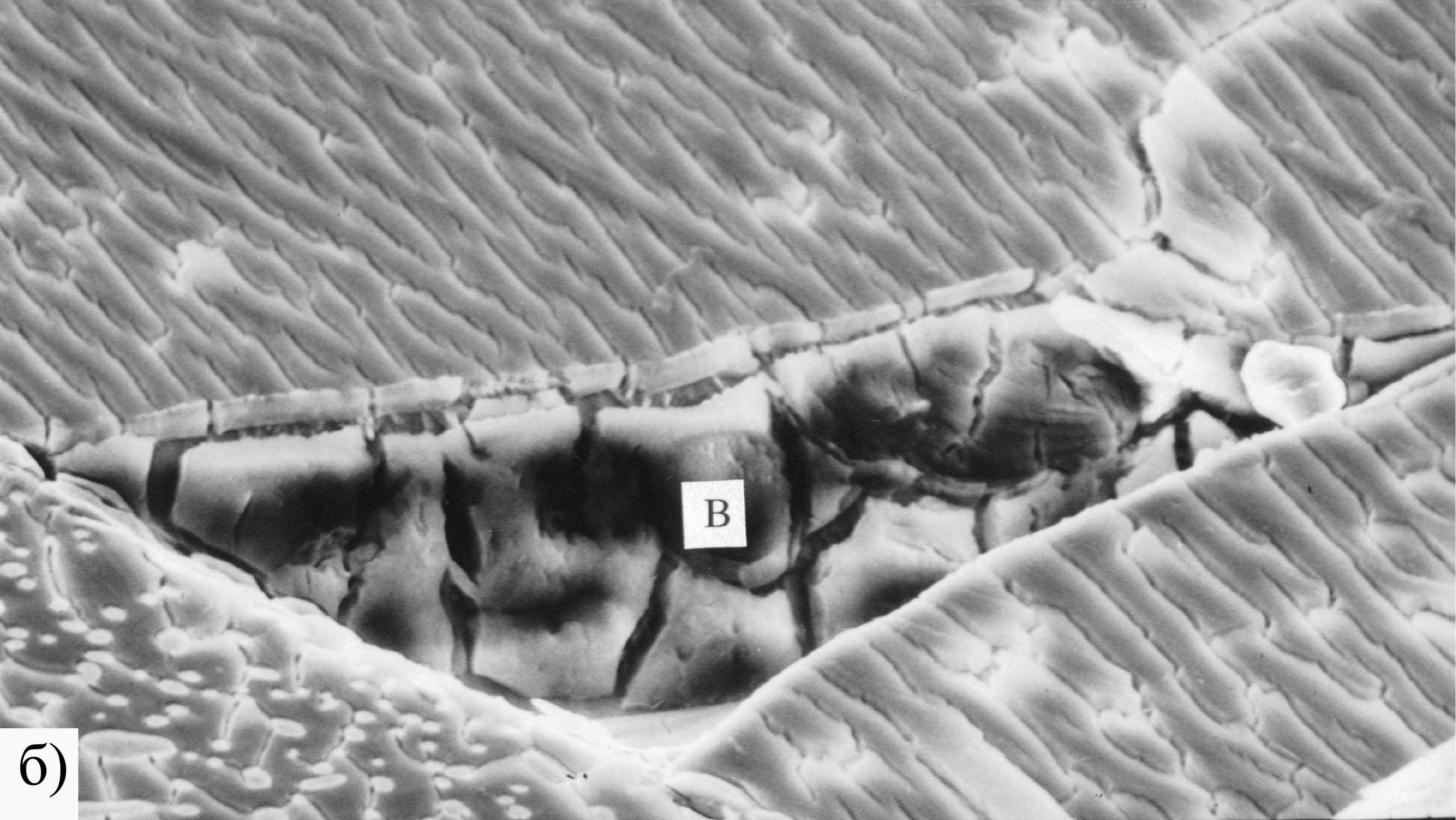
Рис. 11. Микрофотографии поверхности Co2Si после 1 ч анодного травления при потенциале Е = -0.3 В в 0.5 М H2SO4. Увеличение: а - 1930, б – 1240.

Рис. 12. Рентгеновские спектры участков поверхности Co2Si: а – участки А и Б с рис. 11а; В с рис. 11б; I – интенсивность; λ – длина волны.
Анодная обработка силицидов в кислых и щелочных средах приводит к различным результатам, что сказывается на последующем катодном процессе. Анодная обработка в щелочах приводит к большему ускорению р.в.в., чем травление в кислом электролите. В кислотах также происходит развитие поверхности силицида, но, в отличие от щелочи, общее содержание металла в приповерхностном слое уменьшается. Об этом свидетельствуют данные, полученные методом сканирующей электронной микроскопии в сочетании с микрорентгеноспектральным анализом поверхности электродов после анодной обработки (рис.11, 12).
ВЫВОДЫ
- Выполнено комплексное исследование процесса выделения водорода на силицидах металлов группы железа и составляющих их компонентах в кислом электролите с добавками галоидных ионов и показано, что в случае силицидов практически всегда по степени торможения катодного процесса галогенид-ионы образуют ряд: CI- < Br-< I-. Однако, на силицидах они не вызывают такого резкого торможения р.в.в. как на чистых металлах. Это связано с влиянием галоидных ионов в основном на кинетику р.в.в. на атомах металла в подрешетке силицида. На атомах кремния кинетика катодного процесса практически не изменяется.
- Порядки катодной реакции по ионам водорода для моносилицидов металлов подгруппы железа уменьшаются по сравнению с величинами для чистых металлов, что указывает на определенную роль атомов кремния. Установлено, что на атомах металла в моносилициде кобальта реакция выделения водорода облегчается по сравнению с атомами этого же металла в своей собственной фазе.
- Установлено, что при повышении содержания кремния в силицидах железа и кобальта различного состава скорость р.в.в., как правило, резко уменьшается. Но на низших силицидах кобальта (Co2Si, CoSi), в отличии от силицидов железа, наблюдается электрокаталитический эффект по отношению к реакции выделения водорода.
- Катодный процесс выделения водорода на порошковом NiSi протекает со значительно большей скоростью, чем на литом NiSi, практически во всей области потенциалов (кроме области глубокой катодной поляризации). Это связано с неравномерным распределением электродного процесса при удалении от внешней поверхности электрода вглубь пористой среды и с отличием площади истинной поверхности порошкового электрода от видимой поверхности.
- Скорость р.в.в. на FeGe2 в серной кислоте всегда больше, чем на FeSi2 независимо от вида галоидного иона и его присутствия. На FeGe2, в отличии от FeSi2, наблюдается увеличение скорости р.в.в. в присутствии галоидных ионов.
- Тетрабутиламмоний бромид и триметилтеллуроний иодид замедляют катодный процесс, но на металлах это торможение происходит в большей степени, чем на силицидах, что, очевидно, связано с лучшей адсорбируемостью поверхностно-активных веществ на атомах металла.
- Показано, что при повышении температуры раствора сернокислого электролита на 20°С скорость реакции выделения водорода на чистых металлах возрастает в 2-2,8 раза. Для высших силицидов железа рост плотности тока более значителен, чем для силицидов железа с меньшим содержанием кремния. Для силицидов кобальта наблюдается обратная картина. Повышение температуры более сильно сказывается на увеличении плотности тока для низших силицидов кобальта, чем для высших силицидов.
- Деаэрация сернокислого электролита приводит к увеличению
скорости р.в.в. на силицидах, что может быть связано с восстановлением оксидной пленки SiO2 и затрудненностью её образования в случае силицидов.
- Анодная обработка поверхности силицидов травлением в щелочном растворе приводит к более существенному ускорению (в 2 – 7,5 раз, в зависимости от состава силицидов) реакции выделения водорода, чем их травление в кислоте, при последующей катодной поляризации силицидов в кислом электролите. Увеличение скорости катодного процесса на силицидах после предварительной анодной обработки связано с реорганизацией приповерхностного слоя электрода и изменением его количественного состава. В кислых средах происходит развитие поверхности силицидов, но общее содержание металла уменьшается вследствии селективного растворения металла, сопровождаемого окислением кремния, остающегося в приповерхностном слое до SiO2. В щелочных средах также происходит развитие поверхности на которой формируется защитный слой, состоящий в основном из оксида металла.
ОСНОВНОЕ СОДЕРЖАНИЕ ДИССЕРТАЦИИИ ОПУБЛИКОВАНО В СЛЕДУЮЩИХ РАБОТАХ:
- Поврозник В.С. Катодное выделение водорода на силицидах металлов подгруппы железа // В кн.: Молодежная наука Прикамья – 2002. Тезисы докладов областной научной конференции молодых ученых, студентов и аспирантов. Пермь, 2002. С. 90-91.
- Поврозник В.С., Шеин А.Б. Катодное выделение водорода на силицидах металлов подгруппы железа в присутствии поверхностно-активных веществ. // В кн.: Российские химические дни – 2002. Материалы международной научной конференции «Молодежь и химия». Красноярск, 2002. С.264-267.
- Поврозник В.С. Катодное выделение водорода на силицидах металлов подгруппы железа в кислых электролитах // В кн.: Отчетная научная конференция студентов и аспирантов Пермского государственного университета. Материалы конференции. Пермь, 2003. С. 29.
- Шеин А.Б., Сергеева И.Л., Иванова О.С., Поврозник В.С. Механизмы анодного растворения силицидов металлов подгруппы железа в кислых и щелочных электролитах // В кн.: Теория и практика электрохимических технологий. Современное состояние и перспективы развития. Тез. докл. научно-практ. Конф., посвященной 80-летию кафедры "Технология электрохимических производств" УПИ. Екатеринбург, 2003. С.223-224.
- Шеин А.Б., Сергеева И.Л., Иванова О.С., Поврозник В.С. Электрохимические процессы на силицидах переходных металлов в электролитах различного состава // В кн.: Проблемы химии и химической технологии. Материалы докладов Х межрегиональной научно-технической конференции. Тамбов, 2003. С.162-166.
- Шеин А.Б., Сергеева И.Л., Иванова О.С., Поврозник В.С. Электрохимическое поведение силицидов металлов подгруппы железа в кислых и щелочных электролитах // В кн.: Химия и химическое образование. Сб. научных трудов 3-го Международного Симпозиума. Владивосток: Изд-во Дальневост. ун-та, 2003. С.186-187.
- Поврозник В.С., Шеин А.Б. Катодные процессы на силицидах переходных металлов в кислых электролитах // В кн.: Проблемы теоретической и экспериментальной химии. Тез. докл. XIV Российской студенческой научной конф., посвящ. 80-летию со дня рожд. проф. В.Ф. Барковского, Екатеринбург, 20-23 апр. 2004. Екатеринбург: Изд-во Урал. Ун-та, 2004. С. 91-92.
- Шеин А.Б., Ракитянская И.Л., Иванова О.С., Поврозник В.С. Механизм и кинетика электрохимических реакций на силицидах металлов в электролитах различного состава // В кн.: Физико- химические процессы в неорганических материалах. Тез. докл. IX Международной конф. (ФХП-9). Кузбассвузиздат. Кемерово, 2004. Т.1. С. 650-652.
- Поврозник В.С., Шеин А.Б. Катодные процессы на силицидах переходных металлов в кислых электролитах. // В кн.: Современное состояние и приоритеты развития фундаментальных наук в регионах. Тез. докл. Всероссийской научной конференции молодых ученых и студентов. Краснодар: Изд-во «Просвещение – Юг», 2004. Т. 2. С. 91-92.
- Шеин А.Б., Ракитянская И.Л., Иванова О.С., Поврозник В.С. Электрохимия силицидов и германидов переходных металлов // В кн.: Химия твердого тела и функциональные материалы. Тез. докл. Всероссийской конф. Екатеринбург, 2004. С. 447.
- Шеин А.Б., Ракитянская И.Л., Иванова О.С., Поврозник В.С. Электрохимические процессы на силицидах металлов переходных металлов в электролитах // Химия в Московском университете в контексте российской и мировой науки. Тез. докл. Международной конференции, посвященной 250-летию МГУ и 75-летию химического факультета МГУ. М.: МГУ, 2004.С.80-81.
- Шеин А.Б., Ракитянская И.Л., Поврозник В.С. , Иванова О.С. Силициды переходных металлов – новые перспективные электродные материалы // В кн.: «Высокие технологии, фундаментальные и прикладные исследования, образование». Сборник трудов первой международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности». Санкт-Петербург. Изд. Политехнического ун-та, 2005. С. 162-164.
- Поврозник В.С. Катодное поведение силицидов переходных металлов различного состава в кислых электролитах // Материалы XLIII Международной научной студенческой конференции «Студент и научно-технический прогресс». Серия Химия. Новосиб. Гос. Ун-т. Новосибирск, 2005. С.158-159.
- Поврозник В.С., Шеин А.Б. Катодное выделение водорода на силицидах металлов группы железа в кислых электролитах различного состава //Вестник Удмуртского университета. Серия Химия, 2005. № 8. С.43-50.
- Поврозник В.С., Шеин А.Б. Катодное поведение силицидов металлов группы железа в кислых электролитах различного состава. Материалы Международной конференции молодых ученых по фундаментальным наукам «Ломоносов-2006», секция «Химия». Москва, 2006. Т. 1. С. 175
- Шеин А.Б., Ракитянская И.Л., Поврозник В.С., Иванова О.С., Минх Р.Н. Силициды переходных металлов – новые перспективные электродные материалы // В кн.: «Принципы и процессы создания неорганических материалов». Материалы Междунар. Симпозиума «III Самсоновские чтения», Хабаровск, 12-15 апреля 2006, Хабаровск: Изд. ТОГУ, 2006. С.94-95.
- Поврозник В.С. Влияние процесса деаэрации на реакцию выделения водорода на металлах подгруппы железа и их силицидах // Материалы XLIV Международной научной студенческой конференции «Студент и научно-технический прогресс». Серия Химия / Новосиб. Гос. Ун-т. Новосибирск, 2006. С.73-74.
- Поврозник В.С. «Влияние температуры электролита на катодное выделение водорода на силицидах металлов группы железа в кислом электролите» // Проблемы теоретической и экспериментальной химии: тез. докл. XVI Рос. молодёж. науч. конф., посвящ. 85-летию со дня рожд. проф. В. П. Кочергина, Екатеринбург, Екатеринбург: Изд-во Урал. ун-та, 2006. С.133
- Поврозник В.С., Шеин А.Б. Катодные процессы на силицидах металлов триады железа в кислых электролитах. Материалы Всероссийской конференции «Физико-Химические процессы в конденсированном состоянии и на межфазных границах»(«ФАГРАН-2006»). Воронеж, 2006. T 1.С.186-188.
- Шеин А.Б., Ракитянская И.Л., Поврозник В.С., Иванова О.С., Минх Р.Н. Силициды переходных металлов – новые перспективные электродные материалы // В кн.: «Высокие технологии, фундаментальные и прикладные исследования, образование». Сборник трудов второй международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности». Санкт-Петербург. Изд-во Политехнического ун-та, 2006. С. 106-109.
- Поврозник В.С., Ракитянская И.Л., Шеин А.Б. Влияние способа изготовления электрода на кинетику катодного процесса // В кн.: Инновационный потенциал естественных наук. Труды Междунар. науч. конф. Пермский ун-т; Естественнонаучный ин-т. Пермь, 2006. Т.1. С.118-121.
- Поврозник В.С., Шеин А.Б. Влияние внутренних и внешних факторов на катодное выделение водорода на силицидах металлов группы железа в сернокислом электролите // Защита металлов. 2007. Т.43. № 2 . С. 216-227.
