Выделение серебра из концентрированных хлоридных растворов 05. 17. 03 Технология электрохимических процессов и защита от коррозии
| Вид материала | Автореферат |
- Локальная коррозия оборудования из нержавеющих сталей при эксплуатации установок переработки, 371.28kb.
- Состояние структуры, электрохимическое поведение и магнитные свойства наноструктурируемых, 327.79kb.
- Катодные процессы на силицидах металлов триады железа в кислых электролитах 05. 17., 237.17kb.
- Электрохимическое получение наноразмерных pt/c катализаторов для твердополимерных топливных, 944.18kb.
- Получение оптически селективных и чёрных оксидных плёнок на алюминии и его сплавах, 222.41kb.
- Высокопроизводительные процессы электроосаждения никеля и сплава никель-фосфор из электролитов,, 468.58kb.
- Нестационарные процессы деградации в щелочных аккумуляторах, закономерности и технологические, 585.56kb.
- Утверждаю, 108.58kb.
- «Вызов», 86.73kb.
- Совершенствование электрохимических процессов водородной энергетики, 327.81kb.
На правах рукописи
НАТОРХИН МАКСИМ ИГОРЕВИЧ
ВЫДЕЛЕНИЕ СЕРЕБРА
ИЗ КОНЦЕНТРИРОВАННЫХ ХЛОРИДНЫХ РАСТВОРОВ
05.17.03 - Технология электрохимических процессов и защита от коррозии
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Санкт-Петербург – 2011
Работа выполнена на кафедре «Физика и математическое моделирование в механике» при федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Санкт-Петербургский государственный политехнический университет»
Научный руководитель
доктор технических наук,
профессор Гаршин Анатолий Петрович
Официальные оппоненты:
доктор химических наук,
профессор Беляев Александр Николаевич
кандидат технических наук Борцов Николай Николаевич
Ведущая организация: Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Санкт-Петербургский государственный Горный университет»
Защита состоится «15» февраля 2012 г. в 1000 час., ауд. 61 на заседании совета по защите докторских и кандидатских диссертаций Д 212.230.08 при федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Санкт-Петербургский государственный технологический институт (технический университет)»
С диссертацией можно ознакомиться в фундаментальной библиотеке института.
Отзывы на автореферат в одном экземпляре, заверенные печатью, просим направлять по адресу: 190013, Санкт-Петербург, Московский пр. д.26, Санкт-Петербургский государственный технологический институт (технический университет), Ученый совет; тел. 494-93-75; факс: 712-77-91; Email: dissovet@technolog.edu.ru.
Автореферат разослан «27 » декабря 2011 г.

Ученый секретарь совета,
к.техн.наук, доцент С.А.Лаврищева
ОБЩАЯ ХАРАКТЕРИСТКА РАБОТЫ
Актуальность темы.
Истощение серебросодержащего сырья и рост стоимости серебра приводят к необходимости разработки новых, экологически чистых технологий получения металлов из бедных и некондиционных источников. Одним из перспективных путей переработки бедного, некондиционного свинцово-цинкового сырья, являющегося ценным источником серебра, может служить его хлоридное выщелачивание, в результате которого серебро совместно со свинцом извлекается насыщенными растворами хлоридов. Проводить операцию обессеребривания на стадии очистки хлоридных растворов гораздо проще, быстрее, дешевле и экологичнее, чем на стадии получения металлического свинца. Теория и методы выделения серебра из концентрированных хлоридных растворов еще недостаточно исследованы, хотя существует практика успешного глубокого выделения серебра и меди с помощью контактного обмена (цементации) из сульфатных и цианидных растворов, что позволяет предположить эффективность данных методов и в случае хлоридных растворов. Недостаточность сведений, как по теории, так и по практике глубокого извлечения металлов из хлоридных растворов, равно как и данных для развития хлоридных технологий, а также все возрастающие цены на серебро являются основанием целесообразности проведения данного исследования.
Цель работы.
Цель работы состояла в научно-обоснованном выборе и всестороннем исследовании процессов, обеспечивающих глубокое извлечение серебра из хлоридных растворов с последующим получением его в виде металла.
Задачи диссертационной работы:
1.Рассмотреть теоретические основы метода химического осаждения серебра в виде малорастворимых соединений и метода контактного обмена и провести их анализ.
2.Изучить термодинамику и кинетику процессов, лежащих в основе выбранного метода. Исследовать влияние состава раствора и условий проведения процесса и его контроля для достижения эффективного извлечения (осаждения) серебра.
3.Разработать метод переработки продуктов осаждения серебра из хлоридных растворов с целью получения серебра в металлическом виде.
Методы исследования.
Для решения поставленных в работе задач использован комплекс физико-химических и электрохимических методов: электронная микроскопия, снятие потенциодинамических поляризационных кривых с использованием потенциостатов ПИ 50.1.1, IPC-М, фотоколориметрические, атомно-адсорбционные и потенциометрические методы анализа. Для исследований применялись модельные хлоридные растворы на основе хлорида кальция и хлорида цинка. Опыты по осаждению серебра и меди проводились в реакторах объемом 1 дм3 с блоками автоматического перемешивания и контролем температуры в атмосфере аргона. Погрешность экспериментальных результатов составляла 5-20% в зависимости от метода.
Обработка полученных данных осуществлялась с помощью компьютерных программ STATISTICA 6, Origin Pro 8, Math Cad 10. Исследование промежуточных и конечных продуктов осуществлялась с использованием сканирующего электронного микроскопа JSM 7001F при напряжении 2-5 kV.
Научная новизна:
1. Определены кинетические закономерности и представления о механизмах протекания сопряженных процессов при цементации ионов серебра и меди свинцом и цинком.
2. Найдены и научно обоснованы условия, необходимые для образования структурированной свинцовой губки, обладающей высокоразвитой поверхностью, позволяющей практически нацело извлекать серебро из насыщенных хлоридных растворов. Установлена структура и механизм образования структурированных свинцовых губок и высокопористого губчатого серебра.
3. Определены зависимости скорости и глубины протекания (полноты) процесса цементации серебра и меди свинцово-цинковой губкой от следующих факторов: концентрации металлов, температуры, количества и способа введения цинка, режима перемешивания.
4. Получены результаты по кинетике растворения свинца, меди и серебра в соляной кислоте в присутствии и отсутствии ионов меди, кальция и цинка.
Практическая ценность:
- Рекомендованные условия проведения процесса цементации позволяют осуществлять достаточно полную очистку концентрированных хлоридных растворов от серебра и меди, а также, минуя в дальнейшем стадию обессеребривания, получать из данных растворов свинец, соответствующий свинцу марки С-1, что значительно сокращает материальные и энергетические затраты.
- Предложенные методы колориметрического определения содержания серебра в хлоридном растворе и измерения потенциалов в дисперсных средах в процессе осаждения серебра, позволяют значительно сократить время и стоимость анализов при проведении процесса цементации.
- Показана возможность получения в результате выщелачивания в HCl свинцово-серебряных отходов практически чистого порошкового серебра (G0) и хлорида свинца (ч.д.а.), а также высокопористого губчатого серебра, которые могут быть использованы как самостоятельные товарные продукты с высокой добавленной стоимостью.
На защиту выносятся:
- Результаты по термодинамике и кинетике сопряженных электрохимических реакций, лежащих в основе цементации ионов серебра и меди структурированной свинцово-цинковой губкой из концентрированных хлоридных растворов.
- Результаты комплексных исследований скорости извлечения серебра и меди из хлоридных растворов в зависимости от состава раствора и условий протекания процесса.
- Результаты исследований по условиям получения металлического серебра и хлорида свинца в виде товарных продуктов с помощью солянокислого растворения свинцовых губок, образующихся в результате осаждения серебра.
- Представления о модели образования высокопористых свинцовых и серебряных губок, модели протекания процессов осаждения серебра, растворения металлов в соляной кислоте, а также метод колориметрического определения концентраций серебра и меди в хлоридном растворе в процессе цементации и способ измерения потенциалов в дисперсных средах.
Личный вклад автора заключается в общей постановке цели и задач исследования, получении, анализе, интерпретации и обобщении экспериментальных результатов, формулировке выводов, вытекающих из экспериментальных и теоретических исследований. Основная экспериментальная часть работы, а также написание и публикация печатных материалов выполнена лично автором.
Достоверность результатов работы обеспечивается использованием фундаментальных положений физической химии, химии комплексных соединений, теоретической электрохимии и химической кинетики и применением современных компьютерных методов статистической обработки и моделирования. Научные положения, результаты экспериментов и выводы, полученные на основе анализа теоретических положений и экспериментальных данных, подтверждены экспериментально независимыми методами и сопоставлены с экспериментальными и теоретическими данными, полученными другими исследователями.
Апробация работы. Результаты диссертационной работы обсуждались на 6 Международных и российских конференциях и семинарах, в том числе: на Международной конференции «Металлургические технологии и экология», проходившей 13-16 июня 2000 г. в СПб, на III Бардинских чтениях, на I конференции молодых специалистов института «Гипроникель». Один из докладов на Политехническом Симпозиуме удостоен диплома «За лучший доклад».
Публикации. По теме диссертации опубликовано 14 научных работ, из них 5 статей опубликовано в журналах ВАК; тезисы 6-ти докладов на Российских и Международных научно-практических конференциях и 3 патента РФ.
Объем и структура работы. Диссертационная работа изложена на 161 странице машинописного текста, содержит 32 рисунка, 23 таблицы, 4 приложения и состоит из введения, пяти глав, выводов и списка литературы, включающего 154 наименования.
Краткое содержание работы
Во введении обоснована актуальность работы, сформулирована цель исследования, определены основные задачи. Показана научная новизна и практическая значимость проводимых исследований, приведены сведения по апробации, объему и структуре работы.
В первой главе приведен обзор литературных данных по методам выделения серебра из твердых фракций и из растворов. Проанализированы источники получения серебра из хлоридных растворов и сделан вывод, что эффективные методы выделения серебра из концентрированных хлоридных растворов, содержащих другие металлы, практически отсутствуют. Наиболее перспективными по полноте осаждения серебра из насыщенных хлоридных растворов является осаждение в виде малорастворимых соединений серебра и цементационное осаждение более активными металлами. В связи с этим в первой главе подробно рассмотрены теоретические основы осаждения металлов с помощью контактного обмена. В литературе достаточно полно освещены вопросы цементации различных металлов, но мало данных по теории и практике цементации серебра из комплексной формы на губках, обладающих высокоразвитой поверхностью. В то же время, исходя из теории процесса контактного обмена, и из анализа результатов работ по цементационному осаждению меди следует, что и процесс контактного осаждения серебра может оказаться весьма эффективным.
Во второй главе представлены применяемые в работе методики исследований: приготовление и анализ растворов, снятия поляризационных кривых и измерения потенциалов в процессе цементации, исследования кинетики цементации на вращающемся дисковом электроде, исследования растворения металлов и изучения структуры губок, а также методики расчета, обработки результатов, построения графиков и редактирования рисунков.
В третьей главе рассматривается процесс осаждения серебра и примесей из хлоридных растворов методом образования малорастворимых соединений. Так как растворы хлоридного выщелачивания, содержат от 10 до 15 г/дм3 свинца (что определяется растворимостью хлорида свинца) и от 10 до 25 мг/дм3 серебра, то для дальнейшего получения свинца марки С-1 (ГОСТ 3778-98), необходимо снизить содержание серебра до 0,001%, то есть - менее 0,1-0,15 мг/дм3. С целью изучения возможностей осаждения серебра и поведения примесей в хлоридном растворе был приготовлен модельный раствор следующего состава, г/дм3: Ca2+: 137- 138, Cl-: 240 - 242, Pb2+: 12 - 15, Fe общее: 0,48 – 0,52 , Ag+: 15 - 25 мг/дм3, Cu общая: 15 - 25 мг/дм3, рН = 1,4 – 1,6. Для приготовления растворов использовали вещества классификации х.ч. и ч.д.а. Опыты проводились в реакторе с блоком автоматического перемешивания, контролем температуры и водородного показателя (рН). Растворы и осадки анализировались методами атомно-адсорбционной эмиссионной спектроскопии (ААЭС), индукционно - связанной плазмы (ИСП), циклической вольтамперометрии (ЦВА), и потенциометрического титрования. Приведен расчет массы необходимых добавок реагентов для наиболее полного осаждения серебра. В ходе исследований экспериментально установлено, что осаждение серебра простыми химическими реагентами, такими как CaSO3, CaS2O3 и KBr малоэффективно из-за высокого остаточного содержания серебра.
В четвертой главе рассматривается процесс осаждения серебра и примесей из растворов хлоридного выщелачивания методом цементации на свинцовых губках. Рассмотрен процесс комплексообразования с ионами серебра и его спутниками (медь, свинец, цинк). На основании расчетов долей ионов при комплексообразовании по уравнению 1, исходя из уравнения 2 рассчитаны значения равновесных потенциалов (рис.1).
где: q – координационное число комплекса, n – заряд иона металла, [L] – концентрация лиганда, βi – общие константы образования комплексов
(причем, β0 =1).
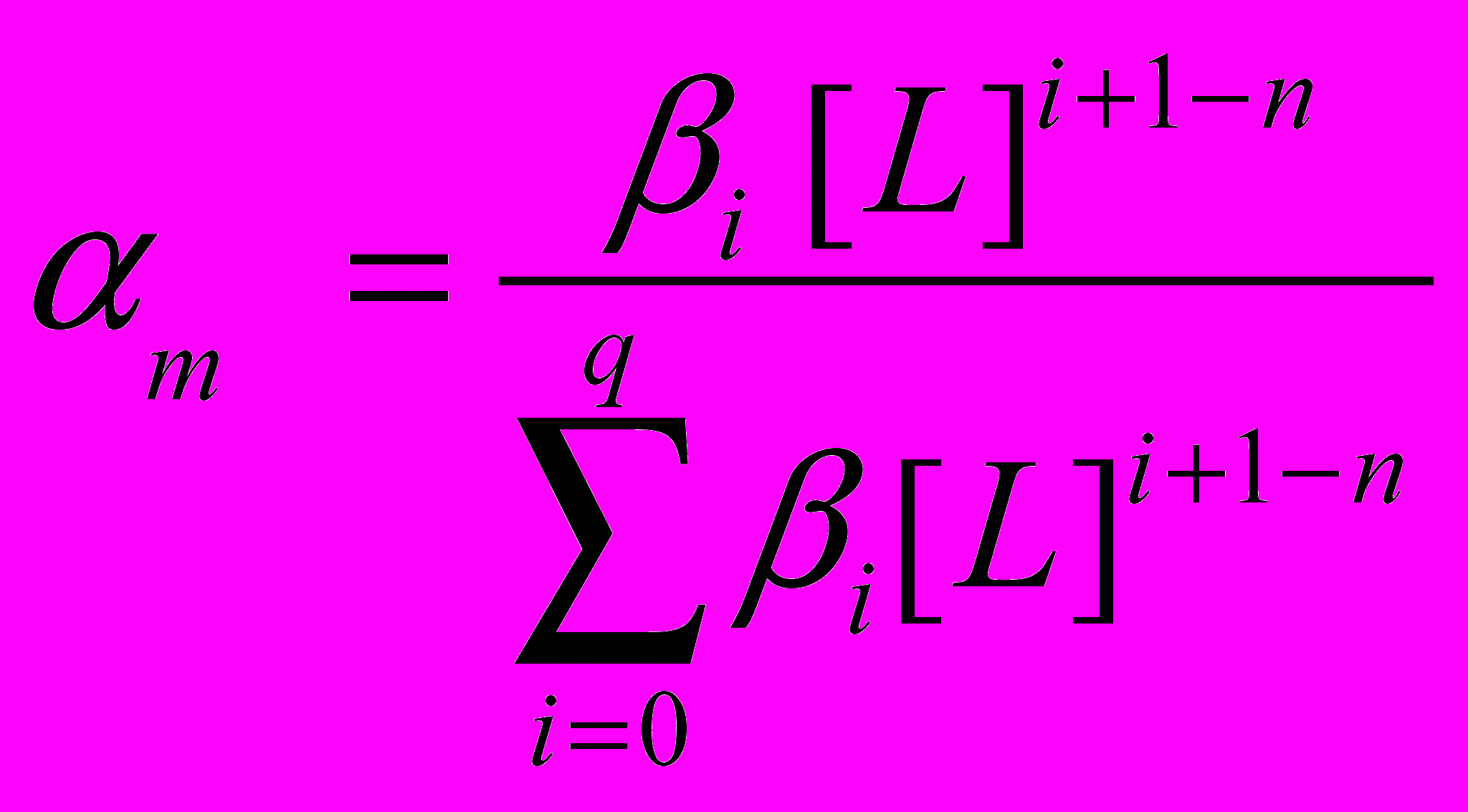 (1)
(1)
Рисунок 1. Зависимость равновесных потенциалов металлов от концентрации хлорид-ионов.
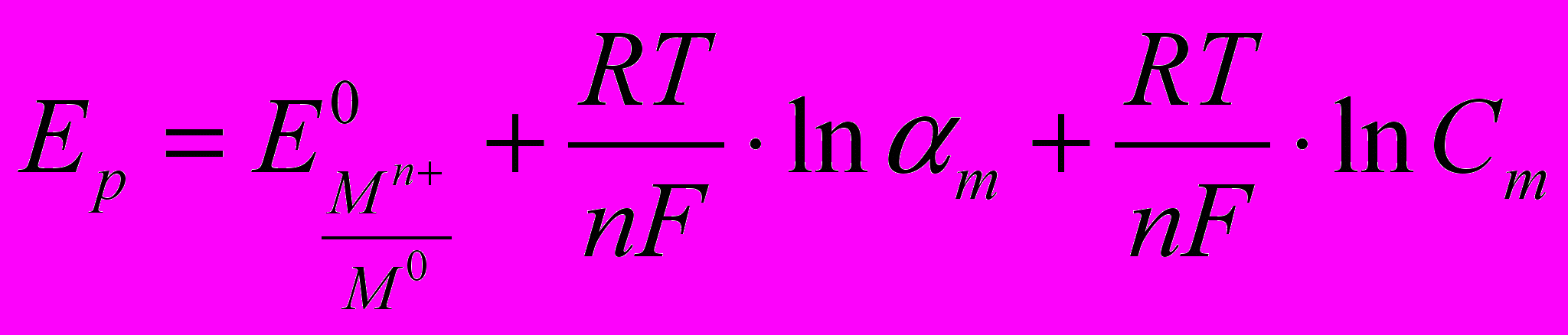 (2)
(2)где: Сm - концентрация металла в растворе, моль/дм3; m - доля ионов металла в растворе;Е0 – стандартный потенциал реакции Мn++ne→M; R – газовая постоянная, 8,31 Дж/К·моль; Т – температура, °К; n – число электронов в реакции; F – число Фарадея, 96485 Кл/моль электронов.
В области концентраций модельных хлоридных растворов разница равновесных потенциалов остается достаточной для того, чтобы реакции цементации серебра и меди не только на цинке, но и на свинце были термодинамически возможны, что осуществляется, когда значение равновесного потенциала реакции окисления металла (Eр(Ox)) отрицательнее значения равновесного потенциала реакции восстановления ионов другого металла (Eр(Red)) до металлического состояния.
При условии достижения равновесия, когда Eр (Red) = Eр(Ox) может быть рассчитана остаточная концентрация металла в растворе:
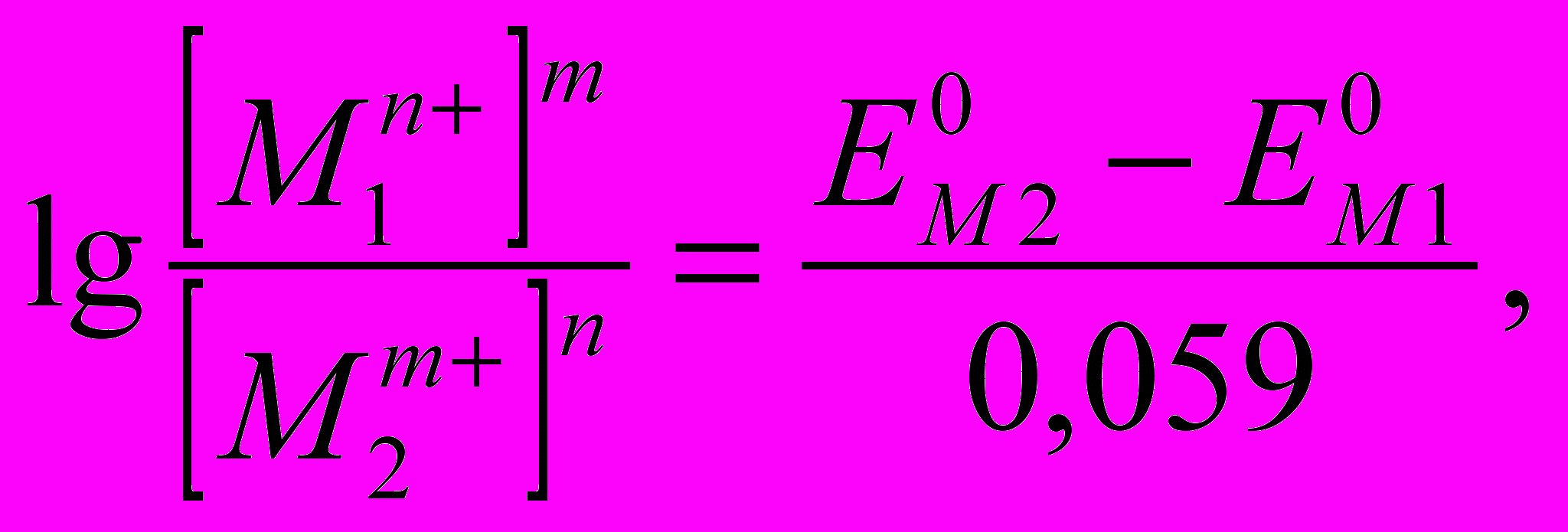 (3)
(3)где: Е°М1 и Е°М2 - стандартные потенциалы металлов в растворе их простых ионов, [M1n+] и [M2m+] их равновесные концентрации, 0,059 = 2,3 · (RT/F) при 25°С.
В случае осаждения серебра и меди из модельного раствора свинцом [Ag] равн.= 1,85 ·10-5 моль/дм3 (0,002 мг/дм3); [Cu] равн. = 5,98·10-4 моль/дм3 (0,038 мг/дм3).
Из приведенных значений величин равновесных концентраций видно, что с помощью цементации возможно достаточно полно выделить как медь, так и серебро.
Возможность эффективного осаждения серебра и меди определяется не только термодинамическими факторами, но и механизмом и кинетикой протекания сопряженных реакций. В связи с этим была изучена кинетика разряда ионов серебра и меди, а также ионизация свинца на чистых металлах.
При анализе поляризационных кривых, полученных экспериментально на чистых серебре, меди и свинце из 2,5 М раствора CaCl2 с содержанием 100 мг/дм3 серебра, 200 мг/дм3 меди и 6,8 г/дм3 свинца при 60°С со скоростью развертки потенциала 1-100 мВ/с, было установлено, что осаждение серебра и меди осуществляется на предельном токе, а растворение свинца происходит в активной области (рис.2).
Рисунок 2. Поляризационные кривые разряда ионов серебра (Ag) меди (Cu) и ионизации свинца (Pb) и цинка (Zn).
Zn – расчетная кривая
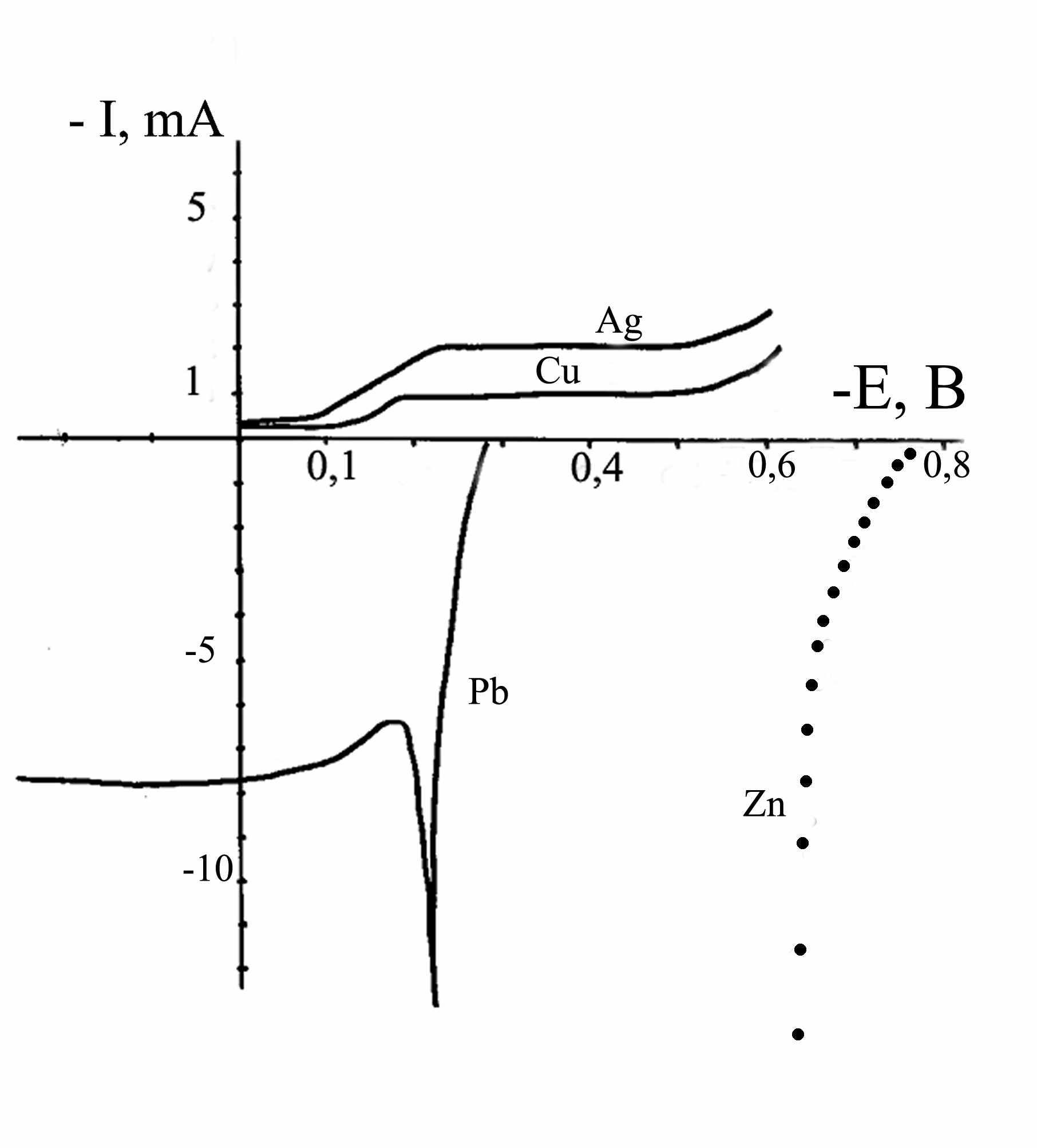
Увеличение абсолютного значения потенциала (например, осаждение на более активном металле), не приведет к ускорению выделения серебра и меди, но будет способствовать увеличению выделения водорода за счет растворения в кислоте более активного металла. Поэтому, ускорить достижение равновесия и интенсифицировать процесс осаждения возможно при увеличении площади поверхности контакта металлов с раствором.
Экспериментально было установлено, что цементация значительно интенсифицируется, если проходит на свинцовой губке, обладающей развитой поверхностью. Разветвленность и площадь поверхности образующейся свинцовой губки зависят от способа подачи цинкового порошка.

Pb
губка

Хлоридный
раствор

Рисунок 3. Вид свинцовой губки в момент её образования. Губка состоит из переплетенных друг с другом свинцовых нитей.
При подаче цинкового порошка, диспергированного в 1-5% растворе HCl, в первые же секунды образуется структурированная свинцовая губка, на которой осаждаются металлы. Губка образуется потому, что скорость выделения металлического свинца существенно превосходит скорость его кристаллизации.
При образовании структурированной свинцовой губки наблюдается существенное изменение потенциалов на границе с раствором. Для измерения потенциалов в дисперсных средах (внутри свинцовой губки) была разработана методика измерения потенциала в процессе цементации на углеволоконных нитях (ткань графитовая ТГН). Для этого был изготовлен специальный электрод, представленный на рис. 4. Предварительно, перед измерением потенциала, волокна ТГН покрывались 10-15 минут на предельном токе цинком из раствора, содержащем 5 г/дм3 ZnSO4. Измерение и запись потенциала проводилась на потенциостате IPC – М с использование двухэлектродной схемы: рабочий электрод – ткань ТГН, электрод сравнения – насыщенный хлоридсеребряный KCl, (AgCl/Ag), присоединенный через капилляр Луггина.

Термоусадочная трубка

Капилляр
Луггина

Волокно
ТГН 1


Рисунок 4. Электрод для измерения потенциала в дисперсной среде в процессе цементации.
Для проведения процесса цементации и измерения потенциала использовалась стеклянная ячейка на 500 см3, которая термостатировалась при (60 ± 1)°С. В ячейку заливали рабочий раствор, аналогичный используемому для снятия поляризационных кривых, но без серебра и меди: раствор 2,5М CaCl2, содержащий и 6,8 г/дм3Pb с рН 1,4-1,6. При погружении в данный раствор электрода для измерения потенциала, волокна ТГН, покрываются в результате реакции контактного обмена разветвленной свинцовой губкой, которая осуществляет токоподвод к дисперсным частицам среды. В результате получается интегральное (а не локальное, как в случае, например, платинового электрода) измерение потенциала. Результаты изменения потенциала в процессе цементации представлены на рис. 5.
В интервале времени, соответствующем 0-160 секунд происходит выделение свинца на оцинкованном углеволокне, при этом потенциал приближается к – 505 мВ, что соответствует компромиссному потенциалу цинк – свинец. На участке 160-200 секунд происходило введение в реактор диспергированной навески цинковой пыли, что привело к падению потенциала до – 980 мВ, а это соответствует потенциалу реакции
Zn 2+ +2e→Zn в хлоридном растворе.

Рисунок 5. Изменение во времени потенциала на ТГН при образовании свинцовой губки из модельного раствора.
На участке 200-300 секунд происходит образование структурированной свинцовой губки, сопровождающееся повышением потенциала до уровня – 500 мВ, что соответствует – 298 мВ по водородной шкале. Данное значение в пределах погрешности вполне согласуется со значением - 307 мВ для реакции разряда свинца и потенциалом – 761 мВ для реакции разряда цинка в 2,5 М хлоридном растворе, полученными расчетным путем (рис.1).
Таким образом, из рисунка 5 видно, что в процессе формирования свинцовой губки потенциал меняется от цинкового к свинцовому, поэтому осаждение серебра и меди также происходит в условиях изменения потенциала.
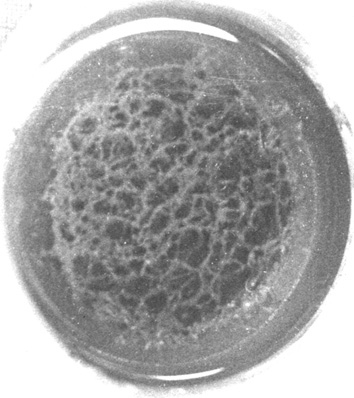
Была изучена структура и механизм образования свинцовой губки. Механизм образования свинцовой губки включает три стадии: образование зародышей (микрочастиц свинца), структурирование образовавшихся частиц в нитевидные цепочки, переплетенные друг с другом и далее – сжатие губки. При исследовании свинцовой губки под электронным микроскопом (рис.6.) были обнаружены многочисленные фрагменты нитевидных структур, которые при большом увеличении состояли из многочисленных частичек свинца и небольших пустот (правый фрагмент на рис.6) от пузырьков водорода.

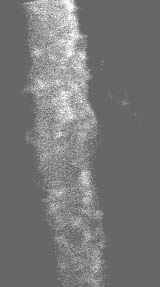

Рисунок 6. Структура свинцовой губки под электронным микроскопом (правый фрагмент показывает свинцовую нить при большем (4×) увеличении).
Кинетика цементации изучалась методами изменения концентрации серебра в растворе во время осаждения при цементации на свинцовой губке и на вращающемся свинцовом дисковом электроде.
При изучении механизма осаждения серебра на вращающемся дисковом электроде было установлено, что осаждение серебра и меди протекает по реакции первого порядка.
В случае цементации на свинцовых губках осаждение металлов протекает более сложно, (рис.7). Экспериментально было установлено, что через 10 - 15 минут наступает самопроизвольное сжатие свинцовой губки, в результате чего скорость осаждения серебра и меди замедляется.
Кинетика осаждения в этом случае хорошо описывается эмпирическими уравнениями (4) в начальный и (5) в заключительный период:
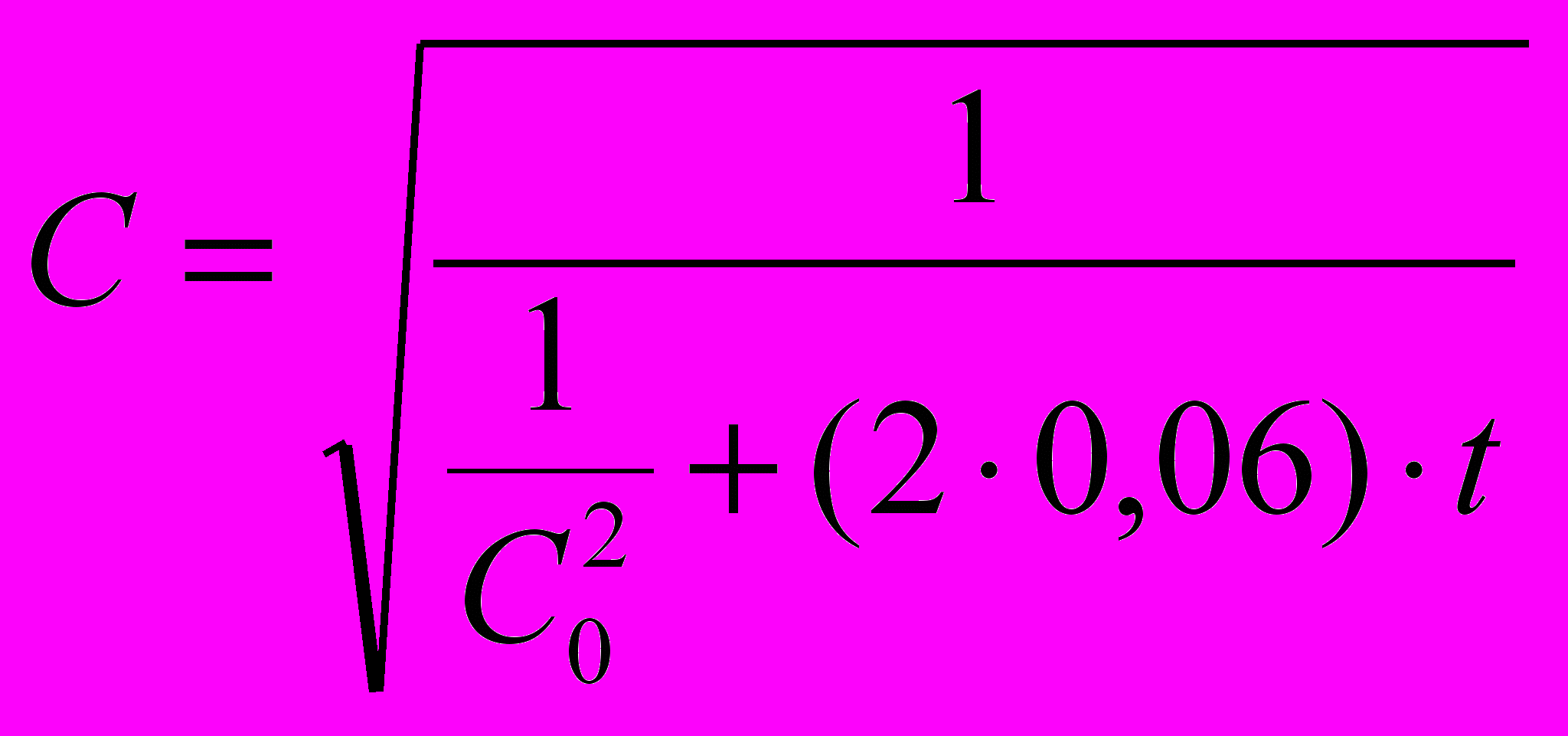 (4)
(4)С =
 (5)
(5)где: С0 – начальная концентрация серебра, мг/дм3; t – время, с.
Учитывая, что механизм процесса цементации серебра свинцово-цинковой губкой идентичен механизму, рассмотренному Дроздовым, полученные результаты были построены в координатах, требуемых уравнением, которое было предложено автором.

Рисунок 7. Изменение концентрации металлов при их осаждении свинцовой губкой.
Следует отметить, что предполагается в этом случае уменьшение поверхности при цементации на предельном токе за счет уменьшения активной поверхности металла (S) обратно пропорциональной осевшему металлу, определяемой как убыль содержания металла в растворе (С0 – Сi), при этом S = K1/(С0-Сi), где К1 – константа; C0, Ci – начальная и текущая концентрация осаждаемого металла в растворе:
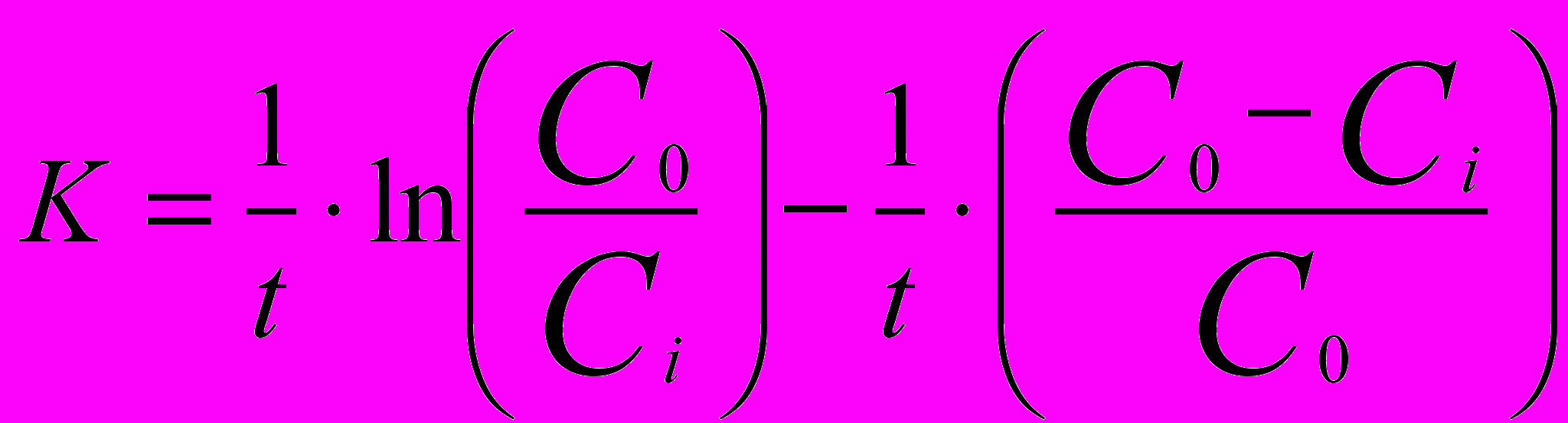 (6)
(6)где: С0; Ci – исходная и текущая концентрации; t – время, с.
При температуре 60°С: К = 0,027, при температуре 90°С : К = 0,015.
Энергия активации на участке 60 - 90°С, составляет 20 кДж/моль.
Построенный по полученным нами экспериментальным точкам график подтверждает зависимость Б.В. Дроздова (рис.8).
Таким образом, соответствие экспериментальных данных уравнению Дроздова еще раз подтверждает, что цементация серебра из хлоридных растворов происходит на предельном токе на внешней поверхности активного металла.
Экспериментальные исследования влияния начальной концентрации серебра показали, что при увеличении начальной концентрации осаждение протекает более полно, что, по-видимому, связано с увеличением движущей силы цементации в этом случае.
На основании исследования кинетических факторов процесса цементации было установлено, что наиболее разумное время проведения процесса осаждения для достижения остаточного содержания серебра 0,15 мг/дм3 составляет 60 минут.
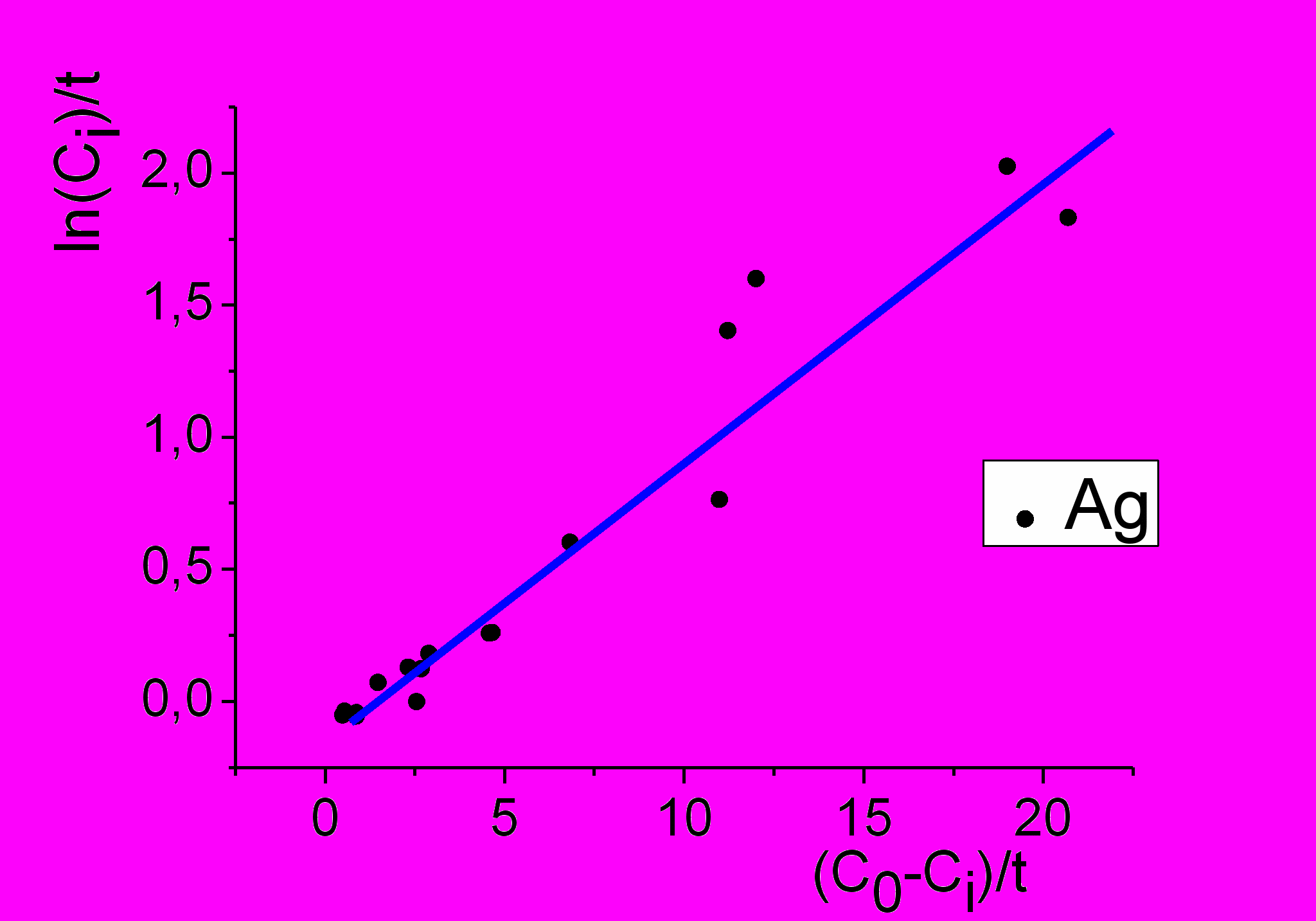
Рисунок 8. Зависимость концентрации серебра от времени в координатах
Б.В. Дроздова: Х = (C0 – Ci)/t; Y =ln(Ci)/t.
Были исследованы также другие существенные факторы, такие как температура, способ введения цинка и режим перемешивания.
При рассмотрении зависимости остаточного содержания серебра после его выделения из хлоридного раствора от расхода цинка было установлено, что необходимая глубина осаждения серебра (0,15 мг/дм3) достигается при расходе цинка 1200 мг/дм3. Кратность подачи позволяет снизить расход цинка. При 2-3 кратной подаче требуемая глубина осаждения серебра достигается за 1-2 часа при введении 500-700 мг Zn на 1 дм3 раствора. Оптимальная температура осаждения серебра на свинцовой губке составляет 60ºС, оптимальный режим перемешивания включает небольшую выдержку 1-5 минут, необходимую для структурирования губки и затем – перемешивание в умеренном режиме со скоростью 600 об/с.
Для контроля проведения процесса цементации была исследована возможность определения Ag и Cu колориметрически. При цементационном осаждении Ag и Cu меняется их содержание в растворе, что приводит к уменьшению интенсивности окраски раствора. Раствор имеет максимум в спектре поглощения при 330 нм (рис 9).
Измеряя светопоглощение (относительно воды при толщине кюветы в 1 см) при 330 нм, можно построить калибровочные кривые и рассчитать зависимости содержания серебра и меди от светопоглощения (D):
содержание меди = 1,58·D – 1,00 (мг/дм3) (7)
содержание серебра = 2,07·D – 2,04 (мг/дм3) (8)

Рисунок 9. Спектр поглощения исходного медьсодержащего хлоридного раствора.
Определение содержания Ag и Cu может быть легко осуществлено измерением светопоглощения при 330 нм и расчетом по формулам, подобным (7) или (8).
Таким образом, при цементации на свинцовых губках может быть достигнута достаточно полная очистка концентрированных хлоридных растворов (достигнута цель: серебро осаждается из хлоридных растворов до остаточного содержания 0,08 мг/дм3, а медь - 0,15 мг/дм3), что делает возможным использование этого метода для очистки концентрированных хлоридных растворов.
В пятой главе представлены результаты по исследованию переработки серебро - содержащей свинцовой губки с целью разделения входящих в нее металлов. Свинцовая губка, полученная при цементационной очистке свинецсодержащего хлоридно-кальциевого раствора, содержит кроме свинца и серебра еще медь, цинк и адсорбированный из раствора хлорид кальция. Содержание серебра и меди в свинцовых губках зависит главным образом от начальных и конечных содержаний металлов в хлоридно-кальциевом растворе и составляло 0,3-1,8% для Ag и 0,4-2% для Cu.
При переработке свинцовых губок необходимо отделить свинец от серебра и меди и получить серебро и медь в металлическом виде. Были проведены исследования возможности растворения входящих в состав свинцовой губки металлов и установлено, что возможно выполнить данную задачу с помощью солянокислого растворения, когда свинец и медь растворяются в HCl, а серебро - нет.
На основании проведенных исследований методом трехстадийного противоточного солянокислого выщелачивания был получен PbCl2 (72,4% Pb, 0,0005% Ag, 0,0011% Cu, 0,0021%Zn, 27,9% Cl). Согласно ГОСТ 4210-77 и ТУ 6-09-5383-88, хлорид свинца, получаемый по данному методу, может соответствовать марке «чда». В результате солянокислого выщелачивания свинцовых губок получается также чистое, порошковое серебро: Ag99,95%, 0,03%Cu, 0,01%Pb.
При проведении опытов по получению и растворению свинцовых губок была обнаружена экспериментальная закономерность, заключающаяся в том, что при высоких отношениях серебра к свинцу в губке и последующем солянокислом растворении серебро также получалось в виде высокопористой губки с плотностью 1,2 – 1,4 г/см3. С помощью электронной микроскопии был исследован механизм образования высокопористого губчатого серебра. Было установлено, что при растворении в HCl серебросодержащей свинцовой губки происходит ее разрушение с образованием отдельных частичек серебра, которые впоследствии «срастаются» друг с другом, образуя серебряную губку (рис.10).



1
2
Рисунок 10. Серебряная губка под электронным микроскопом. Видны места «срастания» (1) частичек серебра (2).
Предположительный механизм «срастания» частичек серебра можно объяснить наличием на поверхности серебра, находящегося в HCl, тонких пленок AgCl, способных разлагаться с выделением серебра. Незначительная плотность образцов объясняется их высокой пористостью, образованной на месте растворенного в HCl свинца, а также наличием «двойных стенок» (рис.11).
Возможная интерпретация «двойных контуров» на рис.11 - наличие пустоты внутри частиц серебра, образованной при растворении металлов в HCl, на поверхности которых сцементировалось серебро. При травлении в HCl наблюдается образование глубоких пор в массиве губчатого серебра (рис.12).
Получаемое таким способом губчатое серебро может использоваться как самостоятельный товарный продукт с высокой добавленной стоимостью, например, в медицине (нанокластерные материалы для уничтожения бактерий, вирусов, грибков и.т.д.), в источниках тока (высокоактивная электродная масса серебряно-цинковых элементов) и как катализатор с высокоразвитой поверхностью.


Рисунок 12. Губчатое серебро при травлении в HCl:
1 – пора
2 – серебро.
1
2

1
2
Р
 исунок 11. Микрофотография губчатого серебра (1)
исунок 11. Микрофотография губчатого серебра (1)и «двойных стенок» (2) на его поверхности.
Таким образом, с помощью исследованного нами процесса цементации серебра из концентрированных хлоридных растворов и трехстадийного противоточного выщелачивания свинцовых губок в HCl возможно не только проводить эффективную переработку свинецсодержащих отходов, но и получать товарные продукты с высокой добавленной стоимостью: чистый хлорид свинца и порошковое серебро и высокопористое губчатое серебро.
Основные выводы по работе
1. Проведен расчет равновесных потенциалов исследуемых металлов в хлоридных растворах и показано, что в этих растворах, состав которых близок к растворам хлоридного выщелачивания, протекание процесса цементации серебра свинцом и цинком термодинамически возможно.
2. Определены условия проведения процесса цементации, приводящие к образованию структурированной свинцовой губки с высокоразвитой поверхностью; установлено, что структура свинцовых губок включает нитевидные структуры, стабилизированные в своей форме газообразным водородом. Изучено влияние комплекса факторов и предложены оптимальные условия осаждения серебра и меди.
3. Определены кинетические параметры цементационного осаждения серебра и изменение состава свинцово-цинковой губки в зависимости от изменения условий осаждения. Установлено, что процесс осаждения серебра свинцом происходит на предельном токе и описывается кинетическими уравнениями первого порядка; при осаждении серебра структурированной свинцовой губкой с сильно меняющейся во времени поверхностью процесс осаждения описывается уравнениями, учитывающими изменение площади поверхности активного металла.
4. Разработан метод колориметрического определения концентраций ионов серебра и меди в хлоридных растворах в процессе совместного осаждения путем измерения светопоглощения и способ измерения потенциалов в дисперсных средах, существующих в условиях цементации.
5. Экспериментально установлено, что практически полное удаление серебра (и меди) из насыщенных хлоридных растворов может быть достигнуто при их цементационном осаждении на структурированной свинцовой губке, обладающей высокоразвитой поверхностью. Теоретически рассчитанная остаточная концентрация ионов серебра Ag+ в хлоридном растворе при содержании катионов свинца Pb2+ 10 г/дм3 составляет 0,002 мг/дм3, а остаточная концентрация катионов меди Cu+ - 0,038 мг/дм3; экспериментально установлено, что при цементации на свинцовой губке серебро осаждается из хлоридных растворов до остаточного содержания 0,08 мг/дм3, а медь - 0,15 мг/дм3, что делает возможным использование этого метода для очистки концентрированных хлоридных растворов.
6. Показана возможность выделения металлического серебра, меди и цинка из свинцово-серебряной губки при ее выщелачивании в соляной кислоте с получением чистого серебра (99,5% Ag) и хлорида свинца (PbCl2).
7. С использованием разработанных в данной работе особенностей цементационных методов получена высокопористая серебряная губка, которая может представлять самостоятельный ценный продукт и с успехом применяться в источниках тока и как катализатор. Показано, что образцы высокопористой серебряной губки имеют плотность 1,2 - 1,45 г/см3 при достаточно однородной микроструктуре.
Материалы диссертации изложены в следующих публикациях:
- Наторхин М.И. Энергосберегающее извлечение серебра при гидрометаллургической переработке некондиционного сырья. - Тезисы доклада Политехнического симпозиума «Технические науки - промышленности региона». СПб: СПбГПУ, 2002.- С. 24 - 25.
- Наторхин М.И. Извлечение металлического серебра при гидрометаллургической переработке свинцово-цинкового сырья // Известия Вузов. Цветная металлургия. - 2002.-№2.- С. 14-16.
- Наторхин М.И. Колориметрическое определение серебра и меди. - Тезисы доклада Политехнического симпозиума «Технические науки - промышленности региона». СПб: СПбГПУ, 2002. - С. 14-15.
- Наторхин М.И. Колориметрическое определение серебра и меди в растворах хлоридного выщелачивания // Известия Вузов. Цветная металлургия. - 2003.-№1.- С. 4-5.
- Наторхин М.И. Получение металлического серебра из некондиционного сырья. Тезисы доклада Политехнического симпозиума «Молодые ученые – промышленности Северо-Западного региона» СПб: СПбГПУ, 2003. - С.41-42.
- Наторхин М.И. Растворимость PbCl2 в соляной кислоте // Известия Вузов. Цветная металлургия. - 2003.-№4.- С. 17-20.
- Наторхин М.И., Гаршин А.П. Новый способ извлечения серебра из хлоридных свинцово-серебряных растворов. Тезисы доклада в Материалах Политехнического симпозиума. СПб: СПбГПУ, 2007. - С. 106.
- Наторхин М.И. Мировые тенденции в развитии технологий получения серебра// Научно-технические ведомости СПбГПУ. - 2009.-№2(78). - С. 174-178.
- Наторхин М.И., Гаршин А.П. Некоторые мировые тенденции развития технологий получения серебра. Тезисы доклада Международной научно-практической конференции XXXVIII Неделя науки СПбГПУ. СПб: СПбГПУ, 2009.- С. 172 -173.
- Способ извлечения серебра из концентрированных хлоридных растворов: пат. 2399687 Российская Федерация: МПК С22В11/00, С22В3/46 / Наторхин М.И., Гаршин А.П.; заявитель и патентообладатель ФГБОУ ВПО СПбГПУ. - 2009107642/02; заявл. 03.03.09; опубл. 20.09.10.
- Способ переработки серебросодержащих свинцовых отходов для извлечения серебра и свинца в виде продуктов: пат. 2397259 Российская Федерация: МПК С22В11/00, С22В13/00, С22В7/00, С22В3/10 / Наторхин М.И., Гаршин А.П.; заявитель и патентообладатель ФГБОУ ВПО СПбГПУ. - 2009108781/02; заявл. 10.03.09; опубл. 20.08.09.
- Способ получения высокопористой серебряной губки из серебросодержащих материалов: пат. 2413778 Российская Федерация: МПК С22В11/00, С22В3/04, С22В3/46 / Наторхин М.И., Гаршин А.П.; заявитель и патентообладатель ФГБОУ ВПО СПбГПУ. - 2009144373/02; заявл. 30.11.09; опубл. 10.03.11.
- Наторхин М.И. Высокоэффективная переработка полиметаллического свинцово-серебряного сырья с помощью хлоридного выщелачивания. // Научно-технические ведомости СПбГПУ. - 2010.-№2-2(100). - С. 158-164.
- Наторхин М.И., Гаршин А.П. Переработка полиметаллического свинцово-серебряного сырья методом хлоридного выщелачивания. Тезисы доклада XIV Всероссийской научно-методической конференции «Фундаментальные исследования и инновации в технических университетах». СПб: СПбГПУ, 2010.- С. 249-250.
