Высокопроизводительные процессы электроосаждения никеля и сплава никель-фосфор из электролитов, содержащих карбоновые кислоты 05. 17. 03. Технология электрохимических процессов и защита от коррозии
| Вид материала | Автореферат |
СодержаниеБуферные свойства электролитов никелирования Глава 4. Разработка процессов никелирования, основанных на использовании диффузионно-миграционных эффектов. |
- Катодные процессы на силицидах металлов триады железа в кислых электролитах 05. 17., 237.17kb.
- Локальная коррозия оборудования из нержавеющих сталей при эксплуатации установок переработки, 371.28kb.
- Состояние структуры, электрохимическое поведение и магнитные свойства наноструктурируемых, 327.79kb.
- Нестационарные процессы деградации в щелочных аккумуляторах, закономерности и технологические, 585.56kb.
- Электрохимическое получение наноразмерных pt/c катализаторов для твердополимерных топливных, 944.18kb.
- Выделение серебра из концентрированных хлоридных растворов 05. 17. 03 Технология электрохимических, 229.4kb.
- Получение оптически селективных и чёрных оксидных плёнок на алюминии и его сплавах, 222.41kb.
- Лекция Нуклеиновые кислоты. Атф нуклеиновые кислоты, 119.07kb.
- “Сварка никеля”, 308.75kb.
- Компания «Norilsk Nickel Investments Ltd.», являющаяся дочерней компанией ОАО «гмк, 74.09kb.
Изменение кислотности прикатодного слоя рНS при электролизе ацетатно-хлоридных электролитов никелирования. Водород, выделяющийся совместно с никелем, с одной стороны, как показано выше, усиливает массоперенос никельсодержащих частиц, с другой стороны, его выделение вызывает подщелачивание прикатодного слоя.
Кислотность прикатодного слоя (pHS) исследовали экспериментально методом микростеклянного электрода, а также численным расчетом концентрации ионов водорода на внутренней границе диффузионного слоя (CS,H+). Методом Рунге-Кутта на ЭВМ решалась система уравнений, включающая в себя уравнения диффузионно-миграционного массопереноса по каждому виду частиц, уравнения электронейтральности, образования комплексов и ионное произведение воды. Толщина диффузионного слоя в зависимости от
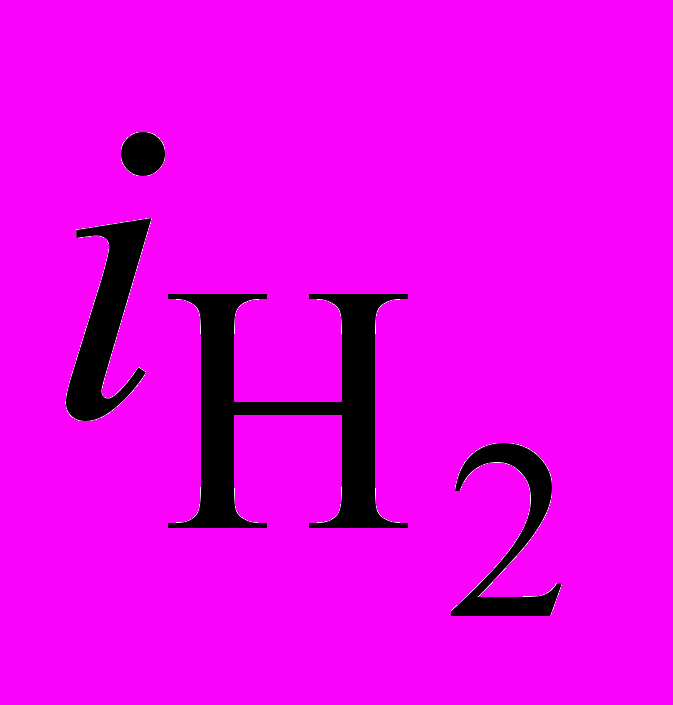 принята по работам Н.Ибла1.
принята по работам Н.Ибла1.В ацетатно-хлоридном электролите присутствуют комплексы [NiAc2]0, [NiAc]+, [NiCl2]0, [NiCl]+, [NiOH]+, [HAc]0, с соответствующими константами образования и ионы Ni2+, Cl–, Ac– (анион СН3СОО–), Н+, ОН–.
При электроосаждении металлов из растворов, содержащих комплексные ионы с лигандом, склонным к протонированию (к ним относится и исследуемый электролит, где одним из лигандов является ацетат-ион) рНS может изменяться по нескольким причинам. Во-первых, ввиду совместного выделения водорода, в результате чего изменяется локальное значение баланса по Н+. Во-вторых, в связи с «высвобождением» части ацетат-ионов при разряде комплексов [HAc], [NiAc2], [NiAc+] и их участием в установлении равновесий:
НАс↔Н++Ас– ; NiАс2↔NiAc++Ас–; NiАс+↔Ni2++Ас–. (13)
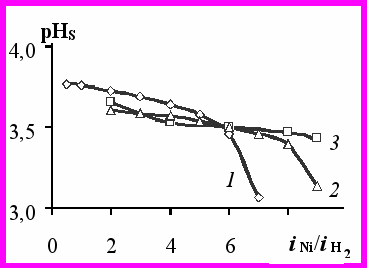
Как следует из расчетов при постоянной скорости электроосаждения никеля, но увеличивающейся скорости выделения водорода (рис.2а, кр.2) происходит подщелачивание прикатодного слоя. Если же парциальная плотность тока по никелю растет при постоянной
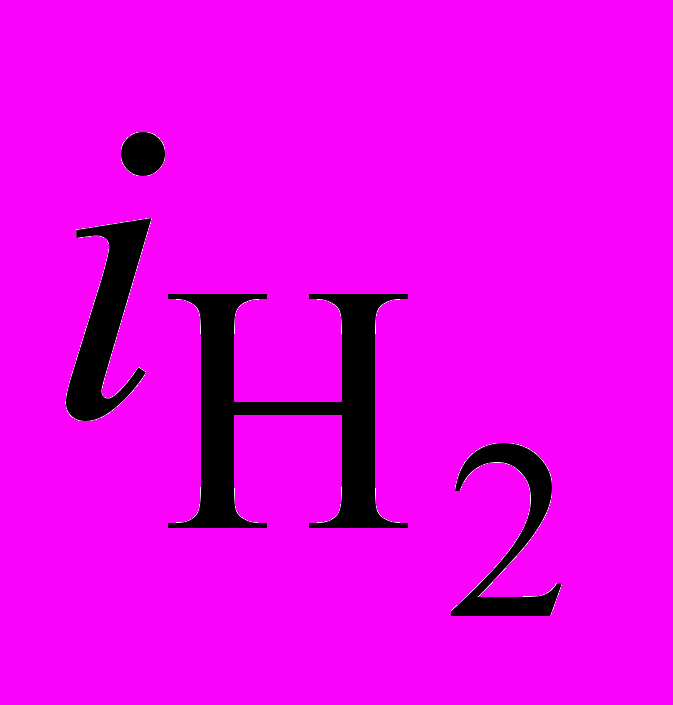 , то происходит сильное подкисление прикатодного слоя. Так, при отношении iNi/
, то происходит сильное подкисление прикатодного слоя. Так, при отношении iNi/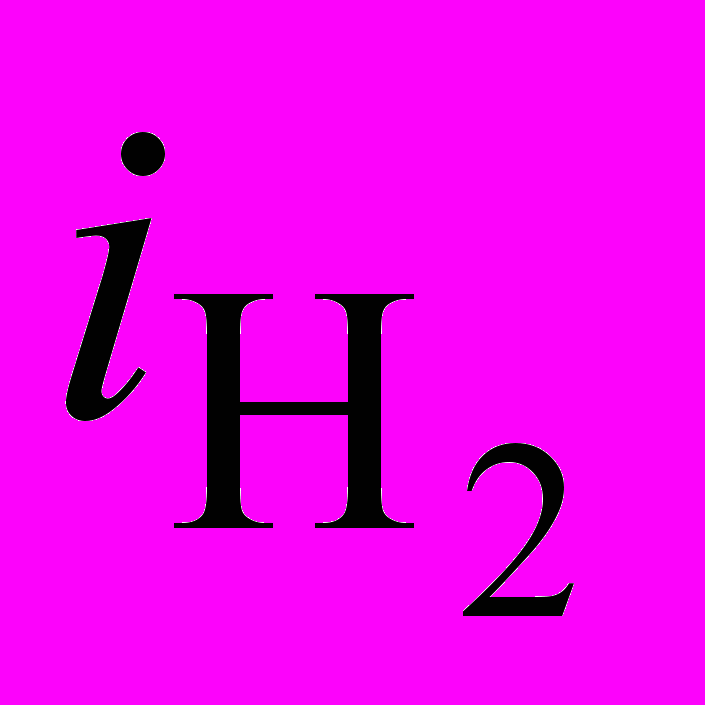 =5 величина рНS уменьшается до 3,4 единицы (рис.2б, кр.2).
=5 величина рНS уменьшается до 3,4 единицы (рис.2б, кр.2).Расчеты, с использованием модельных систем, показали, что pHS зависит от отношения парциальных плотностей тока по никелю и водороду. Если отношение iNi/
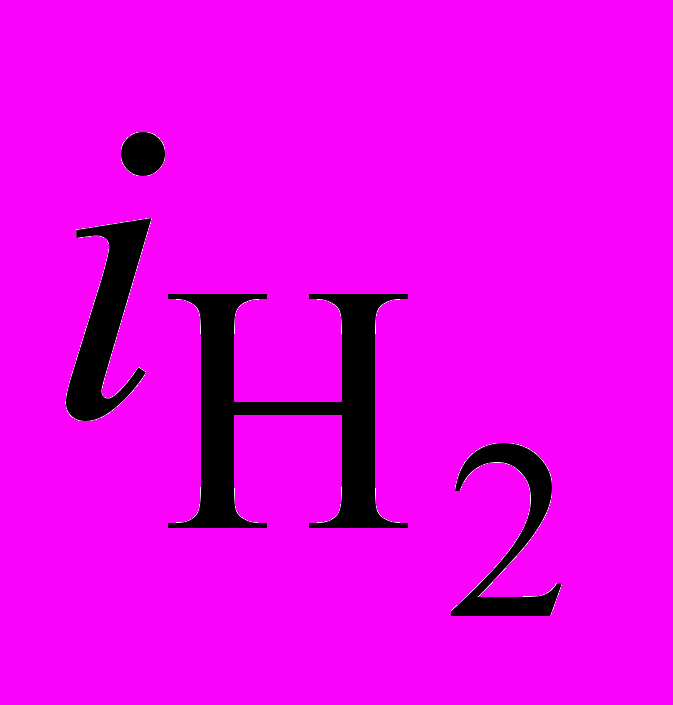 c ростом iк уменьшается, то происходит подщелачивание прикатодного слоя и, наоборот, при увеличении этого отношения – подкисление прикатодного слоя (рис. 3). При отношении iNi/
c ростом iк уменьшается, то происходит подщелачивание прикатодного слоя и, наоборот, при увеличении этого отношения – подкисление прикатодного слоя (рис. 3). При отношении iNi/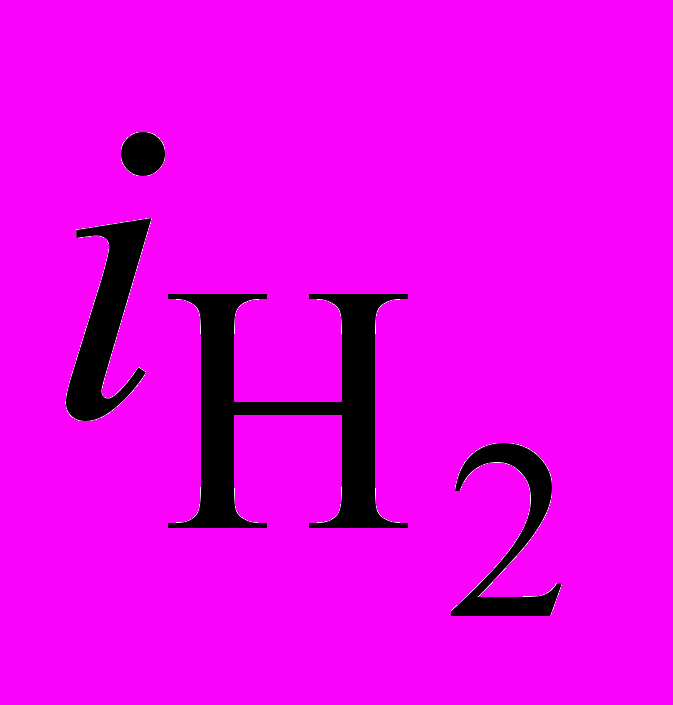 < 6, независимо от величины
< 6, независимо от величины 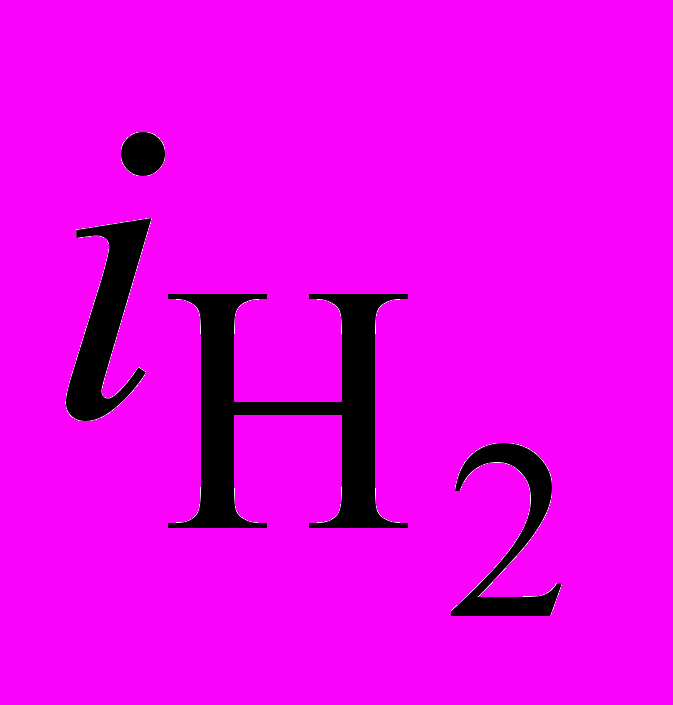 имеет место подщелачивание раствора в прикатодном слое. Начиная с соотношения iNi/
имеет место подщелачивание раствора в прикатодном слое. Начиная с соотношения iNi/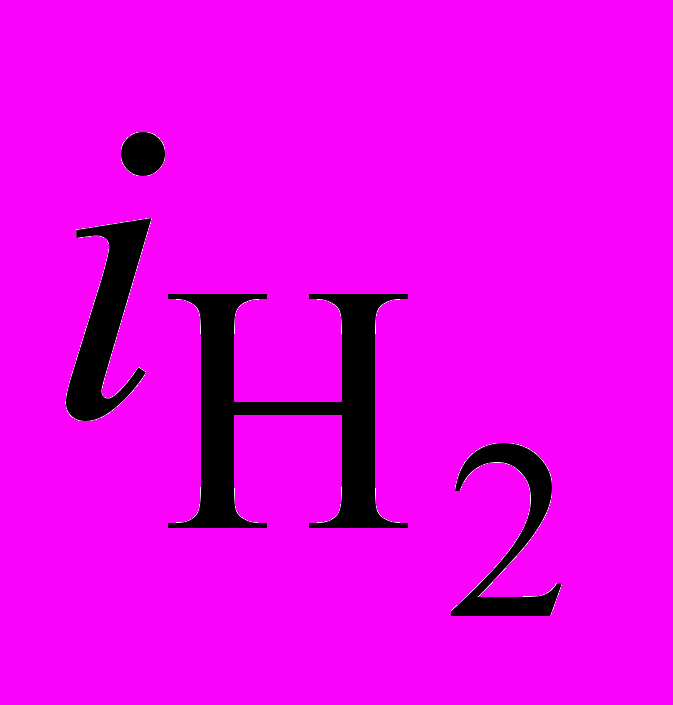 ≥ 6 прикатодный слой подкисляется, тем в большей степени, чем больше
≥ 6 прикатодный слой подкисляется, тем в большей степени, чем больше 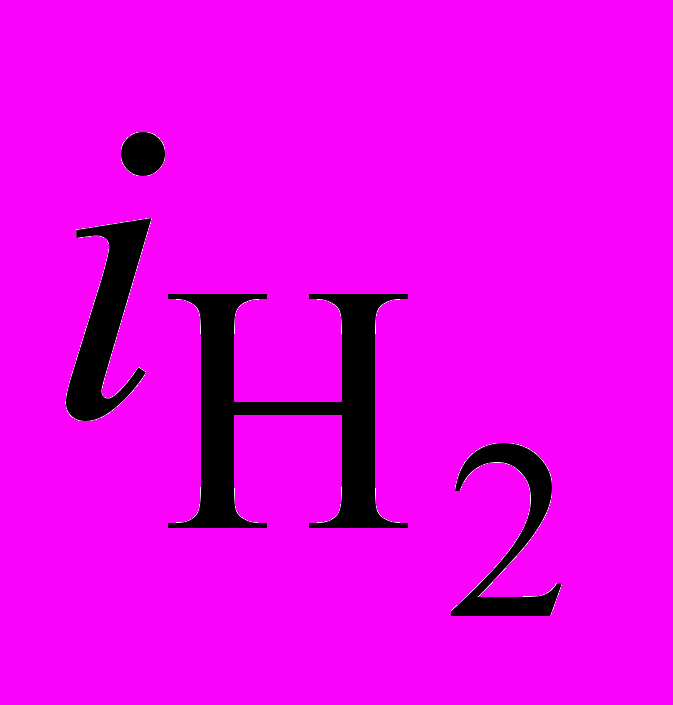 .
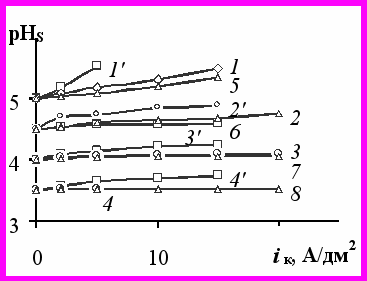
.При электролизе ацетатно-хлоридных растворов (реальные системы) электроосаждение никеля протекает с относительно высоким выходом по току и всегда сопровождается выделением водорода. Как следует из расчетов и экспериментально определенной величины рНS, как правило, имеет место незначительное подщелачивание прикатодного слоя (рис.4).


Буферные свойства электролитов никелирования
Результаты исследования буферных свойств электролитов, приготовленных на основе солей никеля с карбоновыми кислотами, рассмотрим на примере ацетатно-хлоридных электролитов никелирования.
Расчет и экспериментальное определение буферных свойств электролитов, основным компонентом которых является ацетат никеля, по данным потенциометрического титрования показывают, что буферная емкость электролитов высокая и обусловлена присутствием в растворе обоих компонентов ацетатного буфера СН3СООН – СН3СОО–.
Из данных табл.1 следует, что буферная емкость ацетатно-хлоридного электролита в интервале рН 3,5-4,5 более чем в 160 раз превышает таковую для электролита Уоттса, широко применяемого в промышленности.
Таблица 1
Буферная емкость электролитов никелирования. Температура 50°С
| Электролит | Буферная емкость (М) NaOH в интервале рН | |||||
| 2-3 | 2,5-3,5 | 3-4 | 3,5-4,5 | 4-5 | 4,5-5,5 | |
| Ацетатно-хлоридный (0,875 М Ni) | 0,3 | 0,46 | 0,72 | 0,9 | 0,78 | 0,56 |
| Электролит Уоттса (0,975 М Ni) | 0,03 | 0,009 | 0,0074 | 0,0054 | 0,005 | 0,031 |
Снижение концентрации ацетата никеля от 0,875 до 0,5 М практически не ухудшает буферных свойств раствора. Дальнейшее снижение концентрации ацетата никеля до 0,3-0,1 М приводит к уменьшению содержания [NiCH3COO]+, [Ni(CH3COO)3], уксусной кислоты и ухудшению буферных свойств растворов. Однако, буферная емкость даже наиболее «разбавленного» 0,1 М раствора значительно превышает буферную емкость электролита Уоттса, отношение которых в интервале рН 4,0-5,0 составляет 96. Ограничения iдоп зависят не только от буферных свойств электролита, но и от величины рНг.о., которая возрастает от 7,1 до 7,75 при снижении аналитической концентрации никеля от 0,875 до 0,1 М.
Таким образом, исследования транспортных и буферных свойств электролитов, основным компонентом которых является ацетат никеля, показали, что высокие iдоп электроосаждения никеля обусловлены с одной стороны – ускорением массопереноса никель- и водородсодержащих частиц в результате влияния комплексообразования на диффузионно-миграционные процессы, с другой – очень высокой буферной способностью электролитов и повышенным значением рНг.о.
Аналогичные исследования буферных свойств и рНS были проведены для сульфатно-хлоридных растворов никелирования с буферными добавками янтарной, глутаровой и адипиновой кислот, которые показали, что во всех случаях буферная емкость была велика. Наибольшая стабильность рНS обнаружена для электролита с янтарной кислотой.
Глава 4. Разработка процессов никелирования, основанных на использовании диффузионно-миграционных эффектов. В главе 3 было показано, что из ацетатно-хлоридных электролитов можно получать никелевые покрытия при высоких катодных плотностях тока. При выборе соотношения компонентов электролита Ni(CH3COO)2/Clˉ учитывается склонность Ni анодов к пассивации. Методом получения анодных потенциодинамических поляризационных кривых установлено, что активное растворение анода Н-О в ацетатно-хлоридном растворе имеет место до ia не более 0,04 А/дм2 (хлорид-ион вводили в виде HCl от 0,01 до 0,25 М). При рабочих ia 0,5-20 А/дм2 анод растворяется при потенциалах питтингообразования (Еп.о. 0,5-0,8 В) с выходом по току около 100%, для чего достаточной является концентрация Clˉ 0,03-0,05 М.
Исследование катодного процесса показало, что максимальная плотность тока (iдоп) получения компактных, светлосерых осадков никеля при рН0 4,5 и аналитической концентрации никеля в растворе (C0,Ni) от 0,875 до 0,5 М – 20-30 А/дм2 с выходом по току металла (ВТNi) 90-95% (t раствора 50ºС). При уменьшении концентрации никеля до 0,3 М iдоп составляет 10 А/дм2 и при концентрации C0,Ni 0,1 М – 6 А/дм2. Последнее соответствует скорости электроосаждения никеля из сульфатно-хлоридных электролитов с содержанием никеля 1-2 М. Причиной ухудшения качества осадков Ni при iк > iдоп и рН0 4,5 является включение гидроксида в катодное покрытие. При понижении рН0 до 4,0 и 3,5 ВТNi снижается до 65 85%, но при этом резко увеличивается iдоп (возрастает эффект экзальтации тока по никелю). Так, снижение рН0 электролита с С0,Ni 0,1 М от 4,5 до 4,0 увеличивается iдоп до 15 А/дм2, а при рН0 3,5 – до 30 А/дм2; в электролите с с0,Ni 0,5М при рН0 4,0 и 3,5 iдоп повышается до 60 А/дм2 и 100 А/дм2 соответственно. При iк > iдоп и рН0 4,0 и 3,5 проявляются ограничения в массопереносе никельсодержащих компонентов (рост дендридов).
Для выяснения кинетики и механизма выделения никеля и водорода из растворов ацетата никеля проведены исследования на вращающихся цилиндрическом и дисковом электродах. Зависимость ВТNi от потенциала катода имеет три области (рис.5а). В области потенциалов I (Ек < -0,5 В) ВТNi стабильно высокий и не зависит от скорости вращения катода. Область потенциалов от -0,3 до -0,45 В (область II) характеризуется низким ВТNi, уменьшающимся с увеличением скорости вращения электрода до 2-7%, что связано с облегчением выделения водорода.
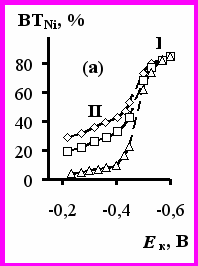
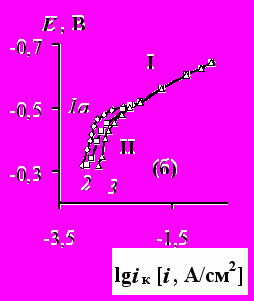
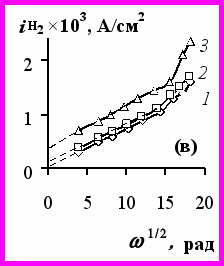
Рис.5 Зависимость выхода по току никеля (а) и суммарной скорости выделения никеля и водорода (б) от потенциала катода. Скорость вращения катода (об/мин): 300 (кр.1а), 500 (кр.1), 1000 (кр.2), 2500 (кр.3). Зависимость
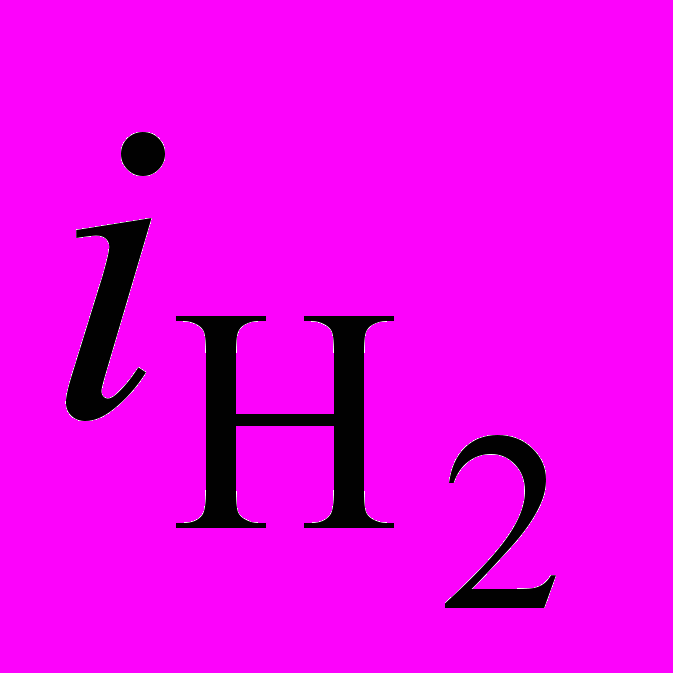 – ω1/2 (в) при Е (В): -0,35 (кр.1), -0,4 (кр.2), -0,45 (кр.3). Ацетатный электролит 0,75 М, рН0 5,0, температура 50ºС.
– ω1/2 (в) при Е (В): -0,35 (кр.1), -0,4 (кр.2), -0,45 (кр.3). Ацетатный электролит 0,75 М, рН0 5,0, температура 50ºС.В диапазоне потенциалов от -0,45 до -0,5 В наблюдается переходная область (пунктир на рис.5а), характеризующаяся низкой воспроизводимостью результатов. Закономерности влияния iк, рН0 на катодный процесс на вращающемся катоде аналогичны таковым для неподвижного катода. Исследование кинетики катодного процесса показало (рис.5б), что в области потенциалов I (соответствующих iк 1 20 А/дм2) катодная поляризация (также как и ВТNi) не зависит от скорости вращения катода. Следовательно, при высоких iк (1-20 А/дм2) отсутствуют ограничения по массопереносу никель- и водородсодержащих частиц. При низких же iк (до 0,3 А/дм2) зависимость Ек от скорости вращения катода (уменьшение поляризации с увеличением скорости вращения) свидетельствует о диффузионных ограничениях процесса выделения водорода. Действительно, при потенциалах -0,35 и -0,4 В наблюдается линейная зависимость
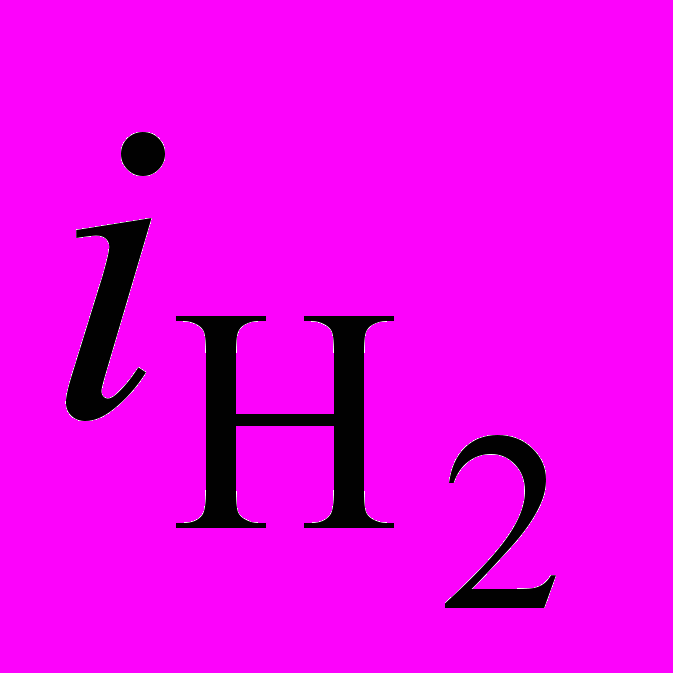 – ω1/2, характерная для предельного диффузионного тока (рис.5в), которая искажается при -0,45 В. Измерения
– ω1/2, характерная для предельного диффузионного тока (рис.5в), которая искажается при -0,45 В. Измерения 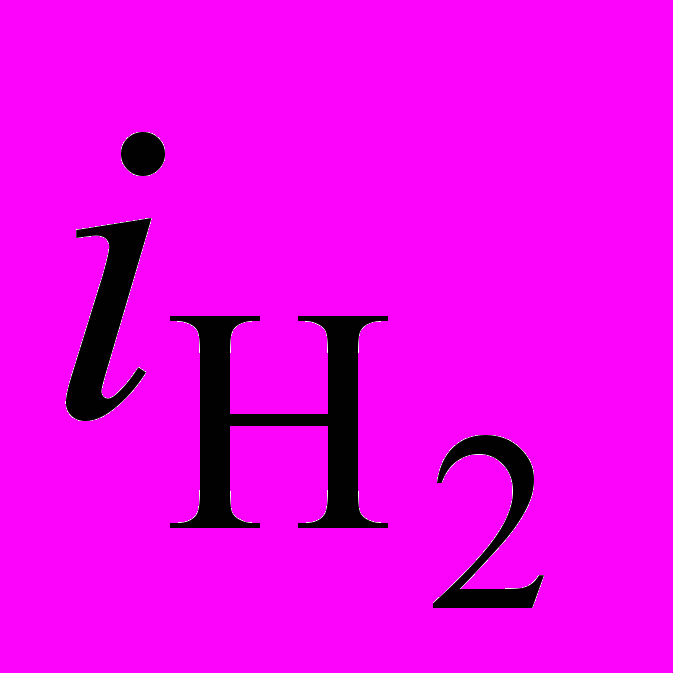 (на свежеосажденном никеле) при электролизе раствора сульфата натрия и этого же раствора с введенной в него уксусной кислотой показали, что в последнем случае скорость выделения водорода резко возросла по мере снижения рНо раствора. Это позволяет сделать вывод о выделении водорода при низких iк (до 0,3 А/дм2) из Н3О+ и при высоких iк (Ек 0,5÷ 0,7 В) главным образом, в результате разряда недиссоциированных молекул уксусной кислоты:
(на свежеосажденном никеле) при электролизе раствора сульфата натрия и этого же раствора с введенной в него уксусной кислотой показали, что в последнем случае скорость выделения водорода резко возросла по мере снижения рНо раствора. Это позволяет сделать вывод о выделении водорода при низких iк (до 0,3 А/дм2) из Н3О+ и при высоких iк (Ек 0,5÷ 0,7 В) главным образом, в результате разряда недиссоциированных молекул уксусной кислоты:2СН3СООН + 2ē→Н2 + 2СН3СОО–. (14)
В последнее время аналогичный вывод сделан при экспериментальном исследовании выделения водорода из растворов уксусной кислоты при рН 2-6 (В. Маринович, А.Р. Деспич)2.
Парциальные поляризационные кривые выделения водорода (при
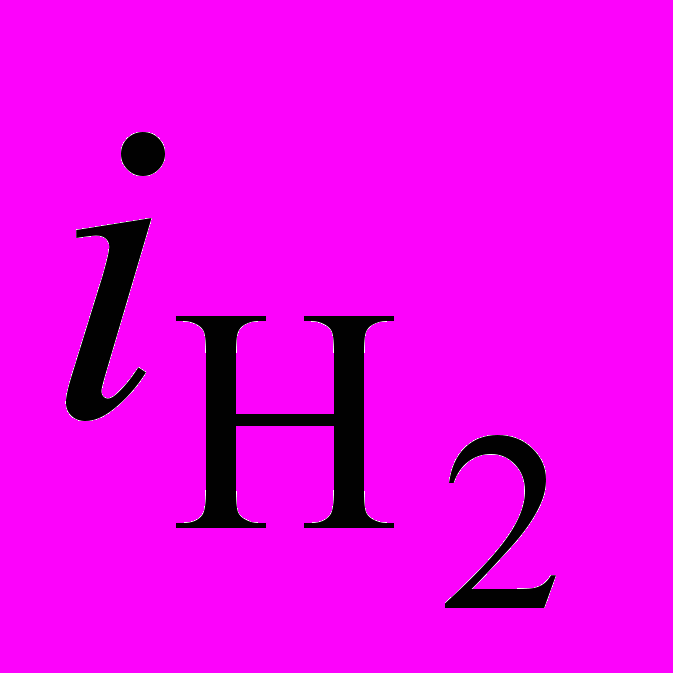 > 0,3 А/дм2) и выделения никеля имеют четко выраженные линейные участки на зависимости lg
> 0,3 А/дм2) и выделения никеля имеют четко выраженные линейные участки на зависимости lg 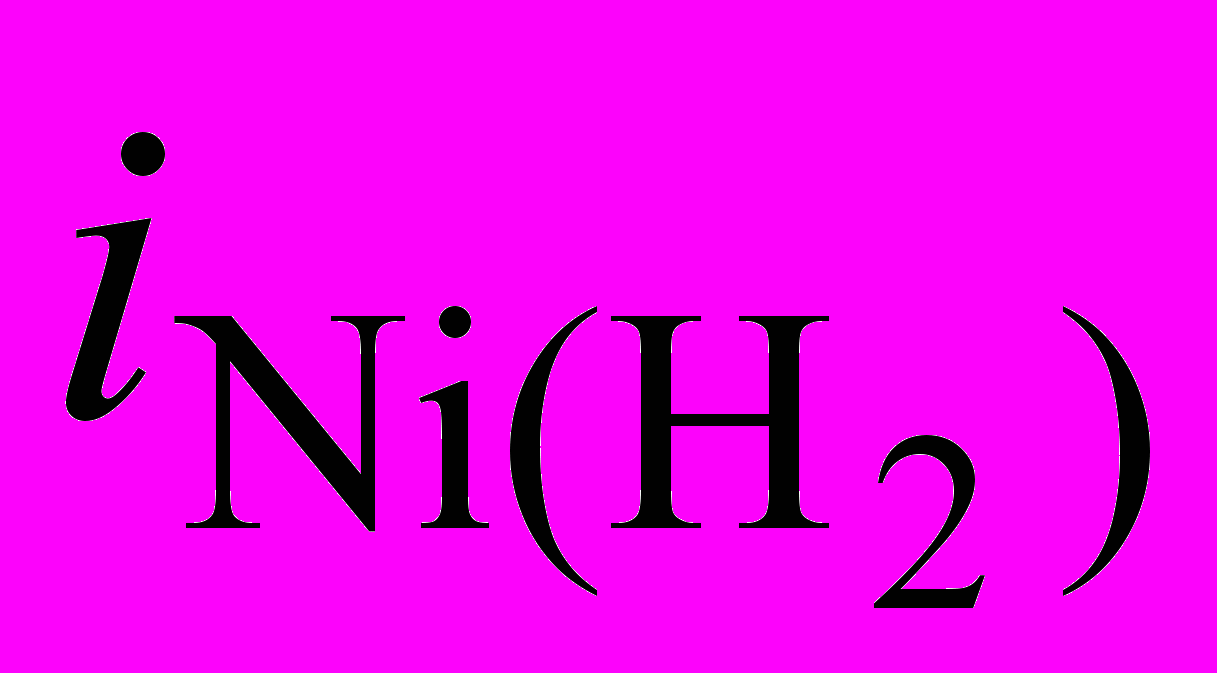 – Ек (подчинение теории замедленного разряда).
– Ек (подчинение теории замедленного разряда).Н
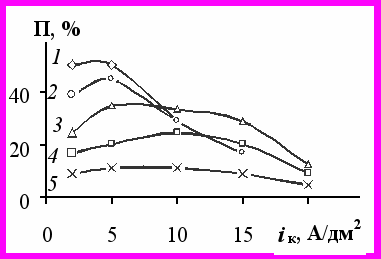
Рис.6 Зависимость пластичности никелевых покрытий от iк. Концентрация никеля (моль/л): 0,1 (кр.1); 0,3 (кр.2); 0,5 (кр.3); 0,75 (кр.4); 0,875 (кр.5). Температура 50°С, рН0 4,5
икелевые покрытия, полученные из ацетатно-хлоридных электролитов, имеют улучшенные физико-химические свойства. Микротвердость (Н) осадков никеля изменяется от 2,5 до 4,0 ГПа. Максимальная Н соответствует низким iк (0,5 2 А/дм2). При всех значениях рН0 растворов зависимость Н – iк имеет минимум, который сдвигается в область более низких iк при увеличении рН0 и снижении аналитической концентрации никеля в растворе. Осадки никеля характеризуются высоким пределом прочности на разрыв (σ), равным 600 800 МПа, который обусловлен повышенной плотностью дислокаций (N), равной (2 8)·1015 м 1. (рентгеноструктурный анализ) Зависимость N – iк аналогична зависимости σ – iк, а последняя – зависимости Н – iк. Относительное удлинение при разрыве (δ) осадков никеля составляет 1-2,5% (электролиты с СNi 0,875 0,75 М). Снижение концентрации ацетата никеля до 0,1-0,3 М приводит к получению осадков никеля с δ 4,5-4,9%, что приближается к δ медных покрытий.
Данные по определению δ осадков никеля согласуются с результатами исследования пластичности (П). Наиболее пластичные покрытия (П 34-50%) получены из электролитов с СNi 0,1 и 0,3 М при iк 2-5 А/дм2 (рис. 6, кр. 1 и 2).
В
 нутренние напряжения (Р) никелевых покрытий изменяются от 16 до 180 МПа (толщина 20 мкм) в зависимости от условий электроосаждения. Наибольшее влияние оказывает концентрация никеля: внутренние напряжения снижаются от 120-150 МПа (CNi 0,875 М) до 16-32 МПа (CNi 0,1-0,3 М) при рН 4,0-4,5 и температуре 50оС. Повышение температуры раствора от 30 до 50оС приводит к снижению Р, особенно при получении покрытий с iк
нутренние напряжения (Р) никелевых покрытий изменяются от 16 до 180 МПа (толщина 20 мкм) в зависимости от условий электроосаждения. Наибольшее влияние оказывает концентрация никеля: внутренние напряжения снижаются от 120-150 МПа (CNi 0,875 М) до 16-32 МПа (CNi 0,1-0,3 М) при рН 4,0-4,5 и температуре 50оС. Повышение температуры раствора от 30 до 50оС приводит к снижению Р, особенно при получении покрытий с iк 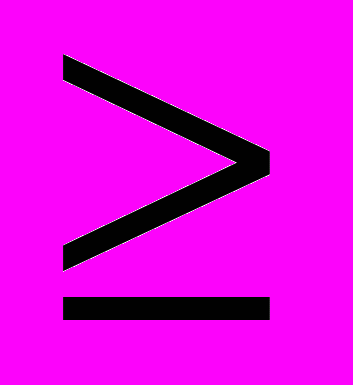 10 А/дм2.
10 А/дм2.О
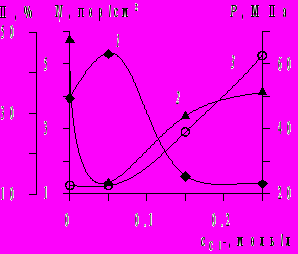
Рис.7 Зависимость пластичности (кр.1), внутренних напряжений (кр.2) и пористости никелевых покрытий (кр.3) от концентрации ионов хлора в 0,3 М ацетатном электролите при iк 5 А/дм2, рН0 4,5, температуре 50°С.
тмечено особое влияние иона хлора на свойства никелевых покрытий (рис.7). При концентрации Сl– 0,05 М получены наиболее пластичные, малонапряженные, малопористые, а также с наименьшей микротвердостью осадки никеля, которым соответствуют субзерна максимальных размеров (ОКР 105 нм). Защитная способность никелевых покрытий, полученных из ацетатно-хлоридных электролитов, превосходит таковую для покрытий из электролита Уоттса. Практически беспористые покрытия толщиной 9-12 мкм получены из электролитов с концентрацией ацетата никеля 0,1-0,3 М. Повышение концентрации Cl– свыше 0,05 М увеличивает пористость покрытий (рис 7, кр.3) и ток коррозии (метод И.Л. Розенфельда). Испытания никелевых покрытий в коррозионных камерах подтвердили их высокую защитную способность. Содержание водорода в осадках никеля, полученных при рН0 4,5-3,5 невелико (от 100 до 17 см3 Н2/100 г Ni или 0,53-0,09 ат.%), несмотря на большую
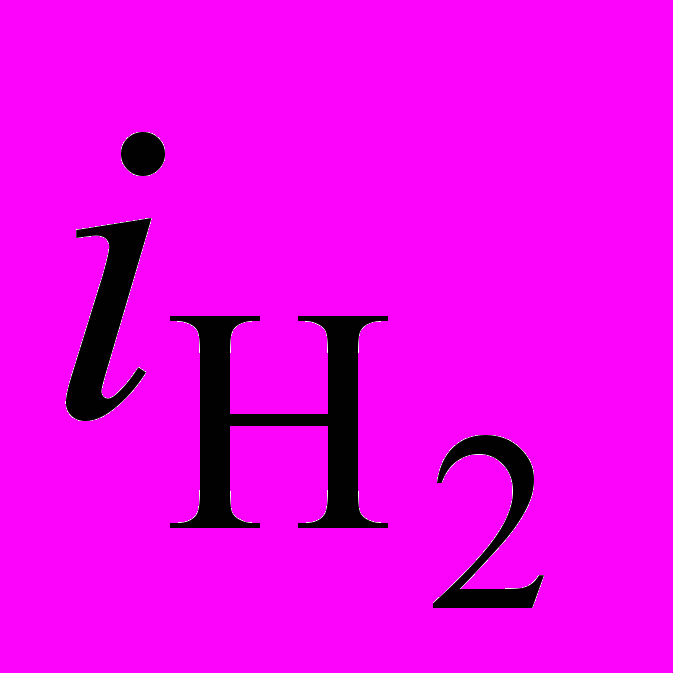 , что может быть обусловлено адсорбцией ацетатсодержащих частиц на поверхности растущего осадка и локальным увеличением температуры в приэлектродном слое (пониженная электрическая проводимость электролита). Установлено, что основная часть водорода содержится в виде твердого раствора, а также в молекулярной форме в микропустотах размером около 1 нм и в составе органических соединений. Сопоставление данных о количестве включенного водорода с размерами субзерен никеля показывает, что максимальное наводороживание соответствует осадкам с более мелкими субзернами, минимальное – с наиболее крупными. Так, минимальное содержание Н2 (17 22 см3 Н2/100 г Ni) в покрытиях, полученных при iк 2 и 5 А/дм2, соответствует максимальным размерам ОКР 158 и 108 нм. Осадки никеля содержат углерод (0,05-0,038 мас.% или 0,245-0,186 ат.%) и кислород (0,067-0,033 мас.% или 0,248 0,200 ат.%), как правило, в соотношении 1:1 (ат.%). При увеличении толщины никелевого покрытия от 5 до 30 мкм содержание примесей снижается (неравномерное распределение по толщине). Исследование никелевого покрытия методом РФЭС показало, что поверхностные слои металла обогащены углеродом и кислородом, находящимися в составе ацетатсодержащих частиц. При удалении покрытия толщиной 300-450 Å обнаруживается чистый Ni. Относительно низкое содержание примесей в никеле подтверждают исследования электросопротивления (ρ), которое находится в пределах 7,1-7,6 мкОм·см, что близко к ρ металлургического никеля.
, что может быть обусловлено адсорбцией ацетатсодержащих частиц на поверхности растущего осадка и локальным увеличением температуры в приэлектродном слое (пониженная электрическая проводимость электролита). Установлено, что основная часть водорода содержится в виде твердого раствора, а также в молекулярной форме в микропустотах размером около 1 нм и в составе органических соединений. Сопоставление данных о количестве включенного водорода с размерами субзерен никеля показывает, что максимальное наводороживание соответствует осадкам с более мелкими субзернами, минимальное – с наиболее крупными. Так, минимальное содержание Н2 (17 22 см3 Н2/100 г Ni) в покрытиях, полученных при iк 2 и 5 А/дм2, соответствует максимальным размерам ОКР 158 и 108 нм. Осадки никеля содержат углерод (0,05-0,038 мас.% или 0,245-0,186 ат.%) и кислород (0,067-0,033 мас.% или 0,248 0,200 ат.%), как правило, в соотношении 1:1 (ат.%). При увеличении толщины никелевого покрытия от 5 до 30 мкм содержание примесей снижается (неравномерное распределение по толщине). Исследование никелевого покрытия методом РФЭС показало, что поверхностные слои металла обогащены углеродом и кислородом, находящимися в составе ацетатсодержащих частиц. При удалении покрытия толщиной 300-450 Å обнаруживается чистый Ni. Относительно низкое содержание примесей в никеле подтверждают исследования электросопротивления (ρ), которое находится в пределах 7,1-7,6 мкОм·см, что близко к ρ металлургического никеля.Осадки никеля имеют пониженный период кристаллической решётки 0,3512 0,3522 нм, состоят из субзёрен размером от 11 до 158 нм. Наиболее мелкие субзёрна формируются из раствора с СNi 0,875 М, подкисленного HCl, наиболее крупные – из растворов с концентрацией никеля 0,1-0,3 М и хлорид-иона 0,05 М.
Ацетатно-хлоридные электролиты характеризуются более высокими допустимыми концентрациями примесей меди (0,5-0,9 г/л), железа (0,5-1,3 г/л) и цинка (0,15-0,4 г/л) по сравнению с электролитами никелирования другого химического состава, что связано со стабильностью рНS и комплексообразованием металлов-примесей с ацетат-ионом.
При эксплуатации ацетатно-хлоридные электролиты стабильны по рН0 (изменение ΔрН около 0,05 единиц за 10 А·ч/л) и концентрации хлорид-иона. Концентрация ионов никеля незначительно увеличивается вследствие превышения ВТА над ВТК никеля.
Из отработанных растворов (ванны электролиза и улавливания) никель можно выделить в виде компактного катодного металла (рН0 5,0; iк 5 А/дм2, аноды ОРТА) до остаточной концентрации 20 мг/л. Применение последующего электролиза (рН0 8,0; ia 1 А/дм2, концентрация хлорид-иона около 12 г/л, аноды ОРТА) снижает остаточную концентрацию ионов никеля в растворе до 0,2 мг/л.
Введение добавок сахарина (2 г/л) и бутин-2-диола-1,4 (0,4-0,5 г/л) в ацетатно-хлоридный электролит с концентрацией металла 0,1-0,3 М и рН0 4,5 позволяет получать блестящие никелевые покрытия при iк 1-10 А/дм2. Осадки имеют повышенную микротвёрдость (2,7-5,7 ГПа), внутренние напряжения сжатия (Р), переходящие в Р растяжения при увеличении iк. Из ацетатно-хлоридного электролита с СNi 0,6 М в присутствии приведённых выше органических добавок получены осадки никеля с содержанием серы 0,05-0,07 мас.%. Большее количество серы (0,07 0,12 мас.%) включается в осадки никеля из сульфатно-ацетатно-хлоридного электролита (СNi 1,5 М) при iк 1-15 А/дм2.Серосодержащий никель можно использовать в качестве непассивирующегося анода: в электролите типа Уоттса анод растворяется «активно» до iа ~150 А/дм2. Никель, содержащий 0,12 мас.% серы, растворяется не пассивируясь до iа 25 А/дм2 в растворе сульфата никеля.
