Интеркалаты оксидов ванадия и нанотубулены на их основе: синтез, строение, свойства 02. 00. 04 физическая химия
| Вид материала | Автореферат |
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Урок химии в 9 классе. Тема: «Оксиды азота», 68.76kb.
- Синтез и строение N,o- содержащих гетероциклических соединений на основе несимметричных, 201.05kb.
- Влияние условий синтеза и легирования на физические свойства оксидов ванадия, 316.45kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Лесничая марина Владимировна синтез и свойства ag(0)-, Au(0)-содержащих нанокомпозитов, 308.79kb.
- Перколяционный переход в пористых керамиках на основе нанокристаллических оксидов,, 120.58kb.
- Кристаллические и стеклообразные фазы в системах biF 3 Bi 2 o 3 BaF, 505.44kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
На правах рукописи
ЗАХАРОВА Галина Степановна
Интеркалаты оксидов ванадия и нанотубулены на их основе: синтез, строение, свойства
02.00.04 – физическая химия
АВТОРЕФЕРАТ
Диссертации на соискание ученой степени
доктора химических наук
Екатеринбург – 2007
Работа выполнена в лаборатории химии редких элементов Института химии твердого тела Уральского отделения Российской академии наук
Официальные оппоненты доктор химических наук, профессор
Нейман Аркадий Яковлевич
доктор химических наук, профессор
Марков Вячеслав Филиппович
доктор химических наук
Гаврилов Владимир Юрьевич
Ведущая организация Ижевский государственный
технический университет
Защита состоится 10 октября 2007г. в 1300 на заседании диссертационного совета
Д 004.002.01 в Институте высокотемпературной электрохимии Уральского отделения РАН по адресу: 620219, г. Екатеринбург, ГСП-146, ул. С.Ковалевской, 22, конференц-зал.
С диссертацией можно ознакомиться в библиотеке Уральского отделения Российской академии наук.
Автореферат разослан « »_________________2007 г.
Ученый секретарь
диссертационного совета, к.х.н. Анфиногенов А.И.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Интеркаляционные соединения на основе слоистой структуры гидрата V2O5·nH2O, как материалы, находят в последние годы все более широкое практическое применение. Особое внимание исследователей уделяется высокодисперсным порошкам и пленкам этих веществ, полученным золь-гель методом. Ксерогели оксида ванадия (V) имеют смешанный ионно-электронный тип проводимости, уровень составляющих которых можно изменять в широких пределах. Основными областями возможного использования данных соединений являются переключающие устройства, антистатические покрытия, фотохромные и электрохромные преобразователи информаций и катодные материалы в низкотемпературных источниках тока. В настоящее время они рассматриваются как перспективные прекурсоры для синтеза нанотубулярных и родственных наноструктур простых и сложных оксидов ванадия. Кроме того, ксерогели оксида ванадия (V) - реакционно-способные вещества и могут быть использованы для эффективного синтеза низкотемпературных сложных оксидов ванадия.
В связи с возрастающей потребностью в создании новых и улучшении характеристик имеющихся материалов важное значение приобретает вопрос о возможном регулировании физико-химических свойств соединений, решение которого зависит от уровня фундаментальных исследований условия синтеза, структуры и свойств веществ.
Несмотря на возросшее в последние десять лет количество публикаций по гелям оксида ванадия (V), представления об их структуре и составе недостаточно полно отражают специфику данных соединений (наличие четырехвалентного ванадия и различных типов водородно-кислородных группировок). В литературе отсутствуют какие-либо сведения о возможности замещения ванадия ксерогелей на другие ионы, об областях гомогенности и термодинамических характеристиках фаз. Очень важным для материаловедения является определение термодинамических равновесных параметров существования веществ конкретного состава, особенно для гидратов. Данные о структурных особенностях, условиях образования и термических свойствах рассматриваемого класса соединений позволили бы проводить моделирование всех возможных изменений, происходящих в материалах под действием различных факторов. Все это, в конечном итоге, явилось бы фундаментом для синтеза веществ с заданными свойствами. Кроме того, решение затронутых вопросов позволит расширить материаловедческую значимость интеркаляционных соединений со слоистой структурой гидрата V2O5·nH2O и наметить новые пути практического использования данных веществ.
Настоящая работа является результатом систематических исследований, выполненных за последние 20 лет в лаборатории химии редких элементов Института химии твердого тела УрО РАН. Она проводилась в соответствии с госрегистрационными темами № 01.99.0007014, 01.99.0007015 «Изучение фазовых равновесий и взаимодействий в системах на основе оксидов редких металлов (V, W, Mo, РЗЭ, Mn, Ti, Sb и др.) с целью получения новых соединений с комплексом полезных свойств (сверхпроводящих, магнитных, сорбционных, электродных, каталитических и др.)», № 01.200.1 16040 «Синтез, кристаллохимия и физико-химические свойства фаз внедрения MxV12 yTyO31 ·nH2O (T = Mo, Ti)» и № 0120.0 412692 «Синтез, строение и физико-химические свойства нанотубуленов простых и сложных оксидов ванадия». Исследования были поддержаны Российским фондом фундаментальных исследований (грант 03-03-32104, НШ 00-15-97418), Российским фондом фундаментальных исследований и Государственным фондом естественных наук Китая (грант 99-03-39065 и 03-03-39009), Министерством образования Российской Федерации по программе «Научные исследования высшей школы по приоритетным направления науки и техники» (проект № 203.06.06.032).
Цель работы. Целью настоящей работы являлось разработка золь-гель метода синтеза порошков, пленок и наноразмерных структур нового поколения функциональных материалов на основе гидратированных интеркалатов сложных оксидов ванадия, исследование их химического состава, структуры, морфологии, устойчивости, физико-химических свойств и материаловедческой значимости.
Поставленная цель достигалась путем решения следующих экспериментальных задач:
- Определение основных физико-химических параметров золь-гель метода синтеза твердых растворов общей формулы MxV12-yTyO31±d×nH2O, где (T = Mo, W, Cr, Ti; M = H, Li, Na, K, Rb, Cs, NH4, Mg, Ca, Sr, Ba, Cu, Ce, Pb), и получение их в виде порошков и пленок.
- Изучение влияния катионов внедрения и атомов замещения ванадия на область гомогенности, структурные параметры и термическую устойчивость интеркалатов. Определение валентного состояния атомов, их энергии связи в структуре соединений.
- Изучение термодинамических параметров устойчивости и изменений парциальных величин `DG, `DS и `DH катионов внедрения в зависимости от состава интеркалатов.
- Установление влияния состава, ориентации, температуры и давления паров воды на электропроводность и тип проводимости пленок интеркалатов.
- Определение основных параметров синтеза, морфологии, состава, строения, валентного состояния атомов, электрических и термических свойств нанотубулярных структур интеркалатов.
- Изучение возможных областей практического применения порошков, пленок и нанотубуленов полученных интеркалатов.
Научная новизна. Определены условия образования, структурные параметры, состав интеркаляционных соединений со слоистой структурой ксерогеля V2O5·nH2O с частичным замещением ванадия на молибден, хром, вольфрам, титан и внедренными катионами щелочных, щелочноземельных металлов и аммония, построены диаграммы фазовых соотношений. Установлены зависимости физико-химических свойств соединений от степени замещения ванадия на молибден, вольфрам, титан и хром, а водорода на ионы одно- и двухвалентных металлов. Определены термодинамические характеристики, состояние водородно-кислородных групп и ванадия, построена модель структуры соединений. Впервые получены нанотубулярные структуры простых и сложных оксидов ванадия с внедренными радикалами гидроксильных органических соединений (этанола, поливинилового спирта, гидрохинона, пирокатехина). Определен состав, морфология, строение, электронная структура, термические и электрические свойства полученных наноструктур. Рассмотрена модель образования нанотубуленов оксидов ванадия.
На защиту выносятся:
- Результаты исследований условий образования интеркаляционных соединений простых и сложных оксидов ванадия со слоистой структурой, областей их гомогенности и структурных параметров.
- Результаты определения соотношения водородно-кислородных групп, состояния атомов ванадия, титана, хрома, вольфрама в полученных новых соединениях.
- Модель слоистой структуры интеркаляционных соединений на примере V2O5·nH2O.
- Установленные закономерности между физико-химическими, термодинамическими характеристиками полученных соединений, их составом и структурными особенностями.
- Результаты исследований условий гидротермального синтеза нанотубулярных форм оксида ванадия с использованием гидроксилсодержащих органических соединений (фенолы, спирты) в качестве темплата, состава, морфологии, строения и свойств этих веществ.
- Материаловедческая значимость полученных порошков, пленок и наноразмерных интеркаляционных соединений.
Практическая значимость работы. Показана возможность использования ксерогелей интеркаляционных соединений оксидов ванадия в качестве материалов для объемных и тонкопленочных терморезисторов, материалов для элементов памяти. Перспективно применение порошкообразных и пленочных ксерогелей в качестве твердых полуэлементов сравнения ионоселективных электродов с мембраной, обеспечивающих обратимость по носителям тока. Установлено, что поливанадаты являются эффективными активаторами окисления порошка алюминия, используемого в качестве горючего в составах конденсированных систем. Они снижают температуру воспламенения, увеличивают скорость и полноту горения порошка алюминия АСД-4. На основе этих соединений разработана водоактивируемая батарея, которая может быть использована для питания радиозондов метеорологического назначения, спасательной на море и др. аппаратуры. Пленки водородсодержащих ксерогелей перспективны как резистивный датчик влажности, который может быть использован при аэрологических исследованиях приземных слоев атмосферы, в производственных и сельскохозяйственных объектах. Полученные соединения проявляют каталитическую активность в реакции окисления триметилфенолов до триметилбензохинона – полупродукта в производстве витамина Е. Литийсодержащие ксерогели могут быть использованы в качестве твердых катионпроводящих электролитов для низкотемпературных электрохимических устройств. Ксерогели поливанадиевой, поливанадиевомолибденовой (титановой) кислоты являются прекурсорами для синтеза нанотубулярных форм оксида ванадия. Разработан оригинальный метод получения наноструктур оксидов d-элементов.
Личный вклад автора. Автором сформулирована научное направление, поставлена задача исследования, проведена систематизация имеющихся литературных данных и интерпретация полученных результатов. Синтез, идентификация всех образцов, обработка основных экспериментальных результатов физико-химических исследований и выводы сделаны соискателем лично.
Апробация работы. Основные результаты и положения диссертации доложены и обсуждены на IV Всесоюзном совещании по ХТТ (Свердловск, 1985), II Всесоюзном симпозиуме «Твердые электролиты и их аналитическое применение» (Свердловск, 1985), II Всесоюзной конференции «Квантовая химия и спектроскопия твердого тела (Свердловск, 1985), X Всесоюзном семинаре «Химия и технология неорганических сорбентов» (Душанбе, 1986), IV Всесоюзном совещании «Спектроскопия координационных соединений». (Краснодар, 1986), V, VI, VII, VIII, IX Всесоюзных совещаниях «Химия, технология и применение ванадиевых соединений» (Чусовой, 1987; Н-Тагил. 1990, Пермь, 1996; Чусовой, 2000; Тула. 2004), VI, Всесоюзном совещании по химии и технологии молибдена и вольфрама (Нальчик, 1988;), II, IV Всесоюзного совещания по научным основам приготовления и технологии катализаторов. (Минск, 1989; Стерлитамак, 2000), I Международной конференции по ХТТ (Одесса, 1990), Всесоюзном семинаре «Химия, строение и применение изо- и гетерополисоединений». (Днепропетровск, 1990), X Всесоюзной конференции по физической химии и электрохимии ионных расплавов в твердых электролитах (Екатеринбург, 1992), V International Conference of electron spectroscopy (Ukraine, Kiev, 1993), III, VI Международных совещаниях по литиевым источникам тока (Екатеринбург, 1994; Новочеркасск, 2000), Всероссийских конференциях по ХТТ (Екатеринбург, 1996; Екатеринбург, 2000; Екатеринбург, 2004), II Inter. Seminar ’’Monolith Honeycomb Supports and Catalysts’’ (Russia, Novosibirsk, 1997), XVI, XVII Менделеевских съездах по общей и прикладной химии (Москва, 1998; Казань, 2003), Baltic. Electron. Confer. BEC’98 (Estonia, Tallin, 1998), 2-ое Уральском кристаллографическом совещании «Кристаллография-92» (Сыктывкар, 1998), Международной конференции по физике твердого тела «Исследование материалов и применение» (Польша, Закопане, 1998), Всероссийской конференции «Электрохимия мембран и процессы в тонких ионпроводящих пленках на электродах» (Энгельс, 1999), IV Международной конференции «Фундаментальные проблемы электрохимической энергетики» (Саратов, 1999), III Russion-German seminar on electron and X-ray spectroscopy (Yekaterinburg, 1999), E-MRS, Spring Meeting (France, Strasburg, 2000), Всероссийской конференции «Сенсор-2000». (Санкт-Петербург, 2000), Научно-практической конференции «Новые конструкционные материалы» (Москва, 2000), 1, 2, 3, 4, 5, 6 семинарах СО РАН-УрО РАН «Новые неорганические материалы и химическая термодинамика” (Новосибирск, 2001; Екатеринбург, 2002; Новосибирск, 2003; Екатеринбург, 2004; Новосибирск, 2005; Екатеринбург, 2006), 2-nd Int. Conf. “Mass and Change Transport in Inorganic Materials” (Italy, Florence, 2002), 6-ом совещании «Фундаментальные проблемы ионики твердого тела» (Черноголовка, 2002), научной конференции по неорганической химии и радиохимии, посвященной 100-летию со дня рождения акад. В.И. Спицына. (Москва, 2002), Международной научной конференции «Химия твердого тела и современные микро- и нанотехнологии» (Кисловодск, 2002; Кисловодск, 2003), 35-ой юбилейной национальной физической конференции Литвы (Литва, Вильнюс, 2003), 10th APAM Seminar “Materials of Siberia” and 3rd conference “Nanoscience and Technology” (Russia, Novosibirsk, 2003), 7, 8, 9 Международных симпозиумах «Порядок, беспорядок и свойства оксидов» (Сочи, 2004; Сочи, 2005; Сочи, 2006), Всероссийской конференции «Керамика и композиционные материалы». (Сыктывкар, 2004), VII конференции «Аналитика Сибири и Дальнего Востока» (Новосибирск, 2004), X Международном семинаре «Дислокационная структура и механические свойства металлов и сплавов». «Нанотехнология и физика функциональных нанокристаллических материалов» (Екатеринбург, 2005), 8 Международном симпозиуме «Фазовые превращения в твёрдых растворах и сплавах» (Сочи, 2005).
Публикации. По результатам исследований опубликовано 189 печатных работ, в том числе 2 монографии, 5 обзоров, 79 статей в отечественных и зарубежных журналах, получено 13 патентов на изобретения, 95 тезисов докладов в трудах региональных, Всероссийских, Всесоюзных и международных конференций.
Объем и структура работы. Диссертационная работа состоит из введения, 7 глав, выводов и списка литературы. Материал изложен на 277 страницах, работа содержит 151 рисунка, 52 таблицы. Список литературы содержит 292 наименований работ отечественных и зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Введение
Во введение обосновывается актуальность темы, ее практическое и научное значение, дана краткая характеристика изучаемых объектов и сформулированы основные цели работы.
1. Исходные вещества и методы исследования
В главе описаны характеристики исходных веществ, способы их получения, аттестации и экспериментальные методы исследований. Для решения поставленных задач использовали следующие основные экспериментальные методики:
- методы аттестации соединений по фазовому и химическому составу: рентгенофазовый на дифрактометре ДРОН-2 и STADI в Cu K-излучении; ИК спектроскопический на спектрометре UR-20 и Specord. Спектры записывали в интервале 400-4000 см1. Точность определения частот полос поглощения составляет ±5 см1; химический; комплексный термический анализ на дериватографе Q-1000 системы Ф.Паулик, И.Паулик, Л.Эрдей при скорости нагрева 10 град/мин и чувствительности ДТГ -2.5мВ, ДТА-1 мВ, ТГ-100 мг и Т-10000С. В качестве эталона использовали порошок -Al2O3, покаленный при 12000С.
- методы определения структурных характеристик, ионного состояния атомов ванадия, молибдена, титана, хрома и вольфрама соединений, водородно-кислородных группировок: рентгенографический анализ пленок ксерогелей, полученных на стекле и ситалле; рентгеноэлектронная спектроскопия на спектрометре VG ESCALAB MK II (Al K1,2 – излучение), который калибровали по линии РЭС Au 4f7/2 (Есв. = 84.0 эВ). Зарядку образца учитывали по линии графита C1s (Есв. = 284.7 эВ), погрешность измерения энергии связи составляла ± 0.1 эВ; электронный парамагнитный резонанс на радиоспектрометре РЭ -1301 и ПС 100.Х фирмы «АДАНИ» (Беларусь) в кварцевых тонкостенных круглых ампулах (d = 4 мм). Температуру отжига при ЭПР исследованиях регулировали с точностью ± 50С. Погрешность определения относительной концентрации парамагнитных центров составляла 25%, ширины линии - ± 5 Гс и g-фактора - ±0.005; протонный магнитный резонанс на спектрометре BS-487B (“Tesla”) широких линий. Рассчитывали весовые вклады pi каждой конфигурации протонов с точностью ±0.005. Относительное содержание водородно-кислородных группировок, присутствующих в виде OH, H2O и Н3О+, оценивали соответственно: N1 = 2np1, N2 = np2, N3 = 2/3np3, где n – общее содержание воды в образцах.
- методы определения термодинамических свойств: метод измерения ЭДС гальванической ячейки с использованием протонпроводящего электролита кремневольфрамовой кислоты H2SiW12O42nH2O; статический метод определения равновесного давления паров воды над ксерогелями, используя специально сконструированную установку, работающую в интервале P(H2O) = 13.3 - 3200 Па. Погрешность измерения давления паров воды равнялась ±13.3 Па и массы образца ±0.3 мг. Температуру в печи регулировали высокоточным регулятором температуры ВРТ-2 с точностью ±1К и контролировали вблизи образца хромель-алюмелевой термопарой. Обработку полученных результатов проводили по методу наименьших квадратов с доверительной вероятностью 0.95.
- метод измерения электрических свойств: на переменном токе с частотой 1 кГц цифровым мостом переменного тока Е7-12, на постоянном токе прибором Щ301-3, вольтметром универсальным цифровым В7-23. Постоянную относительную влажность воздуха обеспечивали с помощью насыщенных растворов соответствующих солей: LiCl – 11.9%, MgCl2 – 33.1%, NaBr – 59.1%, KCl – 85.1%, Pb(NO3)2 – 98%. Образцы готовили в виде таблеток диаметром 6 мм и высотой 3 мм, спрессованных под давлением (19-25)107 Па. Для осуществления надежного контакта таблеток с прижимными платиновыми пластинками измерительной ячейки в торцевые поверхности образца втирали порошок графита спектральной чистоты. Пленки ксерогелей толщиной 15-20 мкм получали путем нанесения соответствующего геля на никелевую пластинку или ситалл с никелевыми контактами и последующего высушивания на воздухе. Контакты также наносили в виде пленок из токопроводящего клея с наполнителем из порошка металлического серебра. Вольт-амперные характеристики снимали с помощью источника постоянного тока Б 5-47, измеряя ток амперовольтметром Р-386.
- исследование морфологии нанотубулярных структур: с помощью сканирующего растрового электронного микроскопа LEO-982 фирмы «Карл Цейс» и просвечивающего электронного микроскопа JEM-200CX.
Частично изучение физико-химических свойств было проведено совместно с коллегами Институтов химии твердого тела, высокотемпературной электрохимии, органического синтеза, физики металлов, электрофизики УрО РАН, УГТУ-УПИ, Института физики полупроводников (г. Вильнюс, Литва), Дзилинского университета (г. Чангчунь, Китай), Института материаловедения Вуханского технологического университета (г. Вухан, Китай).
2. Ксерогели оксидов ванадия.
Ксерогели оксидов ванадия V2O5nH2O относятся к интеркаляционным соединениям, в которых ионы или молекулы-гости расположены между оксидными слоями вещества-хозяина. Они проявляют свойства как основной ванадий-кислородной матрицы, так и интеркалятов. Характерная особенность таких соединений – квазиодномерная структура с турбослоистым разупорядочением, в которую можно легко внедрить не только катионы, но и молекулы органических соединений. Слоистая структура ксерогелей образована спутанными волокнами из V-O цепочек и молекул воды. Волокна представляют собой плоские ленты длиной 1000 и шириной 100 Å. Их структура в плоскости ленты аналогична орторомбическому V2O5. Орторомбические звенья, составляющие ленту, не располагаются в одной общей плоскости, а образуют рельефную структуру с амплитудой 2.8 Å [1,2]. Межслоевое расстояние (d) зависит от содержания воды и при нормальных условиях равно примерно 11.6 Å. По своей природе эти соединения относятся к кислотам. Химическая формула стехиометрического состава – H2V12O31×nH2O [3].
Синтез ксерогелей. Проведен анализ известных литературных данных по методам синтеза ксерогелей оксида ванадия и обоснована задача по изучению условий получения химически чистых порошков и пленок ксерогелей сложных оксидов ванадия общей формулы MzV12 yTyO31±d×nH2O (T = Mo, W, Cr, Ti; M = H, Li, Na, K, Rb, Cs, NH4, Mg, Ca, Sr, Ba, Cu, Ce, Pb). В качестве исходных веществ использовали соединения растворимые в пероксиде водорода и воде. Стехиометрические количества соответствующих веществ при температуре 2-70С растворяли в пероксиде водорода из расчета 12 мл 40% раствора Н2О2 на 1 г твердой фазы. Температурный интервал 2-70С является оптимальным для получения устойчивого раствора пероксидных соединений и сохранения высокой реакционной способности пероксида водорода. При этом происходит образование красно-коричневой монопероксованадиевой кислоты по реакции:
V2O5 + 2H2O2 = 2HVO2(O2) + H2O. (1)
Полученный раствор пероксидных соединений медленно нагревали до 60-800С и выдерживали при этой температуре в течение 1 часа. При нагревании пероксованадиевая кислота разлагается с образованием нейтрального гексакоординированного комплекса ванадия:
HVO2(O2) + 3H2O = [VO(OH)3(OH2)2]0 + 1/2O2. (2)
После конденсации этого нейтрального прекурсора система переходит в гель V2O5nH2O по реакции:
2[VO(OH)3(OH2)2]0 → V2O57H2O. (3)
В основе процессов конденсации соединений ванадия лежат реакции оляции (4) и оксоляции (5):
V-OH + V-OH2 → V-OH-V + H2O, (4)
V-OH + HO-V → V-O-V + H2O. (5)
Н
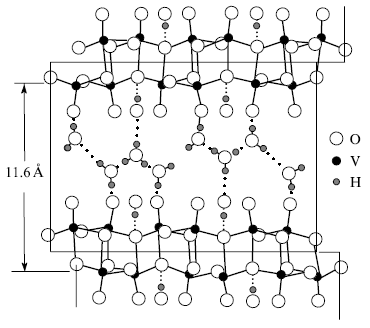
Рис.1. Модель структуры ксерогеля H2V12O31nH2O.
аиболее быстрая реакция оляции (4) ответственна за рост полимерных звеньев, связанных вершинами, а наиболее медленная реакция оксоляции (5) приводит к образованию двойных звеньев, соединенных ребрами. В результате высушивания геля на воздухе образуется темно-бурый продукт, называемый ксерогелем. Количество воды в ксерогелях зависит от относительной влажности воздуха, степени замещения ванадия на молибден, титан, хром, вольфрам и увеличивается в следующем ряду содержащихся в них катионов Cs≤Rb
Структура ксерогелей. Важное место в установлении точной структуры ксерогеля V2O5nH2O занимают исследования состояния кислородно-водородных группировок. В соответствии с результатами ПМР структура ксерогеля H2V12O31nH2O представлена как результат взаимодействия молекул воды с координационно ненасыщенными атомами ванадия орторомбического оксида V2O5 (рис. 1). Этот процесс сопровождается образованием мостиковых OH-групп. Последние, соединяясь с молекулами воды, дают трехспиновые системы, характеризующиеся высокой подвижностью. Аксиально искаженная тетрагональная пирамида VO5 является основным структурным фрагментом двойного ванадий-кислородного слоя ксерогеля оксида ванадия (V). Предложенная структурная модель ксерогеля объясняет высокую подвижность протона за счет движения последнего по сетке водородных связей из молекул воды.
3. Интеркалаты на основе ксерогелей простых и сложных оксидов ванадия.
Интеркалаты на основе ксерогеля оксида ванадия (V). Определены области гомогенности ксерогелей по катионам металлов, зависимости межслоевого расстояния от концентрации интеркалята и ионное состояние ванадия соединений.
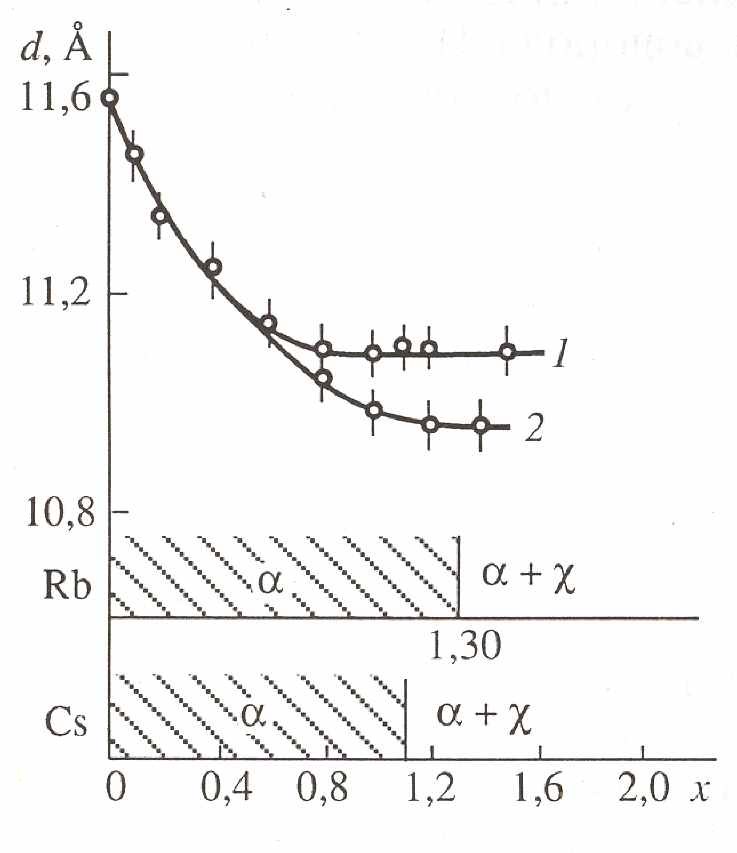
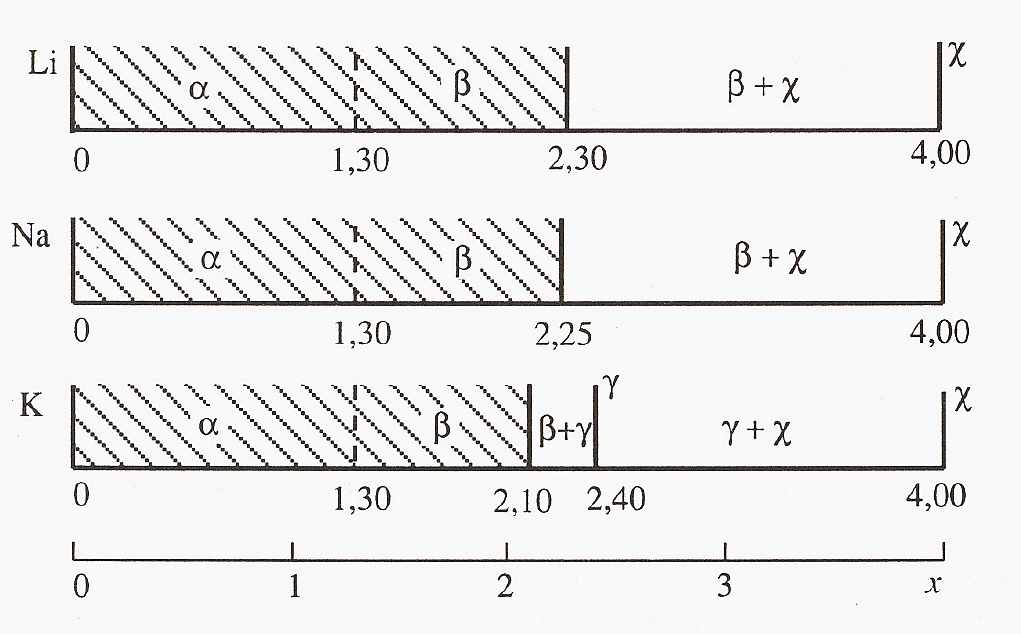
Рис. 2. Фазовые соотношения гидратированных поливанадатов в системе MxV12O31 d×nH2O: a - H2 xMxV12O31-d×nH2O, b - H2 xMx+yV12O31 d×nH2O, - M2V6O16 d×nH2O и - MV5O13-d×2.2H2O.
Рис. 3. Зависимость межслоевого расстояния и фазовый состав ксерогелей H2 xMxV12O31-d×nH2O от содержания ионов Rb+ (1) и Cs+ (2).
Установлено (рис.2), что интеркаляционные соединения относятся к фазам переменного состава с областями гомогенности: H2-xMxV12O31-d×nH2O - a (M = Li, Na, K; 0 < x < 1.30; 0.3 £ d £ 0.4; 7.5 < n < 8.6) и H2-xMx+yV12O31-d×nH2O - b (x 2, 1.30 £ x+y £ 2.30, M = Li; 1.30 < x + y £ 2.25, M = Na; 1.30 < x + y £ 2.10, M = K; 0.3 £ d £ 0.4; 6.7 < n < 10.0). Фазой a обозначен твердый раствор замещения H2-xMxV12O31-d×nH2O, межплоскостное расстояние которого уменьшается с ростом x. Он переходит в b-фазу H2 xMx+yV12O31 d×nH2O с постоянным параметром d00l, определяемым размером гидратированных ионов M+. В случае катионов рубидия и цезия образуется два типа соединений: ксерогель переменного состава H2 xMxV12O31-d×nH2O (a-фаза), где 0 < x £ 1.30 и 1.10 соответственно для M = Rb и Cs, d £ 0.3, а 3.9 < n < 7.0, и кристаллическая c-фаза M2V6O16. Величины областей гомогенности и межслоевых расстояний (рис. 3) предельных составов a-фаз хорошо коррелируют с размерами негидратированных катионов рубидия и цезия.
Ксерогели общей формулы MV12O30.7×nH2O, где M = Mg, Ca, Sr, Ba, также имеют квазиодномерный слоистый тип структуры, межслоевое расстояние которых, как и поливанадатов M2V12O30.7×nH2O (M = Li, Na, K) находится в прямолинейной зависимости от размера гидратированных ионов M2+. Области гомогенности по катионам щелочноземельных металлов для этих соединений не установлены.
Ксерогели H2-xMxV12O31-d×nH2O всегда содержат четырехвалентный ванадий. По данным ЭПР обнаружено два типа парамагнитных центров, что обусловлено различным влиянием на электронную структуру атомов V4+ ионов гидроксония и М+. Зависимость количества парамагнитных центров от температуры имеет максимум вблизи 1000С, который уменьшается по величине в ряду Li>Na>K. Происходящее до 1000С изменение концентрации парамагнитных центров ксерогелей обратимо. С повышением степени гидратации ксерогелей поливанадиевой кислоты, на спектрах ЭПР увеличивается разрешенность сверхтонкой структуры парамагнитных центров. Это может быть связано с переходом ионов VO2+(H2O)5 в квазижидкое состояние межслоевого пространства фаз и уменьшением обменного взаимодействия между 3d-электронами ионов ванадия. Наблюдаемое изменение содержания четырехвалентного ванадия на стадии дегидратации соединений H2 xMxV12O30.7×nH2O можно представить следующей схемой:
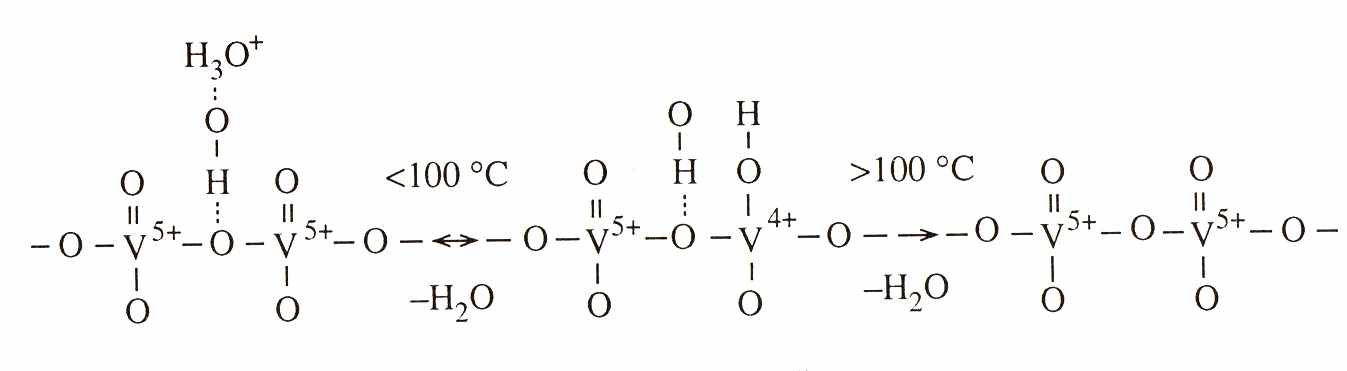
В пределах области гомогенности ксерогелей по кислороду структура интеркалатов не изменяется и остается слоистой. Межслоевое расстояние поливанадиевой кислоты (d=11.55±0.05Å) практически не изменяется в интервале 0£d£0.5, затем увеличивается и для максимальной величины d=1.0 становится равным 11.72±0.05Å. В случае поливанадатов щелочных и щелочноземельных металлов предельное значение d=0.50±0.05, межслоевое расстояние не зависит от концентрации четырехвалентного ванадия и равно 11.11, 10.82, 10.65, 11.27, 11.01, 11.02 и 10.96±0.05Å соответственно для M=Li, Na, K, Mg, Ca, Sr, Ba.
Катионы двухвалентной меди образуют интеркаляционные соединения состава Cu1 x(CuOH)2xV12O31×nH2O (0£x£1 и 8.6£n£9.6) и H2 2xCuxV12O31×nH2O. Высокодисперсный порошок (CuOH)2V12O31×nH2O образуется в результате нагревания влажной стехиометрической смеси металлической меди и оксида ванадия (V) при температуре 500С. Впервые синтезированы гидратированные фазы CuxV2O5×0.2H2O (a-фаза 0
Таблица 1
Параметры элементарной ячейки V2O5 и CuxV2O5×0.2H2O
-
Соединение
Параметры, Å
a
b
c
V2O5
11.513
3.560
4.372
Cu0.08V2O5×0.2H2O
11.513
3.564
4.373
Cu0.60V2O5×0.2H2O
11.470
3.539
4.526
Образование гидратов CuxV2O5×0.2H2O начинается уже при комнатной температуре во время перемешивания реакционной смеси Cu – V2O5 – H2O. Такая высокая реакционность исходных веществ объясняется гидратацией оксида ванадия (V), в результате которой образуется плохо растворимая декаванадиевая кислота по реакции:
5V2O5 + 3H2O = H6V10O28 ↔ V2O5∙nH2O + (3-n)H2O. (6)
Происходящие при этом взаимодействия с участием металлической меди можно представить уравнением:
H6V10O28 + 3Cu → Cu3V10O25∙nH2O + (3-n)H2O = 5Cu0.6V2O5×0.2H2O + 0.5H2O. (7)
Интеркалаты CuxV2O5×0.2H2O очень реакционно-способны по отношению к молекулярному кислороду. Данное свойство этих соединений свидетельствует о перспективности использования их в качестве катализаторов низкотемпературных процессов окисления органических веществ.
В результате взаимодействия PbO2 и PbO с гелем оксида ванадия (V) образуются поливанадаты общей формулы [H2 x(PbOH)x]V12O31×nH2O (0
xPbO2 + H2V12O31×nH2O = [H2 x(PbOH)x]V12O31×nH2O + x/2O2, (8)
xPbO + H2V12O31×nH2O = (H2 2xPbx)V12O31×nH2O + xH2O. (9)
Согласно РЭС весь ванадий соединений находится в пяти-, а свинец - в двухвалентном состояниях. Энергия связи V2p3/2- полосы равна 517.1 и 517.2эВ, а Pb4f7/2- полосы – 138.8 и 139.0эВ соответственно. После разложения O1s - полосы выделены дополнительные полосы вблизи 531.8 и 533.1эВ, относящиеся к OH-группам и молекулам воды. Энергия связи по O1s линии ванадий-кислородных группировок равна 530.2 и 530эВ.
Поливанадат церия (III) Ce2(V12O31)3×nH2O (11.0£n£15.0) образуется в виде рентгеноаморфного осадка коричневого цвета в результате ионообменного взаимодействия в системе H2V12O31-Ce(NO3)3-H2O. Соединение выделяет основную массу воды (11 молей) до 3000С, при 3400С удаляется более прочно связанная конституционная вода и происходит разрушение структуры поливанадата. Ионообменный процесс создает благоприятные условия для образования гидроксоаквакомплексов Ce(III) в структуре поливанадата по схеме:
Ce(H2O)63+ +nH2O ® [Ce(H2O)6 n(OH)n]3-n + nH3O+. (10)
Интеркалаты на основе сложных оксидов ванадия. Оксид V2O5 образует твердые растворы замещения ионов ванадия на четырех-, пяти- и шестивалентные ионы. Установлено, что подобный процесс реализуется и в гидратах V2O5×nH2O. Получены аналогичные по составу ксерогели общей формулы M2V12-yTyO31±d×nH2O (M=H, Li, Na, K и T=Mo, W, Cr, Ti). Отношение V4+/Mo6+ в них изменяется также как в твердых растворах MoO3 в V2O5, синтезированных на воздухе. Образующиеся при этом ионы четырехвалентного ванадия способствуют полимеризации золей и получению устойчивых гелей.
Поливанадатомолибдаты Ксерогели поливанадиевомолибденовой кислоты описываются общей формулой H2V12 yMoyO31±d×nH2O (0
Согласно рентгенографическим исследованиям ксерогели поливанадатомолибдатов имеют квазиодномерную слоистую структуру. Величина параметра d00l, характеризующая расстояние между слоями, определяется несколькими факторами. Во-первых, силой взаимодействия молекул воды с ванадий-кислородными слоями за счет водородных связей, что обуславливает раздвижение слоев, и, во-вторых, силой электростатического взаимодействия между отрицательно заряженными слоями V-O и внедренными катионами, стягивающими слои.
В
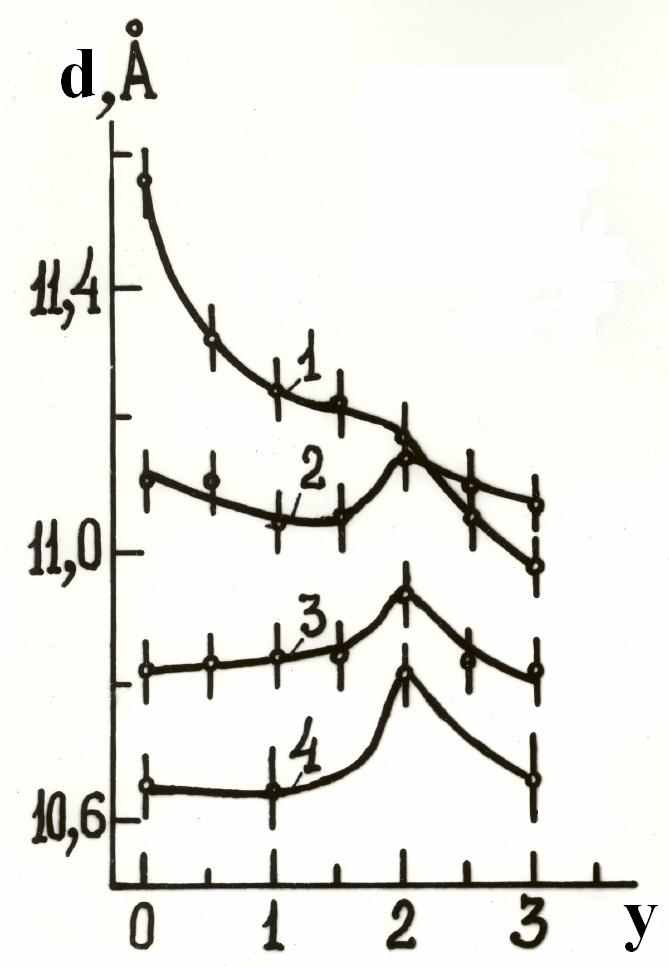
Рис. 4. Зависимость межслоевого расстояния (d) от степени замещения ионов ванадия на молибден (y) в ксерогелях M2V12 yMoyO31±d×nH2O: M = H (1), Li (2), Na (3), K (4).
свою очередь сила электростатического взаимодействия зависит от способности катионов координировать вокруг себя молекулы воды, т.е. от радиусов гидратированных катионов. Координация молекул воды вокруг катиона увеличивает его эффективный радиус и уменьшает электростатическое взаимодействие между ним и слоями V-O. Увеличение степени замещения ванадия на молибден повышает общее содержание воды в соединениях M2V12 yMoyO31±d×nH2O. Однако характер изменения межслоевого расстояния в поливанадатомолибдатах различен (рис. 4). При y=2 на концентрационных зависимостях имеется четко выраженный экстремум, который, по-видимому, является следствием упорядочения ионов Mo6+ в структуре ксерогелей.
Установлено, что количество катионов М+ в этих соединениях можно изменять согласно общей формуле H2 2xM2xV12 xMoxO31±d×nH2O, где M=Li, Na, K; 0
По данным РЭС подтверждается пяти- и четырехвалентное состояния ванадия в данных соединениях. Энергия связи полосы V2p3/2 пятивалентного ванадия соответствует 517.5 эВ, а для V4+ - 516.5 эВ. Концентрация V4+ увеличивается с ростом содержания ионов молибдена в образцах. Энергия связи линии Mo3d-полосы равна 232.7 эВ и свидетельствует о шестивалентном состоянии ионов молибдена в H2V12 yMoyO31±d×nH2O. Высокоэнергетическая составляющая O1s-спектра состоит их двух полос соответствующих OH-группам и молекулам воды.
При замещении ванадия на молибден сверхтонкая структура спектров ЭПР постепенно исчезает. Это свидетельствует об уменьшении степени локализации неспаренного электрона в позиции ванадия. Изменение концентрации парамагнитных центров в зависимости от температуры прокаливания образцов имеет максимум в интервале 150 – 2000С, что объясняется протеканием окислительно-восстановительных процессов и образованием твердого раствора V2-xMoxO5+.
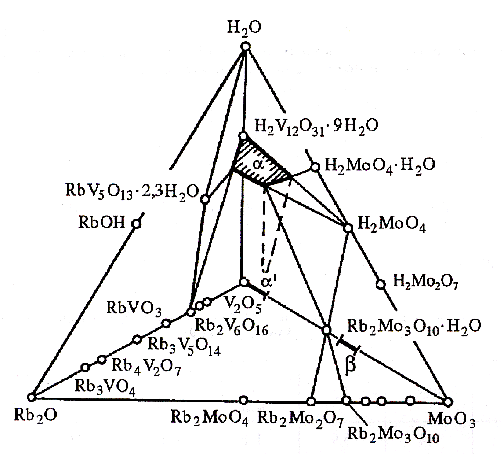
Рис. 5. Фазовый состав системы Rb2O-V2O5-MoO3-H2O. ´ - (V1-yMoy)2O5+ (0 < y 0.15); - V2-yMo1+y/2O8- (0 y 0.30, 0.1).
