Интеркалаты оксидов ванадия и нанотубулены на их основе: синтез, строение, свойства 02. 00. 04 физическая химия
| Вид материала | Автореферат |
Содержание7. Материаловедческая значимость полученных соединений. Электрохимические устройства. |
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Урок химии в 9 классе. Тема: «Оксиды азота», 68.76kb.
- Синтез и строение N,o- содержащих гетероциклических соединений на основе несимметричных, 201.05kb.
- Влияние условий синтеза и легирования на физические свойства оксидов ванадия, 316.45kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Лесничая марина Владимировна синтез и свойства ag(0)-, Au(0)-содержащих нанокомпозитов, 308.79kb.
- Перколяционный переход в пористых керамиках на основе нанокристаллических оксидов,, 120.58kb.
- Кристаллические и стеклообразные фазы в системах biF 3 Bi 2 o 3 BaF, 505.44kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
Установлено, что как протонные проводники наибольший интерес представляют соединения общей формулы (NH4)2 xHxV12 yMoyO31nH2O, которые образуют пленки хорошего качества. Максимальную электропроводность имеет пленка состава (NH4)1.5H0.5V9Mo3O32.5-nH2O. В твердых растворах (NH4)2 xHxV9Mo3O31+nH2O образуются две частично упорядоченные структуры в катионной подрешетке, а при x=1 существует дальний порядок в расположении ионов аммония и гидроксония. Протонная проводимость в данных соединениях осуществляется по двум основным схемам (12) и (13), которые взаимно связаны единой протонной системой:
H3N-H+…OH2 H3N…H+-OH2, (12)
H2O-H+…OH2 H2O…H+-OH2. (13)
Проводимость поливанадатомолибдата аммония прямо пропорциональна относительной влажности воздуха (рис. 14). Зависимость электропроводности пленок от относительного содержания паров воды в воздухе позволяет рекомендовать их для использования в качестве резистивных датчиков влажности.
Для соединений H2V12-yWyO31+nH2O электропроводность уменьшается с ростом степени замещения ионов ванадия на вольфрам, а энергия активации проводимости остается практически постоянной и равной 0.22 – 0.24 эВ. Зависимость проводимости пленки H2V11WO31+nH2O от относительной влажности воздуха вдоль (=) и перпендикулярно () V-O слоям отличается приблизительно на четыре порядка (рис.15). Установлено, что определяется ионной составляющей, = - ионной и электронной проводимостью.
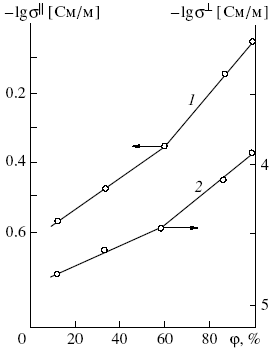
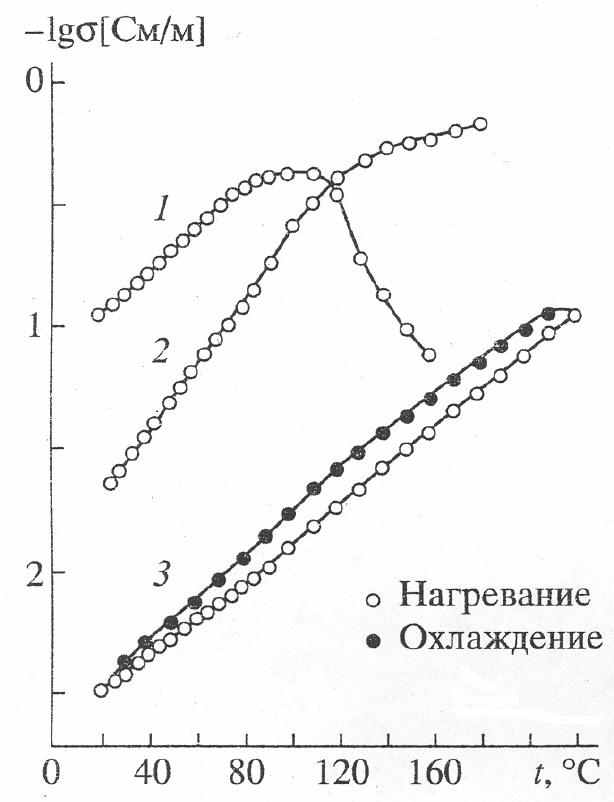
Рис. 15. Зависимость электропроводности пленки H2V11WO31+nH2O вдоль (1) и перпендикулярно (2) V-O-W слоям от относительной влажности воздуха при 293 К.
Рис. 16. Зависимости логарифма электропроводности от температуры поливанадата свинца: H(PbOH)V12O31∙nH2O (1), PbV12O31∙10.6H2O (2), (PbOH)2V12O31∙8.5H2O (3).
Электропроводность таблетированных порошков HxV12 yTiyO30+0.5(x-y)nH2O при 293 К уменьшается с понижением содержания протонов и ростом количества ионов титана в образцах. Минимальную величину = 5.9610-4 См/м имеет упорядоченный твердый раствор H0.7V4Ti8O26.35nH2O. Зависимости lg-1/T близки к прямолинейной при нагревании до Т 373К, а для гидратированного диоксида титана H0.02TiO1.92(OH)0.19nH2O – до 340 К. Энергия активации проводимости уменьшается от 0.20 до 0.16 эВ при переходе от V2O5nH2O к TiO2nH2O.
Ионная проводимость по двухвалентным катионам наиболее подробно изучена для интеркаляционных соединений свинца (рис.16). Наибольший практический интерес среди них представляет фаза (PbOH)2V12O31∙nH2O. На воздухе при 298К она имеет проводимость 3.21·103 См/м. После дегидратации образца при 355К и последующего охлаждения до 303К значение σ = 1.38·102 См/м. Увеличение проводимости связано с уменьшением межслоевого расстояния в структуре соединения, частичным разрушением комплексных ионов гидроксида свинца и ростом подвижности Pb2+. Исследовании температурной зависимости свидетельствуют о том, что данный интеркалат можно использовать в качестве твердого электролита в низкотемпературных электрохимических устройствах. Потенциал электрода, изготовленного этого вещества в растворах Pb(NO3)2 подчиняется линейной зависимости Е = 690-30рС(Pb2+) в интервале 1 рС(Pb2+) 5. Угловой коэффициент этой функции близок к теоретическому для катиона в степени окисления 2+.
6. Нанотубулярные структуры оксида ванадия.
С

Рис. 18. СЭМ тубуленов VO2.45(C2H5)0.30.

Рис. 17. ПЭМ нанотрубок VO2.35(C2H3)0.28.
лоистые структуры являются идеальными прекурсорами для нанотубулярных форм оксидов металлов. Благоприятные условия для сворачивания оксидных плоскостей возникают при увеличении расстояния между ними и образовании нескомпенсированных связей. Для синтеза нанотубуленов оксида ванадия нами впервые использованы композиты гель (ксерогель) V2O5nH2O/гидроксильное органической соединение. В качестве последнего использовали поливиниловый спирт (ПВС) C2H3OH, этанол C2H5OH, пирокатехин (ПКХ) и гидрохинон (ГХН) C4H6(OH)2, где ОН-группы в орто- и параположениях соответственно. Эти соединения, выполня роль темплата, увеличивают расстояние между V-O слоями и, частично восстанавливая ванадий, способствуют образованию тубуленов.
Из композита V2O5nH2O/ПВС получены НТ состава VO2.35(C2H3)0.28 с внешним диаметром 30 – 150 нм, длиной несколько мкм и межслоевым расстоянием 13.9 Å (рис.17). По данным РЭС НТ содержат заметное количество четырехвалентного ванадия. Линия V 2p3/2 ионов V5+ и V4+ соответствует энергиям связи 517.1 и 515.7 эВ. Спектр C1s полученных образцов состоит из четырех составляющих: C-C (284 эВ), С-Н (285.6 эВ) и С-О (286.6 и 288.1 эВ), что подтверждает внедрение ПВС в структуру тубуленов. Таблетированные образцы нанотрубок имеют полупроводниковый характер электропроводности, которая сильно зависит от давления и состава газовой фазы.
При использовании прекурсора V2O5nH2O/C2H5OH образуются сросшиеся трубчатые структуры большого размера (1.5 – 2 мкм) с толщиной стенок 300 – 400 нм (рис. 18). Они описываются формулой VO2.45(C2H5)0.30. Трубки очень эластичные и легко подвергаются деформации даже при небольших механических воздействиях, параметр d00l = 14.30 Å. Изучены РЭС, ИК-спектры и термические свойства порошков тубуленов. Определена проводимость тубуленов вдоль и перпендикулярно V O слоям. Установлено, что электропроводность в направлении перпендикулярном V-O слоям увеличивается с ростом количества циклов нагрев-охлаждение в интервале 298 – 393 К и практически не изменяется после четвертого цикла. Проводимость вдоль ванадий-кислородных слоев в 35 раз больше, чем в перпендикулярном направлении, что свидетельствует об анизотропии свойств вдоль и перпендикулярно V-O слоям тубулена.

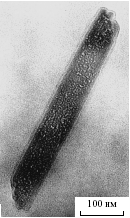
Рис. 19. СЭМ VO2.35(C6H4)0.35 НТ, полученных из композита ксерогель V2O5·1.6H2O/ПКХ.
Рис. 20. ПЭМ VO2.35(C6H4)0.11 НТ, полученных из композита ксерогель V2O5·1.6H2O/ГХН.
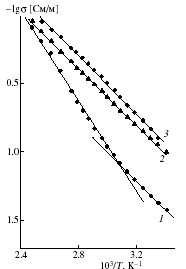
Рис. 21. Температурные зависимости электропроводности таблетки порошка VO2.35(C6H4)0.35 НТ, полученных из композита ксерогель V2O5·1.6H2O/ПКХ: 1 – первичное нагревание, 2 – вторичное нагревание и 3 – охлаждение.
В случае композитов V2O5nH2O/ПКХ или ГХН внешний диаметр НТ равен 40 – 140 нм и 50 – 110 нм соответственно (рис. 19 и 20). Состав НТ описывается как VO2.35(C6H4)y, где y = 0.35 и 0.11 для ПКХ и ГХН соответственно. Расстояние между слоями d00l 13.85 ± 0.05 Å и параметр структуры слоев a = 6.0 и 6.2 Å соответственно. РЭС синтезированных тубуленов подобны и свидетельствуют о содержании в образцах пяти- и четырехвалентного ванадия. Электропроводность таблетированных порошков тубуленов имеет полупроводниковый характер (рис. 21). Структурные особенности хиноидного ядра орто-хинона способствуют существенному образованию углеродных структур, в том числе и НТ, при окислении ПКХ кислородом оксида ванадия (V). Методом энергодисперсионного микроанализа (рис. 22, 23) изучено распределение элементов по сечению нанотрубки VO2.35(C6H4)0.11. Установлено, что они состоят из семи ванадий-кислородных слоев и имеют канал.

Рис. 22. ПЭМ VO2.35(C6H4)0.11 НТ в темном поле.
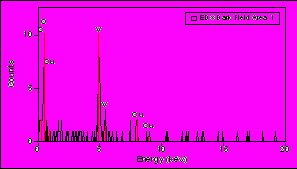
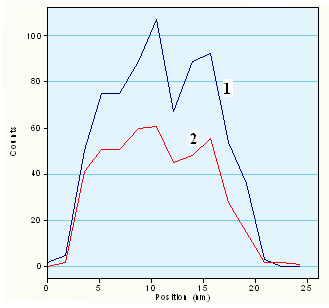
Рис. 23. Спектр энергии рассеяния рентгеновского излучения и элементный состав по сечению VO2.35(C6H4)0.35 НТ: 1- ванадия, 2 – отношение V/O.
Процесс образования ванадий-оксидной наноструктуры с использованием в качестве темплата ГХН может быть описан реакцией (14):
H2V12O31 + 3(HO-C6H4-OH) = C6H4(V85+V44+O28(OH)2) + 3H2O + 2C6H4O2 (14)
О правомерности данной реакции свидетельствует состав нанотрубок, вычисленный по результатам РЭС.
Для синтеза наноразмерных структур сложных оксидов ванадия были использованы соответствующие гели и ксерогели. НТ состава V0.78Мо0.22O2.49(С2Н3)0.46 синтезированы из композита гель V1.67Мо0.33O5.16·nH2О/ПВС (рис. 24). Образец состоял из пучков и одиночных нанотрубок с внешним диаметром 10 – 20 нм и длиною несколько мкм. Межслоевое расстояние составляет 13.75 ± 0.05 Å и параметр структуры V-O-Mo слоев a = 6.23 ± 0.04 Å. По данным РЭС они содержат V5+, V4+, Mo6+. Энергия связи для Mo3d-полосы равна 231.3 эВ. При нагревании образцов на воздухе при 1750С фиксируется эндоэффект выделения газовой фазы, которое заканчивается при 2800С.


Рис. 24. ПЭМ высокого разрешения ванадий-молибденовых НТ.
Рис. 25. СЭМ НТ V0.95Ti0.05O2.33(C6H4)0.12.
Наностержни состава V0.95Ti0.05O2.33(C6H4)0.12 синтезированы из прекурсора V1.67Ti0.33O4.84nH2O/ГХН (рис.25). Внешний диаметр полученных структур 20 – 40 нм, длина 150 – 300 нм, расстояние между V-O слоями 13.85 ± 0.05 Å. Параметр структуры V-O-Ti слоев – a = 6.20 Å. По данным РЭС они содержат V5+, V4+ и Ti4+. Энергии связи для V2p3/2 полосы V5+ и V4+ равны 517.1 и 516.0 эВ соответственно, Ti2p3/2 – 458 эВ и O1s структурного кислорода – 529.9 эВ. Изучены электропроводность и ИК спектры наноструктур. Нагревание порошка НТ на воздухе сопровождается выделением сорбированных газовых составляющих воздуха. Далее следует окисление органической компоненты и восстановление ванадия с максимумом экзоэффекта при 2900С. Процесс заканчивается окислением продуктов термолиза при 4750С.
Полученные в настоящей работе результаты позволяют предложить следующую модель формирования тубулярных структур простых и сложных оксидов ванадия (рис.26). Образованию трубок способствует увеличение межслоевого расстояния в структуре гелей (ксерогелей) при внедрении гидроксилсодержащих органических соединений. При этом взаимодействие между V-O слоями уменьшается. Гель V2O5·nH2O (0.1 М по ванадию) относится к классу кислот (рН = 2.3 – 2.4) и взаимодействует с гидроксилсодержащими органическими соединениями по гидролитическому механизму с увеличением рН до 3.6 – 3.8. В дальнейшем часть органической компоненты восстанавливает ванадий до четырехвалентного состояния, без которого тубулены оксида ванадия не образуются. Фактором скручивания V-O слоев может служить анизотропное распределение ионов ванадия различной валентности и размера, приводящее к скручиванию V-O слоев.
Н
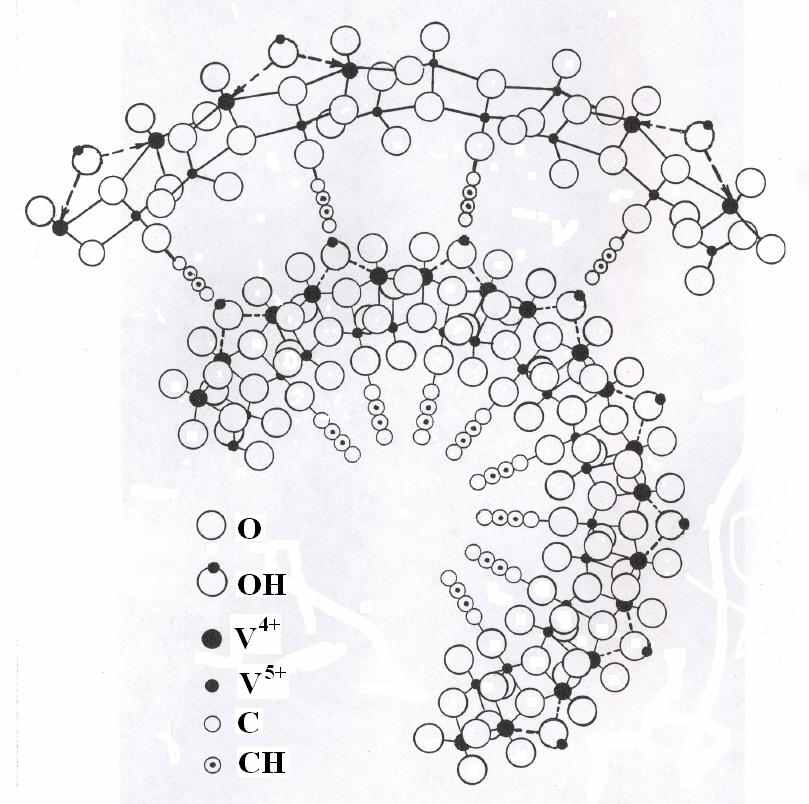
Рис. 26. Модель формирования ванадий-оксидной нанотрубки.
апример, увеличение количества больших по размеру атомов V4+ в одной плоскости слоев приведет к увеличению размера этой поверхности и изгибу V-O плоскости. Начало скручивания V-O слоев приведет к перераспределению зарядов, образованию и стабилизации НТ. При таком механизме формирования трубок наиболее эффективными прекурсорами могут быть ксерогели оксида ванадия. Замена протонов ксерогеля на несущий положительный заряд радикал органической компоненты ослабит взаимодействие V-O слоев. Избыток гидроксилсодержащих органических соединений восстановит поверхностные слои ксерогеля. Это приведет к эффективному скручиванию V-O слоев и формированию тубуленов.
Таблица 6
Морфологические характеристики ванадий-оксидных наноструктур
| Темплат | Состав наноматериала | D | d00l, Å |
| этанол | VO2.45(C2H5)0.30 | 1.5 - 2 мкм | 14.3 |
| ПВС | VO2.35(C2H3)0.28 | 30 - 150 нм | 13.9 |
| ГХН | VO2.35(C6H4)0.11 | 50 - 110 нм | 14.1 |
| ПКХ | VO2.35(C6H4)0.35 | 40 - 140 нм | 13.9 |
| ПВС | V0.78Mo0.22O2.49(C2H3)0.46 | 10 – 20 нм | 13.8 |
| ГХН | V0.95Ti0.05O2.33(C6H4)0.12 | 20 – 40 нм | 13.9 |
В табл. 6 суммированы результаты по синтезу ванадий-оксидных наноструктур, позволяющие сделать следующие выводы:
- образование наноструктур идет по гидролитическому механизму;
- диаметр наноструктур зависит от концентрации ионов (V4+, Mo6+, Ti4+), размер которых больше V5+;
- тип темплата влияет на величину межслоевого расстояния.
Таким образом, в результате проведенных исследований получено два типа наноразмерных структур оксида ванадия: в виде нанотрубок и наностержней. Электронно-микроскопические изображения высокого разрешения этих структур приведены на рис. 27 и 28.


Рис. 27. ПЭМ высокого разрешения ванадий-оксидных наностержней.
Рис. 28. СЭМ нанотрубок оксида ванадия.
7. Материаловедческая значимость полученных соединений.
Результаты фундаментальных исследований интеркаляционных соединений простых и сложных оксидов ванадия, полученных в виде ксерогелей, свидетельствуют о том, что они устойчивы при нормальных условиях и могут быть использованы в качестве новых материалов для решения практических задач. Простота получения их в виде пленок, высокодисперсных порошков и нанокомпозитов с низкими энергетическими затратами позволяет занять им одно из ведущих мест в технологиях и материалах будущего. Основные работы в этом направлении рассмотрены в настоящей главе.
Электрохимические устройства. Положительные результаты получены при использовании ксерогелей простых и сложных оксидов ванадия в качестве катодного материала химических источников тока с литиевым анодом и апротонным электролитом. Катодная масса, состоявшая из 65% рентгеноаморфного оксида V2 yCryO5+ (0x0.67), 30% графита и ацетиленовой сажи эффективно работает во вторичных элементах. При температуре 2
 50С, плотности тока 1 мА/см2 разрядное напряжение одного элемента 2.53.2 В и удельная емкость катода 200220 Ач/кг. Для разработки резервных батарей биполярной конструкции с водным электролитом и магниевым анодом в качестве катодного материала использовали ксерогели состава M2V12O31 nH2O, где М - ион щелочного металла. Такие источники тока необходимы при аэрологических исследованиях приземных слоев атмосферы. При разрядной плотности тока 45 мА/см2 среднее разрядное н
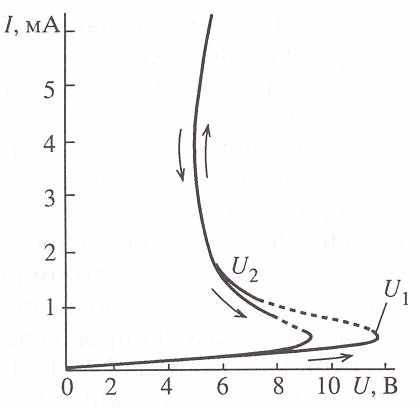
50С, плотности тока 1 мА/см2 разрядное напряжение одного элемента 2.53.2 В и удельная емкость катода 200220 Ач/кг. Для разработки резервных батарей биполярной конструкции с водным электролитом и магниевым анодом в качестве катодного материала использовали ксерогели состава M2V12O31 nH2O, где М - ион щелочного металла. Такие источники тока необходимы при аэрологических исследованиях приземных слоев атмосферы. При разрядной плотности тока 45 мА/см2 среднее разрядное н Рис. 29. Вольтамперная характеристика пленки ксерогеля Н2V12O30.7nH2O.
апряжение батареи равнялось 2628 В, а удельная энергия - 7580 Втч/кг.
Пленки ксерогелей поливанадиевой кислоты Н2V12O30.7nH2O с большим содержанием четырехвалентного ванадия могут быть использованы в качестве материала переключающего устройства. Переключение возникает в результате электрической формовки образца и соответствует резкому переходу от низко- к высокопроводящему состоянию (рис. 29).
Ксерогели поливанадатомолибдатов (вольфраматов) представляют интерес как твердые электролиты с проводимостью по катиону Li+ для низкотемпературных электрохимических устройств и электрохромные материалы, изменение цвета которых происходит в результате интеркаляции – деинтеркаляции протонов или ионов лития.
Сенсорные материалы. Ксерогели составов М2(V12-yMoyO31±)3nH2O, где 0.5 y 3; 0.3 1.0, предложено использовать в качестве ионочувствительных материалов электродов прямого потенциометрического определения концентрации трехвалентного катиона в растворах. Интервал их работы изменяется от 1 до 10-3 10-5 М. Электроды умеренно селективны к двухвалентным ионам.
Ксерогели M2V12-yTyO31±nH2O, где M = H или Li, T = Mo, W, Cr, в виде пленок были апробированы в качестве внутреннего твердого контакта стеклянного электрода для определения рН растворов. Твердый контакт изготовляли в виде пленки ксерогеля или композита ксерогеля с глицерином. Они обладают широким диапазоном работы от рН=1 до рН=14, большой стабильностью потенциала (± 1 мВ) и имеют электросопротивление 40 – 1000 МОм.
Зависимость электропроводности ксерогелей (NH4)2 xHxV12 yMoyO31nH2O от давления паров воды использована для разработки пленочных резистивных датчиков влажности воздуха. В качестве подложки для влагочувствительной пленки использовали стандартные резисторы типа МЛТ. Используя резисторы с различным электросопротивлением можно получать датчики влажности с различной чувствительностью. Время установления равновесного состояния при измерениях составляет менее 30 сек.
Пленки состава H2V12O31-nH2O проявляют сенсорные свойства по отношению к парам этанола. При температуре 1800С они не реагирует на содержание в воздухе до 1000 ppm NH3, H2, CO, CH3COCH3, паров воды.
Катализ. Поливанадаты могут быть использованы в индивидуальном виде или иммобилизованными на анионите АВ-17 как катализаторы реакции окисления метилфенолов до метилбензохинонов. Степень превращения исходного сырья и селективность по хинону достигают 100%. Ксерогели H2V12 yMoyO31nH2O, нанесенные на -Al2O3 с последующим прокаливанием при 5500С, проявили высокую каталитическую активность в реакции парофазного окисления этиленгликоля кислородом воздуха. Конверсия этиленгликоля увеличивается с ростом температуры процесса и уменьшается при повышении содержания молибдена и введении щелочного элемента в катализатор. Смешанные оксиды состава V2 yCryO5+nH2O (0 < y 1.3), нанесенные на -Al2O3, обладают каталитической активностью в процессе восстановления оксидов азота аммиаком. Эти катализаторы позволяют достигать степень восстановления оксидов более 90% в интервале 280 - 3300С при высоких промышленных скоростях газов (10000 - 30000 ч-1). Поливанадаты M2V12O31nH2O (M = Na, K) являются эффективными катализаторами окисления порошка алюминия. Степень окисления алюминия равная 90% с добавкой поливанадатов достигается при температуре 10000С, а без добавки – при 15000С.
