Интеркалаты оксидов ванадия и нанотубулены на их основе: синтез, строение, свойства 02. 00. 04 физическая химия
| Вид материала | Автореферат |
- Синтез и физико-химические свойства координационных соединений рения(V) с производными, 208.83kb.
- Урок химии в 9 классе. Тема: «Оксиды азота», 68.76kb.
- Синтез и строение N,o- содержащих гетероциклических соединений на основе несимметричных, 201.05kb.
- Влияние условий синтеза и легирования на физические свойства оксидов ванадия, 316.45kb.
- Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных, 287.71kb.
- Синтез и исследование полифункциональных люминофоров на основе алюминатов стронция, 307.95kb.
- Лесничая марина Владимировна синтез и свойства ag(0)-, Au(0)-содержащих нанокомпозитов, 308.79kb.
- Перколяционный переход в пористых керамиках на основе нанокристаллических оксидов,, 120.58kb.
- Кристаллические и стеклообразные фазы в системах biF 3 Bi 2 o 3 BaF, 505.44kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
Максимальная степень замещения ионов ванадия на вольфрам достигнута для соединений общей формулы H2V12 yWyO31±d×nH2O (0 < y £ 3). На ИК спектрах этих ксерогелей частота полосы валентных колебаний V=O связи постоянна и равна 1010 см-1. С повышением содержания вольфрама в образцах становится заметной полоса вблизи 980см 1, которая соответствует (W=O) и колебаниям V4+=O – группировок. Поглощение ИК излучения деформационными колебаниями V-O…H связями смещается от 925 до 910 см 1 в интервале составов 0 y 3. Полоса мостиковых связей (V-O-V) сдвигается в сторону меньших частот на 10 см-1, увеличивается по интенсивности и при y = 3 находится вблизи 760 см-1. Частотные характеристики колебаний (V-O), (H-O-H) молекул воды практически не изменяются и равны 525 5 см-1, 1615 5 см-1 соответственно. Соединения H2V12 yWyO31+nH2O до y 1.5 образуют устойчивые гели и пленки со слоистой структурой и межслоевым расстоянием 11.60 0.05 Å. На основе структуры гидратов WO3nH2O получены соединения общей формулы HxVxW1-xO3nH2O орторомбической сингонии с параметрами элементарной ячейки:
-
кристаллогидрат
a, Å
b, Å
c, Å
WO3(1.5-1.7)H2O
7.68(3)
13.81(5)
7.39(3)
H0.08V0.08W0.92O31.2H2O
5.208(3)
10.607(9)
5.079(3)
H0.17V0.17W0.83O31.5H2O
7.60(3)
13.86(5)
7.37(3)
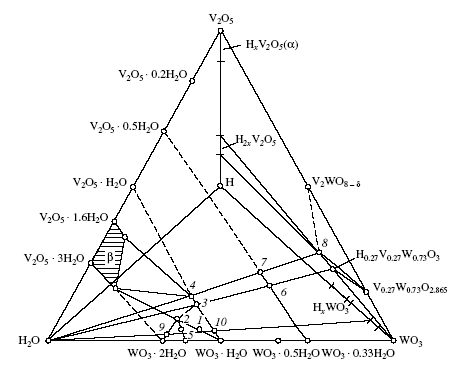
Рис. 6. Схема фазовых соотношений в системе H2O-H-WO3-V2O5 (мол.%): 1 - H0.08V0.08W0.92O31.2H2O, 2 - H0.17V0.17W0.83O31.5H2O, 3 - H0.25V0.25W0.75O3H2O, 4 - H0.33V0.33W0.67O3H2O, 5-H0.125V0.125W0.875O31.5H2O, 6 - H0.27V0.27W0.73O30.33H2O, 7 - H0.33V0.33W0.67O30.33H2O, 8 - H0.33V0.33W0.67O3, 9 - H0.12WO32H2O, 10 - H0.1WO32H2O и -H2V12-yWyO31+nH2O.
При x = 0.25 и 0.33 методом ИК спектроскопии идентифицированы рентгеноаморфные фазы. По данным РЭС в рентгеноаморфных H2V12-yWyO31+nH2O и HxVxW1 xO3nH2O (x = 0.25 и 0.33) имеется заметное количество V4+, а кристаллические фазы HxVxW1-xO3nH2O (x = 0.08 и 0.17) практически не содержат четырехвалентного ванадия. В структуре полученных соединений имеются четыре различных химических состояния атомов кислорода: два состояния связаны с атомами ванадия и вольфрама, высокоэнергетические максимумы относятся к OH- - группам и молекулам воды. Энергия связи O1s-полосы ионов кислорода, связанных с ванадием в H2V12-yWyO31+nH2O, равна 530.4 эВ, в HxVxW1 xO3nH2O – 530.2 эВ. Для связи O-W она составляет 531.3 эВ и 530.9 эВ соответственно. Фазовые соотношения сложных гидратированных оксидов ванадия (V) и вольфрама (VI), без учета примеси V4+, приведены на рис.6.
Поливанадатохроматы. При замещении ионов ванадия на хром образуются соединения общей формулы H2 xy[V12 yCry(OH)2yO31 2y]×nH2O (x=0.4, 0
Ионным обменом протонов поливанадиевохромовой кислоты на катионы Ce3+ и Ce4+ получены соответствующие соединения церия состава Ce(2 0.4y)/33+[V12 yCry(OH)2yO31-2y]×nH2O и (Ce4+(OH)2)1 0.2y[V12 yCry(OH)2yO31 2y]×nH2O, где 0 < y £ 4 и 9 £ n £ 22. Межслоевые расстояние в структуре пленок ксерогелей поливанадатохроматов церия следующие:
Ксерогель y=0 y=1.5
H2-0.4yV12-yCry(OH)2yO31-2y×nH2O 11.57 11.27Å
Ce(2-0.4y)/33+[V12-yCry(OH)2yO31-2y] ×nH2O 12.64 12.56Å
(Ce4+(OH)2)1-0.2y[V12-yCry(OH)2yO31-2y] ×nH2O 10.95 11.05Å
Поливанадатотитанаты. Максимальная область гомогенности существует для ксерогелей поливанадиевотитановой кислоты общей формулы HxV12 yTiyO30+0.5(x y)nH2O (0
HxV12-yTiyO30+0.5(x-y)·nH2O (b) (0.7 £ x < 2 0 < y £ 8 8.6 £ n £ 14.6)
HxTi12-yVyO24+0.5(x+y)·nH2O (g) (0.12 < x <0.36 0 < y £ 3 9.2 £ n £ 16)
TiO1.9(OH)0.2·nH2O или H0.02TiO1.92(OH)0.18·nH2O.
Ксерогель HxV12-yTiyO30+0.5(x-y)·nH2O (b) является твердым раствором замещения ванадия на титан на основе слоистой структуры поливанадиевой кислоты. При y = 5 на ИК спектре этой фазы становится заметной полоса вблизи 640 см-1, достигающая максимальной интенсивности для состава y = 8 и соответствующая 670 см-1. Она относится к антисимметричным валентным колебаниям мостиков Ti – O – Ti и V – O – Ti. Гидратированный диоксид титана имеет искаженную структуру анатаза и описывается формулой TiO1.9(OH)0.2nH2O (H0.02TiO1.92(OH)0.18nH2O). Замещение титана на ванадий в TiO2nH2O стабилизирует структуру анатаза до состава V3Ti9O25.5nH2O, а при дальнейшем увеличении V5+ образец становится рентгеноаморфным. Область существования твердого раствора с искаженной структурой анатаза описывается химической формулой HxTi12 yVyO24+0.5(x+y)nH2O ().
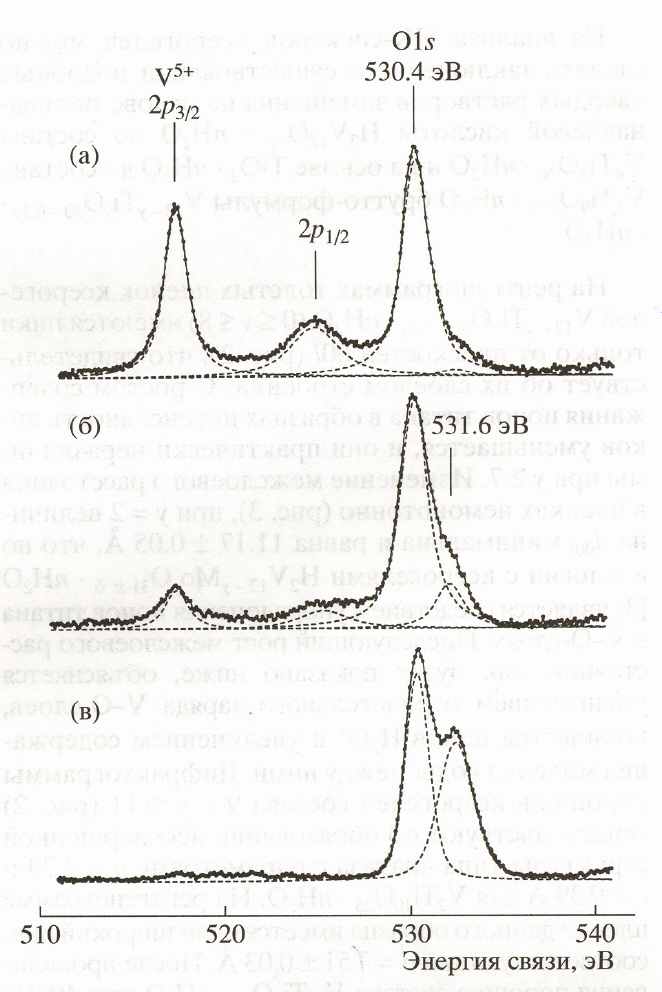
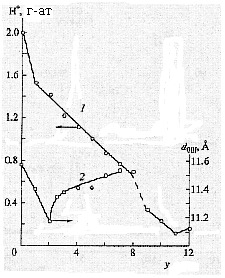
Рис. 7. Зависимость количества ионообменных протонов (1) и межслоевого расстояния d00l (2) от состава образцов V12 yTiyO30 0,5ynH2O.
Рис. 8. РЭС V2p и O1s таблеток образцов V12 yTiyO30 0,5ynH2O: y=2 (a), 10 (б), 12 (в).
По данным РЭС весь ванадий находится в пятивалентном состоянии (рис.8). Линии V2p3/2 и V2p1/2 соответствуют энергиям связи 517.5 и 524.9 эВ. Согласно полосе O1s в структуре соединений имеется два различных химических состояний атомов кислорода. Основной структурный кислород характеризуется энергией связи 530.4 эВ и кислород ОН-групп – 532.2 эВ (y=2), 532.5 эВ (y=10). Образование ионов гидроксила на поверхности TiO2nH2O происходит в результате гидролитического расщепления молекул воды на координационно ненасыщенных атомах титана. Узкая линия Ti2p3/2 получена для всех образцов при энергии связи 458.90.2 эВ, что указывает на четырехвалентное состояние титана, как в TiO2. После прокаливания ксерогелей при 4000С в атмосфере воздуха на спектрах появляется линия V2p ионов четырехвалентного ванадия. Для V2p3/2 она соответствует энергиям связи 516.2 и 516.5эВ, когда y=2 и 10 в формуле V12 yTiyO30 0.5ynH2O.
Спектры ЭПР ксерогелей поливанадатотитанатов свидетельствуют о присутствии парамагнитных ионов V4+. В твердом растворе -HxTi12-yVyO24+0.5(x+y)·nH2O типа анатаза ионы V4+ преимущественно находятся в местах с октаэдрической симметрией, замещая ионы Ti4+ в узлах кристаллической решетки. В ксерогеле b-HxV12-yTiyO30+0.5(x-y)·nH2O парамагнетизм обеспечивается присутствием VO2+- ионов, размещенных либо на поверхности V-O слоев, либо в областях, окруженных искаженной за счет введения ионов титана матрицей. Содержание V4+ в них на порядок выше, чем в образцах со структурой анатаза. При этом хорошо просматривается формирование четырех типов парамагнитных комплексов ионов V4+ с различными параметрами спин-гамильтониана. Это указывает на происходящие структурные изменения, влияющие на ближайшее окружение четырехвалентного ванадия при замещении ионов ванадия на титан.
4. Состояние кислородно-водородных группировок и ванадия в ксерогелях. Свойства ксерогелей поливанадатов в значительной степени зависят от содержания в них воды и четырехвалентного ванадия. Поэтому важно знать их количественное соотношение и характер взаимосвязи с элементами структуры соединений.
С
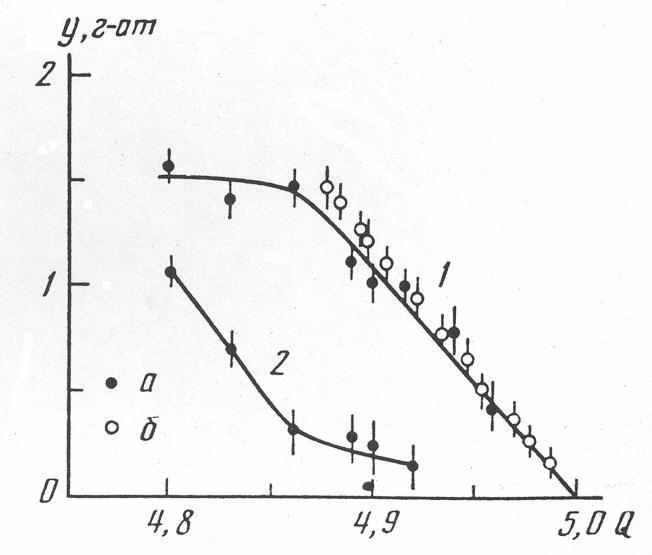
Рис. 9. Зависимость количества четырехвалентного ванадия в слоях (1) и между ними (2) в М2V12O31 ×nH2O: М = Н (а) и Na (б) от степени окисления ванадия (Q).
 остояние кислородно-водородных групп в ксерогелях. Соотношение между кислородно-водородных группировками в ксерогелях поливанадатов MxV12O31-d×nH2O определяется степенью гидратации фаз, зависит от природы и количества катионов M+. Выделено три типа водородсодержащих структур: молекулы воды цеолитного типа, молекулы воды, входящие в состав трехспиновых протонных конфигураций с образованием ионов оксония H3O+ и изолированные протоны гидроксильных группировок, химически связанные с атомами ванадия и удаляющиеся с разрушением структуры ксерогеля. В ксерогелях HxV12 yMoyO30+d×nH2O (0
остояние кислородно-водородных групп в ксерогелях. Соотношение между кислородно-водородных группировками в ксерогелях поливанадатов MxV12O31-d×nH2O определяется степенью гидратации фаз, зависит от природы и количества катионов M+. Выделено три типа водородсодержащих структур: молекулы воды цеолитного типа, молекулы воды, входящие в состав трехспиновых протонных конфигураций с образованием ионов оксония H3O+ и изолированные протоны гидроксильных группировок, химически связанные с атомами ванадия и удаляющиеся с разрушением структуры ксерогеля. В ксерогелях HxV12 yMoyO30+d×nH2O (0Согласно РЭС для титансодержащих ксерогелей интенсивность O1s полосы гидроксилов увеличивается с ростом концентрации ионов титана, что указывает о координации ОН-групп ионами титана.
Состояние ванадия в ксерогелях поливанадатов. Ванадий в ксерогелях находится в пяти- и четырехвалентном состоянии. Методом ионного обмена установлено, что четырехвалентный ванадий находится в виде ионов V4+ в слоях и в виде ионов VO2+ в межслоевом пространстве. Соотношение данных состояний ванадия зависит от общей степени восстановления его в образцах. Анализ распределения четырехвалентного ванадия в ксерогелях М2V12O31 ×nH2O (M = Li, Na, K), где 0.5, показал, что весь V4+ находится в ванадий-кислородных слоях (рис. 9).
5. Физико-химические свойства интеркалатов.
Термодинамические свойства. Изученные соединения являются термодинамически устойчивыми в интервале температур от комнатной до 2000С, и процесс их дегидратации является обратимым. Установленные зависимости lgP(H2O) и G(H2O) = f(T, nH2O) для поливанадатов М2V12 yMoyO31nH2O (M = H, Li, Na, K, Rb, Cs, Mg, Ca, Sr, Ba) хорошо коррелируют с уменьшением степени гидратации данных ионов. Термодинамические характеристики H(H2O) и P(H2O) ксерогелей поливанадатомолибдатов состава (M = H, Li, Na, K) экстремальны при y = 0.5 и 2. Проявление данных аномалий является следствием структурных и электронных изменений фаз. При y = 0.5, возможно, имеет место частичная делокализация 3d-электронов V4+ с образованием ионов Mo5+, а при y = 2 – структурное упорядочение ионов молибдена, о чем свидетельствуют данные рентгенографических исследований. Для поливанадиевой кислоты H2V12O30.7nH2O при n=4 H(H2O)=-41.882.32кДж/моль, что в пределах погрешности определений равно энергии образования кластера En-En-1=-43.050.63кДж/моль по реакции:
H3O+(H2O)n-1 + H2O H3O+(H2O)n. (11)
Близкие значения изменений парциальных мольных энтальпий воды при n=4 имеют фазы, содержащие один и два молибдена на формульную единицу ксерогеля, для которых H(H2O)=-43.740.54 и -44.351.01кДж/моль соответственно. Заметно отличается от этих данных H(H2O)= 54.730.20кДж/моль поливанадиевомолибденовой кислоты состава H2V11.5Mo0.5O31nH2O. С ростом n энергия образования кластера H3O+(H2O)n по абсолютной величине уменьшается, а H(H2O) всех изученных ксерогелей увеличивается. Такое различие в изменениях H(H2O) и энергии образования кластера H3O+(H2O)n с увеличением степени гидратации связано с координацией воды в ксерогелях не только ионами гидроксония, но также ванадий-кислородными слоями.
Впервые определены парциальные термодинамические характеристики водорода и лития (рис. 10) ксерогелей общей формулы M2V12-yMoyO31nH2O, где M = H, Li, NH4. Установлено, что величины G, H и S изменяются немонотонно во всем интервале составов. Минимумы на зависимостях S(Н2) и S(Li) от степени замещения ванадия на молибден являются следствием упорядочения как ионов молибдена, так водорода и лития при y=2. Для ксерогелей (NH4)2-xHxV9Mo3O31+nH2O величина G(H2) изменяется немонотонно в зависимости от состава соединения. Сложным образом зависят от соотношения водородсодержащих группировок (NH4+, H3O+) и значения H(H2), S(H2) (рис.11). Максимальные отрицательные величины данных термодинамических характеристик находятся вблизи x=0.75 и 1.5. Этим экстремальным точкам соответствуют максимум (0.36эВ) и минимум (0.25эВ) энергии активации проводимости смешанного поливанадатомолибдата. Анализ полученных результатов позволил сделать вывод о частичном упорядочении в катионной подрешетке в единой системе водородсодержащих группировок, когда ближайшими соседями NH4+ являются лишь ионы H3O+ и наоборот.
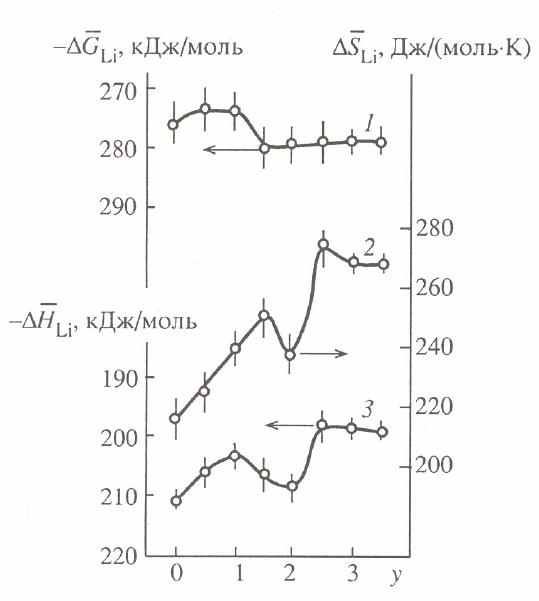
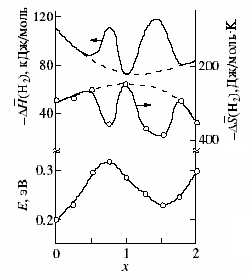
Рис. 10. Зависимость G(Li) (1), S(Li) (2) и H(Li) (3) ксерогеля Li2V12 yMoyO31nH2O от y при 298К.
Рис. 11. Зависимость H(H2) (1), S(H2) (2) и энергии активации проводимости (3) от состава (x) ксерогелей (NH4)2 xHxV9Mo3O31+nH2O
Термодинамические характеристики G(H2), H(H2) и S(H2) поливанадиевовольфрамовой кислоты H2V12 yWyO31+nH2O также изменяются немонотонно с ростом концентрации ионов вольфрама в соединениях (рис. 12). С увеличением количества ионов вольфрама в твердом растворе величина G(H2) уменьшается до состава y = 2. В интервале 2 < y < 3 она увеличивается и в двухфазной области (3 < y < 8) практически не изменяется. Как и в случае поливанадатомолибдатов при y = 2 наблюдается совместное упорядочение ионов вольфрама и водорода, что определяется соответствующим минимумом изменения энтропии водорода.
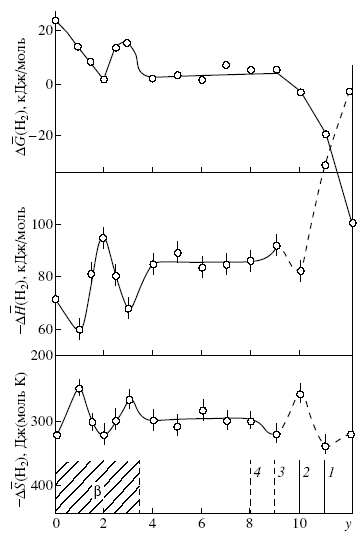
Рис. 12. Зависимости G(H2), H(H2) и S(H2) от состава образцов: - H2V12 yWyO31+nH2O (y3.5), 1 –H0.08V0.08W0.92O3×1.2H2O, 2 - H0.17V0.17W0.83O3×1.5H2O, 3 - H0.25V0.25W0.75O3×H2O, 4 - H0.33V0.33W0.67O3×H2O.
Величина G(H2) с увеличением количества ионов титана в твердом растворе HxV12 yTiyO30+0.5(x y)nH2O () уменьшается до состава y = 2. В интервале 2 < y 4 она увеличивается и до y = 7 практически не изменяется. После этого G(H2) уменьшается прямо пропорционально росту содержания титана в образцах, что является следствием образования структур на основе диоксида титана. Парциальные значения H(H2) и S(H2) максимальны по абсолютной величине для образцов состава y = 2 и 8, что свидетельствует о совместном упорядочении ионов титана и водорода в образцах состава y = 2 и ионов V5+ и H+ в соединении H0.7V4Ti8O26.35nH2O.
Термические свойства интеркалатов. Важной характеристикой ксерогелей, как материалов, является устойчивость их при нагревании. Термическая дегидратация ксерогелей поливанадатов происходит ступенчато. На первой стадии удаляется вода цеолитного типа, обратимо поглощаемая при охлаждении и выдержке образца в атмосфере воздуха. Процесс дегидратации сопровождается эндоэффектом с максимумом при температуре 160 – 2050С не зависимо от степени замещения атомов ванадия на молибден, вольфрам, хром или титан, определяется типом иона-интеркалята. Выделение химически связанных с атомами ванадия ОН-групп заканчивается полным распадом соединений и образованием фаз системы V2O5-MoO3 (CrO3, TiO2, WO3). Термическая устойчивость ксерогелей поливанадатов увеличивается при введении в ванадий-кислородную подрешетку ионов молибдена (вольфрама, хрома). Температура экзоэффекта кристаллизации аморфных продуктов термолиза H2V12 yТyO31+nH2O увеличивается от 310 до 370, 355 и 4750С при изменении y от 0 до 3 соответственно для Т = Mo, W, Cr. Температура экзоэффекта кристаллизации аморфных продуктов термолиза HxV12 yTiyO30+0.5(x-y)·nH2O ксерогелей уменьшается с ростом количества титана в образцах.
Интеркаляционные и ионообменные свойства Протоны водородно-кислородных групп ксерогелей HxV12 yMoyO31±d×nH2O участвуют в ионном обмене с катионами водных растворов солей. Величина коэффициента ионного обмена зависит от состава соединений и для катионов калия резко уменьшается при y = 1, а при дальнейшем увеличении степени замещения ванадия на молибден изменяется незначительно (табл.4). Понижение способности к ионному обмену поливанадиевомолибденовой кислоты с ростом содержания молибдена связано с уменьшением межслоевого расстояния в структуре соединений. Установлено, что ионообменными функциональными центрами являются протоны Н3О+ и ОН- группы.
Таблица 4
Ионообменные характеристики соединения HmV12-yMoyO31±d×nH2O в водном растворе KCl
-
KCl,
y=0
y=1
y=2
y=3
моль/л
qK,H
K̃H,К
qK,H
K̃H,К
qK,H
K̃H,К
qK,H
K̃H,К
0.04
0.81
32.46
0.76
5.56
0.72
3.06
0.77
4.81
0.06
0.89
12.37
0.83
3.75
0.78
2.14
0.78
2.22
0.08
0.91
7.62
0.86
2.97
0.82
1.82
0.80
1.60
0.09
0.92
6.98
-
-
0.82
1.55
0.83
1.60
0.10
0.92
6.11
0.87
2.54
0.84
1.55
0.84
1.56
1.00
1.00
1.00
1.00
1.00
qK,H - степень заполнения ионита
Соединения-внедрения получены взаимодействием ксерогелей H2V12 yMoyO31 d×nH2O (0£y£3) с растворами ферроцена в присутствии кислорода воздуха и ферробромида феррициния в смеси ацетонитрила с водой при соотношении 8:2 и концентрации 10 3моль/л. Взаимодействие ферробромида ферроциния с ксерогелями H2V12 yMoyO31±d×nH2O протекает по ионообменому механизму с образованием соединений включения катионов ферроциния в межслоевое пространство данных веществ. Процесс описывается реакцией:
H2V12 yMoyO31±d×nH2O + zFe(C5H5)2 + 1/2O2 [Fe(C5H5)2]zV12 yMoyO31±d×nH2O + Н2О. (12)
Величина межслоевого расстояния свидетельствует о перпендикулярном расположении групп циклопентадиенила относительно ванадий-кислородных слоев. В ИК спектрах синтезированных соединений включения имеются все наиболее характерные полосы феррициния без существенных смещений их по частоте (табл.5). Электропроводность пленок H2V12 yMoyO31±nH2O при интеркаляции феррициния увеличивается, а при замещении ванадия на молибден уменьшается. Для всех соединений, кроме [Fe(C5H5)2]1.44V12O31±nH2O в низкотемпературной области происходит резкое изменение энергии активации электропроводности, что может быть связано с упорядочением слоев воды в структуре пленок.
При раздельном и совместном с ионами меди интеркалировании 4-морфолинилизотиоциана в структуру ксерогеля V2O5×nH2O получены новые комплексные соединения состава (C5H8N2OS)0.35H2[V12O31-d]×8.8H2O и (C5H8N2OS)0.35Cu0.2H2[V12O31 d]×10.5H2O, характеризующиеся межслоевым расстоянием 11.55 и 14.30±0.05Å соответственно. Термической стабильность ксерогеля при интеркалировании молекул C5H8N2OS с 345 до 3700С увеличивается. Это связано с возможной координацией вокруг ионов водорода 4-морфолинилизотиоциана за счет неподеленной пары электронов на донорных атомах кислорода, азота и серы. Характер электропроводности – полупроводниковый. С понижением температуры от +50 до 500С электросопротивление пленок сложных соединений внедрения резко увеличивается, оставаясь более низким для медьсодержащих ксерогелей. Интеркалирование молекул C5H8N2OS в ксерогель уменьшает сопротивление образцов незначительно.
Таблица 5
Частоты (см1) основных полос поглощения в ИК спектрах соединений
| H2V12O30.7nH2O | 1600 | - | 1010 | 990 | 920 | - | 760 | 530 |
| [FeL2*]1.44V12O30.7nH2O | 1600 | 1400 | 1010 | 980 | 910 | 845 | 740 | 520 |
| [FeL2*]1.52V9Mo3O31±nH2O | 1600 | 1400 | 1000 | 970 | 890 | 840 | 740 | 520 |
| FeL2Br | - | 1400 | 1000 | - | - | 845 | - | - |
*L – C5H5
Электропроводность интеркалатов. Интеркалаты на основе гидратированного оксида ванадия относятся к проводникам со смешанным типом электропроводности. Электронная проводимость обеспечивается движением полярона малого радиуса между разновалентными атомами ванадия. Величина этой составляющей зависит от концентрации четырехвалентного ванадия. Ионная подвижность определяется диффузией катионов в межслоевом пространстве и зависит от влажности воздуха. Эти необычные свойства делают ксерогели привлекательным материалом для решения различных практических проблем.
Электросопротивление таблетированных и тонкопленочных образцов ксерогелей поливанадатов, поливанадатомолибдатов (вольфраматов), измеренное на переменном токе в атмосфере паров воды, резко увеличивается на 2-3 порядка в интервале температур 35-900С (рис. 13). Это связано с частичной дегидратацией и уменьшением межслоевого расстояния ксерогелей. При охлаждении поливанадатов имеет место гистерезис электросопротивления, равный 20-500С, и обратимая гидратация. Замещение ванадия на молибден (вольфрам) увеличивает среднюю температуру участка с положительным температурным коэффициентом сопротивления. Основной причиной экстремумов на зависимостях = f(y) для таблетированных ксерогелей при y = 0.5 и 2.0, по-видимому, является изменение подвижности составляющих проводимости фаз. В первом случае это происходит за счет увеличения степени локализации 3d – электронов на атомах V4+, а во втором - за счет увеличения межслоевого расстояния ксерогелей.
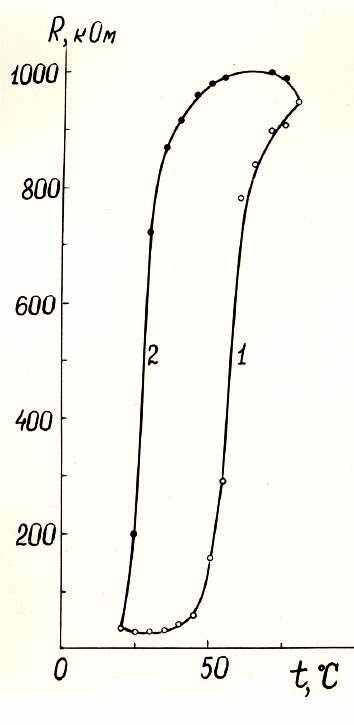
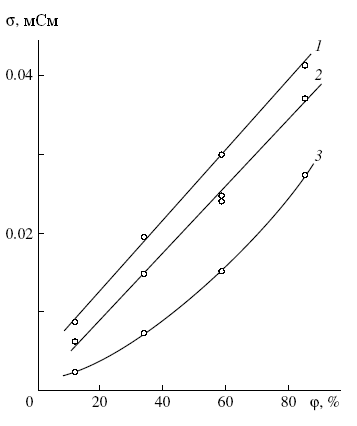
Рис. 13. Температурная зависимость электросопротивления пленки (=20 мкм) Li2V9Mo3O32.1nH2O: 1 – нагрев, 2 – охлаждение.
Рис. 14. Зависимость проводимости пленок ( = 20 мкм) ксерогелей (NH4)2 xHxV9Mo3O32.5 nH2O от относительной влажности воздуха () при 200С, где x = 0.5 (1), 0.25 и 0.75 (2), 1.0 (3).
