Учреждения Российской Академии Медицинских Наук Научно-исследовательском институте общей реаниматологии им. В. А. Неговского рамн автореферат
| Вид материала | Автореферат |
- Учреждения Российской Академии медицинских наук нии общей реаниматологии имени, 841.59kb.
- На правах рукописи, 694.69kb.
- Автореферат диссертации на соискание ученой степени, 408.46kb.
- Рапопорт Илья Эмануилович ранний артрит: сравнительная клинико-лучевая и магнитно-резонансная, 299.99kb.
- На состояние эякулята, 348.78kb.
- На правах рукописи, 616.34kb.
- На правах рукописи, 1973.13kb.
- Новые подходы к исследованию хрусталика на основе комбинированного ультразвукового, 275.38kb.
- Методы оценки и клиническое значение биомеханических свойств роговицы (клинико-экспериментальное, 429.56kb.
- Методические аспекты совершенствования и гармоНИзациИ требований к гигиенической оценке, 328.67kb.
* p < 0,005 – достоверность различий по массе тела, росту, сроку гестации у новорождённых группы «Контрольная» по сравнению с группами «Куросурф», «Сурфактант БЛ» и «БГМ»
▼ p < 0,005 – достоверность различий летальности группы «Контрольная» по сравнению с группами «Куросурф», «Сурфактант БЛ» и «БГМ»
Введение сурфактанта БЛ: 14 (73,7%) больных получили препарат однократно и 5 (26,3%) – двукратно. Через 30 минут – 3 часа после рождения сурфактант вве-дён 5 новорожденным, через 4-8 часов после рождения -7 и через 15 часов после рождения – 2 детям. При двукратном введении первая доза препарата назначалась через 1,5 – 7 часов после рождения, повторно сурфактант введён через 13-20 часов, а в одном случае через 3 суток после рождения. Сурфактант БЛ вводился одному (5,2%) ребёнку с ЭНМТ. Минимальная доза введения сурфактанта БЛ составила 62 мг/кг, максимальная -225 мг/кг, средняя доза - 75±4,7мг/кг.
Методики введения экзогенных сурфактантов
Сурфактант БЛ
Сурфактант БЛ высокоочищенный природный сурфактант лёгкого крупного рогатого скота, представляет собой лиофилизированный порошок белого цвета с желтоватым оттенком, в воде образует молочного вида гомогенную эмульсию. Состав сурфактанта БЛ: 75-82% фосфолипидов, 6% нейтральных липидов, 9-11% свободного холестерина, 1,8-2,5% SP-B и SP-C; все классы фосфолипидов, включая 62-70% ФХ, 63-66% ДПФХ. Перед введением сурфактант БЛ разводили подог-ретым до 37ºС физиологическим раствором хлорида натрия из расчёта 30мг/мл. Разовая доза препарата составляла 75мг/кг.
Методика введения: через боковое отверстие специального коннектора с помо-щью шприцевого насоса, без разгерметизации дыхательного контура и прерывания ИВЛ, проводилась интратрахеальная инстилляция препарата в дозе 1,5-1,8 мг/кг/ час. После завершения введения препарата в течение 6 часов санацию трахеи не проводили. Последующие дозы препарата вводили при условии сохраняющейся потребности в проведении ИВЛ с концентрацией кислорода в воздушно-кис-лородной смеси 40% и более, не менее, чем через 6 часов после введения предыдущей дозы. Максимально вводили две дозы препарата сурфактанта БЛ.
Куросурф
Куросурф является природным сурфактантом, выделенным из лёгочной ткани свиньи, состоящим исключительно из полярных липидов, в частности, фосфати-дилхолина (составляющего около 70% от общего количества фосфолипидов) и около 1% специфических низкомолекулярных гидрофобных протеинов SP-B и SP-C. Состав на 1 мл суспензии: фосфолипидная фракция, выделенная из лёгких сви-ньи - 80мг/мл, эквивалентная приблизительно 74 мг/мл общей концентрации фос-фолипидов и 0,9мг/мл низкомолекулярных гидрофобных протеинов. Препарат подогревали до 37ºС, после чего вводили эндотрахеально струйно через эндо-бронхиальный катетер. После введения проводили ручную вентиляцию мешком «Ambu» в течение 1-2- минут с FiO2, равной исходной величине параметра, уста-новленного на аппарате ИВЛ.
Профилактика РДСН: препарат в разовой дозе =100-200 мг/кг (1,5-2,5 мл/кг) вводили в течение первых 15 минут после рождения ребёнка с подозрением на возможное развитие РДСН. Вторую дозу препарата 100 мг/кг вводили через 6-12 часов. В случае установления диагноза РДСН и необходимости проведения ИВЛ, введение препарата продолжали с 12-часовым интервалом. Максимальная доза – 300-400 мг/кг.
Инструментальные, лабораторные и рентгенологические методы исследования:
- Исследование активности ионов водорода, парциального давления двуокиси угле-рода, кислорода крови, с последующим расчётом параметров: насыщения кис-лородом при Р50 (%SO2c), альвеолярно-артериального кислородного градиента (А-а DО2), респираторного коэффициента (RI). Исследовалась артериолизированная капиллярная кровь.
- Регистрация режима и параметров ИВЛ: частоты аппаратных вдохов, концент-рации кислорода в газовой смеси, максимального давления в конце вдоха, поло-жительного давления в конце выдоха, времени вдоха, среднего давления в дыха-тельных путях. Рассчитывались оксигенационный индекс (OI) и индекс эффек-тивности вентиляции (VEI).
- Ииммуноферментным методом определяли концентрации ИЛ-1, ИЛ-4, ИЛ-6, TNF-α и SP-D у рожениц и недоношенных новорождённых.
- Определение количества лейкоцитов и дифференциальный подсчёт лейкоцитов. Исследовалась периферическая кровь недоношенных новорожденных в 1, 3 и 5 сутки жизни.
- Бактериологическое обследование новорождённых: посевы лаважной жидкости из трахеобронхиального дерева.
- Комплексная эхокардиография с импульсно-волновой допплерографией про водилась новорождённым в 1, 3, 5 сутки после рождения.
VІІ. Гистологические и морфометрические исследование лёгких и плаценты. В гисто-
логических срезах лёгких выполнены следующие морфометрические исследова-
ния:
- Определение процентного отношения площади воздушных альвеол к общей площади поля зрения. Подсчёт количества альвеол в поле зрения.
- Подсчёт количества альвеол с гиалиновыми мембранами в поле зрения
- Измерение высоты альвеолярного эпителия
- Измерение толщины гиалиновых мембран
- Измерение толщины межальвеолярных перегородок
- Определение площади ядер и расчёт количества ядер на 1000 мкм2
VІІІ. Рентгенологическое исследование: рентгенограмма органов грудной клетки и спиральная компьютерная томография.
Статистическая обработка результатов
Статистическая обработка полученных результатов проводилась методом вариа-ционной статистики с вычислением средней арифметической величины (М), стан-дартной ошибки средней арифметической (m), средне-квадратичного отклонения (). Уровень достоверности различий цифровых параметров определялся по t- кри-терию Стьюдента (t), уровню значимости различий (р). Проверка статистических гипотез осуществлялась на основе методов непараметрической статистики – крите-риев Вилкоксона-Манна-Уитни (рU). Проводился корреляционный анализ с расче-том коэффициента корреляции (r) и его достоверности с использованием критерия Фишера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
- Клинико-лабораторная диагностика дыхательной недостаточности у недоношенных новорождённых.
В результате проведённого исследования выявлены неблагоприятные факторы, влияющие на внутриутробное развитие плода, способствующие преждевременным родам и развитию дыхательной недостаточности у недоношенных новорождённых: наличие в анамнезе абортов, самопроизвольных выкидышей, преждевременных родов, многоплодие, беременность с помощью ЭКО. Многоплодие является одним из факторов риска по развитию РДСН: 31,1% новорождённых были от многоплод-ной беременности. При многоплодии играет роль хориальность плаценты: РДСН достоверно чаще (p>0,05) развивался при монохориальной биамниотической двой-не. Неблагоприятный соматический и акушерско-гинекологический анамнез мате-рей с ранних сроков настоящей беременности создают предпосылки её прерыва-ния, способствует развитию тяжёлой формы острого гестоза и вызывают патоло-гические изменения в плаценте.
Для каждого гестационного возраста характерны определенные изменения в плаценте, способствующие нарушению маточно-плацентарно-плодового кровотока и наступлению преждевременных родов.
Дети родились с низкой оценкой по шкале Апгар 4,8±1,6 балла, оценка по шкале Сильвермана составила 6,4±1,3 балла. При рождении у 88,4% недоношен-ных новорождённых отмечалось нерегулярное самостоятельное дыхание с перио-дами апноэ, а также дыхание типа «gasping», что явилось показанием для интуба-ции трахеи, проведения ИВЛ. Клиническим проявлениям ДН соответствовали лабораторные критерии нарушения дыхательной функции лёгких: гипоксемия (рО2=38±2,5мм рт. ст), низкое насыщение гемоглобина кислородом (57,3±3,4%), повышенные A-a DO2 (236±31,5мм рт. ст.) и RI (4,6±0,6). У недоношенных ново-рождённых с ДН в амниотической жидкости определяли повышенное содержание ИЛ-6 до 602±234 пг/мл, TNF-α–69,7±14,5пг/мл в желудочном аспирате величина SP-D достигала 248,5±113,1 пг/мл. В ОПК новорождённых выявлены разнонап-равленное содержания ИЛ-6, не зависящее от клинической картины ДН: высокое и низкое содержание исследуемого ИЛ. Повышение концентрации ИЛ-6 в ОПК является неспецифической реакцией, возникающей в ответ на развитие воспали-тельного или дистрофических процессов в плаценте, что подтверждается морфоло-гическими исследованиями. Низкая продукция ИЛ-6 у части новорождённых обус-ловлена, вероятно, с транзиторной недостаточностью иммунной системы.
Морфологические исследования новорождённых, умерших в 1-й час после рождения, показали, что строение лёгких соответствует гестационному возрасту. Чем меньше гестационный возраст ребёнка, тем вариабельнее форма альвеол. У новорождённых с ЭНМТ альвеолы имеют угловатую, полигональную, звёздчатую, округлую форму. При сроке гестации более 29 недель просвет альвеол преиму-щественно овальной либо округлой формы. У части новорождённых альвеолярный эпителий высокий, с округлыми нормохромными ядрами. У многих детей альвео-лярный эпителий с признаками повреждения, ядра эпителиальных клеток дефор-мированы, в некоторых клетках не окрашены. Часть альвеол округлой формы с уплощенным альвеолярным эпителием. Высота альвеолярного эпителия у ново-рождённых этой группы составляет 10,3±4,4 мкм. У новорожденных с гестаци-онным возрастом 23-24 недели высота эпителия составляет 9,8±4,7 мкм, а в сроке гестации 26-27 недель – 11,6±3,2 мкм (p <0,05). В капиллярах межальвеолярных перегородок отмечается агрегация эритроцитов. Спавшиеся альвеолы выстланы крупным кубическим эпителием с гомогенной цитоплазмой, краевым расположе-нием ядра. В расправленных альвеолах эпителий уплощен. Просветы бронхов преимущественно звёздчатой формы. Многие кистозно расширенные бронхиолы переходят в расширенные альвеолярные ходы, образуя полости причудливой фор-мы. В таких образованиях отмечается слущивание эпителия. У данной группы но-ворождённых межальвеолярные перегородки утолщенные, рыхлые. Толщина меж-альвеолярных перегородок составляет 25,5±4,0 мкм. Количество ядер на 1000 мкм2 – 18,1±3,9. Лимфатические сосуды, локализующиеся в междольковых прослойках соединительной ткани, расширены. Ветви легочной артерии с утолщенными стен-ками, пристеночным расположением эритроцитов. В большинстве случаев в аль-веолах обнаруживается аспирированные чешуйки амниотелия, материнские эрит-роциты, признаки аспирации отсутствуют у 7,8% детей. У новорожденных детей, умерших в пределах первого часа после рождения, ГМ отсутствовали в 100% слу-чаев.
Патогенез развития РДСН
Исследования показали, что развитию РДСН способствуют анте – и интрана-тальное повреждение альвеолярного и бронхиального эпителия, расстройства мик-роциркуляции, интранатальная гипоксия и аспирация околоплодных вод в соче-тании с морфологической незрелостью лёгких и дефицитом сурфактанта. Гистоло-гическое исследование свидетельствует о том, что ГМ (без применения сурфактан-тов) формируются через 4-7 часов после рождения. Альвеолярные ходы расши-рены, большая их часть содержит слоистые гиалиновые массы. Клеточная реакция на ГМ в этот период не выражена. Эпителий бронхов отслоен по всему периметру. Вокруг респираторных бронхиол находится большое количество мелких полно-кровных сосудов. В широких межальвеолярных перегородках выражено полно-кровие капилляров. Под плеврой, в межальвеолярных перегородках, вокруг сосу-дов и респираторных бронхиол регистрируются мелкоочаговые кровоизлияния.
Через 13-24 часа после рождения ГМ визуализируются во всех полях зрения. В спавшихся альвеолах ГМ не встречаются. Эпителий бронхов частично слущен. При наступлении летального исхода через 25-48 часов после рождения ГМ обна-руживаются в крупных альвеолах, в альвеолярных ходах, встречаются в спавшихся альвеолах. Отмечается выраженное полнокровие сосудов межальвеолярных пере-городок с очаговыми кровоизлияниями. Бронхиолярный эпителий слущен, в респи-раторных бронхиолах содержатся эозинофильные комковатые гиалиновые массы. Артериоло-венулярные анастомозы и лимфатические сосуды расширены. Вокруг сосудов, бронхиол, под плеврой выявляются очаговые кровоизлияния.
У новорожденных с ЭНМТ, проживших 49-72 часа, в альвеолах визуализиру-ются фрагментарные ГМ. Клеточная реакция не выражена. Имеются перибронхи-альные участки мелких дистелектазов, очаговой субплевральной эмфиземы. Харак-терно полнокровие кровеносных сосудов. С увеличением продолжительности жиз-ни до 97-120 и более часов в мелких и средних альвеолах регистрируются редкие фрагментированные ГМ. Альвеолярный эпителий слущен, деформирован, со смор-щенными гиперхромными ядрами. Соединительная ткань отёчна, лимфатические сосуды расширены. Выражены явления резорбции ГМ и клеточная реакция.
В 57,6% альвеол формируются ГМ, при этом площадь альвеолярной поверх-ности уменьшается с 51,5±7,2 мкм2 до 24,7±8,1 мкм2 и достоверно снижается (p<0,005) высота альвеолярного эпителия с 10,3±4,4 мкм до 5,3±0,9 мкм. При раз-витии РДСН процентное отношение площади альвеол к общей площади исследо-вания составляет 28,7±8,2%, общее количество альвеол в одном поле зрения иссле-дованной поверхности лёгких – 14,4±4,9, толщина межальвеолярных перегородок составляет 23,9±3,75 мкм, среднее количество ядер на 1000 мкм2 лёгких - 23,0±5,0. Толщина ГМ варьирует от 1,5 до 30,4 мкм (M±σ =8,66±2,85 мкм).
Таким образом, гестационный возраст новорождённого ребёнка от 25 до 35 недель характеризуется морфофункциональной незрелостью лёгких, в этот период продолжается дальнейшая дифференцировка дыхательных путей. Характерными морфологическими признаками заболевания являются: повреждение альвеолярного и бронхиолярного эпителия, эндотелия, нарушения кровообращения в лёгких, в том числе гемомикроциркуляции, формирование ГМ через 4-7 часов после рожде-ния.
Особенности постнатальной адаптации недоношенных новорождённых с РДСН
Наряду c повреждением альвеолярного и бронхиолярного эпителия, гемодина-мическими нарушениями, формированием гиалиновых мембран в лёгких у недо-ношенных новорождённых существуют компенсаторные процессы, обеспечива-ющие их постнатальную адаптацию. В результате исследования выявлены приз-наки адаптации у новорождённых с РДСН, заключающиеся в активации некото-рых цитокинов и сурфактант-ассоциированного протеина D. Иммунная система плода, с одной стороны, обладает автономностью функции распознавания и уда-ления чужеродных клеток, с другой стороны, её развитие зависит от состояния материнского организма. Посредниками в развитии воспалительных, регулятор-ных и иммунных реакций в системе мать-плацента-плод выступают цитокины. Главным регулятором иммунного ответа и гемопоэза является ИЛ-6. Кроме того, он выполняет функцию медиатора защитных процессов от инфекции и поврежде-ния тканей. Течение РДСН характеризовалось различной динамикой ИЛ-6. У ново-рождённых выявлено различное содержание ИЛ-6 в ОПК, в связи с чем новорож-денные разделены на 2 подгруппы: с высоким и низким содержанием цитокина. У 38,2% новорождённых с исходно высоким содержанием ИЛ-6 - 493,3±92,3 пг/мл в ОПК (1-я подгруппа) через 8 часов после рождения величина показателя в плазме крови практически не изменялась (рис. 1).
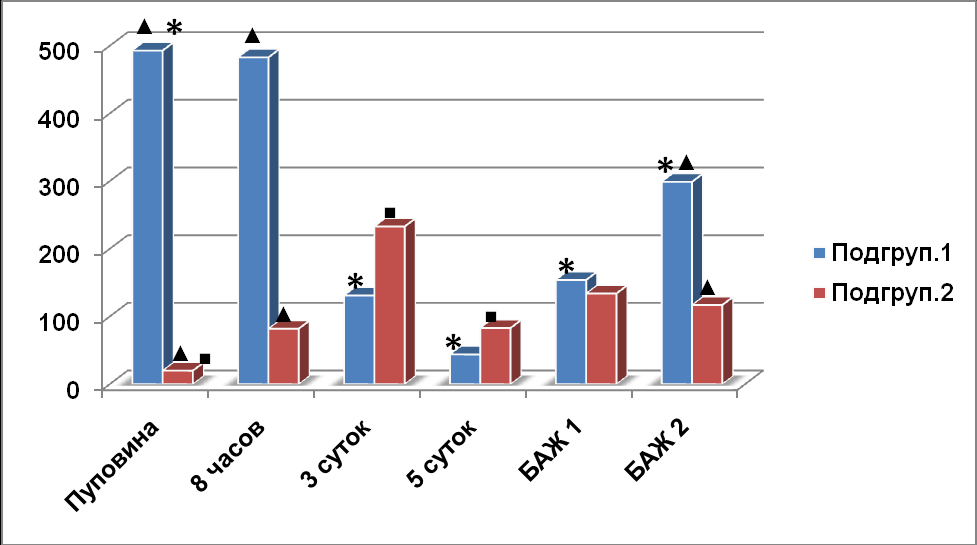
Рис.1. Содержание ИЛ-6 у недоношенных новорождённых с РДСН
* - p<0,05 достоверность различий в подгруппе 1.
■ - p<0,05 достоверность различий в подгруппе 2.
▲ - - p<0,05 достоверность различий между подгруппами больных
К 3-м суткам постнатального возраста произошло достоверное (p<0,05) снижение ИЛ-6 в плазме крови, по сравнению с исследованием при рождении. К 5-м суткам жизни содержание ИЛ-6 снизилось до физиологического значения. Во 2-й подг-руппе с исходно низким содержанием ИЛ-6 в ОПК, в течение 3-х суток в крови недоношенных новорождённых отмечалось достоверное увеличение (p< 0,05) содержания исследуемого интерлейкина до 233,6±81,5пг/мл. К 5 суткам жизни про-изошло снижение содержания ИЛ-6 в плазме крови до 83,1±10,6 пг/мл, что в 2 раза выше, чем у новорождённых 1-й подгруппы.
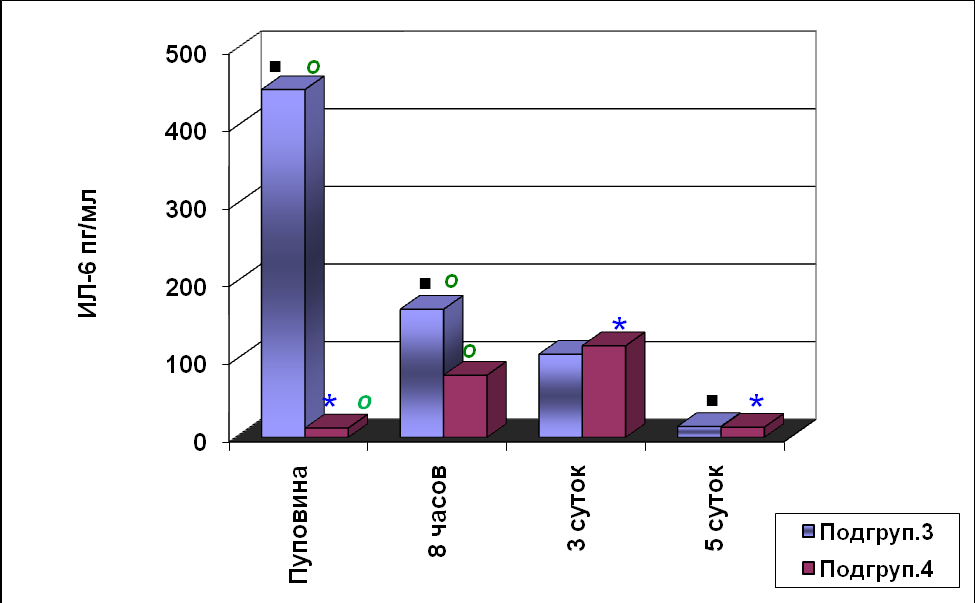
Рис.2. Содержание ИЛ-6 у здоровых недоношенных новорождённых
* - p<0,05 достоверность различий в подгруппе 4.
■ - p<0,05 достоверность различий в подгруппе 3.
○- - p<0,05 достоверность различий между подгруппами больных
Аналогичные изменения ИЛ-6 выявлены у недоношенных новорождённых без РДСН (рис.2). У новорождённых этой группы период ранней постнатальной адаптации протекал благоприятно, это связано с полноценной респираторно–гемо-динамической адаптацией, синхронизацией функциональных систем к условиям внеутробной жизни; с ненарушенным газообменом, полноценным функциониро-ванием иммунной системы.
Содержание ИЛ-1β в сыворотке периферической крови у всех рожениц в конце первого периода родов составляла 3,5±0,7пг/мл. В АЖ рожениц группы «Сравне-ния» содержание ИЛ-1β было достоверно выше (p<0,05), чем в исследуемой группе «РДСН» (рис.3). Аналогичная ситуация характерна для концентрации ИЛ-1β в желудочном аспирате: содержание исследуемого интерлейкина в группе «Сравне-ния» достигало величины 10,6±1,4 пг/мл, в группе «РДСН» - 4,3±2,2 пг/мл, данные различия статистически достоверны (p<0,05).
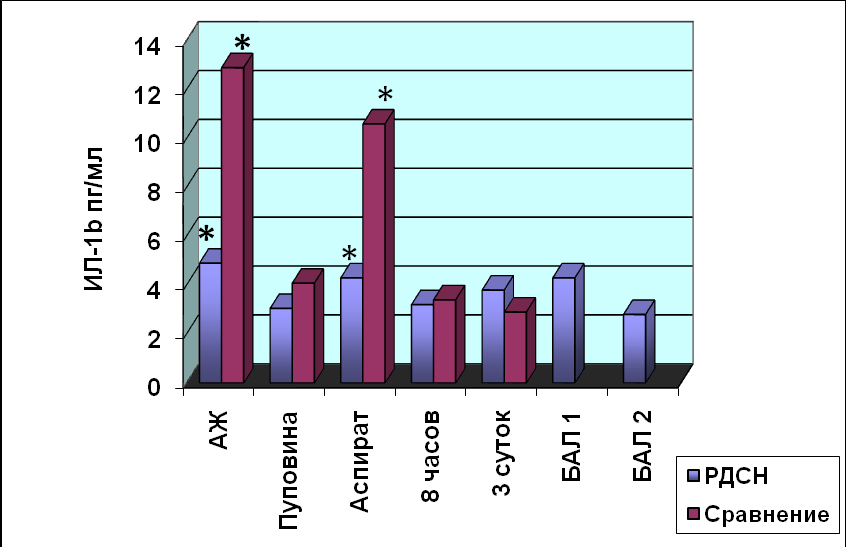
Рис. 3. Содержание ИЛ-1β у недоношенных новорождённых
* - p<0,05 достоверность различий между группами больных
Содержание ИЛ-1β в ОПК и плазме крови у новорождённых обеих групп было одинаковым. При дальнейшем наблюдении содержание исследуемого интерлей-кина было стабильным у всех новорождённых, достоверных отличий не выявлено (p>0,05). Сразу после рождения у новорождённых группы «РДСН» в БАЖ содер-жание ИЛ-1β составляло 4,3±3,8 пг/мл, через 8 часов после введения куросурфа величина показателя снизилась до 2,8± 0,1пг/мл. Данные различия статистически не достоверны (p>0,05). У новорождённых группы «РДСН» выявлена обратная сильная корреляционная связь (r=-0,96,p=0,008) между продукцией ИЛ-1β в амниотической жидкости и оценкой по шкале Апгар на 1-й минуте жизни.
В конце первого периода родов содержание TNF-α в сыворотке перифери-ческой крови рожениц группы «РДСН» составляло 36,0±8,3 пг/мл, в группе «Срав-нения» - 34,4±12,2 пг/мл и достоверно не отличались (p>0,05). В АЖ рожениц выявлены достоверные отличия (p<0,05) содержания TNF-α: в группе «РДСН» -69,7±43,4 пг/мл, в группе «Сравнения»-43,0±22,0пг/мл (рис.4). Содержание TNF-α в желудочном аспирате у новорождённых обеих групп было одинаковым.
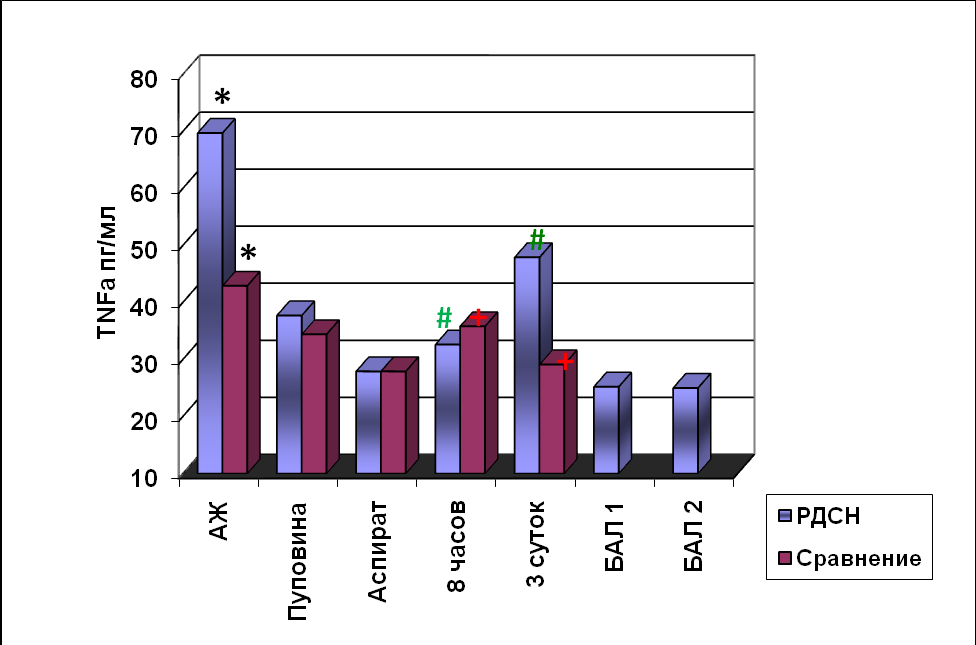
Рис. 4. Содержание TNF-α у недоношенных новорождённых
* - p<0,05 достоверность различий между группами больных
#- p<0,05 достоверность различий в группе «РДСН»
+- p<0,05 достоверность различий в группе «Сравнения»
Динамика TNF-α в крови у новорождённых была следующей: при рождении и через 8 часов после рождения продукция TNF-α у новорождённых обеих групп была одинаковой. К 3-суткам жизни у детей группы «Сравнения» содержание TNF-α снизилось до 29,1±4,2 пг/мл, а у больных группы «РДСН» - достоверно увеличи-лось (p<0,05) до 47,9±5,2 пг/мл. В БАЛ непосредственно после рождения и через 8 часов после введения куросурфа изменений содержания TNF-α не было. При про-ведении корреляционного анализа выявлена сильная связь продукции TNF-α и ИЛ-1β в желудочном аспирате (r=0,89; р=0,003), что свидетельствует о внутриутроб-ной активности клеток моноцитарно-макрофагального ряда, преобладании в пер-вые сутки жизни влияния провоспалительных цитокинов.
При исследовании содержания ИЛ-4, ингибирующего дифференцировку Т-хелперов 1 типа и угнетающего синтез провоспалительных цитокинов макрофа-гами, выявлены следующие изменения (рис.5).
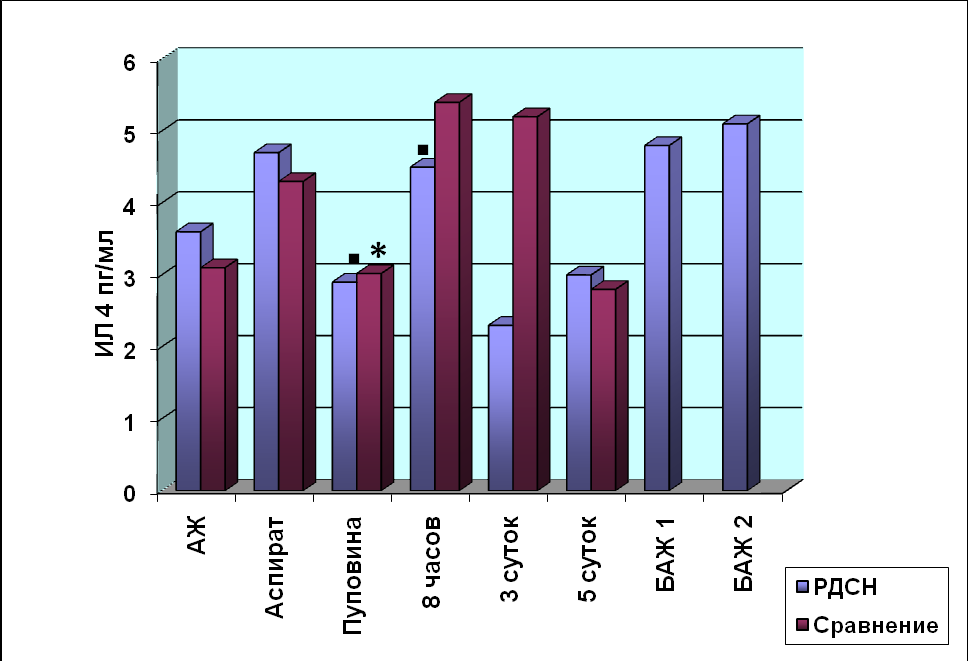
*
Рис. 5. Содержание ИЛ-4 у недоношенных новорождённых
■- p<0,05 достоверность различий в группе «РДСН»
*- p<0,05 достоверность различий в группе «Сравнения»
Содержание ИЛ-4 в конце первого периода родов в периферической крови роже-ниц группы «РДСН» составляла 4,6±0,9 пг/мл, в группе «Сравнения» - 3,9±0,1пг/ мл (p >0,05). Содержание исследуемого интерлейкина в АЖ рожениц и желудоч-ном аспирате новорождённых было идентичным. Содержание ИЛ-4 в ОПК не име-ло достоверных отличий (p>0,05). В дальнейшем в крови новорождённых обеих групп содержание ИЛ-4 изменялось одинаково: максимальное увеличение средней величины показателя произошло к 3-м суткам жизни, а к 5-м суткам постнаталь-ного возраста содержание ИЛ-4 снизилось до исходного значения. У новорождён-ных группы «РДСН» продукция ИЛ-4 в БАЖ после рождения и через 8 часов после введения «Куросурфа» не изменялась и составляла 4,8±1,8 пг/мл. При проведении корреляционного анализа была выявлена прямая сильная связь уровня ИЛ-4 в АЖ и оценкой по Апгар на 1-ой минуте жизни у новорождённых группы «РДСН» (r=0,77, p=0,001), что свидетельствует о взаимосвязи степени тяжести анте- и интранатальной гипоксии и внутриутробной продукции ИЛ-4 плацентарными макрофагами.
У новорождённых с тяжёлым течением РДСН применялась антибактериаль-ная и иммунозаместительная терапия. Выделены следующие варианты назначения препаратов:
- Сочетание ампициллина в суточной дозе (СД)=100 мг/кг в течение 4 суток и стандартных внутривенных иммуноглобулинов в СД=0,2/кг в течение 2 суток применялось у 26,5% новорождённых
- Сочетание цефазолина в СД=100 мг/кг в течение 4 суток и стандартных внутривенных иммуноглобулинов в СД= 0,2г/кг в течение 2 суток применя-лось в 8,8% случаев
- Комбинированная антибактериальная терапия ампициллином в СД=100 мг/кг, нетромицином в СД=6 мг/кг в течение 4 суток со стандартными внут-ривенными иммуноглобулинами в СД= 0,2г/кг в течение 2 суток проведена у 47,1% детей
- Комбинированная антибактериальная терапия ампициллином в СД=100 мг/кг, амикацином в СД=6 мг/кг в течение 4 суток со стандартными внутри-венными иммуноглобулинами в СД= 0,2 г/кг в течение 2 суток проведена у 8,8% детей
- Без применения антибактериальной терапии и стандартных внутривенных иммуноглобулинов пролечили 8,8% больных.
Недоношенным новорождённым группы «Сравнения» в 95,6% случаев антибакте-риальную терапию не назначали. Только в 4,4% наблюдений была назначена ком-бинированная антибактериальная терапия ампициллином в СД=100 мг/кг, нетро-мицином в СД=6 мг/кг в течение 3 суток жизни в сочетании со стандартными внут-ривенными иммуноглобулинами в СД=0,2 г/кг в течение 2 суток жизни. В 56,5% случаев проводилась иммунозаместительная терапия. Препаратом выбора явились стандартные внутривенные иммуноглобулины в СД=0,2г/кг в течение 2 суток жиз-ни. Остальные 43,5% новорождённых иммунозаместительную терапию не полу-чали. За время наблюдения у новорождённых обеих групп клинических признаков врождённой инфекции не было. Все бактериологические посевы из трахеоброн-хиального дерева, взятые при рождении, были отрицательные. Всем новорождён-ным с РДСН проводилась ИВЛ, но развития инфекционных осложнений, таких как вентилятор-ассоциированная пневмония не было. Проведённое исследование не выявило влияния антибактериальной и иммунозаместительной терапии на содер-жание цитокинов у недоношенных новорождённых.
Таким образом, ранняя постнатальная иммунная адаптация у недоношенных новорождённых проявляется изменением содержания ИЛ-6. Содержание этого цитокина в биологических жидкостях вариабельно. Высокая продукция ИЛ-6 про-исходит в пределах маточно-плацентарного комплекса, о чём свидетельствует его высокое содержание в амниотической жидкости. В желудочном аспирате ново-рождённых, полученном сразу после рождения, также отмечалось высокое содер-жание ИЛ-6, что подтверждает внутриутробную стимуляцию макрофагальных реакций и Т-клеточного иммунитета плода. Сильная корреляционная связь уровня ИЛ-6 в БАЖ, оценкой по Апгар на 1-ой минуте жизни и длительностью ИВЛ, свидетельствует о взаимосвязи степени тяжести анте- и интранатальной гипоксии и интенсивности продукции ИЛ-6. Повышение содержания ИЛ-6 в ОПК является неспецифической реакцией, возникающей в ответ на развитие в плаценте воспалительного и дистрофических процессов, что подтверждается морфологи-ческими исследованиями плаценты. После рождения низкая внутриутробная про-дукция ИЛ-6 сменяется активацией иммунной системы новорождённого, нараста-нием продукции ИЛ-6 и продолжается до 3 суток жизни. Нормализация продук-ции ИЛ-6 у всех новорождённых происходит к 5 суткам постнатального возраста и совпадает с окончанием раннего периода адаптации. Наряду с повышенным содер-жанием ИЛ-6 отмечается активизация экспрессии TNF-α. Его содержание возрас-тало в АЖ и желудочном аспирате. Выявлена сильная корреляционная связь про-дукции TNF-α и ИЛ-1β в желудочном аспирате. Концентрация ИЛ-4 обеспечивала необходимый баланс цитокинов. При РДСН наличие обратной сильной корреля-ционной связи между продукцией ИЛ-1β, сильной прямой связи уровня ИЛ-4 в АЖ, ИЛ-6 в БАЖ, аспирированной сразу после рождения, и оценкой по Апгар на 1-ой минуте жизни, длительностью ИВЛ, свидетельствует о взаимосвязи тяжести анте- и интранатальной гипоксии и интенсивности продукции исследуемых цито-кинов.
Важную роль во врождённом и антителонезависимом иммунном ответе играет сурфактант–ассоциированный протеин D.
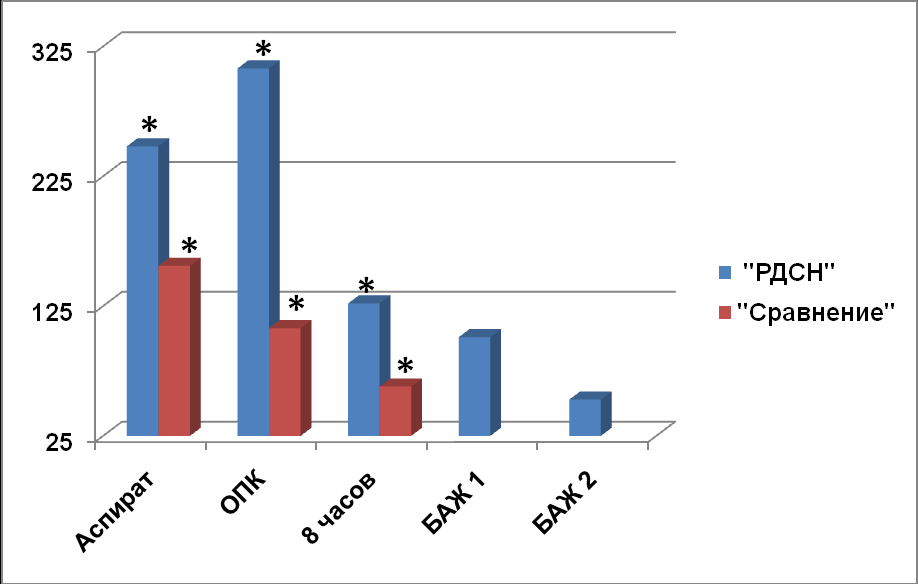
Рис. 6. Содержание SP-D у недоношенных новорождённых
* - p<0,05 достоверность различий между группами больных
В конце первого периода родов в периферической крови рожениц обеих групп содержание SP-D не имело достоверных отличий и составляло 39,9±6,2 пг/мл. В АЖ определялась высокая концентрация исследуемого протеина: средняя величина SP-D в группе «РДСН» составляла 2673,4±2326,1 пг/мл, в группе «Сравнения» - 3248,9±1188,3 пг/мл, данные различия статистически не достоверны (p>0,05). Вы-сокое содержание SP-D в АЖ свидетельствует о его внутриутробной продукции. Концентрация в SP-D у недоношенных новорожденных представлена на рис. 6. У новорождённых не выявлено достоверных отличий содержания SP-D в желудоч-ном аспирате (p>0,05). У новорождённых группы «РДСН» при рождении содержа-ние SP-D в ОПК составляло 307,6±149,1пг/мл, что в 2,8 раза выше, чем у новорож-дённых группы «Сравнения». Различия между этими группами статистически зна-чимые (p<0,05). Несмотря на повышенную внутриутробную продукцию SP-D у новорождённых группы «РДСН» при рождении были признаки ДН, что, возможно, связано с дисбалансом в сурфактантой системе лёгких. Через 8 часов после рож-дения у новорождённых группы «РДСН» содержание SP-D в сыворотке крови дос-товерно снизилось до 126,9±73,4пг/мл (p<0,05). В группе «Сравнения» также прои-зошло снижение продукции SP-D до 63,2±26,6 пг/мл. Непосредственно после рож-дения (до введения сурфактанта куросурфа) содержание SP-D в БАЖ составляло 100,9±65,2пг/мл. Через 8 часов после введения куросурфа произошло снижение содержания SP-D до 52,3±51 пг/мл, данные изменения статистически не досто-верные (p>0,05). Снижение содержания SP-D в БАЖ у новорождённых группы «РДСН» через 8 часов после рождения связано, возможно, с отсутствием факторов, стимулирующих его продукцию. При проведении корреляционного анализа у ново-рождённых группы «РДСН» выявлены множественные корреляционные связи про-дукции SP-D с показателями газообмена, длительностью ИВЛ и другими пока-зателями иммунной системы: сильная прямая связь с достоверным коэффициентом корреляции содержания SP-D в АЖ и рО2 крови через 2 часа после рождения (r=0,76; р=0,02); сильной прямой связи содержания SP-D в ОПК с RI (r=0,74; р=0,005) и A-a DO2 в крови через 2 часа после рождения (r=0,72;р=0,007); корреля-ционная прямая связь средней силы между содержанием SP-D в БАЖ, полученной сразу после рождения, и длительностью ИВЛ (r=0,64,p=0,04); сильная обратная связь с достоверным коэффициентом корреляции содержания SP-D в АЖ и содер-жанием ИЛ-4 в АЖ (r=-0,93, p=0,02); функциональная прямая связь содержания SP-D в ОПК и TNF-α в ОПК (r=0,98, p=0,02); сильная обратная связь с достоверным коэффициентом корреляции содержания SP-D в сыворотке центральной венозной крови через 8 часов после рождения и процентным содержанием клеток среднего размера в периферической крови в первые сутки жизни (r=-0,92, p =0,0001). Полу-ченные результаты свидетельствуют о наличии внутриутробной продукции иссле-дуемого сурфактантного апопротеина лёгкими плода, что в первые часы после рождения способствует сохранению газообменной функции лёгких. Внутриут-робная продукция апопротеина D и полученные корреляционные связи с ИЛ-4, TNF-α также свидетельствует об эффективном иммунном ответе недоношенного новорождённого, препятствует развитию воспалительного процесса в лёгких, влияя, таким образом, на продолжительность ИВЛ.
Полученные данные подтверждают наличие у недоношенных новорождённых баланса цитокинов, достаточно зрелой иммунной системы, препятствующей раз-витию воспалительного процесса на фоне РДСН во время проведения ИВЛ. При РДСН не отмечалось угнетения функционального состояния клеток моноцитарно-макрофагального ряда по выработке провоспалительных цитокинов. Изменения цитокинов и SP-D способствовали постнатальной адаптации иммунной системы недоношенного новорождённого.
Изменения внутрисердечной гемодинамики у новорождённых с РДСН
Оценка систолической функции желудочков в М- и В-режимах.
Система кровообращения в каждом возрастном периоде плода имеет свои индивидуальные особенности. После рождения ребёнка происходит адаптация к новым условиям жизни: прекращается плацентарный кровоток и функция газооб-мена переходит к лёгким, закрываются активно функционировавшие внутриут-робно фетальные коммуникации. Начало лёгочного дыхания вызывает кардиналь-ные изменения гемодинамики: увеличение сердечного выброса ЛЖ, становятся последовательными большой и малый круги кровообращения, изменяется сопро-тивление сосудов. Функциональная напряжённость дыхательной и сердечно - сосудистой систем вследствие развития РДСН, а также проведения ИВЛ у ново-рождённых группы «РДСН» препятствовали достижению физиологических раз-меров предсердий. Уменьшенный венозный возврат крови у 25% новорождённых в 1-е сутки лечения не обеспечивал физиологический объем полостей обеих пред-сердий. У новорождённых группы «РДСН» с 1-х суток жизни и зарегистрированы признаки систолической дисфункции ЛЖ: сниженные показатели КДР и КДО (табл.3).
Таблица 3.
Параметры систолической функции желудочков у недоношенных новорождённых
Показатель | 1-е сутки | 3-и сутки | 5-е сутки | |||
| «РДСН» | «Сравне-ние» | «РДСН» | «Сравне-ние» | «РДСН» | «Сравне-ние» | |
| КСРлж, мм | 6,3±1,7 | 7,1±1,7 | 6,1±1,9 | 7,0±1,5 | 6,4±2,0♦ | 8,3±2,2♦ |
| КДРлж, мм | 11,8±1,9 | 12,8±1,3* | 12,3±1,7 | 13,2±1,6 | 12,1±1,5♦ | 15,0±1,7*♦ |
| КДОлж, мл | 3,4±1,4 | 4,1±1,1* | 3,8±1,2 | 4,4±1,6 | 3,9±1,1♦ | 6,0±1,4*♦ |
| КСОлж, мл | 0,6±0,6♦ | 1,0±0,6♦ | 0,7±0,7 | 0,8±0,7 | 0,8±0,7 | 1,0±0,9 |
| КДРпж, мм | 11,9±2,0 | 12,2±1,3* | 12,0±1,8ϯ | 13,2±1,2ϯ | 12,0±1,5♦ | 14,4±1,5*♦ |
| КСРпж, мм | 6,4±1,7 | 6,7±1,3 | 5,7±2,0ϯ | 7,4±1,1ϯ | 5,7±1,5♦ | 7,4±0,9♦ |
| КДОпж, мл | 3,6±1,3 | 3,6±0,9* | 3,3±1,4 | 4,4±1,0 | 3,6±1,2♦ | 5,6±1,9*♦ |
| КСОпж, мл | 0,7±0,5* | 0,8±0,5 | 0,6±0,5ϯ | 1,0±0,6ϯ | 0,4±0,5*♦ | 1,0±0,3♦ |
