Автореферат диссертации на соискание ученой степени
| Вид материала | Автореферат диссертации |
- Автореферат диссертации на соискание ученой степени, 378.33kb.
- Автореферат диссертации на соискание учёной степени, 846.35kb.
- Автореферат диссертации на соискание ученой степени, 267.76kb.
- Акинфиев Сергей Николаевич автореферат диссертации, 1335.17kb.
- L. в экосистемах баренцева моря >03. 02. 04 зоология 03. 02. 08 экология Автореферат, 302.63kb.
- Автореферат диссертации на соискание ученой степени, 645.65kb.
- Автореферат диссертации на соискание ученой степени, 678.39kb.
- Автореферат диссертации на соискание ученой степени, 331.91kb.
- Автореферат диссертации на соискание ученой степени, 298.92kb.
- Автореферат диссертации на соискание ученой степени, 500.38kb.
1 2
На правах рукописи
ВЕНЕДИКТОВА
Анастасия Александровна
РОЛЬ ПРОТЕАЗ РАЗЛИЧНЫХ КЛАССОВ
В РАЗВИТИИ ОСТЕОПОРОЗА У КРЫС
03.00.04 – биохимия
14.00.16 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск – 2009
Работа выполнена в Научно-исследовательском институте физиологии Сибирского отделения Российской академии медицинских наук и в Новосибирском научно-исследовательском институте травматологии и ортопедии Федерального агентства по высокотехнологичной медицинской помощи
Научные руководители:
доктор медицинских наук,
профессор Короленко Татьяна Александровна
доктор медицинских наук Фаламеева Ольга Викторовна
Официальные оппоненты:
доктор медицинских наук,
профессор Колпаков Аркадий Ростиславович
доктор биологических наук Макарова Ольга Петровна
Ведущая организация:
Федеральное государственное учреждение «Российский научный центр «Восстановительная травматология и ортопедия» им. академика Г.А. Илизарова Росмедтехнологий»
Защита состоится « » 2009 г. в час на заседании диссертационного совета Д 001.034.01 при Научно-исследовательском институте биохимии СО РАМН (630117, г. Новосибирск, ул. Академика Тимакова, 2)
С диссертацией можно ознакомиться в библиотеке
Научно-исследовательского института биохимии СО РАМН
(630117, г. Новосибирск, ул. Академика Тимакова, 2)
Автореферат разослан « » 2009г.
У
 ченый секретарь диссертационного совета
ченый секретарь диссертационного советакандидат биологических наук Русских Г. С.
Общая характеристика работы
Актуальность темы. Остеопороз - одно из наиболее распространенных метаболических заболеваний скелета - представляет собой серьезную медицинскую и социальную проблему (Цейтлин, 2002; Марченкова, 2000) из-за невозможности его выявления на ранних стадиях, сложности лечения, частых осложнений в виде трудно срастающихся переломов.
В основе развития данной патологии лежит нарушение ремоделирования костной ткани. В норме ремоделирование костной ткани включает в себя процесс резорбции участка «старой» кости остеокластами и обязательный, достаточный для заполнения резорбционных лакун, процесс биосинтеза компонентов костного матрикса остеобластами. Сдвиг баланса ремоделирования в сторону резорбции является наиболее частой предпосылкой разрежения костной ткани и развития остеопороза.
Резорбция костной ткани сопровождается высвобождением кальция, фосфора и тартрат-резистентной кислой фосфатазы (ТРКФ), а биосинтез – щелочной (ЩФ) в сыворотку крови. Эти показатели до сих пор используются для оценки состояния процессов резорбции костной ткани как показатели деятельности остеокластов, а активность щелочной фосфатазы– для оценки процессов формирования и деятельности остеобластов (Камышников, 2002). Эти простые и недорогие методы диагностики обладают рядом недостатков, главными из которых являются невысокая информативность, низкая специфичность, а также существующие противоречивые данные об их изменении при развитии остеопороза (Баранов, 2002).
При резорбции костной ткани после растворения гидроксиапатитов происходит расщепление органических компонентов костного матрикса с участием протеолитических ферментов остеокластов. Ключевая роль в этом процессе принадлежит цистеиновой протеазе катепсину К (Buhlung et al., 2004; Buhlung et al., 2006). Предполагают, что он вовлечен в развитие остеопороза различного генеза, в том числе - сенильного и развивающегося у женщин в постменопаузальном периоде (Buhlung et al., 2004; Buhlung et al., 2006). Также показано участие матриксных металлопротеаз (ММП) первого, второго, седьмого, девятого, тринадцатого типа в ремоделировании костной ткани, однако сведения об их участии в резорбции кости противоречивы (Vaananen et al., 2000; Hou P. et al., 2004; Henriksen K. al., 2006). К настоящему времени не изучена степень вовлеченности катепсина К и ММП в патогенез разных вариантов остеопороза и не определена возможность использования сывороточной активности катепсина К и ММП в качестве прогностических маркеров.
Логично предположить, что заболевание, связанное с усилением активности протеаз может смещать баланс протеазы/ингибиторы в организме в сторону протеаз за счет выхода протеаз в кровяное русло. Изменение этого баланса, как показали исследования последних лет, создают условия для развития многих патологий (Фаламеева, 2003; Ярыгина, 2005; Юзько, 2007) и, вероятно, могут усугублять течение основного заболевания. Контроль за активностью протеаз, попавших в кровоток из различных органов и тканей осуществляется α2-макроглобулином (α2-МГ) и α1-антитрипсином (α1-АТ). А2-макроглобулин обладает свойством захватывать и ингибировать все известные классы пептидаз (Веремеенко, 1998). Комплексы α2-макроглобулина с протеазами элиминируются из крови в течение 2 минут (Зорин, 2004), поэтому активность α2-макроглобулина в сыворотке отражает ее ингибиторные возможности. Кроме того, α2-МГ осуществляет транспорт различных цитокинов, в том числе - трансформирующего фактора роста β, стимулирующего остеобласты и подавляющего активность остеокластов. Однако, после связывания с протеазами, комплексы цитокин-ингибитор-протеаза опознаются макрофагами печени как элементы, подлежащие деградации, поэтому происходит их захват и расщепление. Таким образом, цитокины могут не достигать клеток-мишеней.
Изменения активности α2-МГ и α1-АТ как резервов, способствующих адаптации организма при усилении резорбции костной ткани, а также возможность частичной передачи функций инактивации протеаз от одного ингибитора другому при усилении резорбции костного матрикса не изучались. Это особенно актуально при исследовании сенильного остеопороза, поскольку старение организма сопровождается усилением катаболических процессов, увеличением проницаемости в том числе, - лизосомальных мембран из-за окислительных повреждений. Кроме того, естественный процесс старения приводит к возникновению различных заболеваний, что существенным образом влияет на возникновение и течение остеопороза в этом возрасте. В частности, установлено, что развитие остеопороза у пожилых людей происходит на фоне болезней печени (Nakano, 1996; Kissler, 2002; Катикова, 2004). Печень является центральным органом в обеспечении организма пластическим материалом. Функциональные возможности печени в значительной мере определяются способностью осуществлять биосинтез и деградацию различных белков (Шкурупий, 1989). В печени происходит биосинтез сывороточных ингибиторов протеаз α2-МГ и α1-АТ, а также деградация их комплексов с протеазами в лизосомах. 90% внутриклеточного лизосомального протеолиза реализуется за счет согласованного действия катепсинов B, L, D (Рывняк, 2004). Поэтому изменение активности этих протеаз в печени может определять системные последствия, во-первых, из-за возможного нарушения пластической функции печени, а во-вторых, - из-за возникшего дисбаланса протеазы/ингибиторы в организме.
Для установления особенностей этиопатогенеза заболеваний в настоящее время большое значение придается исследованиям на животных-моделях. Адекватность модели определяется ее приближенностью к процессам, происходящим в организме человека. Крысы OXYS могут являться подходящей моделью для исследования сенильного остеопороза, поскольку развитие остеопороза у этой линии крыс сопровождается такими проявления старения, как усиление катаболизма белка, активация свободнорадикального окисления, нарушениями в работе печени из-за развивающихся фиброзных изменений, характерных для стареющего организма.
Еще одной распространенной формой остеопороза, а потому актуальной для исследования на животных-моделях, является остеопороз, развивающийся вследствие эстрогеновой недостаточности. Если постменопаузальный остеопороз активно изучается и более или менее успешно лечится, то остеопороз, вызываемый эстрогеновой недостаточностью у лиц женского пола в молодом возрасте изучен не достаточно хорошо. Особенную значимость этой проблеме придает то, что от формирования костной ткани в детском и подростковом возрасте зависит прочность костной ткани у взрослых. Значительную сложность в лечении остеопороза, развивающегося в молодом возрасте, представляет выбор препаратов лечения, поскольку препараты для взрослых обладают побочными эффектами, оказывающими влияние на рост и развитие молодого организма (Шварц, 2002; Фаламеева, 2008). Ранелат стронция (РС), применяемый для лечения постменопаузального остеопороза, способствует увеличению минеральной плотности костной ткани (МПКТ). В опытах in vivo и in vitro (Atkins, 2009), а также проспективных исследованиях (Meunier, 2004) он проявил себя не только как ингибитор резорбции, но и как стимулятор формирования костной ткани. Тем не менее, влияние РС на процессы резорбции костной ткани при лечении ОП в молодом возрасте не изучено.
Целью настоящей работы явилось изучение роли изменений в системе протеаз и их сывороточных ингибиторов в развитии разных форм остеопороза и влияния ранелата стронция на активность протеаз в костной ткани при развитии остеопороза на фоне эстрогеновой недостаточности.
В соответствии с целью были поставлены следующие задачи:
- Исследовать особенности изменения активности катепсина К и матриксных металлопротеаз (ММП) в костной ткани и сыворотке крови у животных при остеопорозе различного генеза и их взаимосвязь с плотностью костной ткани.
- В эксперименте исследовать концентрацию кальция, фосфора, активность щелочной и тартрат-резистентной кислой фосфатаз в сыворотке крови в зависимости от формы остеопороза и оценить их диагностическое значение в сравнении с диагностическим значением сывороточной активности катепсина К.
- Изучить изменения активности катепсинов B, L, D в печени и катепсин L-подобной активности в сыворотки крови у быстро стареющих крыс линии OXYS до и после появления признаков остеопороза.
- Оценить изменения активности сывороточных ингибиторов α1-антитрипсина и α2-макроглобулина при различной активности цистеиновых и металлопротеаз в костной ткани, печени и сыворотке крови экспериментальных животных.
- Изучить влияние ранелата стронция в составе препарата «Бивалос» на исследуемые параметры при остеопорозе у крыс, развивающегося в результате эстрогеновой недостаточности.
Научная новизна
Выявлено, что повышение активности катепсина К и снижение активности остеобластов является общей чертой сенильного остепороза у крыс линии OXYS и остеопороза, развивающегося у самок крыс Wistar после овариэктомии. Активность катепсина К в сыворотке крови отражает активность резорбционного процесса. Установлено, что при сенильном остеопорозе у преждевременно стареющих крыс OXYS активность катепсина К в костной ткани позвоночника повышается в меньшей степени, чем при развитии остеопороза у овариэктомированных самок крыс Wistar. Показано, что активность ММП до манифестации остеопороза у крыс OXYS снижена по сравнению с группой контроля в отличие от остеопороза, вызываемом овариэктомией у самок крыс Wistar, при котором активность ММП в костной ткани не изменяется.
Показано, что остеопороз у крыс линии OXYS протекает на фоне усиления активности катепсинов L и D в печени и катепсин L-подобной сыворотки крови на отдельных этапах онтогенеза по сравнению с крысами Wistar аналогичного возраста. Показано увеличение активности сывороточного ингибитора α2-макроглобулина при одновременном снижении активности протеаз в кровяном русле у преждевременно стареющих крыс OXYS.
Установлено, что на ранних сроках после овариэктомии наблюдается сдвиг баланса ремоделирования в сторону процессов формирования костной ткани позвоночника и бедренной кости. На момент достижения максимума количества жировой ткани и массы крыс приходится максимум МП позвоночника и бедренной кости и начало снижения МПКТ скелета в целом. На более поздних стадиях после овариэктомии наблюдается усиление процессов формирования костной ткани в отделах скелета, на которые приходится меньшая физическая нагрузка. Одновременно с этим происходит замедление процессов формирования в костной ткани позвоночника и бедренной кости и усилением резорбтивных процессов этих отделах скелета, что выражается в снижении их минеральной плотности.
Впервые показано, что введение ранелата стронция в дозе 200 мг/кг молодым овариэктомированным самкам крыс увеличивает скорость и объем ремоделирования костной ткани. На первом этапе это выражается в значительном увеличении формирования костной ткани позвоночника и бедренной кости. На втором этапе усиливается резорбция в позвоночнике, задерживается формирование костной ткани в бедренной кости и, одновременно, усиливается формирование в переферических отделах скелета. Увеличение объемов ремоделирования костной ткани под действием РС приводит к уменьшению активности ММП и α2-макроглобулина в сыворотке крови.
Научно-практическая значимость
Результаты исследования выявляют неодинаковую степень вовлеченности протеаз в ремоделировании костной ткани при развитии разных форм остеопороза. Исходя из этого, определение их активности позволяет подобрать более адекватную схему лечения остепороза. Поскольку активность катепсина К в костной ткани и сыворотке крови увеличивается задолго до манифестации остеопороза, определение его активности в сыворотке крови может быть использовано для ранней диагностики данного заболевания.
Основные положения, выносимые на защиту
- Увеличение активности катепсина К в костной ткани у преждевременно стареющих крыс OXYS и у овариэктомированных самок крыс Wistar является причиной избыточной резорбции костного матрикса, что вместе со снижением активности остеобластов приводит к развитию остеопороза.
- Активность катепсина К в сыворотке крови является показателем усиленной резорбции костной ткани при развитии остеопороза и может быть использована в качестве диагностического маркера.
- Дополнительным фактором в развитии сенильного остеопороза у преждевременно стареющих крыс линии OXYS является нарушение соотношения протеазы/ингибиторы протеаз в организме.
- Введение ранелата стронция в дозе 200 мг/кг молодым овариэктомированным самкам крыс Wistar вызывает нарушение естественных механизмов сохранения костной плотности на ранних этапах после овариэктомии.
Апробация работы Результаты работы доложены на Съезде физиологов Сибири, Томск, 2005; на Физиологическом Съезде, Москва, 2007; на конференции молодых ученых Института физиологии СО РАМН, Новосибирск, 2007; на конференции молодых ученых, посвященной патологии позвоночника, Новосибирск, 2008; на Всероссийской конференции молодых ученых «Фундаментальные науки и прогресс клинической медицины», Москва 2008; на Съезде физиологов Сибири, Барнаул, 2008.
Структура и объем диссертации Диссертация состоит из введения, четырех глав, включающих литературный обзор, материалы и методы исследования, результаты исследования, обсуждение результатов, после которых следуют заключение, выводы и список цитируемой литературы, содержащий 272 источника, в том числе 201 зарубежный. Работа изложена на 166 страницах машинописного текста, содержит 7 таблиц и 23 рисунка.
Публикации По теме диссертации опубликовано 10 работ, из них 2 статьи опубликованы в изданиях, включенных в перечень ВАК.
Материалы и методы исследований.
Для выяснения патогенеза остеопороза в работе использовались 2 экспериментальные модели: выведенные в Институте цитологии и генетики СО РАН самцы преждевременно стареющих крыс OXYS, и овариэктомированные самки крыс Wistar. Для изучения особенностей патогенеза остеопороза у крыс линии OXYS было проведено 3 серии экспериментов.
В первой серии экспериментов изучались возрастные показатели МПКТ у самцов крыс линии OXYS. Измерение МПКТ проводилось у животных 2-х, 4-х, 6-ти, 8-ми и 12-ти месяцев, контролем послужили самцы крыс Wistar соответствующих возрастов.
Вторая серия экспериментов, выполненная на самцах крыс OXYS, была направлена на исследование роли катепсина К и ММП в развитии сенильного остеопороза у этих животных.
Поскольку развитие сенильного остеопороза является спутником возрастных изменений в организме человека и животных, третья серия экспериментов проведена с целью изучения роли системного изменения активности протеаз, вызываемого старением, а также возможной роли изменения активности этих ферментов в функциональном состоянии печени крыс OXYS до и после развития остеопороза. Эксперименты проведены на крысах-самцах линии OXYS 3-х, 12-ти и 18-ти месяцев. Предметом исследования послужили возрастные изменения активности катепсинов В, L и D в печени и катепсин L-подобная активность в сыворотке крови.
Для изучения роли катепсина К и ММП в изменении ремоделирования костной ткани, развивающейся на фоне эстрогеновой недостаточности и влияния РС в составе антиостеопоротического препарата «Бивалос» на исследуемые показатели, была выполнена серия экспериментов на овариэктомированных самках крыс Wistar. Животным в возрасте 3-х месяцев проведена овариэктомия. Исследование минеральной плотности костной ткани (МПКТ) проводили животным до 10 месяца жизни через каждые 1-2 месяца. Часть крыс с 6-месячного возраста (через 3 мес. после удаления гонад) ежедневно получала РС в дозе 200 мг/кг в течение 2-х месяцев. В 8 месяцев (по прошествии 5 месяцев после овариэктомии) забивали всех животных, которым вводился РС, половину интактных животных и половину овариэктомированных, не получавших РС. Остальным животным продолжали измерять МПКТ для оценки наступления сроков системного остеопороза после овариэктомии.
МПКТ крыс измеряли методом дихроматической рентгеновской абсорбциометрии (DEХА) с использованием программы - «small animals», результаты выражали в г/см3. У овариэктомированных самок крыс с помощью данного метода измеряли также содержание жировой ткани в теле.
Гистологическое исследование препаратов костной ткани методом световой микроскопии выполнено с использованием микроскопа Axioskop 40 (Сarl Zeiss, Германия). Костные фрагменты фиксировали в растворе 12% формалина, декальцинировали в растворе 0,5% соляной кислоты, парафиновые срезы окрашивали гематоксилином и эозином.
Для исследований использовали сыворотку крови, гомогенаты костной ткани и печени, приготовленные в 0,25М сахарозе с 1мкМ ЭДТА, рН 7,3.
Активность катепсинов В и L, а также катепсин L-подобную активность в сыворотке крови определяли с помощью флюорeсцентного субстрата Z-Arg-Arg-MCA (НПО "Вектор", Россия) в соответствие с методом (Kirschke, Barrett, 1987). Активность катепсина D определяли в соответствие с методом (Wiederanders, 1982) с помощью азоказеина (Fluka, США) с использованием пепстатина – специфического ингибитора катепсина D. Активность катепсина К определяли против флуоресцентного субстрата Z-Gly-Pro-Arg-MCA (Sigma, США) по методу, предложенному Bromme (Bromme, 2002). Активность ММП определяли по методу Nagase (Nagase, 1994) против МСА-Pro-Leu-Gly-Leu-DpA-Ala-Arg-NH2 (American Peptide Co, США).
Концентрацию белка определяли по методу Bradford (Bradford, 1976).
Активность тартрат-резистентной кислой фосфатазы определяли по методу, предложенному Меньшиковым (Меньшиков, 1987) с модификациями против п-нитрофенилфосфата в качестве субстрата. Активность щелочной фосфатазы, концентрацию кальция и фосфора определяли с помощью коммерческих наборов («Вектор-Бест», Россия) в соответствие с протоколами фирмы производителя.
Активность α2-МГ и α1-АТ определяли против бензоил-аргинин-этилового эфира в качестве субстрата по методу Яровой в модификации Ярыгиной (Ярыгина, 2005).
Определение общей концентрации ММП-2 в сыворотке крови проводили методом ИФА наборами R&D (США) в соответствии с протоколом фирмы-производителя.
Статистическую обработку результатов проводили с помощью непараметрических методов Манна-Уитни и углового преобразования Фишера.
Результаты исследования и их обсуждение
Исследование системы протеаз и их сывороточных ингибиторов при развитии остеопороза у преждевременно стареющих крыс OXYS
Изменения минеральной плотности костной ткани у крыс OXYS по сравнению с крысами Wistar
У крыс Wistar с возрастом происходит постепенный прирост МПКТ (рис. 1). У крыс OXYS прирост МПКТ происходит медленнее и не достигает уровня значений, характерного для крыс Wistar соответствующего возраста. Различия МП у крыс OXYS отмечены с 4-х месяцев в позвоночнике и всего скелета. Начиная с 6-ти месячного возраста, у крыс линии OXYS МПКТ и в позвоночнике, и в скелете в целом выходит на плато.
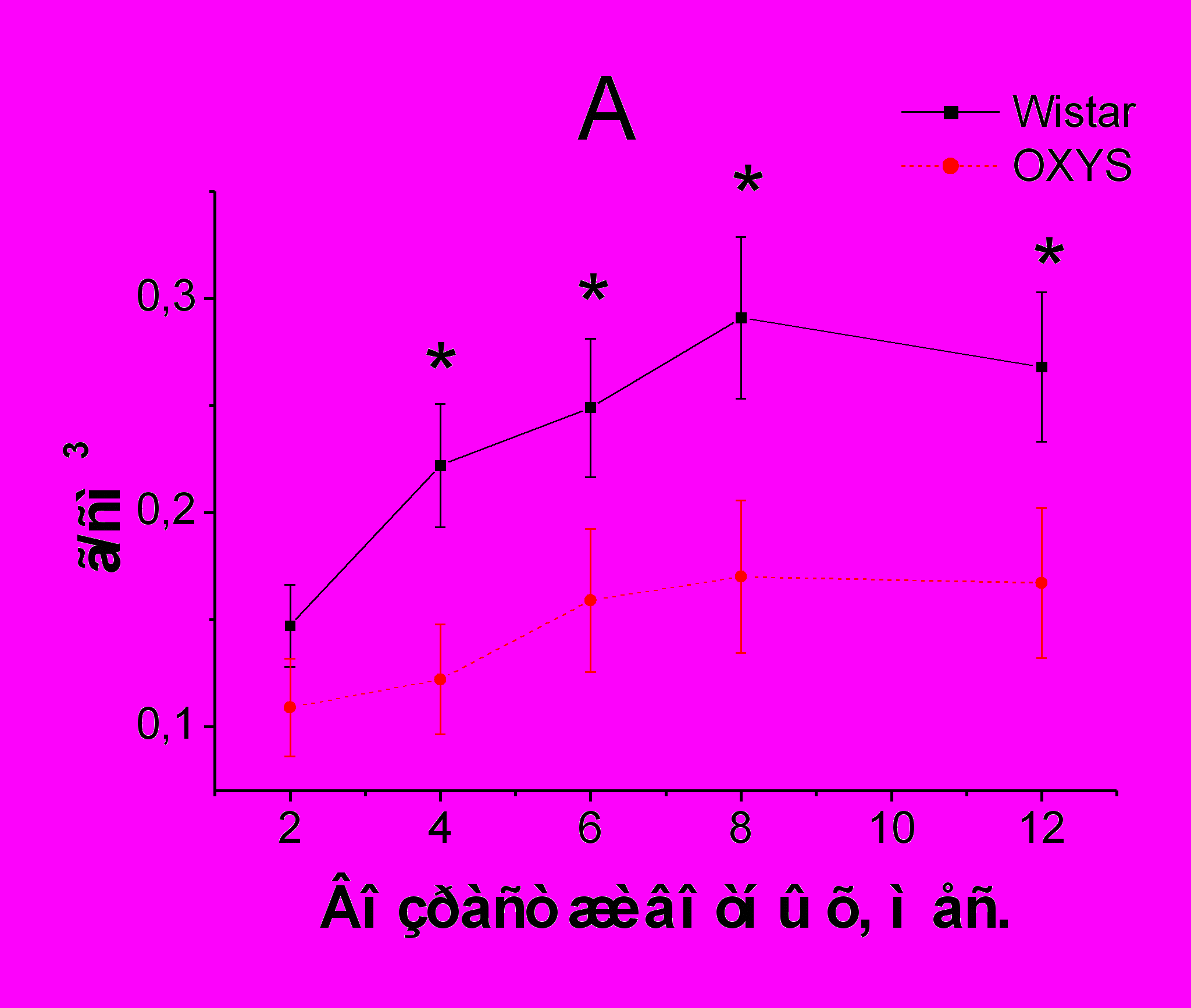
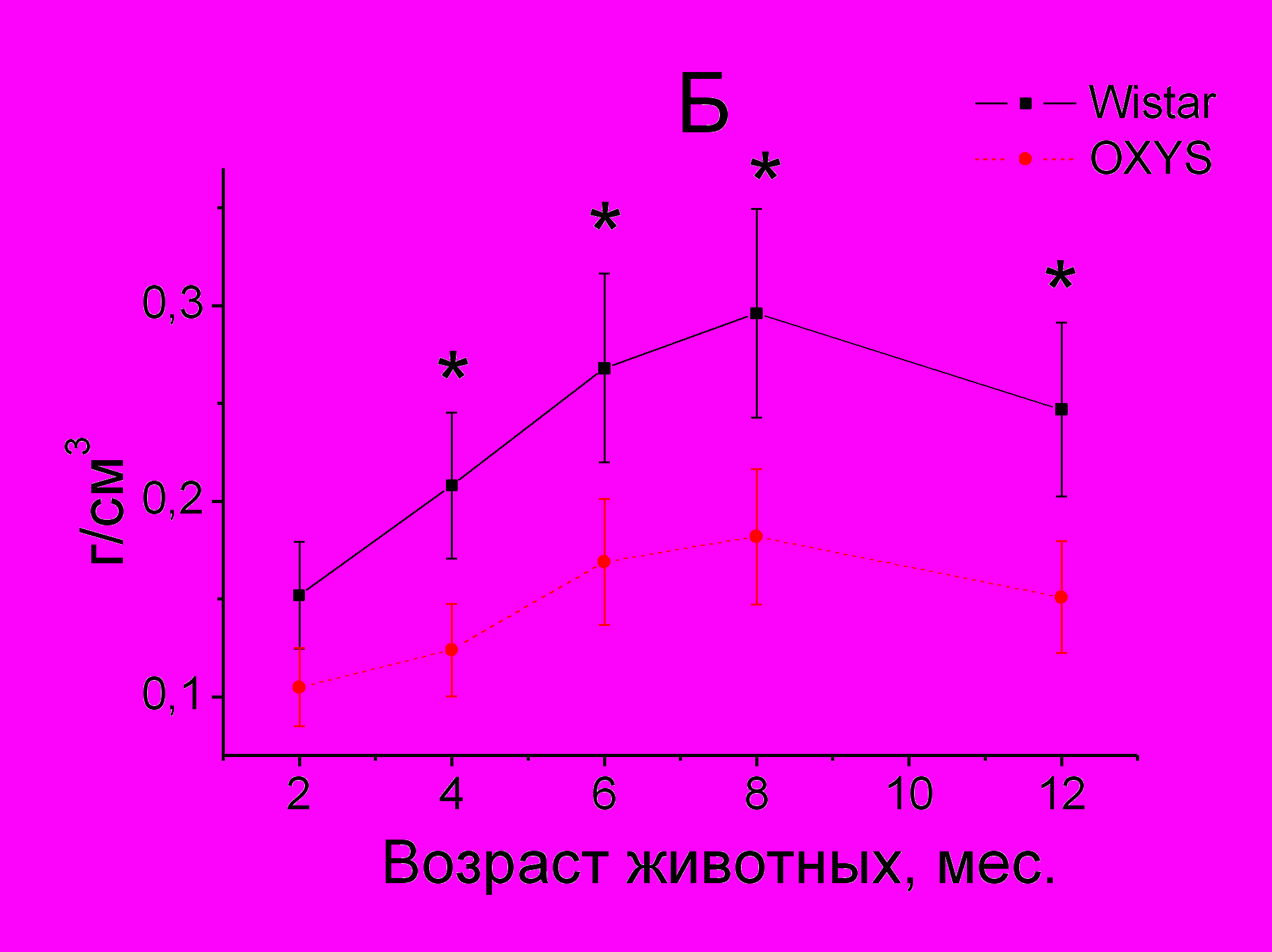
Рис. 1. Возрастные изменения МПКТ всего скелета (А) и позвоночника (Б) у крыс линии OXYS по сравнению с крысами Wistar
Примечание. *p < 0,05, **p < 0,01 по сравнению c крысами Wistar соответствующего возраста
Развитие остеопороза у крыс OXYS подтверждено морфологическим исследованием фрагментов тел позвонков. Показано, что у крыс OXYS с 6-ти месяцев определяются источенные костные балки, в некоторых участках с прерыванием трабекулярной сети, с рарефикацией кортикальной пластинки. Костные трабекулы сужены, диаметр гаверсовых каналов увеличен.
Изменения показателей у крыс Wistar и OXYS разного возраста, применяемых для оценки состояния ремоделирования костной ткани
Возрастных изменений в концентрации кальция и фосфора в сыворотке крови у крыс Wistar не обнаружено (табл. 1). У молодых крыс OXYS в сыворотке крови увеличена концентрации кальция и фосфора. При достижении крысами OXYS 14-ти месяцев, концентрация кальция в сыворотке крови снижалась, принимая такие же значения, как Wistar. Возрастных изменений в сывороточной концентрации фосфора у крыс OXYS не выявлено.
Возрастной динамики в активности ТРКФ у животных не обнаружено. Межлинейных различий в возрасте 3-х месяцев выявить не удалось, однако при достижении животными возраста 14-ти месяцев оказалось, что у крыс OXYS активность ТРКФ повышена по сравнению с крысами Wistar в 1,6 раза, что свидетельствует об усилении процессов резорбции костной ткани у крыс OXYS по сравнению с крысами Wistar.
Активность ЩФ в сыворотке крови снижалась с возрастом у крыс Wistar на 25% и более значительно, - на 35%, у крыс OXYS. Значения этого показателя у крыс OXYS снижены по сравнению с крысами Wistar как в молодом, так и в зрелом возрасте. Это свидетельствует об ухудшении формирования костной ткани у крыс OXYS за счет снижения количества и/или активности остеобластов.
Таблица 1
Изменения показателей, у крыс Wistar и OXYS разного возраста в сыворотке крови, применяемых для оценки состояния ремоделирования костной ткани (М±m)
| Показатель | Wistar | OXYS | ||
| 3 мес. | 14 мес. | 3 мес. | 14 мес. | |
| Концентрация кальция, ммоль/л | 2,64±0,11 | 2,65±0,10 | 3,20±0,07** | 2,63±0,08# |
| Концентрация фосфора, ммоль/л | 2,35±0,36 | 2,44±0,10 | 2,89±0,12* | 2,70±0,18 |
| Активность щелочной фосфатазы, мкмоль/мин на 1 л | 499±38 | 375±23°° | 403±26* | 261±7##*** |
| Активность тартрат-резистентной кислой фосфатазы, мкмоль/мин на 1 л | 8,11±0,80 | 6,45±1,21 | 8,45±1,47 | 10,42±0,73## |
Примечание. Количество животных в группах от 5 до 8.
*p < 0,05, **p < 0,01 по сравнению крысами Wistar того же возраста
# p < 0,05, ##p < 0,01 по сравнению с крысами OXYS в 3 месяца
°°p < 0,01 по сравнению с крысами Wistar в 3 месяца
Изменения активности катепсина К, ММП и концентрации ММП-2 у крыс OXYS по сравнению с крысами Wistar
Несмотря на то, что активность ТРКФ (маркера резорбции костной ткани) у крыс молодых OXYS не изменена относительно крыс Wistar, активность катепсина К, основной цистеиновой протеазы остеокластов, в костной ткани позвоночника в возрасте 3-х мес. была в 2,1 раза выше у крыс OXYS (табл. 2), чем у крыс Wistar, что говорит об активном разрушении костной ткани остеокластами. С возрастом активность катепсина К в костной ткани позвоночника у крыс OXYS имела тенденцию к снижению, а у крыс Wistar увеличивалась.
Таблица 2
Изменение активности катепсина К и ММП в костной ткани у крыс Wistar и OXYS разного возраста (M±m)
| Показатель | Wistar | OXYS | ||
| 3 мес. | 14 мес. | 3 мес. | 14 мес. | |
| Активность катепсина К, нмоль/мин на 1 мг белка | 0,74±0,11 | 1,21±0,17* | 1,58±0,39* | 1,09±0,16 |
| Активность ММП, мкмоль/мин на 1 мг белка | 29,29±5,95 | 21,46±3,18* | 10,12±1,57* | 21,60±3,79# |
Примечание. *p < 0,05, по сравнению c крысами Wistar в 3 месяца
# p < 0,05 по сравнению c крысами OXYS в 3 месяца
В 3 месяца, когда у крыс OXYS происходила активная резорбция костного матрикса катепсином К, активность ММП в костной ткани позвоночника была снижена по сравнению с крысами Wistar более чем в 2 раза. Увеличение значений этого показателя происходило у крыс OXYS в 14 месяцев, когда активность катепсина К имела тенденцию к снижению. У крыс Wistar, - напротив, активность ММП в костной ткани с возрастом снижалась. В результате возрастных изменений в возрасте 14-ти месяцев между крысами Wistar и OXYS не выявлено различий по этому показателю.
В сыворотке крови, также как в костной ткани позвоночника, у 3-х месячных крыс OXYS активность катепсина К выше, чем у крыс Wistar того же возраста (табл. 3). К 14-ти месяцам сывороточная активность катепсина К снижалась у животных обеих линий до одного уровня. Таким образом, активность катепсина К может быть использована в качестве маркера только начавшего развиваться сенильного остеопороза, а ТРКФ – уже развившегося.
Таблица 3
Изменение активности катепсина К, ММП а также концентрации ММП-2 в сыворотке крови у крыс Wistar и OXYS разного возраста (M±m)
| Показатель | Wistar | OXYS | ||
| 3 мес. | 14 мес. | 3 мес. | 14 мес. | |
| Активность катепсина К, нмоль/мин на 1 мл | 0,82±0,02 | 0,55±0,02** | 0,89±0,02* | 0,56±0,01### |
| Активность ММП, мкмоль/мин на 1 мл | 4,79±0,56 | 9,11±4,24** | 3,52±0,86* | 4,24±0,34+++ |
| Концентрация ММП-2 (активная форма + профермент), нг/мл | 198±13++ | 144±4 | 184±5 | 193±16++ |
| Активность α2-МГ, мкмоль/мин на 1 мл | 4,21±0,19 | 4,28±0,27 | 4,73±0,59 | 4,89±0,40+ |
| Активность α1 –АТ, мкмоль/мин на 1 мл | 20,48±5,69 | 22,80±7,51 | 16,24±3,28 | 17,63±3,02 |
Примечание. *p < 0,05, ** p<0,01 по сравнению c крысами Wistar в 3 месяца
###p<0,001 по сравнению c крысами OXYS в 3 месяца
+p < 0,05, ++p < 0,01, +++p < 0,001 по сравнению с крысами Wistar в 14 месяцев
У крыс Wistar при снижении активности ММП в костной ткани с возрастом, происходило снижение концентрации ММП-2 в сыворотке крови, но сывороточная активность ММП напротив, - увеличивалась. Это свидетельствует о том, что с возрастом изменяется спектр металлопротеаз, попадающих в кровяное русло. У крыс OXYS не обнаружено возрастных изменений активности ММП и концентрации ММП-2 в сыворотке крови, несмотря на увеличение активности ММП в костной ткани позвоночника в 14 месяцев. Таким образом, об активности ММП в костной ткани нельзя судить по сывороточной активности металлопротеаз. При сравнении животных разных генотипов оказалось, что у крыс Wistar сывороточная активность ММП была выше, чем у крыс OXYS как в три, так и в четырнадцать месяцев, а концентрация ММП-2 ниже у 14-ти месячных животных.
Снижение активности ММП в сыворотке крови в 3 месяца у крыс OXYS по сравнению с крысами Wistar, вероятно, может быть связано с низкой активностью этих протеаз в тканях, в том числе и в костной, а в 14 месяцев – их элиминацией из кровяного русла α2-макроглобулином, активность которого увеличивалась у 14-ти месячных крыс OXYS. Активность α1-антитрипсина в сыворотке крови в зависимости от генотипа и возраста животных не изменялась, что, вероятно, связано с отсутствием необходимости увеличения его биосинтеза.
Изменения активности катепсинов В, L и D в печени и катепсин
L-подобной активности в сыворотке крови у крыс OXYS до и после появления признаков остеопороза
В результате исследования установлено, что развитие и протекание остеопороза у крыс OXYS происходило на фоне увеличения протеолитической активности в печени и сыворотке крови. Так, у крыс OXYS активность в печени основной цистеиновой протеазы гепатоцитов – катепсина L в 3 и 18 месяцев была значительно выше, чем у крыс Wistar (табл. 4). В 12 месяцев не было найдено различий между животными разных линий.
Таблица 4
Возрастные изменения активности катепсинов В, L и D в печени и катепсин L-подобной активности в сыворотке крови у крыс Wistar и OXYS (M±m)
| Животные | Возраст, месяцы | Активность катепсина L (мкмоль/час на 1 мг белка) | Активность катепсина B (мкмоль/час на 1 мг белка) | Активность катепсина D А366/час на 1 мг белка | Катепсин L-подобная активность (мкмоль/час на 1мл) |
| Wistar | 3 | 7,76±0,043 | 11,81±0,83 | 0,300±0,021## | 2,3±0,03 |
| 12 | 16,32±1,34++ | 6,20±0,55+ | 0,590±0,065 | 0,81±0,01+++ | |
| 18 | 18,02±1,40++ | 6,79±0,79+ | 0,316±0,12## | 1,04±0,04+ | |
| OXYS | 3 | 17,35±1,83* | 12,87±0,93 | 0,434±0,029* | 4,95±0,04** |
| 12 | 24,03±5,00 | 7,78±1,55° | 0,369±0,040* | 0,81±0,01°°° | |
| 18 | 27,62±1,4* | 9,22±2,41 | 0,712±0,072* | 2,2±0,66*# |
Примечание. *p<0,05 ** p<0,01 по сравнению с крысами Wistar того же возраста
+ p<0,05, ++p<0,01 +++p<0,001 по сравнению с крысами Wistar 3 месяцев
# p<0,05, ##p<0,01 по сравнению с крысами Wistar 12 месяцев
°p<0,05, °°° p<0,001 по сравнению с крысами OXYS в 3 и в 18 месяцев
p<0,05 по сравнению с крысами OXYS 18 месяцев
Различий в активности катепсина В в печени между крысами Wistar и OXYS не выявлено. Однако были найдены значительные изменения в активности катепсина D, расщепляющего большие плотно упакованные субстраты и облегчающего доступ цистеиновым протеазам к этому субстрату. Установлено, что активность этого фермента у крыс OXYS в 3 месяца выше в 1,4 раза, а в 18 - в 2,2 раза по сравнению с крысами Wistar. Характерное возрастное снижение активности катепсина D, связанное с его инактивацией, у крыс Wistar наблюдалось значительно позднее – в 18 месяцев, а на 12 месяцев приходился максимум его активности. У крыс OXYS напротив, характерное возрастное снижение активности этого фермента в печени происходило раньше и регистрировалось 12 месяцев, а к 18-ти наблюдалось усиление его активности, связанное, по-видимому, с накоплением непереваренного материала в лизосомах, и запросом на усиление экспрессии протеаз. Таким образом, показано, что у крыс линии OXYS на отдельных этапах онтогенеза повышена активность катепсина L и D в печени, что, скорее всего, означает усиление их экспрессии. Избыток протеаз в клетке представляет значительную угрозу, поскольку лабилизация мембран в ходе перекисного окисления, к которому чувствительны крысы OXYS (Колосова, 2003), может приводить к неконтролируемой гибели клеток в значительно большем объеме, по сравнению, с тем, который мог бы вовлекаться в некроз при нормальной экспрессии протеолитических ферментов. Возможно, это и является причиной развития ранних фиброзных процессов в печени у крыс этой линии, а это в свою очередь может приводить к нарушению синтеза и утилизации сигнальных молекул (интерлейкинов и факторов роста), ингибиторов протеаз, снижению карбоксилирования глютаминовой кислоты, являющейся составным компонентом остеокальцина, таким образом, способствует прогрессированию остеопороза.
Исследование катепсин L-подобной активности в сыворотке крови показало, что у крыс Wistar и OXYS в 3 месяца она выше, чем в 12 месяцев, причем в 3 и 18 месяцев ее активность выше у крыс OXYS, чем у крыс Wistar. У близких по возрасту к 12-ти месяцам, 14-месячных крыс OXYS повышается активность сывороточного ингибитора протеаз α2-макроглобулина, происходит снижение активности катепсина К, а активность ММП ниже, по сравнению с крысами Wistar, из чего можно предположить, что снижение катепсин L-подобной активности в сыворотке крови у крыс OXYS в этом возрасте может быть связано с участием α2-макроглобулина в элиминации протеаз из кровяного русла. В 18 месяцев катепсин L-подобная активность в сыворотке у крыс Wistar остается на достигнутом уровне, а у крыс OXYS увеличивается.
Таким образом, нами показано, что на отдельных этапах онтогенеза для крыс линии OXYS характерна повышенная активность протеаз в печени и сыворотке крови по сравнению с крысами Wistar. Увеличение попадания в кровоток катепсинов L и D из печени, катепсина К из костной ткани и протеаз с катепсин L-подобной активностью из других органов у крыс OXYS в 3 месяца до проявления признаков остеопороза может сдвигать баланс протеазы/ингибиторы в организме в сторону усиления протеолитической активности и таким образом являться дополнительным условием, способствующим развитию сенильного остеопороза. Кроме того, увеличение активности протеаз в печени может приводить к нарушению ее пластической функции, поскольку протеазы повреждают паренхиму печени, что приводит у зрелых крыс OXYS к фиброзным изменениям (Колосова, 2001). Это, вероятно, может также служить фактором, осложняющим течение сенильного остеопороза у этих животных.
Исследование ремоделирования костной ткани при развитии остеопороза у овариэктомированных самок крыс Wistar
Динамика изменений МПКТ после овариэктомии и на фоне введения ранелата стронция
У интактных самок крыс Wistar до 10-ти месяцев происходит постепенное накопление МП скелета в целом (рис. 2 А).
У самок после овариэктомии рост МП скелета чередовался со спадами. В возрасте 4-х месяцев, через 1 месяца после овариэктомии МП выше, чем у интактных животных на 19%. В возрасте 5-ти месяцев (через 2 месяца после удаления гонад) МП снижалась и соответствовала МП интактных 5-месячных самок. С 5-ти до 7-ми месяцев у овариэктомированных крыс (через 3 и 4 месяца после удаления гонад) снова происходил рост МП скелета до значений, характерных для интактных самок аналогичного возраста. К 8 месяцам (через 5 месяцев после удалиния гонад) у овариэктомированных крыс МПКТ скелета оставалась на прежнем уровне, однако продолжающийся рост МП скелета у интактных животных обеспечил разницу МП между группами животных на 11%. Значение МП скелета у овариэктомированных самок по сравнению с самками контрольной группы оставалось сниженным на 11% и к 10-месячному возрасту, через 7 месяцев после удаления гонад. Введение РС в дозе 200 мг/кг овариэктомированным самкам не влияло на МП скелета в целом.
Динамика изменений МПКТ позвоночника у животных в группе контроля характеризовалась постепенным медленным приростом этой величины (рис. 2 Б).
У овариэктомированных животных с 4-х до 7-ми месяцев МПКТ позвоночника не изменялась. С 7-ми (через 4 месяцев после овариэктомии) до 8-ми месяцев (через 5 месяцев после овариэктомии) происходило ее увеличение с последующим снижением к 10-ти месяцам (через 7 месяцев после овариэктомии). В возрасте 7-ми месяцев МПКТ позвоночника интактных самок превышала МПКТ позвоночника овариэктомированных. В 8 месяцев у овариэктомированных крыс наблюдался максимум МПКТ позвоночника, при этом ее значения совпадали с МПКТ позвоночника интактных животных (рис. 1 Б). Введение РС овариэктомированным самкам в течение 1-го месяца увеличивало МПКТ позвоночника до значений, превышающих МПКТ позвоночника у крыс контрольной группы (рис. 2 Б). Однако через 2 месяца введения РС МПКТ позвоночника стала ниже, чем у контрольных и овариэктомированных животных, которым РС не вводился.
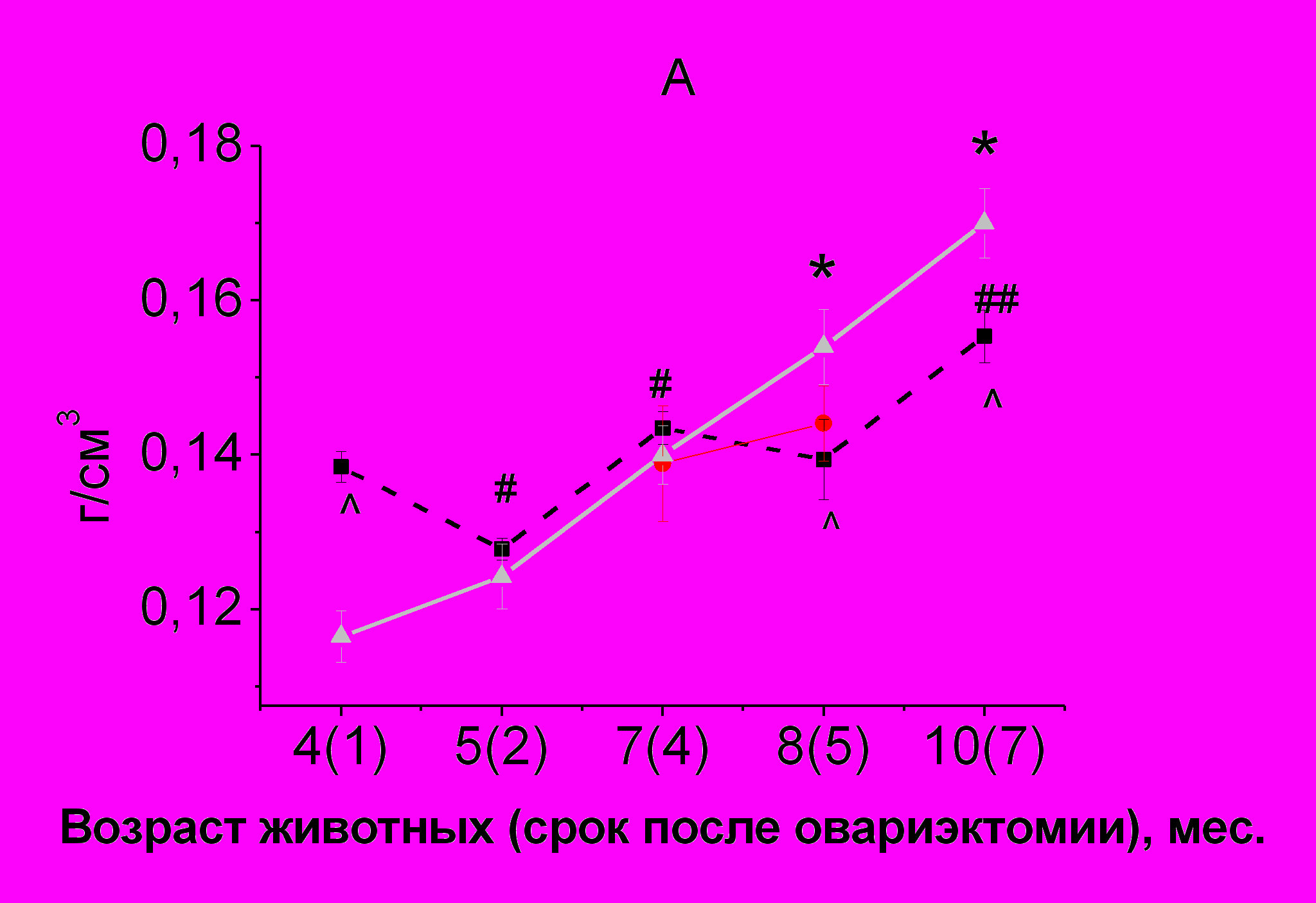
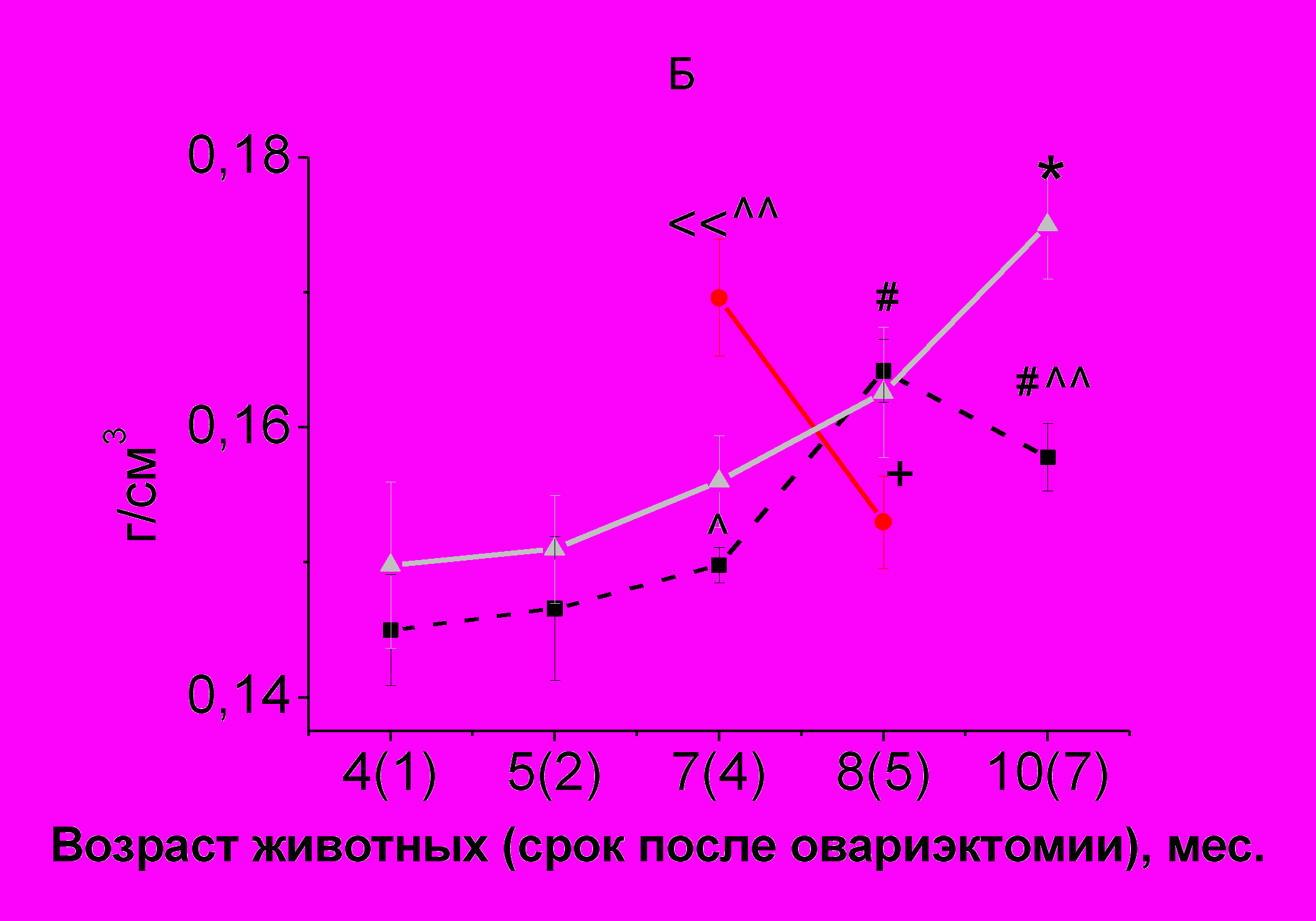
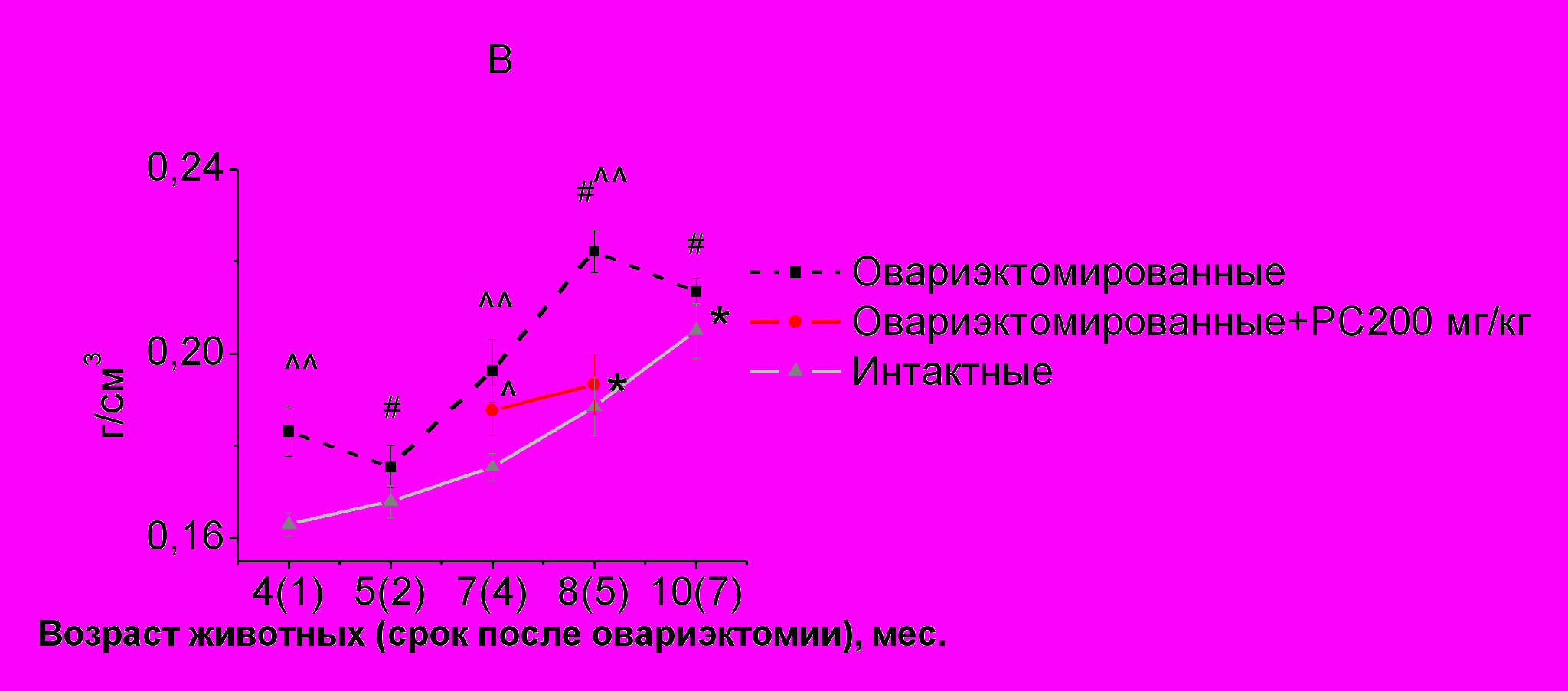
Рис. 2. Сравнение динамики прироста минеральной плотности костной ткани скелета (А), позвоночника (Б) и бедренной кости (В) у интактных и овариэктомированных самок крыс Wistar и влияние введения РС в дозе 200 мг/кг на этот показатель
Примечание.*p < 0,05, по сравнению с предыдущим измерением МПКТ у интактных самок крыс Wistar
#p < 0,05, ##p < 0,01, по сравнению с предыдущим измерением МПКТ у овариэктомированных самок крыс Wistar
p < 0,05, p < 0,01, по сравнению с интактными самками
+p<0,05, по сравнению с предыдущим периодом измерения МПКТ у овариэктомированнных самок крыс Wistar, получавших РС в дозе 200 мг/кг
<< p < 0,01, по сравнению с овариэктомированными самками аналогичного возраста
Особенностью накопления МПКТ в бедренной кости у интактных самок крыс Wistar является медленный постепенный прирост с 4-х до 7-ми месяцев с последующим ускорением минерализации, происходящим между 7-м и 8-м месяцем с продолжающимся почти линейным ростом, по крайней мере, до 10-ти месяцев (рис. 2В). МП бедренной кости у овариэктомированных животных увеличивалась с 5-ти до 8-ми месяцев (через 2-5 месяцев после удаления гонад), а затем снижалась. При этом в возрасте 4-х, 7-ми, 8-ми месяцев (через 1, 4, 5 месяцев после овариэктомии) МП бедренной кости оперированных крыс превышала МП бедренной кости интактных. В возрасте 5-ти и 10-ти месяцев (через 2, 7 месяцев после удаления гонад) у овариэктомированных крыс значения МП бедренной кости не отличались от значений интактных.
У овариэктомированных животных, которым вводился РС через 1 месяц после терапии МП бедренной кости увеличивалась по сравнению с интактными самками и не достигала значений этого показателя, характерных для овариэктомированных крыс, не получавшим РС. Через 2 месяца после начала введения РС МП бедренной кости соответствовала МП у интактных самок.
Изменения росто-весовых показателей овариэктомированных самок крыс Wistar их взаимосвязь с МПКТ
Удаление яичников приводило к увеличению количества жировой ткани, и как следствие - к увеличению массы тела крыс (рис. 3 А, Б).
Введение РС в дозе 200 мг/кг в течение 1-го месяца снижало массу тела (рис. 3 А) и процентное содержание жировой ткани в теле овариэктомированных крыс (рис. 3 В), благодаря чему значения этих показателей становились такими, как у интактных животных соответствующего возраста. Данный эффект сохранялся к концу 2-го месяца использования препарата.
У интактных животных имела место положительная корреляционная связь между общей МПКТ и массой крысы (r=0,76, p<0,05). У овариэктомированных самок в возрасте 4-х месяцев (через 1 месяц после овариэктомии) МПКТ скелета крыс коррелировала с массой жировой ткани (r=0,78, p<0,05) и с МПКТ позвоночника (r=0,76, p<0,05). При этом не было выявлено корреляции между минеральной плотностью скелета и массой крыс, судя по корреляционной зависимости, масса крыс определялась в большей степени массой жировой ткани (r=0,78, p<0,05).
Через 7 месяцев после удаления гонад было обнаружено, что минеральная плотность скелета в целом коррелирует с МПКТ позвоночника и бедренной кости (r=0,68, p<0,05), а масса тела – с количеством жировой ткани (r=0,70, p<0,05). При этом не было выявлено корреляции МПКТ с количеством жировой ткани, характерной для более раннего периода после овариэктомии что может говорить о неспособности организма животных поддерживать МПКТ за счет увеличения силовой нагрузки и гормонов, выделяемых жировой тканью, несмотря на ее значительное содержание в теле. Напротив, между содержанием жировой ткани и МПКТ позвоночника и скелета в целом была обнаружена отрицательная корреляция (r= - 0,60, p<0,01). Это может свидетельствовать о том, что на этот период резервные возможности организма, обеспечивающие дифференцировку и активность остеобластов на необходимом уровне исчерпаны, а увеличение активности катепсина К поспособствовало запуску процесса дифференцировки клеток-предшественниц по пути адипоцитов, а не остеокластов.
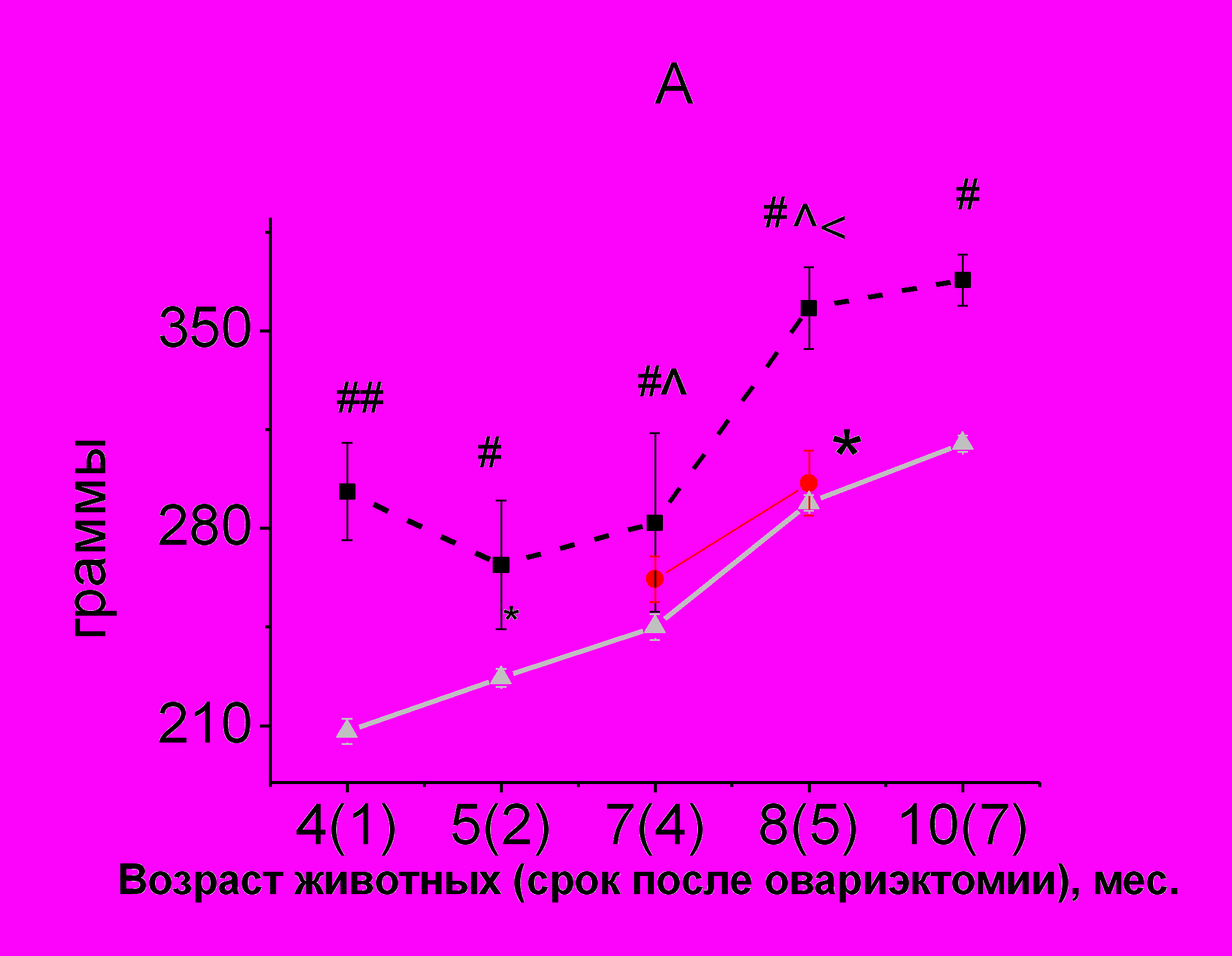
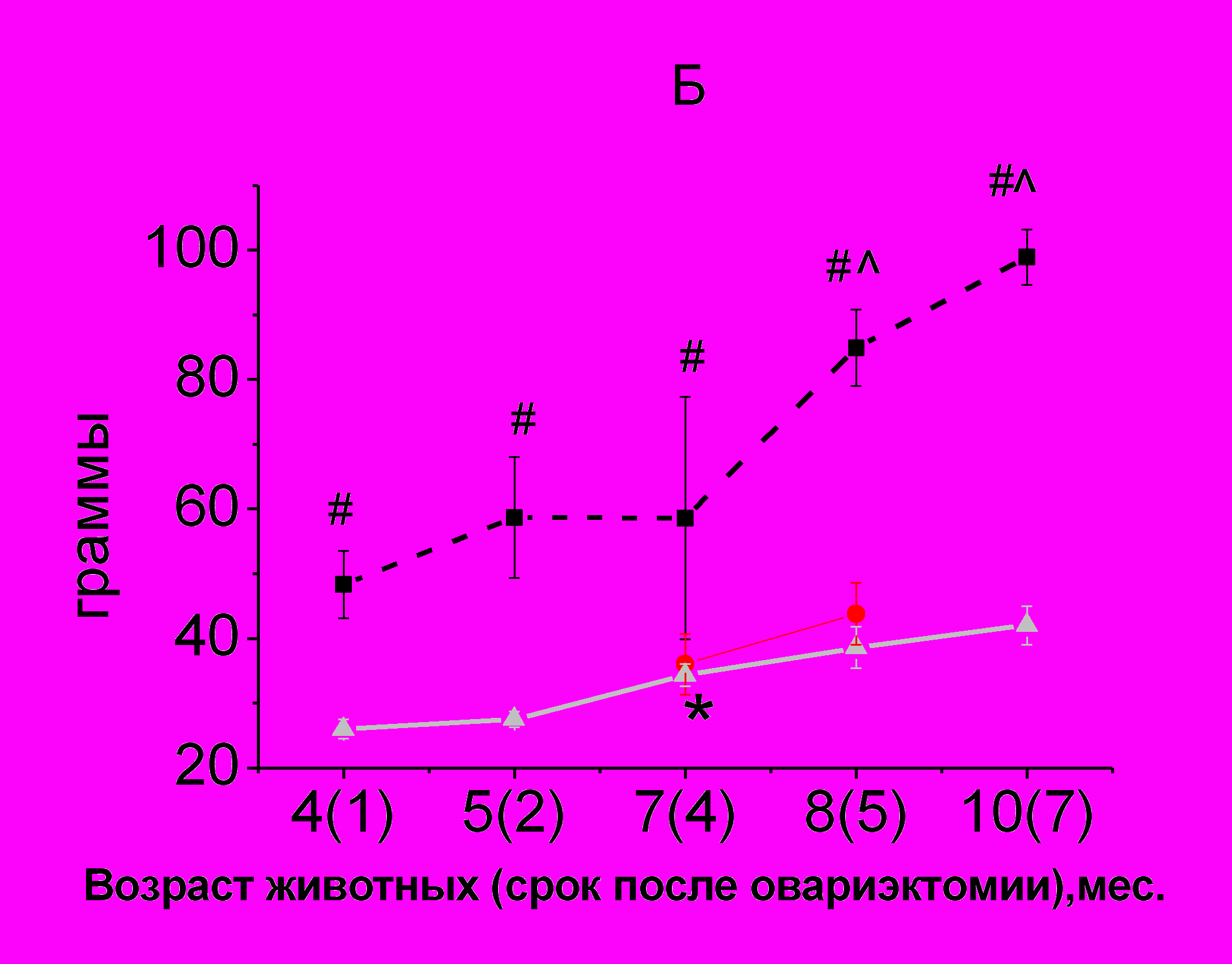

Рис. 3. Динамика изменений массы самок крыс Wistar (А), массы жировой ткани (Б), и процентного содержания жировой ткани в теле (В) в зависимости от экспериментальных воздействий
Примечание. *p < 0,05 по сравнению с предыдущим периодом в группе контроля
p < 0,05 по сравнению с предыдущим периодом у овариэктомированных самок крыc
# p < 0,05, # #p < 0,01 по сравнению с контролем
<p< 0,05, <<p< 0,01 по сравнению c овариэктомированными самками крыс, получавших РС в дозе 200 мг/кг
Изменение активности катепсина К и ММП в костной ткани и сыворотке крови у самок крыс Wistar
У овариэктомированных самок крыс Wistar увеличение активности катепсина К в 4 раза костной ткани позвоночника и в 15 раз бедренной кости по сравнению с интактными (табл. 5) происходило до снижения МПКТ этих отделов скелета.
Таблица 5
Изменение активности катепсина К и ММП в костной ткани различных отделов скелета у самок крыс Wistar в зависимости от экспериментальных воздействий (M±m)
| Показатель | Животные | ||
| Интактные | Овариэктомиро-ванные | Овариэктомиро-ванные+РС, 200 мг/кг | |
| Активность катепсина К в позвоночнике, нмоль/мин на 1 мг белка | 0,84±0,22 | 3,30±0,57** | 3,85±1,71* |
| Активность катепсина К в бедренной кости, нмоль/мин на 1 мг белка | 0,31±0,08 # | 4,70±1,11** | 4,87±1,93* |
| Активность ММП в позвоночнике, мкмоль/мин на 1 мг белка | 10,72±3,32 | 15,65±2,83 | 12,83±3,87 |
| Активность ММП в бедренной кости мкмоль/мин на 1 мг белка | 3,14±0,56## | 4,87±1,98# | 3,19±0,71# |
Примечание. Количество животных в группах от 9 до 10.
*p < 0,05, **p < 0,01 по сравнению c интактными самками крыс Wistar
# p < 0,05, ##p < 0,01 по сравнению c величиной данного показателя в костной ткани позвоночника
Активность ММП в костной ткани позвоночника не имела различий между группами экспериментальных животных. Активность ММП в костной ткани бедренной кости не имела различий по средним во всех трех группах животных, однако овариэктомированные самки, независимо от введения РС различались с интактными самками по распределению (φ=1,72, р<0,05 и φ=1,69, р<0,05 соответственно). Введение РС в дозе 200 мг/кг овариэктомированным самкам не влияло на активность катепсина К и ММП в костной ткани позвоночника и бедренной кости.
При сравнении активности катепсина К в разных отделах скелета оказалось, что активность этой цистеиновой протеазы в костной ткани позвоночника у интактных самок выше, чем в бедренной кости, а у овариэктомированных животных активность катепсина К в этих отделах скелета была одинаковой. Это может говорить о том, что отсутствие гонад приводит к системному усилению резорбции костной ткани и к нарушению механизмов, поддерживающих более низкий уровень резорбции костной ткани в бедренной кости в норме. Общая активность ММП была выше в костной ткани позвоночника, чем в бедренной кости во всех группах животных.
Увеличение активности катепсина К в костной ткани у овариэктомированных самок, коррелировало с увеличением его активности в сыворотке крови (табл. 6), что может быть использовано для ранней диагностики остеопороза, вызываемого эстрогеновой недостаточностью. Активность ММП в сыворотке крови увеличивалась после овариэктомии. Концентрация ММП-2 в сыворотке крови увеличивалась после овариэктомии. Введение РС не влияло на концентрацию ММП-2, но снижало активность ММП в сыворотке крови. Это было вызвано, скорее всего, элиминацией ММП из кровяного русла α2-макроглобулином, активность которого снижалась при введении препарата. Активность α1-АТ оставалась у животных неизмененной, несмотря на различные экспериментальные воздействия.
Таблица 6
Изменение активности катепсина К, ММП, ингибиторов протеаз α2-МГ и α1-АТ и концентрации ММП-2 в сыворотке крови у овариэктомированных самок крыс Wistar (M±m)
| Показатель | Животные | ||
| Интактные | Овариэкто-мированные | Овариэктомиро-ванные+РС, 200 мг/кг | |
| Активность катепсина К, нмоль/мин на 1мл | 0,87±0,18 | 1,25±0,13* | 1,22±0,24 |
| Активность ММП, мкмоль/мин на 1мл | 2,48±0,45 | 4,56±0,33*** | 3,39±0,42*# |
| Концентрация ММП-2 (активная форма +профермент), нг/мл | 92,00±2,75 | 140,00±8,02** | 153,57±4,46* |
| Активность α2-МГ, мкмоль/мин на 1 мл | 4,11±0,23 | 3,87±0,15 | 3,55±0,33* |
| Активность α1-АТ, мкмоль/мин на 1 мл | 32,59±3,24 | 33,10±1,79 | 34,50±2,61 |
Примечание: количество животных в группах от 9 до 10.
*p < 0,05, **p < 0,01, ***p < 0,001 по сравнению c интактными самками крыс Wistar
# p <0,05 по сравннению с овариэктомированными самками, не получавшими РС
Изменения показателей, применяемых для оценки состояния ремоделирования костной ткани, у овариэктомированных крыс Wistar
Несмотря на усиление резорбции костной ткани у овариэктомированных крыс, концентрация кальция у животных всех трех групп была на одном уровне (табл. 7), что свидетельствует о способности организма овариэктомированных животных поддерживать концентрацию кальция в пределах нормы за счет кальций-регулирующих гормонов. Введение РС в дозе 200 мг/кг увеличивало концентрацию фосфора в сыворотке крови, снижая отношение концентрации кальция к концентрации фосфора. Возможно, в этом случае сказывался кальций-замещающий эффект стронция.
Таблица 7
Изменения показателей, у овариэктомированных крыс Wistar
в сыворотке крови, применяемых для оценки состояния ремоделирования костной ткани (М±m)
| Показатель | Животные | ||
| Интактные | Овариэктомиро-ванные | Овариэктомиро-ванные+РС, 200 мг/кг | |
| Концентрация кальция, ммоль/л | 2,33±0,10 | 2,26±0,13 | 2,26±0,12 |
| Концентрация фосфора, ммоль/л | 2,30±0,21 | 1,96±0,10 | 2,32±0,10# |
| Концентрация кальция/ концентрация фосфора | 1,08±0,13 | 1,16±0,05 | 0,97±0,03# |
| Активность щелочной фосфатазы, мкмоль/мин на 1 л | 293,9; Q25175,0: Q75304,7 | 202,2; * Q25161,1: Q75244,6 | 348,9; * # Q25177,9: Q75401,9 |
| Активность тартрат-резистентной кислой фосфатазы, мкмоль/мин на 1л | 10,74; Q259,12: Q7511,82 | 9,21; ** Q255,70: Q7510,95 | 14,28; * # Q2510,98: Q7517,94 |
Примечание. Данные по концентрации кальция и фосфора представлены как M±m, данные по активности ЩФ и ТРКФ – как медиана и 25-й и 75-й квартили. Количество животных в группах от 8 до 10.*p < 0,05, **p < 0,01 по сравнению с интактными самками крыс # p <0,05 по сравннению с овариэктомированными самками, не получавшими РС
Активность ЩФ и ТРКФ в сыворотке крови у животных после овариэктомии снижалась, что говорит о нарушении ремоделирования костной ткани, но судить о том, что при этом преобладает резорбция можно только по увеличению активности катепсина К.
Введение овариэктомированным самкам РС приводило к увеличению активности ЩФ на 13% по сравнению с интактными самками и на 63% по сравнению с овариэктомированными, не получавшими РС. Повышение активности ЩФ в сыворотке крови у овариэктомированных самок, получавших РС, сопровождалось увеличением активности ТРКФ на 20% по сравнению с интактными самками и на 38% по сравнению с овариэктомированными крысами, не получавшими РС. Таким образом, можно заключить, что введение РС увеличивало скорость обновления костной ткани у овариэктомированных крыс, усиливая как формирование, так и резорбцию.
Сравнение развития разных форм остеопороза у крыс
Несмотря на общие черты развития двух исследуемых форм остеопороза, такие, как увеличенная активность катепсина К в костной ткани и сыворотке крови, снижение сывороточной активности щелочной фосфатазы и, в конечном итоге, снижение минеральной плотности скелета, механизмы развития остеопороза у крыс OXYS и овариэктомированных самок крыс Wistar различны.
Полученные данные показали, что развитие остеопороза у крыс OXYS происходит на фоне увеличения протеолитической активности в печени и сыворотке крови. Это, вероятно, связано с накоплением непереваренного материала в лизосомах крыс и как следствие – с увеличением экспрессии протеаз, играющих первостепенную роль в деградации белка – катепсинами L и D. Вместе с тем, чувствительность крыс OXYS к окислительному стрессу и лабилизация мембран лизосом, вероятно, создавали предпосылки не только для усиления протеолитической активности в организме, но и к развитию фиброзоподобных изменений в печени зрелых крыс (Колосова, 2001), что, возможно, вело к ухудшению снабжения костной ткани пластическим материалом, факторами роста. Тем не менее, эти события могли иметь место только при уже развившемся остеопорозе у крыс OXYS, поскольку в молодом возрасте фиброзных изменений у крыс OXYS не обнаружено. Таким образом, нарушения функции печени лишь могут усугублять развитие остеопороза в пожилом возрасте, но не являться его причиной.
Быстрая потеря костной массы у крыс OXYS при активности катепсина К меньшей, чем у самок крыс Wistar после овариэктомии, скорее всего связана со снижением активности и/или количества остеобластов в костной ткани, о чем свидетельствует сниженная активность щелочной фосфатазы. Кроме того, увеличение протеолитической активности в печени, сыворотке, костной ткани у крыс OXYS может приводить к изменению транспорта цитокинов и факторов роста за счет связывания транспортирующего их α2-макроглобулина с протеазами, благодаря чему эти комплексы захватываются клетками печени и подвергаются деградации в лизосомах, не достигая клеток-мишеней в том числе и клеток костной ткани.
Медленное развитие системного остеопороза у самок крыс Wistar после овариэктомии, не смотря на значительную активность катепсина К в костной ткани, может объясняться протекторным эффектом увеличенной за счет содержания жировой ткани массы крыс. Снижение активности щелочной фосфатазы свидетельствует об уменьшении количества и/или активности остеобластов в скелете овариэктомированных самок, но не отражает усиления синтетических процессов, происходящих в физически наиболее нагружаемых отделах скелета – в позвоночнике и бедренной кости. Тем не менее, увеличение минеральной плотности этих отделов скелета регистрируется методом рентгеновской денситометрии.
Таким образом, можно заключить, что катепсин К играет важную роль в развитии остеопороза, но проявления этого заболевания зависит не только от его активности, поскольку обнаружено, что при наличии определенных адаптационных возможностей, манифестация остеопороза может значительно отодвигаться во времени.
