На правах рукописи
| Вид материала | Документы |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
На правах рукописи
ДМИТРИЕВА-ЗДОРОВА ЕЛЕНА ВИКТОРОВНА
ИЗУЧЕНИЕ ГЕНЕТИЧЕСКОЙ ПРЕДРАСПОЛОЖЕННОСТИ К АТОПИЧЕСКОЙ БРОНХИАЛЬНОЙ АСТМЕ С ИСПОЛЬЗОВАНИЕМ ПОЛИМОРФНЫХ МАРКЕРОВ ГЕНОВ-КАНДИДАТОВ
03.01.03 – молекулярная биология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2010
Работа выполнена в лаборатории химической геномики Учреждения Российской академии медицинских наук Научно-исследовательском институте биомедицинской химии имени В.Н. Ореховича РАМН (ИБМХ РАМН).
Научный руководитель:
| | ||||||||
| |
Защита диссертации состоится «___» марта 2010 г. в 14 часов на заседании Диссертационного совета Д.217.013.01 при Государственном научно-исследовательском институте генетики и селекции промышленных микроорганизмов по адресу: 117545, Москва, 1-й Дорожный проезд, 1.
С диссертацией можно ознакомиться в библиотеке ФГУП «ГосНИИ генетика».
Реферат разослан «___» февраля 2010 г.
| Учёный секретарь Диссертационного совета, кандидат химических наук | Т.Л. Воюшина |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Одной из наиболее сложных задач современной генетики является изучение молекулярно-генетических основ многофакторных заболеваний. Важное место среди многофакторных заболеваний бронхолегочной системы человека занимает бронхиальная астма (БА). В некоторых странах БА является главной причиной инвалидности и смертности населения, опережая даже сердечно-сосудистые и онкологические патологии, что характеризует БА как глобальную медико-социальную проблему (Jarvis et al, 1997).
Эпидемиологические исследования последних лет говорят о том, что 4-8% населения страдают БА, в том числе 5-10% детской популяции и 5% взрослой (Чучалин, Баранов, 2006). В России данным заболеванием страдает примерно 10% взрослого и 15% детского населения. В последние десятилетия прогрессивно увеличивается заболеваемость и смертность от БА.
В основе развития БА лежит взаимодействие различных генетических факторов с факторами внешней среды (ссылка скрыта, 2002; ссылка скрыта, 2003). Один из эффективных подходов к изучению роли генетических механизмов развития БА связан с выделением группы генов, продукты которых прямо или косвенно могут быть вовлечены в развитие данной патологии, так называемых генов-кандидатов (Федосеев, 1998). В настоящее время известно более 100 генов-кандидатов БА (ссылка скрыта, 2007; Фрейдин, 2002). Гены предрасположенности к БА условно можно разделить на 5 групп: 1) гены врожденного иммунитета и гены иммунорегуляции; 2) гены, связанные с дифференцировкой клеток Th2 и эффекторными функциями иммунной системы; 3) гены, экспрессирующиеся в клетках эпителия бронхов; 4) гены, ассоциированные с перестройкой (ремоделингом) дыхательных путей и тяжестью заболевания; 5) гены предрасположенности к БА, открытые позиционным клонированием (ссылка скрыта, 2008).
Изучение ассоциации генов-кандидатов с заболеванием проводят с помощью полиморфных маркеров, которые могут располагаться внутри гена или рядом с ним. Исследование ассоциации полиморфных маркеров генов-кандидатов основано на выявлении и сравнении частот встречаемости генотипов и аллелей в группах с наличием и отсутствием заболевания. Если различия в частотах аллелей и генотипов являются статистически достоверными, считают, что данный маркер ассоциирован с развитием заболевания. Установленные предрасполагающие или предохраняющие генетические маркеры в дальнейшем могут быть использованы для прогнозирования заболевания у человека на основе исследования индивидуальных особенностей его генома. Поэтому анализ ассоциации полиморфных маркеров с атопической БА является актуальной задачей современной молекулярной генетики.
Цель и задачи исследования. Цель настоящей работы – оценить уровень ассоциации двенадцати полиморфных маркеров восьми генов-кандидатов БА: интерлейкина-13 (IL13), интерлейкина-5 (IL5), альфа-цепи рецептора интерлейкина-8 (IL8RA), toll-подобного рецептора 4 (TLR4), антигена 4, ассоциированного с цитотоксическими Т-лимфоцитами (CTLA4), G-белка, ассоциированного с астмой (GPRA), эотаксина-3 (CCL26) и регулятора активности нормальной экспрессии и секреции Т-клеток (CCL5) с атопической БА.
Для достижения этой цели были поставлены следующие задачи:
- Сформировать группы больных БА различной степени тяжести, а также группу здорового контроля русского происхождения.
- Определить частоты аллелей и генотипов полиморфных маркеров C(–1055)T и R130Q гена IL13, С(–703)Т гена IL5, M31R и R335C гена IL8RA, Asp299Gly гена TLR4, C(–318)T и A(+49)G гена CTLA4, rs324396 (С/Т) и rs740347 (G/C) гена GPRA, T(+2497)G гена CCL26, A(–403)G гена CCL5 в группе больных атопической бронхиальной астмой и в группе здоровых индивидов.
- Провести сравнительный анализ распределения аллелей и генотипов выбранных полиморфных маркеров в группах больных и здоровых индивидов для выявления их ассоциации с развитием БА и тяжестью течения БА.
- Провести анализ ассоциации гаплотипов генов IL13, IL8RA, CTLA4, GPRA с БА и тяжестью течения БА.
Научная новизна работы. В данной работе впервые изучена ассоциация полиморфных маркеров генов IL13, IL5, IL8RA, TLR4, CTLA4, GPRA, CCL26, CCL5 с атопической БА и тяжестью ее течения среди русского населения г. Москвы.
Вышеизложенные результаты были получены впервые.
Практическая ценность работы. Результаты молекулярно-генетического анализа полиморфных участков генов-кандидатов атопической БА могут использоваться для медико-генетического консультирования с целью раннего выявления пациентов с повышенным риском развития заболевания, проведения донозологической профилактики и прогнозирования течения болезни.
Апробация работы. Результаты настоящей работы докладывались на IV съезде Российского общества биохимиков и молекулярных биологов (Новосибирск, 2008 г.), на II Всемирном форуме по астме и респираторной аллергии (Санкт-Петербург, 2009 г.), на конференции «The 6th Annual Cytokines & Inflammation Conference» (Орландо, 2008 г.), на 4-й интернациональной конференции «Genomics, Proteomics, Bioinformatics and Nanobiotechnologies for Medicine» (Москва, 2008 г.), на конгрессе «The World Asthma Meeting (WAM’2007)» (Стамбул, 2007 г.) и на ежегодном конгрессе Европейского респираторного общества (Стокгольм, 2007 г.; Берлин, 2008 г.; Вена, 2009 г.). Основные положения диссертационной работы доложены и обсуждены на заседании межлабораторного семинара ИБМХ РАМН от 17 ноября 2009 г. и секции «Молекулярная биология» Ученого Совета ФГУП «ГосНИИ генетика» от 9 декабря 2009 г.
Публикации. По теме диссертации опубликовано 12 печатных работ, включая 2 статьи и материалы международных конференций.
Структура диссертации. Диссертация состоит из следующих разделов: введение, обзор литературы, описание использованных материалов и методов, результаты и обсуждение, выводы и список литературы. Материалы диссертации изложены на ___ страницах машинописного текста и содержат __ таблиц и __ рисунков.
СОДЕРЖАНИЕ РАБОТЫ
- Материалы и методы.
В исследовании были использованы образцы ДНК 283 больных атопической БА и 227 здоровых индивидов русского происхождения. Общая характеристика групп представлена в таблице 1. Образцы ДНК и клинические данные больных атопической БА были предоставлены лабораторией аллергодиагностики НИИ вакцин и сывороток им. И.И. Мечникова РАМН. В контрольную группу были включены здоровые индивиды без клинически диагностированной БА, аллергических и бронхолегочных заболеваний. Образцы ДНК здоровых людей были предоставлены лабораторией молекулярно-генетической диагностики НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН. Выборки были этнически однородны и составлены из русских (на основании паспортных данных), проживающих в г. Москве. Для выявления ассоциации генетических маркеров с тяжестью течения заболевания больные атопической БА были разделены на две подгруппы согласно критериям GINA: больные с астмой легкой степени тяжести (n=139) и больные со средним и тяжелым течением заболевания (n=152) (Табл. 1).
Анализ нуклеотидных последовательностей интересующих нас хромосомных областей осуществляли с помощью системы NCBI в сети Интернет (www.ncbi.nlm.nih.gov), с использованием следующих разделов: MapView (расположение полиморфных маркеров на хромосоме), dbSNP (информация об однонуклеотидных полиморфных маркерах). Для подбора праймеров и специфических зондов использовали программу Primer Premier 5.0.
Идентификация генотипов полиморфных маркеров проводилась c использованием времяпролетной масс-спектрометрии с лазерно-десорбционной ионизацией образца в матрице (MALDI-TOF). Метод состоит из следующих стадий:
1) пробоподготовка, включающая в себя амплификацию участка ДНК, содержащего исследуемую нуклеотидную замену, и последующую реакцию удлинения праймера (минисиквенс); 2) разделение фрагментов ДНК (праймеров с присоединенным на 3’-конце нуклеотидом, соответствующим аллелю искомого полиморфного маркера) по массе с помощью масс-спектрометрии MALDI-TOF.
Таблица 1.
Общая характеристика обследованных групп с наличием (БА+) и отсутствием (БА–) атопической БА.
| | «БА+» (n=283) | «БА–» (n=227) | |
| БА легкой степени тяжести (n=131) | БА средней и тяжелой степени тяжести (n=152) | ||
| Пол, м/ж | 71/60 | 65/87 | 103/124 |
| Возраст, лет | 34,4 ± 13,4 | 41,8 ± 16,2 | 38,5 ± 10,4 |
| Длительность заболевания, лет | 11,9 ± 8,6 | 13,1 ± 8,4 | - |
| Возраст начала заболевания, лет | 15,4 7,6 | - | |
| Общий IgE, кЕ/л | 230 (65; 620) | 45 (23; 89) | |
Данные по возрасту и длительности БА представлены в формате M ± SD, где M – среднее, SD – стандартное отклонение. Данные по концентрации IgE – в формате Me (25%; 75%), где Me – медиана, 25-75% – интерквартильный интервал.
Для сравнения частот аллелей и генотипов исследуемых полиморфных маркеров в группах с наличием и отсутствием БА, а также в группах больных различной степени тяжести БА, нами использовался точный двусторонний критерий Фишера. Достоверными считали различия при p<0,05. Распределения аллелей и генотипов всех маркеров проверяли на соответствие закону Харди-Вайнберга. Относительный риск развития заболевания оценивали с помощью показателя соотношения шансов (odds ratio, OR). Значение ОR и 95% доверительный интервал (confidence interval, CI) вычисляли с помощью программы Calculator for confidence intervals of odds ratio (on.net/ConfidOR.htm). OR=1 рассматривали как отсутствие ассоциации; OR>1 – как положительную ассоциацию ("предрасположенность"), OR<1 – как отрицательную ассоциацию аллеля или генотипа с заболеванием.
Анализ гаплотипов проводился с использованием программы Hapstat 3.0 (University of North Carolina, USA).
- Результаты и обсуждение.
- Исследование ассоциации полиморфных маркеров C(–1055)T и R130Q гена IL13 с атопической БА.
- Исследование ассоциации полиморфных маркеров C(–1055)T и R130Q гена IL13 с атопической БА.
Интерлейкин-13 (ИЛ-13) является одним из основных по значимости цитокинов в патогенезе атопической БА. ИЛ-13 – мощный индуктор эозинофильного, макрофагального и лимфоцитарного ответа, связанного с развитием фиброза дыхательных путей, активацией слизепродуцирующих клеток и повышенной бронхореактивностью (Zhu et al, 1999). Воспалительный ответ реализуется через способность ИЛ-13 стимулировать выработку хемокинов и протеолитических ферментов, таких как металлопротеиназы матрикса. Установлено также, что развитие фиброзных изменений в ткани бронхов – результат активации интерлейкином-13 фиброгенного цитокина TGF-β1 через MMP-9 и плазмин-зависимый путь (Lee et al, 2001). Таким образом, ИЛ-13 является конечной точкой приложения Тh2-опосредованных воспалительных эффектов.
Ген IL13 локализован на хромосоме 5q31.1. Последовательность гена содержит ряд однонуклеотидных замен (Рис. 1), часть из которых ассоциирована с развитием БА и атопией. Наибольшее внимание исследователей в настоящее время привлекают два маркера в данном гене: C(–1055)T в промоторной области гена и R130Q в кодирующей области.
Полиморфный маркер C(–1055)T гена IL13 представляет собой однонуклеотидную замену C → T в положении –1055 промоторной области гена (Рис. 1). Функциональное действие данного маркера может быть объяснено тем, что замена расположена непосредственно перед сайтом связывания Т-клеточного транскрипционного фактора NFAT, который регулирует экспрессию генов IL13 и IL4. Ранее было показано, что наличие тимина в положении –1055 приводит к более активному связыванию NFAT с промотором и, таким образом, данный маркер может влиять на экспрессию гена IL13 (van der Pouw Kraan et al, 1999).
Полиморфный маркер R130Q гена IL13 представляет собой однонуклеотидную замену G → A в положении +2043 в экзоне 4, приводящую к аминокислотной замене положительно заряженного аргинина на нейтральный глутамин в положении 130 α-спирали D-домена интерлейкина-13. Это участок, посредством которого происходит взаимодействие ИЛ-13 с рецептором. В последних исследованиях было показано, что замена аргинина на глутамин в положении +2043 не изменяет константу связывания ИЛ-13 с рецептором и не влияет на стабильность этого комплекса. В то же время, данная замена сопровождается повышенным уровнем экспрессии ИЛ-13 (Arima et al, 2002).
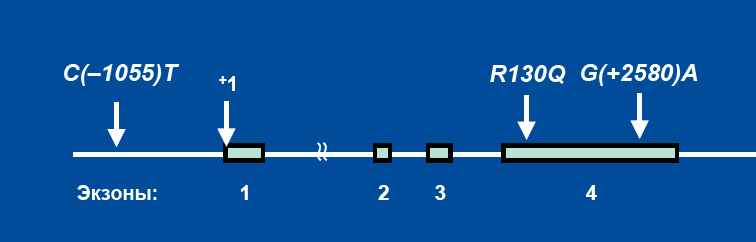
Рис. 1. Полиморфные маркеры гена IL13.
При исследовании распределения частот аллелей и генотипов полиморфного маркера C(–1055)T в группе больных атопической БА и группе здорового контроля отмечено преобладание аллеля С и генотипа СС (Табл. 2). Минорный аллель Т встречался в обеих группах примерно с одинаковой частотой – 27-28%, что согласуется с частотами данного аллеля в европейских популяциях – 20-33% (Дания, Нидерланды, Германия) (Graves et al, 2000). В группе больных БА наблюдалось увеличение частоты аллеля С и генотипа СС с одновременным снижением доли аллеля Т и генотипов СT и TT по сравнению с контрольной группой. Такие различия не являются статистически достоверными, что свидетельствует об отсутствии ассоциации данного маркера с развитием атопической БА.
Таблица 2.
Распределение частот аллелей и генотипов полиморфных маркеров C(–1055)T и R130Q гена IL13 в группах с наличием (БА+) и отсутствием (БА–) атопической БА.
| Аллели и генотипы | Частота аллелей и генотипов | p | |
| «БА+» | «БА–» | ||
| C(–1055)T | |||
| Аллель С | 0,731 | 0,722 | > 0,05 |
| Аллель Т | 0,269 | 0,278 | |
| Генотип СС | 0,526 | 0,515 | > 0,05 |
| Генотип СT | 0,410 | 0,414 | > 0,05 |
| Генотип TT | 0,064 | 0,071 | > 0,05 |
| R130Q | |||
| Аллель Arg | 0,714 | 0,738 | > 0,05 |
| Аллель Gln | 0,286 | 0,262 | |
| Генотип Arg/Arg | 0,509 | 0,551 | > 0,05 |
| Генотип Arg/Gln | 0,410 | 0,374 | > 0,05 |
| Генотип Gln/Gln | 0,081 | 0,075 | > 0,05 |
Таблица 3.
Распределение аллелей и генотипов полиморфного маркера C(–1055)T гена IL13 у больных с атопической БА разной степени тяжести.
| Аллели и генотипы | Частота аллелей и генотипов | p | OR и 95% CI | |
| БА легкой степени тяжести | БА средней и тяжелой степени тяжести | |||
| Аллель С | 0,763 | 0,704 | > 0,05 | - |
| Аллель Т | 0,237 | 0,296 | ||
| Генотип СС | 0,611 | 0,461 | 0,025 | 0,54 [0,34–0,87] |
| Генотип СT | 0,305 | 0,487 | 0,001 | 2,16 [1,44–3,98] |
| Генотип TT | 0,084 | 0,052 | > 0,05 | - |
