Тема: Обобщение темы «Алканы»
| Вид материала | Самостоятельная работа |
- Вводный курс лекций москва Российский университет дружбы народов 2006 Коллектив, 2202.03kb.
- Урок (русский язык-чтение). Тема: Обобщение знаний учащихся об именах прилагательных., 94.32kb.
- Учебное пособие Волгоград 2005 удк 93: 008: (470+571) (07) ббк 63 (2), 2780.67kb.
- Учебно-методическое пособие. Волгоград 2004 удк 93: 008: (470+571) (07) ббк 63 (2), 1545.82kb.
- Вейснер Марии Павловны ( вторая квалификационная категория) Тема «Части речи. Обобщение»., 86.22kb.
- Программа 6-го коллоквиума по Органической химии Алифатические нитросоединения, 82.33kb.
- 7), Волгин О. С. (Темы 11, 12, 15, 18), Орехов А. М. (Темы 13, 16), Рудановская, 2968.24kb.
- Экономическая, 443.52kb.
- Методические указания по выполнению курсовых работ для студентов экономических специальностей, 1425.34kb.
- Обобщение, 295.45kb.
Гомологи – соединения, обладающие сходными химическими свойствами и отличающиеся друг от друга по составу на целое число групп СН2. Совокупность всех гомологов образует гомологический ряд.
Упражнение : гомологами являются :
А) С2Н6 и С2Н4 Б) С3Н8 и С5Н12 В) С4Н8 и С7Н16 Г) СН4 и С6Н10
ответ: Б)
А.М.Бутлеров первым открыл явление изомерии. Изомеры – вещества, имеющие одинаковый состав (одинаковую молекулярную формулу), но разное строение
Для алканов характерна изомерия углеродного скелета (начиная с С4Н10) и оптическая изомерия (начиная с С7Н16)- существует у молекул, зеркальные отображения которых не совместимы друг с другом.
Число структурных изомеров алканов
| Молекулярная формула | СН4 МЕТАН | С2Н6 ЭТАН | С3Н8 ПРОПАН | С4Н10 БУТАН | С5Н12 ПЕНТАН | С6Н14 ГЕКСАН |
| Число изомеров | 1 | 1 | 1 | 2 | 3 | 5 |
| Молекулярная формула | С7Н16 ГЕПТАН | С8Н18 ОКТАН | С9Н20 НОНАН | С15Н32 пентадекан | С30Н62 триаконтан | |
| Число изомеров | 9 | 18 | 35 | 4347 | 4111846673 | |
| Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называется нормальным бутаном (н-бутан), а бутан, цепь атомов углерода которого разветвлена, называется изобутаном: 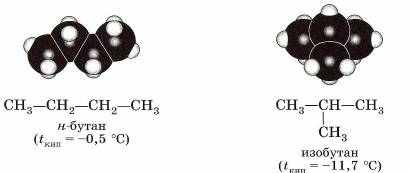 | ||||||
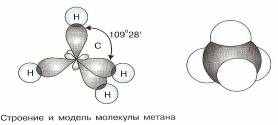
Строение алканов. Атом углерода в невозбужденном состоянии:
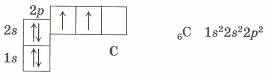 |
в алканах атом углерода находится в возбужденном состоянии:
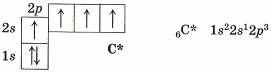 |
При этом происходит гибридизация (перемешивание) электронных облаков –одного s-облака и трех p-облаков (sp3-гибридизация):
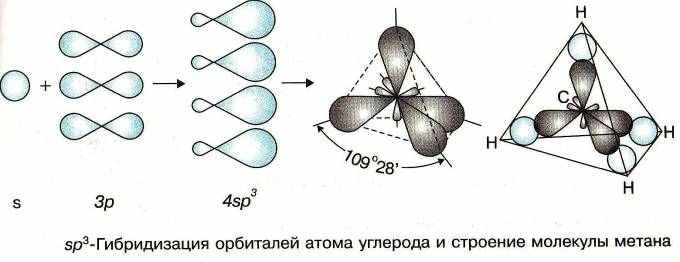 |
Все связи С-С и С-Н – –связи,
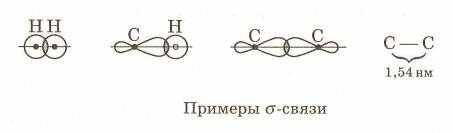 |
Молекулы алканов имеют пространственное тетраэдрическое строение, углы между связями 109,280, поэтому атомы углерода соединяются между собой зигзагообразно:
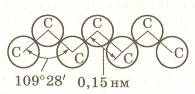
Конформация (поворотные изомеры)- различные геометрические формы молекул, переходящие друг в друга путем вращения вокруг С-С связей. При обычных температурах конформации легко переходят друг в друга.
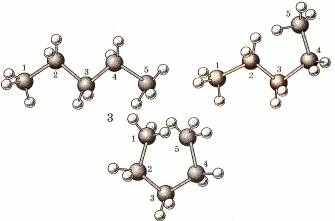 | Конформации молекул пентана. | | | | |
Физические свойства алканов: при обычных условиях С1-С4 - газы; С5 – С17 – жидкости; начиная с С18 – твердые вещества. Практически нерастворимы в воде, хорошо растворимы в неполярных растворителях (бензоле).
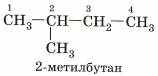
Номенклатура алканов .
Нумеруют атомы углерода, начиная с того конца, к которому ближе заместитель. В названии указывают номер углерода с заместителем, название радикала-заместителя, затем пронумерованную цепочку атомов углерода:
 | 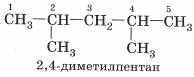 |
Упражнения:
1. Сколько веществ изображено на рисунке:
а)одно б) два в) три г) четыре
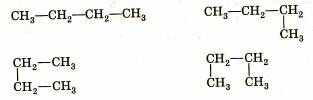 |
| Ответ : одно- это бутан |
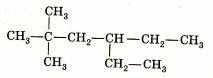 | 2. Это вещество называется: 1). 2,2,4 триметилгексан 2). 2-диметил-4 этилгексан 3). 5,5- диметил-3-этилгексан 4). 2,2-диметил-4этилгексан Ответ : 4 | |
Химические свойства алканов.
Алканы (предельные углеводороды) при обычных условиях химически инертны, поскольку для начала реакции с их участием нужно разорвать весьма прочные связи С-С или С-Н. За низкую реакционную способность их называют парафинами- «лишенными сродства». Связи С-С и С-Н -ковалентные, одинарные (),достаточно прочные, имеют низкую поляризуемость. Поэтому алканы не реагируют при обычных условиях с такими активными веществами, как серная и азотная кислота, металлический натрий, перманганат калия. Важно помнить, что бромную воду и раствор перманганата калия алканы не обесцвечивают. Реакции присоединения для алканов невозможны, так как все их валентности насыщены.
(За такие свойства алканов химик Коновалов назвал их «химическими мертвецами»).
Для этих веществ характерны, в основном, реакции радикального замещения атомов водорода на другие атомы или группы атомов, протекающие в довольно жестких условиях – при УФ-освещении или сильном нагревании.
При высоких температурах могут протекать реакции с разрывом связей С-С, а также дегидрирование и ароматизация. Наконец, как и большинство органических веществ, алканы могут вступать в реакции горения и каталитического окисления.
Характеристика химических свойств алканов:
1. Галогенирование – замещение водорода на галоген.
Хлорирование протекает под действием солнечного света, УФ-излучения или сильного нагревания (до 300-5000С);
CH4 + Cl2 УФ,свет,t CH3Cl + HCl (хлорметан)
CH3 Cl + Cl2 УФ,свет,t CH2Cl 2 + HCl (дихлорметан)
CH2 Cl2 + Cl2 УФ,свет,t CHCl 3 + HCl (трихлорметан- хлороформ)
CH Cl3 + Cl2 УФ,свет,t CCl 4 + HCl (тетрахлорметан)
Эта реакция протекает по цепному радикальному механизму (изучил Н.Н.Семенов).
Бромирование протекает аналогично, но с меньшей скоростью .
Реакции с фтором и йодом на практике не проводят: фтор действует слишком энергично, разрушая молекулу, йодирование же, наоборот, протекает слишком медленно и с очень низкими выходами.
2. Нитрование (реакция Коновалова):
Происходит при их нагревании с разбавленной азотной кислотой:
CH4 + HNO3 (разбавл) t =140 CH3-NO2 + H2O
3. Изомеризация:
CH3-CH2- CH2 CH3 AlCl3 ,t CH3-CH-CH3
CH3
4. Крекинг – расщепление С –С связей при температуре выше 4000С, при этом образуется смесь алканов и алкенов с меньшим числом углеродных атомов:
C8H18 t,kat C4H8 + C4 H10 2CH4 t,kat C2H2 + 3H2
5. Дегидрирование – отщепление водорода, происходит на катализаторах Pd, Pt, Ni, Cr2O3 при температуре от 300 до 6000С.
C6H14 Cr2O3, t C6H12 + H2
6. Риформинг –ароматизация
C6H14 Cr2O3, t C6H6 + 4 H2 C7H16 Cr2O3, t C6H5-CH3 + 4 H2
Бензол толуол
7. Горение
Алканы горят на воздухе с образованием углекислого газа и воды с выделением тепла (что привлекает алканы в качестве энергоносителей, однако они взрывоопасны и требуется соблюдать осторожность при пользовании бытовым газом):
CH4 + 2O2 CO2 + 2H2O + 882 кДж
CnH2n + 2 + (3n + 1)/2 O2 n CO2 + (n + 1) H2O + Q
8 Конверсия метана:
CH4 + H2O kat, t CO + 3H2
9. Окисление алканов:
2CH4 + O2 kat, t 2 CH3OH; CH4 + O2 kat, t CH2O ;
2CH4 + 3O2 kat, t 2HCOOH +2H2O
2 C4H10 + 5 O2 kat, t 4 CH3COOH + 2 H2O
Получение алканов
1. Природное сырье (нефть, газ, горный воск)
2. Реакция Фишера- Тропша (пром.) : -получение из синтез-газа.
n CO + (2n+1) H2 kat,t n H2O + CnH2n+2
3. Гидрирование непредельных углеводородов – присоединение H2
CH2 = CH2 + H2 Ni,t CH3 – CH3
4. Реакция Вюрца – позволяет получать углеводороды с удвоенным числом атомов углерода по сравнению с исходным соединением:
2 CH3 –Cl + 2 Na CH3-CH3 + 2 NaCl
5. Реакция Дюма – декарбоксилирование солей карбоновых кислот ( в молекуле образующегося алкана остается на один атом углерода меньше, чем в молекуле исходной соли):
CH3-CH2-COONa (твердый) + NaOH (твердый))сплавление CH3-CH3 + Na2CO3
6. Реакция Кольбе – электролиз растворов солей карбоновых кислот (продуктами реакции являются симметричные углеводороды):
2 CH3-COONa + H2O электролиз CH3- CH3 + 2 NaOH + H2
7. Синтез метана из простых веществ:
C + 2H2 kat,t,p CH4
8. Гидролиз карбида алюминия:
Al4C3 + 12H2O 3CH4 + 4Al (OH)3
Между алканами и другими классами существует генетическая связь, которая позволяет осуществлять различные синтезы.
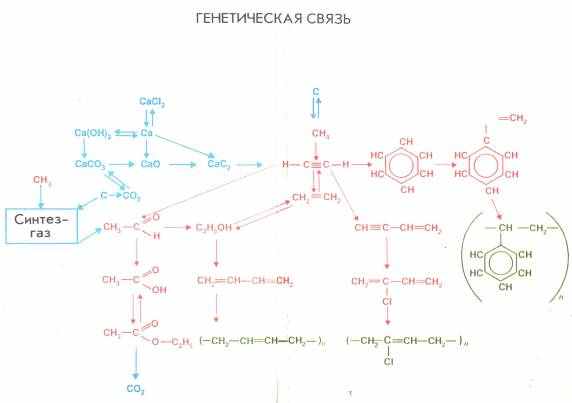 |
Применение алканов:
 | 1. Из алканов получают водород, сажу(резина и типографские краски), непредельные и кислородсодержащие соединения; 2.Используют в качестве топлива: бытового, промышленного, двигателей внутреннего сгорания и дизельных; 3. Вазелин –смесь твердых и жидких алканов –используют в парфюмерии, медицине и технике; 4. Парафин – смесь твердых алканов - используют для изготовления спичек, свечей, водоотталкивающих покрытий; 5.Растворители, хладоагенты, средства тушения пожаров. |
Применение алканов и их соединений сопровождается экологическими последствиями:
- Выбросы в атмосферу парниковых газов (метан, углекислый газ) усиливают парниковый эффект;
- Попадание в атмосферу фреонов (дихлордифторметана) разрушает озоновый слой;
- Горение резины сопровождается образованием диоксинов, которые накапливаясь в атмосфере, негативно воздействуют на здоровье человека;
- Применение бензина с тетраэтилсвинцом вызывает свинцовое загрязнение почвы и растительности;
- Алканы- взрывоопасные, горючие вещества, неосторожное обращение с которыми приводит к экологическим катастрофам.
Выводы :
- Несмотря на химическую инертность алканов, химики научились получать из них широкий спектр практически важных веществ;
- Применение алканов и их соединений требует внимания к технике безопасности и грамотного экологического прогноза.
3.Обучающие задачи:
1. Даны вещества:
а) CH3 CH3 б) H3C – CH2 CH2 – CH3
H3C – CH –CH – CH3 H3C –CH - CH - CH3
в) H3 C – CH – CH – CH3 г) CH2 - CH2 - CH - CH - CH3
H3C- CH CH2 – CH3 CH3 CH3-CH2 CH2 – CH3
CH3
Назовите каждое из веществ в соответствии с правилами номенклатуры ИЮПАК.
а) CH3 CH3
2,3- диметилбутан
H3C – CH –CH – CH3
б) H3C – CH2 CH2 – CH3
запишем иначе: CH3- CH2- CH- CH- CH2-CH3
H3C –CH - CH - CH3
CH3 CH3
3,4-диметилгексан
в) H3 C – CH – CH – CH3 CH3 - CH - CH - CH - СH2- CH3
H3C- CH CH2 – CH3 CH3 CH3 CH3 2,3,4 –триметилгексан
CH3
г) CH2 - CH2 - CH - CH - CH3 CH3 – CH2 – CH2 – CH – CH -CH 2-CH3
CH3 CH3-CH2 CH2 – CH3 CH3-CH2 CH3
3-метил 4-этилгептан
2. Даны вещества
А) 2,3,4- триметилпентан;
Б) 2,4 –диметил-3-этилпентан;
В) 2,2,4,4 – тетраметилгексан;
Г) 2-бром-3-метилпентан;
Д) 3,4-диэтил-2,5-дихлоргексан;
Е) 3-нитро-3этилпентан.
Напишите структурные формулы этих веществ.
2. «скелеты формул»
| А) С- С - С - С - С СH3 CH3 CH3 Б) С- С - С - С - С СH3 CH2 CH3 CH3 B) CH3 CH3 С- С - С - С – С- C СH3 CH3 | Г) С- С - С - С - С Br CH3 Д) С- С - С - С - С - C Cl C2H5 C2H5 Cl Е) NO2 С- С - С - С - С С2 H5 |
3.Алкан состава С7Н16 имеет девять изомеров (включая нормальный гептан). Напишите структурные формулы этих веществ и дайте им названия.
3. «Скелеты формул» и названия
| 1) C-C-C-C-C-C-C н-гептан 2) C-C-C-C-C-C 2-метилгексан СH3 3) C-C-C-C-C-C 3-метил гексан С H3 CH3 4) C-C-C-C-C 2,2-диметилпентан CH3 CH3 5) C-C-C-C-C 3,3-диметилпентан CH3 | 6) C- C- C-C-C 2,3-диметилпентан CH3 CH3 7) C-C- C- C-C 2,4-диметилпентан CH3 CH3 8) C-C-C-C-C 2-этилпентан C2H5 9) C-C-C-C-C 3-этилпентан C2H5 |
4.Напишите уравнения следующих реакций, указывая условия их протекания:
а) нитрования 2- метилбутана;
NO2
CH3-CH-CH2-CH3 + HNO3(разбавл) t=140 CH3 –C –CH2 - CH3 + H2O
CH3 CH3 2-нитро-2-метилбутан
(При нитровании гомологов метана, также как и при бромировании, в первую очередь замещается атом водорода у третичного атома углерода, затем- у вторичного, и в последнюю очередь – у первичного).
б) ароматизации гексана;
CH3-CH2 – CH2 – CH2 –CH2 - CH.3 kat,t C6H6 + 4H2
в)изомеризации пентана (в этой реакции образуется одновременно два изомера. При написании уравнения реакции достаточно в качестве продукта привести один из них)
CH3-CH2 – CH2 – CH2 – CH.3 kat AlCl 3,t CH3 –CH–CH2- CH3
CH3
5.Напишите уравнения реакций бромирования и хлорирования 2,3-диметилбутана. Сколько разных монохлорзамещенных продуктов образуется при хлорировании этого вещества?
CH3- CH – CH – CH3 +Br2 УФ . CH3- CBr– CH – CH3 + HBr
CH3 CH3 CH3 CH3 2-бром - 2,3 –диметил-бутан
(При бромировании происходит замещение атома водорода у третичного атома углерода)
CH3- CH – CH – CH3 +Сl2 УФ 1). CH2Cl- CH– CH – CH3 + HCl
CH3 CH3 CH3 CH3 2,3-диметил- 1 -хлорбутан
2) CH3- CСl– CH – CH3 + HCl
CH3 CH3 2,3 – диметил-2-хлорбутан
Радикал хлор, будучи более активным, чем радикал бром, практически «не чувствует » разницы и прочности связей, поэтому почти с равной вероятностью замещает любой атом водорода. В данном случае получается два монохлорпроизводных вещества, больше всего- 2,3 –диметил-2-хлорбутан
6. Напишите уравнения реакций, позволяющих с помощью реакции Вюрца получить:
а) октан;
2 C4H9Cl + 2 Na C8H18 + 2NaCl
б) 2,5 –диметилгексан.
2 CH3 – CH – CH2Cl + 2Na CH3 – CH – CH2 - CH2 – CH – CH3 + 2NaCl
CH3 CH3 CH3
7. Напишите структурные формулы всех алканов, образующихся при действии металлического натрия на смесь йодэтана и 2-йодпропана.
C2H5J + CH3 - CHJ – CH3 + 2Na 1) CH3 – CH2 – CH2 – CH3 бутан
2) CH3 – CH2 –CH3 пропан
3) CH3 – CH2 – CH2 – CH2 –CH3 пентан
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Карбид алюминия метан бромметан этаннитроэтан
Al4C3 CH4 CH3Br C2H6 C2H5NO2
1) Al4C3 + 12H2O 4 Al(OH)3 + 3 CH4
2) CH4 + Br2 свет CH3Br + HBr
3) 2 CH3 Br + 2Na CH3-CH3 + 2 NaBr
4) C2H6 + HNO3 (разбавл) t=140 C2H5NO2 + H2O
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Бутан изобутан2-бром-2-метилпропан
1) CH3-CH2-CH2-CH3 AlCl3,t CH3 –C H– CH3
CH3
2) CH3 –CH– CH3 + Br2 t CH3 –CBr – CH3 + HBr
CH3 CH3
10.Напишите уравнения реакций, с помощью которых можно получить 2,3-диметилбутан из пропана в две стадии
1) CH3 –CH2 – CH3 + Br2 t CH3-CH- Br + HBr
CH3
2) 2CH3-CH- Br + 2Na CH3-CH - CH -CH3 + 2Na Cl
CH3 CH3 CH3
11.Алкан, выделившийся на аноде при электролизе водного раствора пропионата натрия ( СН3СН2СOONa) , пропустили над платиновым катализатором при температуре 3000С. Какие продукты могли образоваться в результате? Напишите уравнения возможных реакций.
2CH3CH2COONa + 2H2O электролиз
CH3 –CH2- CH2-CH3 + 2CO2 + H2+ 2NaOH
В ходе электролиза на аноде анионы CH3 CH2 COO- окисляются до радикалов CH3CH2COO, которые распадаются с образованием радикалов CH3CH2 и углекислого газа CO2. Радикалы CH3CH2 соединяются попарно и образуется молекула бутана.
CH3 –CH2- CH2-CH3 Pt,t=300 1) CH2 = CH-CH2-CH3
В зависимости от условий 2) C 4H8
может получиться алкен, 3) CH2 = CH-CH =CH2
циклоалкан или алкадиен
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3CH2COONa NaOH,tX1 CH3CH2Clбутан AlCl3,t X2HNO3(разбавл), tX3
CH3CH2COONa NaOH,t CH3-CH3 + Na2CO3 X1- CH3 –CH3
Происходит декарбоксилирование , т.е. отщепление группы COONa от молекулы соли. В молекуле образующегося алкана остается на один атом углерода меньше, чем в молекуле исходной соли
CH3 –CH3 + Cl2свет CH3 –CH2Сl + HCl
2CH3 –CH2Сl + 2Na CH3 –CH2- CH2-CH3
CH3 –CH2- CH2-CH3 AlCl3,t CH3 –CH– CH3
X2 - 2-метилпропан
CH3
CH3 –CH– CH3 NO2
+ HNO3 t=140
CH3 CH3-C-CH3
CH3 X3 – 2-нитро-2-метилпропан
