На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
| Морфологическая характеристика гастродуоденальной слизистой оболочки у больных язвенной болезнью с признаками СТД. Антральная слизистая оболочка. Легкие и умеренные дистрофические явления в антральной слизистой оболочке обнаружены в 18,9% и 7,8% случаев. В тоже время частота и выраженность атрофии антральной слизистой оболочки достоверно различались (2=6,5; p<0,04). Так, выявлена тенденция к увеличению частоты атрофических изменений легкой степени у больных 2-й группы (29,1%) в сравнении с контролем (10%, p=0,06) без достоверных различий с 1-й группой (17,3%; p>0,2). Умеренная атрофия слизистой оболочки была обнаружена в 12,9% и 6,9% у больных 1-й и 2-й групп, соответственно, в сравнении с 3,3% в группе контроля (p>0,4). Кроме того, связь атрофии антральной слизистой оболочки с нарастанием выраженности признаков СТД была подтверждена корреляционным анализом (R=0,26; p=0,01). Среди больных язвенной болезнью с различными диспластическими фенотипами максимальное соответствие с наличием атрофических изменений (φ2=0,16; φ=0,4; χ2=22,2; p<0,04) было выявлено у больных с первичным ПМК (44,4%; φ=0,36), марфаноподобной (100%; φ=0,56) внешностью и неклассифицированным (42,9%; φ=0,36) фенотипом. Гиперплазию поверхностно-ямочного эпителия (фовеолярную гиперплазию) наблюдали весьма часто. Так, отмечена достаточно высокая ее частота в антральной слизистой оболочке у больных 2-й группы (38,7%; точный критерий Фишера, p<0,05) и в 1-й группе (32,1%; p>0,15) в сравнении с контролем (16,1%). Фовеолярная гиперплазия (в целом 29% случаев) была связана с фенотипической выраженностью СТД (τ=0,2; p=0,007, n=90). Среди пациентов с различными диспластическими фенотипами наибольшая частота фовеолярной гиперплазии была выявлена у больных с первичным ПМК (55,5%; φ=0,53; p<0,1) и гипермобильным фенотипом (46,2% ; φ=0,42; p<0,1). У больных контрольной группы фовеолярную гиперплазию наблюдали лишь в 16,6% случаев (φ=0,45; p<0,1), а при неклассифицированном фенотипе она вообще не обнаружена. Признаки хронического антрального гастрита в целом имели место у 100% больных язвенной болезнью преимущественно с умеренной лимфоплазмоцитарной инфильтрацией (51%). Субгрупповой анализ показал, что в контрольной и 1-й группе превалировала умеренная (60% и 42%) и выраженная (33,3% и 34,5% соответственно) мононуклеарная инфильтрация. Но у больных 2 группы наблюдали преимущественно слабую и умеренную лимфоплазмоцитарную инфильтрациею стромы (29% и 51,6% соответственно). Однако при оценке выраженности хронического воспаления среди пациентов этих трех групп достоверных различий не выявлено (критерий Краскела-Уоллиса, p<0,1). Тем не менее, при анализе связи мононуклеарной инфильтрации с выраженностью внешних проявлений СТД была получена слабая отрицательная корреляционная связь (R=-0,21; p<0,05). Кроме того, после объединения умеренной и выраженной степени лимфоплазмоцитарной инфильтрации в одну категорию выраженности признака было обнаружено, что ее частота достоверно выше в контрольной группе в сравнении со 2 группой (2=5,4; p<0,02). При сравнении выраженности мононуклеарной инфильтрации у больных с дуоденальными язвами 2-й (n=31) и 1-й (n=29) групп с различными диспластическими фенотипами, а также в контроле (n=30) достоверных различий не выявлено (p<0,27). Так, выраженность лимфоплазмоцитарной инфильтрации слизистой антрального отдела разнонаправлено изменялась, в частности уменьшалась у больных с первичным ПМК, неклассифицированным и марфаноподобным фенотипом, тогда как при изолированном ПМК, гипермобильном фенотипе и в контрольной группе содержание мононуклеаров увеличивалось (p<0,3). Однако инфильтрация лимфоцитами антральной слизистой оболочки, оцененная по 3-балльной шкале, была достоверно (p<0,05) менее выраженной у больных с первичным ПМК (1,7±0,17), неклассифицированным (1,8±0,28) и марфаноподобным фенотипами (1,5±0,5) в сравнении с контролем (2,3±0,1) и пациентами с изолированным ПМК (2,4±0,26) и гипермобильным фенотипом (2,2±0,2). Сопутствующий активный антральный гастрит был выявлен в 87-96% случаев, без различий от выраженности СТД. Инфильтрацию нейтрофильными гранулоцитами наблюдали с равной частотой во 2-й и контрольной группах больных с дуоденальными язвами (87,1% и 83,3% соответственно), с максимальной частотой в 1-й группе (96,5%). Преобладала умеренная (44,4%) и легкая (29%) степень инфильтрации, тогда как выраженную инфильтрацию, включая межэпителиальные нейтрофилы, наблюдали в 11-20% случаев без достоверных различий в группах (p<0,7). При наличии выраженной нейтрофильной инфильтрации также наблюдали лейкопедез и микроабсцессы. Вместе с тем, среди диспластических фенотипов отмечалось достоверное уменьшение активности воспаления в слизистой антрального отдела (p<0,03) у больных, имеющих первичный ПМК (φ=0,46) и, наоборот, нарастание нейтрофильной инфильтрации у пациентов с изолированным ПМК (φ=0,44) и в группе контроля (φ=0,35). При статистическом анализе было выявлено достоверное различие в частоте лимфоидных фолликулов (критерий Краскела-Уоллиса H=9,6; p=0,008). Частота более или менее крупных очагов скопления лимфоидных клеток была подобна в контрольной и 2-й группе (43% и 32,3% соответственно) с достоверным увеличением в 1-й группе – 69% случаев (точный критерий Фишера p<0,04 и р<0,005 соответственно). Среди диспластических фенотипов, лимфоидно-клеточные скопления достоверно чаще встречались у больных с изолированным ПМК (87%; φ=0,76; p<0,05). Наиболее низкая активизация лимфоидной ткани отмечалась у больных, имеющих первичный ПМК (22%; φ=0,43) и гипермобильный фенотип (23%; φ=0,5; p<0,05). Почти в половине случаев течение язвенной болезни двенадцатиперстной кишки было H. pylori-негативным. Так, при микроскопии гистологических препаратов антральной слизистой оболочки инфекция H. pylori была обнаружена в 61,1% случаев. Инфицированность Н. pylori чаще, но недостоверно (p>0,5), отмечена в контрольной (66,6%) и 1-й группе (65,5%) в сравнении со 2-й группой больных язвенной болезнью двенадцатиперстной кишки (51,6%). При проведении анализа соответствий степени хеликобактерной инфицированности с наличием у больных язвенной болезнью отдельных диспластических фенотипов достоверных различий не обнаружено (p>0,8). Однако максимальная степень инфицированности H. pylori была отмечена у больных с гипермобильным фенотипом (62,5%), а минимальная – у пациентов с первичным ПМК (44,4%). В целом инфицированность H. pylori у больных язвенной болезнью двенадцатиперстной кишки и желудка была тесно связана с активностью воспаления в антральной слизистой оболочке (R=0,34; p<0,001), мононуклеарной инфильтрацией (R=0,23; p<0,02) и лимфоидными фолликулами (R=0,19; p<0,05). При этом достоверной связи атрофии слизистой оболочки с инфицированностью H. pylori не выявлено (p>0,2). Слизистая оболочка тела желудка. Общая структура главных желудочных желез у большинства больных язвенной болезнью практически соответствовала нормальным критериям. Однако была выявлена прямая, хотя и слабая, корреляционная связь между снижением массы секреторных клеток (глубины желез) при увеличении выраженности СТД (R=0,26; p<0,04). При этом максимальная частота атрофии слизистой (21,5%) была отмечена у больных 2-й группы в сравнении с группой контроля (8,3%; p<0,03). Фовеолярная гиперплазия была обнаружена лишь в 4,62% случаев, в частности, у 1 больного в группе контроля и у 2 больных 1-й группы. Патологическая инфильтрация стромы клеточными элементами была либо незначительной, либо отсутствовала. Так, была выявлена тенденция к слабой связи инфильтрации нейтрофилами при нарастании выраженности СТД (τ=0,16; p<0,06) без достоверных различий между группами (p>0,4). Явной связи плазмоцитарной и лимфоцитарной инфильтрации слизистой оболочки тела желудка с выраженностью СТД также не выявлено. Лимфоидные фолликулы в целом были обнаружены в 24,6% случаев, но без достоверных различий в группах (p>0,5). Присутствие H. pylori было обнаружено у 50,8% пациентов в виде единичных бактериальных тел в поле зрения. Однако в зависимости от выраженности СТД достоверных различий выявлено не было (p>0,8). Кроме того, линейная связь выявления H. pylori с минимальной воспалительной реакцией и лимфоидными фолликулами отсутствовала, за исключением прямой слабой корреляции H. pylori и увеличением общей мононуклеарной инфильтрации (γ=0,2; p<0,05). Важно также отметить тенденцию к слабой связи между H. pylori и наличием легких атрофических изменений желез тела желудка (τ=0,16; p<0,06). Морфологическая характеристика гастродуоденальной слизистой оболочки у больных хроническим гастритом (гастродуоденитом) с признаками СТД. Антральная слизистая оболочка. Дисрегенераторные изменения чаще характеризовались атрофическими изменениями и явлениями фовеолярной гиперплазии. Последняя в целом была обнаружена в 12% случаев и была связана с нарастанием выраженности СТД (τ=0,21; p<0,001). Относительная частота фовеолярной гиперплазии была достоверно выше у больных 2-й группы (19,7%) в сравнении с 1-й группой (5,0%, точный критерий Фишера p<0,04) и недостоверно – в контроле (4,2%; 2 с поправкой Йетса=2,1; p=0,15). Между частотой выявления фовеолярной гиперплазии в антральной слизистой оболочке у больных хроническим гастродуоденитом с различными диспластическими фенотипами достоверных различий не получено (φ=0,26; χ2=9,9; p<0,2; n=125). Тем не менее, следует отметить, что наибольшая частота фовеолярной гиперплазии была выявлена у больных с гипермобильным (28,6%) и неклассифицированным фенотипом (14,3%), а также у пациентов с первичным ПМК (16,7%). У больных с эрозивными гастритами атрофия желез была легкой (29,6%) и средней (4,8%) степени. Установлена умеренная связь между тремя группами больных хроническими и эрозивными гастритами и тремя категориями антральной атрофии, которую оценивали как 0 – отсутствует, 1 – легкая, 2 – умеренная. Значимость этой связи оказалась достаточной, т.к. ее уровень по критерию χ2=18,7 составил p<0,001. Взаимосвязь СТД и атрофии слизистой оболочки антрального отдела также подтвердил расчет коэффициента ранговой корреляции по Кендаллу (τ=0,36; p<0,001). Корректность оценок связи между СТД и атрофией слизистой оболочки антрального отдела у больных с хроническими и эрозивными гастродуоденитами подтверждены всеми использованными методами статистического анализа. Кишечную метаплазию у всех больных с СТД обнаружили в 8,8% случаев, а в контрольной группе она не выявлена. Применение теста «максимального правдоподобия – критерия М-П» позволило обнаружить тенденцию к увеличению частоты и выраженности метаплазии у больных с признаками СТД (критерий М-П χ2=8,8; р<0,07). Однако различия в частоте метаплазии слизистой оболочки антрального отдела желудка при использовании критерия χ2 Пирсона с поправкой Йетса при сравнении группы контроля с 1-ой и 2-ой группами больных оказались недостоверными (p<0,26). Состав клеточного инфильтрата стромы слизистой оболочки антрального отдела у больных хроническими гастродуоденитами отличался преимущественно слабой (35,2%; 44/125) и умеренной (39,2%; 49/125) лимфоплазмоцитарной инфильтрацией. Сравнение степени этой инфильтрации при проведении анализа вариаций по Краскелу-Уоллису показало отсутствие достоверных различий (p>0,8) между исследуемыми группами. Однако с помощью модуля анализа соответствий была установлена тенденция к умеренной связи (φ=0,4; χ2=21,1; p<0,1) между выраженностью лимфоплазмоцитарной инфильтрации и диспластическими фенотипами 2-й группы, 1-й группы и группой контроля. Выраженную степень лимфоплазмоцитарной инфильтрации чаще наблюдали у больных с марфаноподобной внешностью (φ=0,47) и изолированным ПМК (φ=0,47); умеренную – при первичном ПМК (φ=0,56) и гипермобильном фенотипе (φ=0,31); легкую – у у больных с повышенной диспластической стигматизацией (φ=0,26), марфаноподобным (φ=0,17) и неклассифицированным (φ=0,16) фенотипами в сравнении с контролем (φ=0,15). Инфильтрация слизистой оболочки антрального отдела желудка нейтрофильными гранулоцитами была чаще легкой (45,6%, 57/125) и умеренной (30,4%, 38/125) без достоверных различий в группах (анализ вариаций по Краскелу-Уоллису, p>0,9). Вместе с тем показатель меры связи (φ2) был максимальным у больных с первичным ПМК (φ=0,47). Кроме того, наибольшая связь активности воспаления среди изучаемых диспластических фенотипов была у больных с марфаноподобной внешностью (φ=0,46), гипермобильным фенотипом (φ=0,33) и изолированным ПМК (φ=0,45). Коэффициенты сопряженности гранулоцитарной инфильтрации были минимальными при неклассифицированном (φ=0,27) и марфаноподобном фенотипах (φ=0,28), повышенной диспластической стигматизации (φ=0,22) и в группе контроля (φ=0,21). При этом максимальное среднее значение содержания нейтрофилов (полуколичественная оценка по 4-х балльной шкале) было отмечено у больных с первичным ПМК (1,7±0,28) и марфаноподобным фенотипом (1,45±0,31), а минимальное – в группе контроля и у больных с гипермобильным фенотипом (1,25±0,15 и 1,01±0,16 соответственно). «Крипт-абсцессы», как проявление максимальной выраженности воспалительной реакции, были обнаружены только у одного больного контрольной группы (4,2%) и у трех больных 2-й группы (4,9%). В целом, у больных с хроническими гастродуоденитами наиболее сильная связь гранулоцитарной и лимфоплазмоцитарной инфильтрации слизистой оболочки антрального отдела среди диспластических фенотипов была выявлена у пациентов с первичным ПМК (φ=0,48; p<0,3 и φ=0,56; p<0,1 соответственно). Более или менее крупные очаги скопления лимфоидных клеток наблюдали почти у половины больных 1-й и 2-й групп (45,0% и 45,9% соответственно) в сравнении с контролем (37,5%). Однако частота лимфоидных фолликулов в группах при различных диспластических фенотипах при сравнении по Краскелу-Уоллису, а также по данным медианного теста анализа соответствий достоверных различий и не выявлено (p<0,8). Тем не менее, следует отметить, что наибольшая частота выявления лимфоидных фолликулов была у больных с марфаноподобной внешностью (50,0%), неклассифицированным и гипермобильным фенотипами (57,2% и 50,0% соответственно). Особого внимания заслуживает тот факт, что была обнаружена выраженная эозинофилия слизистой оболочки постбульбарного отдела двенадцатиперстной кишки у больных с марфаноподобным и гипермобильным фенотипом. Выраженная инфильтрация стромы слизистой оболочки эозинофилами в сочетании с яркими признаками нарушения микроциркуляции может служить прогностическим критерием риска язвенного кровотечения (Голофеевский В.Ю., 1994, 2005), а у больных с хроническим гастродуоденитом – косвенным отражением нарушения гомеостаза соединительной ткани. При микроскопии гистологических препаратов инфекция H. pylori была обнаружена в 55,2 % случаев с преобладанием легкой и умеренной обсемененности (23% случаев), реже - выраженной (9%). При анализе вариаций по Краскелу-Уоллису и по данным медианного теста достоверных различий в частоте инфицированности в группах не выявлено (2=2,5; p<0,3). Однако при применении модуля анализа соответствий с расчетом коэффициента сопряженности (меры связи φ ) была выявлена тенденция к умеренной связи между степенью инфицированности и различными диспластическими фенотипами у больных хроническими гастродуоденитами 2-й группы, 1-й группы и группы контроля (φ=0,36; 2=29,2; p<0,1; df=21). Следует отметить тенденцию к нарастанию частоты инфекции H. pylori у больных с первичным ПМК и марфаноподобной внешностью (66,7% и 81,8% случаев соответственно), тогда как в группе контроля – 54,2% (p<0,1). Минимальная инфицированность H. pylori была отмечена у больных 1-й группы с изолированным ПМК (30%). В целом колонизация H. pylori слизистой оболочки антрального отдела была связана с гранулоцитарной (R=0,57; p<0,001; n=125) и лимфоплазмоцитарной инфильтрацией (R=0,36; p<0,001; n=125), лимфоидными фолликулами (R=0,3; p<0,001; n=125). Следует отметить достоверную прямую корреляционную связи между H. pylori и атрофическими изменениями в слизистой оболочке антрального отдела желудка (R=0,2; p<0,05; n=125). Слизистая оболочка тела желудка. Умеренные структурные нарушения слизистой оболочки тела желудка у больных хроническим и эрозивным гастродуоденитом обнаружены в 6,7% случаев, в частности, атрофия легкой степени без достоверных различий среди групп (p<0,5). Так, при выраженных СТД атрофия желез тела желудка была обнаружена у 5 пациентов (9,6%), у 1 больного в 1-й группе (3,13%) и у 2 – в контроле (4,8%). Тем не менее, у больных с хроническими гастродуоденитами была обнаружена слабая тенденция к связи атрофических изменений с наличием СТД (γ=0,3; p=0,1). Следует отметить, что среди больных с различными диспластическими фенотипами атрофические изменения чаще всего наблюдали у пациентов с первичным ПМК (22,2%). В целом же, в большинстве случаев структура главных желез во всех группах пациентов соответствовала критериям нормы. Фовеолярная гиперплазия слизистой оболочки тела желудка была обнаружена в 7,6% случаев только у больных 2-й группы при нарастании выраженности СТД (τ=0,3; p=0,005). Усиление лимфоплазмоцитарной инфильтрации и наличие гранулоцитов в строме слизистой оболочки тела желудка наблюдали в 71,4% (75/105) и в 47,6% (50/105) случаев, при этом выраженность инфильтрации чаще была легкой (35,3% и 27,6%) и умеренной (27,6% и 17,3%). При сравнении относительных частот лимфоплазмоцитарной и нейтрофильной инфильтрации больных с помощью анализа вариаций по Краскелу-Уоллису достоверных различий не получено (p>0,3 и p<0,06 соответственно). Тенденция к более выраженной лимфоплазмоцитарной инфильтрации была выявлена у больных с марфаноподобным (φ=0,44) и неклассифицированным фенотипами (φ=0,47) и первичным ПМК (φ=0,36). Частота лимфоидных фолликулов при хронических гастритах составила 23,8%, но также без достоверных различий в группах больных (p>0,2). Однако имелась слабая корреляционная связь инфильтрации нейтрофильными гранулоцитами с нарастанием выраженности СТД (γ=0,2; p<0,05). С помощью анализа соответствий между различными диспластическими фенотипами была установлена тенденция к умеренной взаимосвязи (φ=0,39; χ2=29,8; p<0,1) с выраженностью нейтрофильной инфильтрации. У больных с марфаноподобным (φ=0,54; n=10) и неклассифицированным (φ=0,59; n=11) фенотипами и, в меньшей степени, первичным ПМК (φ=0,36; n=9) отмечена тенденция к наличию более яркой воспалительной реакции в слизистой оболочке тела желудка. При микроскопии гистологических препаратов была выявлена слабая инфицированность H. pylori в 17,2% случаев, умеренная – в 13,3%, а выраженная – 5,7%. Сравнение инфицированности Н. pylori методом М-П показало различие в группах больных (χ2=12,9; p<0,04). Различия в частоте обсемененности Н. pylori (тест Манна-Уитни) были значимы с нарастанием во 2-й группе (42,8%; p<0,04) и тенденцией к увеличению в контроле (46,1; p<0,1) в сравнении с 1-й группой (15,6%). Среди диспластических фенотипов следует отметить тенденцию (p<0,1) к увеличению частоты контаминации H. pylori слизистой фундального отдела у больных с марфаноподобной внешностью (80–82%) и первичным ПМК (56-67%) в сравнении с группой контроля (43–54%). Имела место достоверная связь хеликобактерной инфицированности с атрофией желез тела желудка (R=0,24; p<0,014), гранулоцитарной (R=0,6; p<0,000) и лимфоплазмоцитарной инфильтрацией (R=0,46; p<0,01). Состояние основных механизмов врожденного и адаптивного иммунного ответа у больных гастродуоденальными заболеваниями, ассоциированными с СТД. Оценка функциональной активности фагоцитарной системы у больных хроническими (эрозивными) гастродуоденитами. Изучение системы нейтрофильных гранулоцитов у больных эзофагогастродуоденальными заболеваниями убедительно продемонстрировало мультиформный характер дефектов ее функционирования при различных диспластических синдромах и фенотипах. Фагоцитарная активность нейтрофилов, оцениваемая по их поглотительной способности по отношению к микробной тест-культуре (дрожжевые клетки), во 2-й группе больных превышала показатели в 1-й группе (p<0,05). Напротив, у больных с марфаноподобным и гипермобильным фенотипами обнаружена тенденция к подавлению способности нейтрофилов к эндоцитозу (36–50%; p<0,1), а также снижение фагоцитарного индекса нейтрофилов при апостериорном сравнении его средних показателей при различных диспластических фенотипах (p<0,03). При изучении кислородзависимых механизмов фагоцитоза в цитохимическом варианте НСТс-теста методом дисперсионного анализа с помощью точного метода Фишера у больных 1-й и 2-й группы было выявлено существенное повышение (в 2,5-2,9 раза) активности нейтрофилов (26,7±1,43%; 22,7±2,8%) в сравнении с контролем (9,3±0,45%; p<0,01). Показатели стимулированного НСТ-теста во 2-й группе были достоверно выше (53,8±1,9%) в сравнении с 1-й группой (47,6±2,5%, p<0,05). В частности, стимулирующий эффект зимозана отмечался у больных с первичным ПМК и неклассифицированным фенотипом с увеличением значений стимулированного НСТ-теста, достигающих 67% активности нейтрофилов. Индекс фагоцитарного резерва ((НСТз - НСТ) / НСТ) закономерно был снижен во 2-й и в 1-й группах больных в сравнении с контролем (p<0,0001), отражая снижение функциональной активности нейтрофилов. У больных с марфаноподобным фенотипом отмечалось снижение как спонтанного, так и стимулированного НСТ-теста (36% и 54%) относительно средних значений группы контроля (p<0,05), что указывало на супрессию кислороднезависимых механизмов фагоцитоза. Таким образом, при хронических гастродуоденитах, ассоциированных с СТД, по данным спонтанного и стимулированного HСT-теста у большинства пациентов наблюдали выраженную активацию кислородзависимых систем микробицидности нейтрофилов («респираторный стресс») с недостаточностью их функционального резерва. Показатели цитохимического коэффициента ЛКТ-теста у больных 2-й группы были снижены (1,06±0,06 у.е.; p<0,001) в сравнении с контрольной и 1-й группой (1,34±0,02 у.е. и 1,25±0,001 у.е.), указывая на угнетение кислороднезависимого механизма фагоцитоза. Оценка функциональной активности фагоцитарной системы у больных язвенной болезнью двенадцатиперстной кишки. При наличии признаков СТД была выявлена тенденция к увеличению количества фагоцитирующих клеток (p<0,07) (при гипермобильном фенотипе в 100% случаев). Исключение составили больные с первичным ПМК, у которых, напротив, в 40% случаев выявлялось подавление способности нейтрофилов к фагоцитозу. Сравнение дисперсий показателей фагоцитарного индекса показало, что определяющим в изменении среднего числа дрожжевых клеток, поглощенных одним нейтрофилом, является наличие ассоциированной СТД (F-критерий Фишера=4,6, p<0,02). Так, фагоцитарный индекс был достоверно снижен в 1-й (p<0,004) и 2-й группе (p<0,05) и у больных с первичным ПМК (F-критерий Фишера=6,2; p<0,006) в сравнении с контролем. Оценка активности кислородзависимой микробицидной системы нейтрофильных гранулоцитов в спонтанном НСТ-тесте показала ее нарастание в 1-й (p<0,01) и 2-й группе (p<0,02), максимально (до 39,6%) у больных с первичным ПМК в сравнении с контролем. Напротив, показатели стимулированного НСТ-теста у больных с СТД были достоверно снижены (p<0,04). В частности, метаболическая активность гранулоцитов в стимулированном НСТ-тесте была значимо снижена во 2-й группе в сравнении с контролем (p<0,017). Среди диспластических фенотипов максимальная недостаточность функциональных резервов, достигающая нижней границы референтных норм (40%), была отмечена у больных с первичным ПМК и неклассифицированным фенотипом с показателями НСТ-позитивных нейтрофилов в стимулированных условиях 41,2% и 42% соответственно. При этом индекс фагоцитарного резерва достоверно уменьшался в 1-й (t-критерий с раздельными оценками дисперсий, p<0,004) и 2-й (p<0,003) группах в сравнении с контролем. Достоверных различий ЛКТ-теста не выявлено. В целом у больных язвенной болезнью при наличии СТД отмечалось снижение (p<0,001) фагоцитарного индекса (за исключением лиц с гипермобильным фенотипом) со снижением индекса фагоцитарного резерва (p<0,01) – усиление спонтанной (p<0,05) и уменьшение стимулированной НСТ-активности нейтрофилов. Эта закономерность оказалась особенно характерной для больных язвенной болезнью с первичным ПМК (супрессия функциональной активности с явным количественным дефицитом активно фагоцитирующих нейтрофильных гранулоцитов). Напротив, у больных язвенной болезнью с гипермобильным фенотипом переваривающая активность нейтрофилов резко увеличивалась, что указывало на потенциальный «кислородный или респираторный взрыв», обусловленный, вероятно, существенными изменениями тканевого метаболизма. Активация кислородзависимых систем нейтрофилов и продукция активных форм кислорода, возможно, обеспечивают значимое повреждение эндотелия сосудов и эпителия слизистой оболочки желудка с нарушением их регенераторного потенциала. Так, признаки дисфункции механизмов фагоцитоза у больных язвенной болезнью с гипермобильным фенотипом коррелировали с признаками активного (p<0,1) и хронического (p>0,3) воспаления, а также хеликобактерной инфицированностью – до 62,5% (p<0,8) слизистой оболочки антрального отдела желудка. Характеристика клеточного и гуморального звеньев иммунной системы у больных с хроническими гастродуоденитами. При наличии СТД состояние иммунного гомеостаза отличалось достаточно выраженными иммуносупрессивными процессами, как в клеточном, так и в гуморальном звене иммунитета. Сравнение дисперсий (точный метод Фишера) абсолютного количества лимфоцитов в контрольной и оппозитных группах показало, что наличие СТД является наиболее важным фактором в снижении их содержания (p<0,002). При оценке основных популяций и субпопуляций лимфоцитов периферической крови при наличии СТД было выявлено достоверное уменьшение количества CD3+ Т-лимфоцитов и хелперов-индукторов (CD3+CD4+) в сравнении с контролем. В частности, у больных 1-й и 2-й группы (дисперсионный параметрический анализ и метод апостериорного сравнения средних) было выявлено достоверное уменьшение количества Т-лимфоцитов (CD3+ клеток, ×109/л) в периферической крови в сравнении с контролем (53,9±2,3%; 68,8±3,2% и 76,5±1,4% соответственно; p<0,05). При этом абсолютное их значение в 1-ой группе (1,17±0,06х109/л) было достоверно меньше, чем во 2-й группе больных (1,47±0,05х109/л; p<0,04). Также было отмечено уменьшение как процентного (p<0,001), так и абсолютного (p<0,05) количественного содержания T-хелперов (CD3+CD4+) в периферической крови, в равной степени в 1-й и во 2-й группах больных в сравнении с контролем. Такая же тенденция к уменьшению цитотоксических Т-лимфоцитов (CD3+CD8+) отмечалась в 1-й группе (20,9±0,6%) больных, тогда как во 2-й группе, напротив, их увеличение (30,0±4,1%) в сравнении с контролем (26,03±1,6%; p<0,05). Абсолютные значения цитотоксических Т-лимфоцитов (CD3+CD8+) у больных 2-й группы (0,63±0,03х109/л) были достоверно выше в сравнении с 1-й группой (0,41±0,22х109/л; p<0,05) и с тенденцией к увеличению в сравнении с контролем (0,55±0,01х109/л; p>0,07). Эти изменения в содержании количества Т-лимфоцитов отразились на тенденции к уменьшению индекса соотношения CD4+/CD8+ в 1-й группе (1,75±0,12; p<0,07) и достоверному его снижению во 2-й группе (1,3±0,13; p<0,05) (контроль: 2,0±0,1). Полученные результаты характеризуют наличие иммуносупрессивных процессов, направленных на Т-клеточно-опосредованный иммунный ответ, наиболее выраженный при ярких проявлениях СТД. Это подтверждается достоверным снижением при сопутствующих СТД абсолютного и процентного количества лимфоцитов с фенотипом CD25+ во 2-й группе (14,6±1,3%) в сравнении с контролем (19,2±1,7; p<0,05). Увеличенное абсолютное количество NK-клеток (0,41±0,05; p<0,05) и цитотоксическими Т-лимфоцитами у больных 2-й группы расценивали как активизацию деструктивных аутоиммунных цитотоксических процессов. Формирующаяся иммунная дисфункция в Т-клеточном звене иммунитета компенсировалась активацией гуморального иммунитета и фагоцитарной активности, что говорило о функциональном характере иммунных нарушений. Так, гуморальное звено у больных с признаками СТД было активировано более выражено, что подтверждалось тенденцией к увеличению абсолютного и процентного количества В-лимфоцитов в 2,3 и 2 раза в 1-й (p<0,01) и 2-й (p<0,05) группах соответственно. Это объясняет и компенсаторное повышение количества цитотоксических Т-лимфоцитов (CD3+CD8+) при выраженных проявлениях СТД на фоне гиперактивности и поликлональной активации В-лимфоцитов. Уровни Ig А и Ig М в периферической крови практически не изменялись. Концентрация Ig G достоверно была повышена в сыворотке крови больных 2-й группы (12,4±0,4 г/л; p<0,04) в сравнении с больными 1-й группы (10,6±1,06 г/л). Однако умеренное увеличение концентрации иммуноглобулинов в 1-й и 2-й группах на фоне увеличения количества лимфоцитов с фенотипом CD20+ также расценивалось как наличие процессов иммуносупрессии при диспластикозависимом процессе. Содержание в сыворотке крови иммунных комплексов было достоверно повышенным в 1-й группе (23,7±2,9 у.е.; p<0,05) в сравнении с контрольной и 2-й группой, что, вероятно, отражало функциональную неполноценность элиминационных механизмов у лиц с повышенной диспластической стигматизацией. Характеристика клеточного и гуморального звеньев иммунной системы у больных язвенной болезнью двенадцатиперстной кишки. В случае сопутствующих выраженных проявлений СТД отмечались в основном однонаправленные клеточные и цитотоксические процессы без адекватной активации гуморального звена иммунитета. Различия содержания в периферической крови общего количества лейкоцитов, лимфоцитов в группах больных отсутствовали (p>0,2). В то же время, общее количество CD3+ лимфоцитов было уменьшено в 1-й (57,2±1,5%; p<0,01) и во 2-й (59,4±2,3%; p<0,004) группах в сравнении с контролем (65,9±1,2%). Абсолютное количество Т-клеток хелперов-индукторов (CD3+CD4+) не различалось, тогда, как их относительное содержание во 2-й группе было уменьшено (37,4±2,5%; p<0,05) в сравнении с контролем (47,3±2,7%). При изучении как относительного, так и абсолютного содержания цитотоксических Т-лимфоцитов достоверных различий не выявлено. Косвенным отражением о наличии иммуносупрессивных процессов у больных 2-й группы была тенденция к относительному снижению индекса CD4+/CD8 в сравнении с контрольной группой (p<0,09). Иммуносупрессию у больных 1-й (p<0,01) и 2-й (p<0,005) групп также подтверждает достоверное снижение количества лимфоцитов CD25+. Кроме того, у больных 2-й группы в сравнении с 1-й и контрольной группами было увеличено количество NK-клеток (p<0,05), что указывает на наличие цитотоксических процессов. При исследовании гуморального звена иммунитета при различных диспластических синдромах и фенотипах достоверных различий в содержании лимфоцитов CD20+ не выявлено. Уровень сывороточного Ig А был увеличен во 2-й группе в сравнении с 1-й и контрольной группой (p<0,001), тогда как концентрации Ig G и Ig М не различались. Менее выраженные изменения клеточного и гуморального иммунитета при язвенной болезни в сравнении с хроническими гастритами, вероятно, обусловлены редкой сочетаемостью язвенных процессов и такими диспластическими синдромами как марфаноподобный фенотип и марфаноподобная внешность. Оценка профилей цитокинов и компонентов системы комплемента у больных язвенной болезнью двенадцатиперстной кишки. Цитокины, попадающие в системный кровоток, способны оказать эндокринный или коротко-дистантный эффект, достаточно адекватно отражая интенсивность системного воспалительного процесса. Так, было обнаружено повышение как цитокинов, определяющих фазу острого воспаления (IL-1β, IFNγ), так и, в большей степени, цитокинов хронического воспаления (IL-6, IL-10, TGFβ) в фазе обострения у больных хроническими эзофагогастродуоденальными заболеваниями в сравнении с группой здоровых лиц (p<0,05). Самым высоким (в 1,5-2 раза) оказалось повышение уровней IL-10, IL-6, IL-8 в сравнении с показателями здоровых лиц (p<0,05). При эрозивных гастритах по сравнению с язвенной болезнью существенных различий медиаторов межклеточного взаимодействия выявлено не было, за исключением снижения продукции IL-2 у больных язвенной болезнью (11,9±0,3 пг/мл и 12,4±0,3 пг/мл; p<0,05 соответственно), но не ниже референсных значений здоровых лиц. По данным Н.М. Калининой с соавт. (2001) одним из механизмов ульцерогенеза может являться недостаточность Т-клеточного звена местного иммунитета гастродуоденальной слизистой оболочки, проявляющаяся снижением продукции IL-2. Анализ индекса соотношения IFNγ/IL-10, являющихся физиологическими антагонистами и опосредующих взаимный антагонизм субпопуляций Тh1- и Тh2-лимфоцитов, демонстрировал классический Тh1-ассоциированный иммунный ответ, наблюдающийся при хронических H. pylori-ассоциированных кислотозависимых заболеваниях органов пищеварения (Царегородцева Т.М., 2003). Многофакторный дисперсионный анализ позволил установить, что на поляризацию иммунного ответа в сторону Тh1-го типа оказывали значимое влияние H. pylori (9%, p<0,03) и ассоциированная СТД (8%; p<0,02). С учетом эффекта их взаимодействия степень влияния этих факторов возрастала почти до 50% (р<0,0002), что указывало на тесную связь морфогенетической и иммунной функции соединительнотканных структур (Яковлев В.М. и соавт., 2005) и позволяло судить об их влиянии на цитокиновую регуляцию специфического иммунитета в развитии иммуно-опосредованного воспаления. При сравнении уровней комплемента (С3- и С5-компонентов) при эрозивных гастритах и язвенной болезни в целом достоверных различий не выявлено (p>0,6), но отмечено значимое снижение их концентрации по сравнению со здоровыми лицами. В частности, имел место дефицит С3-компонента комплемента сыворотки крови у больных язвенной болезнью и эрозивным гастродуоденитом (p<0,05). Методом дисперсионного анализа выявлен дефицит уровня С3-компонента комплемента у больных с марфаноподобным фенотипом (0,68±0,037 мг/мл; p<0,002) при апостериорном сравнении со всеми группами больных эрозивно-язвенными заболеваниями. Видимо, это приводит к нарушению процессов опсонизации и дефекту системы фагоцитоза (снижение фагоцитарной активности гранулоцитов 36%). Кроме того, выявленное у данной категории больных в каждом третьем и втором случае снижение спонтанной бактерицидной активности нейтрофилов (р<0,05) и отсутствие стимулирующего эффекта зимозана в НСТ-тесте (р<0,01), свидетельствовало о негативном кондиционировании нейтрофилов с утратой способности развивать адекватный ответ на микробную стимуляцию. Морфологическим отражением снижения «емкости функционального депо» и завершенности фагоцитоза у больных с марфаноподобным фенотипом с клиническими признаками иммунодефицита в виде сопутствующего инфекционного синдрома в 87% случаев, явилось нарастание частоты хронического H. pylori-ассоциированного мультифокального атрофического гастрита с частыми обострениями. У больных с первичным ПМК количественная недостаточность активно фагоцитирующих нейтрофилов (супрессия процессов переваривания) была сопряжена с дискордантностью работы микробицидной системы. Так, возросшая активность оксидазной микробицидной системы (до 67%) одновременно сопровождалась угнетением кислороднезависимого механизма фагоцитоза, что в целом характеризовало отсутствие адекватного ответа на инфекцию H. pylori, незавершенность хронического воспалительного процесса в слизистой оболочке. Так, у больных с клиникой «предъязвенного» состояния тенденция к увеличению хеликобактерной инфицированности отмечалась только при марфаноподобная внешности (80–82%) и первичном ПМК (56–67%). При оценке C5-компонента комплемента различий не выявлено (отсутствие равенства дисперсий в тесте Левена и принятие нулевой статистической гипотезы), но отмечена тенденция (p<0,1) к дефициту компонента комплемента C5 у лиц с неклассифицированным, гипермобильным и марфаноподобным фенотипами. При обострении язвенной болезни была выявлена тенденция к повышению сывороточных уровней IL-1β, IL-2, IL-8, TNFα, IFNγ у больных с признаками СТД в сравнении с контролем (p<0,1), за исключением IL-6, что, в целом, отражало более высокую степень инициального воспаления в слизистой оболочке желудка и напряжение гуморального звена иммунитета. Более высокий уровень IL-1 (p<0,06) в 1-й и 2-й группах, участвующего в репарации соединительной ткани, косвенно отражал глубину дефектов повреждения слизистой оболочки (Watanabe T. et al., 2001). Так, среди больных 1-й и 2-й групп с впервые выявленной дуоденальной язвой в 73,3% (χ2=3; p<0,05) и 81,3% (p<0,01) уровень IL-1 соответствовал норме (в контроле только в 63,3%). Напротив, при обострении хронической язвенной болезнью у больных 1-й и 2-й групп, отмечена тенденция к повышению активности IL-1β в 71,4% и 69,2% случаев в сравнении с группой контроля (50%). Это согласуется с результатами других исследователей, указывающих на повышение IL-1 в 5–41% при хронических заболеваниях органов пищеварения, в том числе и при язвенной болезни.. Влияние IL-1 на соединительную ткань имеет разноплановый – как деструктивный (дозозависимое ингибирующее влияние на синтез коллагена), так и репаративный характер при отсутствии деструктивного влияния свободных радикалов и лизосомальных протеиназ с невысоким уровнем IL-8 (Черешнев В.А., Гусев Е.И., 2001). Так, IL-8, модулируя хемотаксис и хемокинез, обуславливает рекрутирование гранулоцитов в слизистую оболочку, праймирует их к продукции активных форм кислорода и нитроксидных радикалов. Однако, уровни продукции хемоаттрактанта нейтрофилов IL-8 и IFN были повышенными во 2-й (16,3±0,6 пг/мл и 18,81±0,7 пг/мл, p<0,04) и в 1-й (15,5±0,73 пг/мл и 17,9±0,6 пг/мл, p<0,04) группах в сравнении с контролем (14,2±0,6 пг/мл и 17,07±0,7 пг/мл). Это подтверждает корреляционная связь между выраженностью СТД и сывороточными концентрациями IL-8 и IFNγ (R=0,26; p<0,02 и R=0,23; p<0,05). Избыточная секреция IL-8 может рассматриваться в структуре аллельного полиморфизма регуляторных районов гена IL-8, как генетического фактора предрасположенности к реализации патогенности H. pylori через механизмы IL-8 гастрин-стимулированной секреции соляной кислоты с развитием пилорической язвы. (Gyulai Z. et al., 2004; ссылка скрыта K. et al., 2005). Статистических различий в продукции IL-2 не было. Уровни TNFα как у больных с признаками СТД, так и в контрольной группе не превышали концентрации у здоровых лиц, что указывало на его менее значимую роль в ульцерогенезе. Так, при изучении роли полиморфизма гена цитокина TNFα в регуляции воспаления и иммунитета доказан минимальный риск развития дуоденальной язвы даже у лиц с потенциально высокой TNFα-продуцирующей способностью (Gyulai Z. et al., 2004). Максимальная сывороточная концентрация противовоспалительного IL-10 была выявлена у больных язвенной болезнью 1-й группы (12,1±0,46 пг/мл) и достоверно превышала уровень IL-10 у больных 2-й (10,54±0,32 пг/мл; p<0,002) и контрольной групп (9,94±0,25 пг/мл; p<0,0002). Тем не менее, учитывая выявленную тенденцию к повышению у них и провоспалительных цитокинов, это не сопровождалось выраженным угнетением формирования цитокиновой сети. Особый интерес представляло изучение соотношения оппозитных пулов цитокинов – IFNγ и IL-10, рассматриваемых как маркеров Тh1- и Тh2-зависимых иммунных ответов, из которых IFNγ усиливает клеточно-опосредованный иммунный ответ, a IL-10 совместно с IL-4, IL-6 – гуморальный. Поэтому, с целью изучения эффекторных механизмов и типов иммунного ответа, важным этапом которых является дифференцировка Т-хелперов на субпопуляции Th1-го или Th2-го типа, различающихся по паттернам продуцируемых ими цитокинов, определяли индекс соотношения IFN и IL-10. Методом однофакторного параметрического дисперсионного анализа было выявлено различие индекса IFNγ/IL-10 в сравниваемых группах (p<0,008). В частности, попарное апостериорное сравнение групп показало снижении Th1-активности в 1-й группе больных дуоденальной язвой (1,53±0,07) и повышение в контрольной (1,71±0,06; р<0,06) и 2-й группе (1,8±0,07; р<0,002). При апостериорном сравнении продукции цитокинов у больных язвенной болезнью с диспластическими фенотипами отмечена тенденция к повышению уровня IL-8 и IL-6 при первичном ПМК, а при гипермобильном фенотипе также TNFα, IFNγ и IL-2 (p<0,1) в сравнении с контрольной группой. У лиц с повышенной диспластической стигматизацией, в контрольной группе было выявлено повышение уровня IL-10 (p<0,01). Как оказалось, выявленная закономерность, подтверждала «протективную» роль IL-10 для развития атрофического процесса, но при этом одновременно способствовало хронизации воспаления. В частности, это объясняет преобладание H. pylori-ассоциированных язв на фоне активного хронического неатрофического антрального гастрита (φ=0,44; p<0,03). В фазе клинико-эндоскопической ремиссии и активации регенераторного процесса в динамике отмечалось снижение сывороточной уровней цитокинов: IL-1 (p<0,001), IL-2 (p<0,02), IL-6 (p<0,001), IL-8 (p<0,002) и TNFα (p<0,001), за исключением IFNγ (p>0,3) (рис.2). 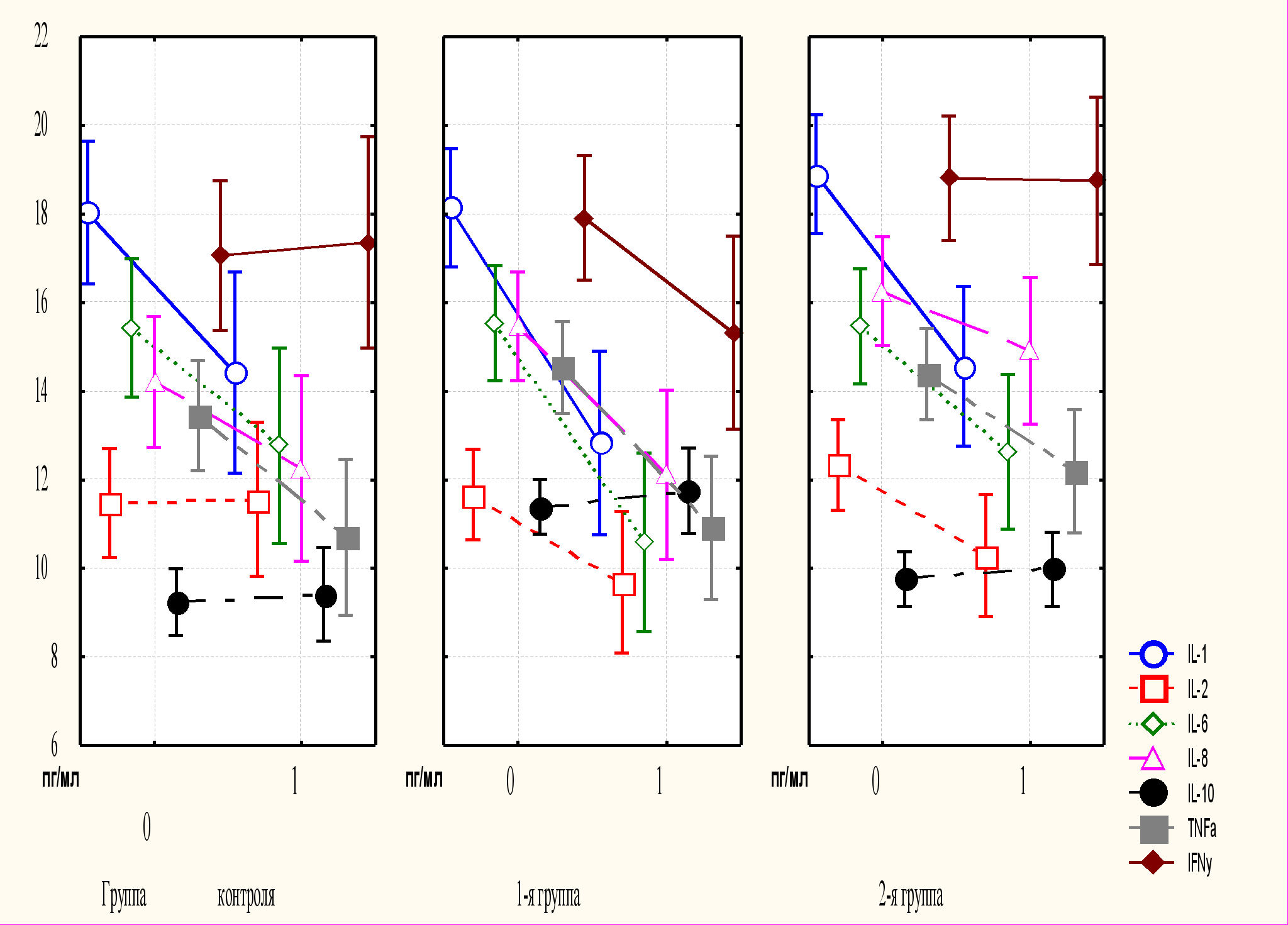 Рис. 2. Динамика уровней цитокинов у больных язвенной болезнью двенадцатиперстной с СТД, пг/мл: 0 – фаза обострения; 1 – фаза ремиссии. Однако динамика снижения уровня провоспалительных цитокинов у больных язвенной болезнью 2-й группы была незначительной. Так, в фазе ремиссии концентрация IL-8 во 2-й группе в сравнении с показателями контрольной и 1-й групп сохранялась достоверно более высокой (14,9±1,05 пг/мл; 12,25±0,74 пг/мл, p<0,05 и 12,1±0,6 пг/мл, p<0,03 соответственно). Также, было установлено, что сопутствующий катаральный и эрозивный рефлюкс-эзофагит совместно с наличием СТД, объясняет основную часть дисперсии, т.е. повышения IL-8 на 21,3% и 35,3% соответственно. Степень влияния этих факторов возрастала до 59–75% с учетом эффекта взаимодействия. Сывороточные концентраций IFNγ сохранялись более высокими также во 2-й группе больных (18,8±1,1 пг/мл) в сравнении с 1-й группой (15,1±1,4, пг/мл; p<0,05), даже превышали показатели контрольной группы в фазе обострения (17,1±0,8 пг/мл; p<0,1). Таким образом, повышенная продукция IFNg и IL-8 в фазе обострения язвенной болезни и ее связь с нарастанием выраженности СТД может отражаться замедлением репарации язвенных дефектов. Так, мультифункциональный цитокин IFNγ проявляет мощные эффекты на физиологическое регулирование межклеточного матричного оборота, оказывая антагонистические эффекты на фибробласт, аннулирует эффекты стимуляции TGFß на синтез в них коллагена, является мощным ингибитором роста эндотелиальных клеток, ангиогенеза, обладая, таким образом, антипролиферативной активностью (Ghosh A.K. et al., 2002). Кроме того, IFNγ может подавлять продукцию простагландина Е2 – основного цитопротектора. Напротив, незначительное повышение уровня IFNg в контрольной группе при завершении рубцевания может характеризовать его способность в небольших концентрациях модулировать синтез фибробластами коллагена I типа, снижать синтез макромолекул межклеточного матрикса (Yufit T. et al., 1995), активность матричных металлопротеиназ (Yu Q. et al., 2005; 2006), тем самым опосредованно уменьшая десмоплазию или неправильную ориентацию коллагена и деградацию молекул межклеточной адгезии (ламинина, фибронектина) (Varga J. et al., 1990). Уровень TNFα в сопоставлении с его секрецией в оппозитных группах больных так же имел тенденцию к невыраженной динамике снижения во 2-й группе (p<0,1) в сравнении с контрольной группой, что могло ухудшать качество рубца и быть следствием рецидива болезни (Aracawa T. еt al., 1998). Так, уровень TNFα коррелировал с гистологической активностью воспаления (R=0,43; p<0,01) и «крипт-абсцессами» (R=0,4; p<0,03) в слизистой оболочке антрального отдела желудка. Изначально сравнительно невысокий уровень TNFα и его достоверная динамика снижения в группе контроля могли отражать реализацию противоположных, а именно репаративных реакций через стимулирующее влияние TNFα на пролиферацию фибробластов и синтез ими коллагена (Черешнев В.А., Гусев Е.И., 2001). Значимая динамика снижения IL-2, являющегося аутокринным и паракринным Т-клеточным ростовым фактором, отсутствовала, даже обнаруживая тенденцию к увеличению ее в фазе ремиссии в контрольной группе в сравнении с 1-й группой, что может являться одной из характеристик Т-клеточной дисфункции и негативно влиять на эффективность Тh1-клеточного ответа Регрессию воспалительно-деструктивных явлений и нарастание регенерации отражает поляризация Т-хелперов (в направлении Тh2) с достоверным уменьшением индекса соотношения IFNγ/IL-10 в 1-й группе (1,35±0,14) в сравнении с контрольной (1,83±0,09, p<0,007) и 2-й (1,87±0,09, p<0,007) группами. Значимых различий концентраций цитокинов IL-1β и IL-6 в период клинико-эндоскопической ремиссии не установлено. Оценка цитокиновых профилей у больных хроническими (эрозивными) гогастродуоденитами. У больных, имеющих признаки СТД, был установлен более высокий уровень продукции IL-1, IL-8 и IL-2 в сравнении с контролем (p<0,001), тенденцию к увеличению IL-8 (16,9±0,4 пг/мл, p<0,07) и значимо IL-2 (14,3±0,4 пг/мл, p<0,001 ) в 1-й группе в сравнении со 2-й группой больных (15,4 ±0,6 пг/мли 11,45±0,4 пг/мл). Эти соотношения отражают существенный провоспалительный потенциал у больных с повышенной диспластической стигматизацией. Высокую активность продукции сывороточного IL-1 у больных с СТД (p<0,001) можно сопоставить с формированием у них фовеолярной гиперплазии поверхностно-ямочного эпителия слизистой оболочки желудка и, что особенно важно, атрофии желез (p<0,001) на фоне выраженной симпатикотонии (p<0,01). Так известно, что генетический полиморфизм гена – IL-1β-511 с замещением аллеля С на Т (IL-1β-511*Т/Т), сочетается с более выраженным провоспалительным ответом, гипохлоргидрией (Beales I.L.P., Calam J., 1998; Mahr S. et al., 2000; El-Omar E.M., 2001), более тяжелым гастритом, атрофией и повреждением париетальных клеток с развитием в конечном итоге ракового фенотипа гастрита в сравнении с генотипами С/Т и С/С (ссылка скрыта. et al., 2002; Hutyrová B. et al., 2004; Li C. et al., 2007). Уровень продукции IFN, также как и при язвенной болезнью, был повышен у больных 2-й группы (18,66±0,53 пг/мл, p<0,003) с тенденцией к увеличению его сывороточной концентрации в 1-й группе (17,81±0,75 пг/мл; p<0,051) в сравнении с контролем (15,5±0,53 пг/мл). Это может отражать характер цитокинового ответа, сопоставимый с иммунным реагированием на инфекцию H. pylori. Так, считается, что именно IFNγ, а не TNFα, играет главенствующую, если не критическую роль в патогенезе гастрита, вызванного инфекцией H. pylori (Hasegawa S. et al., 2004). Поэтому, повышенная продукция IFNγ (p<0,003) и IL-2 (p<0,001) у больных с СТД, свидетельствовала о преобладании у них более выраженного иммунного ответа Th1-го типа наряду с контаминацией слизистой оболочки желудка H. pylori, что подтверждается и результатами морфологического анализа (p<0,05). При анализе взаимосвязи продукции цитокинов с фенотипической выраженностью СТД установлены слабые положительные корреляционные связи с уровнями IFNγ (R=0,24, p<0,04) и IL-8 (R=0,26; p<0,02), а также умеренные положительные связи с уровнями IL-1b (R=0,25; p<0,03) и IL-6 (R=0,37; p<0,001). Сывороточные концентрации TNFα, вовлекаемого в патогенез Н. pylori-ассоциированного гастрита (Hasegawa S. et al., 2004) у больных 1-й и, в меньшей степени, 2-й группы были выше в сравнении с контролем (p<0,02). Повышение сывороточной концентрации IL-6 у больных эрозивными и хроническими гастродуоденитами 1-й и 2-й групп также было более значительным, превышая показатели группы контроля в 1,5 раза (16,62±0,6 пг/мл; 16,5±0,53 пг/мл и 11,1±0,7 пг/мл соответственно). Сравнение сывороточной концентрации IL-10 показало достоверное увеличение уровня данного цитокина у пациентов 1-й группы (11,83±0,16 пг/мл) в сравнении с больными 2-й и контрольной группы (10,8±0,32 пг/мл; p<0,017 и 9,9±0,21 пг/мл; p<0,001 соответственно). Таким образом, достоверное увеличение секреции IL-10 у больных с повышенной диспластической стигматизацией, с одной стороны, способствовало снижению локального воспаления (p<0,1), являясь защитным феноменом, а с другой – было причастным к неспособности эффекторных механизмов иммунной системы элиминировать H. pylori. В целом, провоспалительная активность оказалась наиболее высокой во 2-й группе больных с увеличением индекса соотношения IFNγ/IL-10 в сравнении с 1-й группой (1,77±0,06 у.е. и 1,51±0,07 у.е.; p<0,004 соответственно) и контролем (1,56±0,03 у.е.; p<0,06). У больных, имеющих марфаноподобный фенотип, была установлена высокая продукция мультипотентного Th3-лимфоцитарного цитокина TGFβ – регулятора адаптивного иммунного ответа, модулятора клеточного роста, пролиферации и дифференцировки, превышающая уровень референсных нормативных величин здоровых лиц почти в 1,5-2 раза (170±22,9 пг/мл). Примечательно, что исследования молекулярной патофизиологии синдрома Марфана, выявили взаимосвязь мультисистемных соединительнотканных нарушений (ПМК, гипермобильности суставов и пр.) с аномалией структурного протеина фибриллина-1, регулирующего пространственную и временную активацию TGFβ (Robinson P.N., 2006; Pyeritz R., 2008). В контексте выявленной высокой активности симпатического отдела ВНС и фиброзирующего медиатора TGFβ, можно объяснить крайне редкую встречаемость дуоденальной язвы при диспластикозависимых процессах с вовлечением преимущественно костно-суставной системы, в силу их синергичных репаративных эффектов (усиления клеточной пролиферации внутритканевых фибробластов и пр.) (Blobe G.C. et al., 2000; Akiyama-Uchida Y. et al., 2002). Учитывая возможность IFNγ аннулировать эффекты стимуляции TGFß на синтез коллагена в фибробластах (Ghosh A.K. et al., 2002), высокая продукция IFNγ в условиях расторможенного процесса активации TGFβ может являться состоянием своеобразного иммунопатогенетического механизма, необходимого для завершения ульцерогенеза у больных с марфаноподобным фенотипом. Таким образом, дискордантность или разнонаправленность поляризации иммунного ответа по Th1-типу при H. pylori-ассоциированных заболеваний и по Th3-типу при СТД с TGFβ-ассоциированной активностью объясняют трудность реализации иммуноморфопатогенеза язвенной болезни, которая не встречается у больных с марфаноподобным фенотипом, и крайне редко – при марфаноподобной внешности. Патогенетические взаимосвязи между содержанием свободного оксипролина и цитокиновой продукцией у больных эрозивно-язвенными заболеваниями. Сывороточный уровень свободного оксипролина был достоверно повышен у больных дуоденальными язвами (0,053±0,007 ммоль/л) в сравнении с пациентами эрозивными гастродуоденитами (0,029±0,004 ммоль/л), а также здоровыми лицами (0,021±0,004 ммоль/л; р<0,007), отражая более высокую активность метаболизма с распадом и замедлением стабилизации коллагенсодержащих структур при язвенном дефекте. Однако у больных с дуоденальными язвами уровень оксипролинемии достоверно снижался при нарастании фенотипической выраженности СТД – 0,040±0,005 ммоль/л в 1-й и, практически в три раза, во 2-й группе – 0,024±0,004 ммоль/л (в контроле 0,076±0,011 ммоль/л; р<0,04), указывая на снижение метаболизма соединительной ткани. В период активного коллагенообразования в рубце интенсифицируются процессы новообразования и распада коллагена (в основном “незрелого”) с повышением концентрации свободного оксипролина в крови, уменьшение которого, в 2-3 раза и более рассматривают как показатель угнетения реакции завершающей стадии распада коллагена (Шараев П.Н. и соавт., 2005) и нарушение процессов коллагенообразования при СТД. При проведении корреляционного анализа были установлены отрицательные взаимосвязи между сывороточной продукцией провоспалительных цитокинов и уровнем – IL-1β (rxy = –0,5; p< 0,005), IL-2 (rxy = –0,6; p< 0,004), IL-6 (rxy = -0,5; p< 0,005), IL-8 (rxy = –0,6; p< 0,001), TNF-α (rxy = –0,5; p< 0,01). Таким образом, достоверно более высокая продукция IL-lβ, IL-6, TNFα у больных с СТД, дозозависимая активность которых модулирует деградацию компонентов экстрацеллюлярного матрикса вместе с процессами пролиферации и дифференцировки (Riquet F.B. et al., 2000) носила компенсаторный характер в условиях сниженного регенераторного потенциала с усилением интенсивности фибрилло- и коллагеногенеза Оценка нейроиммунной регуляции и сопоставление цитокиновой продукции с показателями ВРС. Адекватным стимулом для включения иммунокомпетентными клетками провоспалительной цитокиновой программы явилось преобладание парасимпатических влияний (HF), сопряженное с повышением интегральной бальной оценки уровня функционирования физиологической системы (r=0,7; p=0,005). Мощность в диапазоне высоких частот (HF) коррелировала с продукцией провоспалительных цитокинов IL-8 (p<0,1), IL-6 (r=0,45; p<0,01). Однако, избыточный характер продукции IFNγ, характеризующий иммунный ответ Th1-типа, вел к ухудшению функционального состояния организма. Так, сывороточные концентрации IFNg нарастали при снижении интегральной оценки адаптационных резервов организма (R= –0,43; p<0,03), имели обратную корреляционную связь с показателем К30:15, отражающего снижение реактивности парасимпатического отдела ВНС (r= –0,47; p<0,09), и с КВальс (r= –0,37; p<0,08), указывающего на снижение парасимпатической функции ВНС. Симпатические влияния (LF), а также процентный вклад симпатического воздействия (LF/HF) коррелировали с продукцией противовоспалительного цитокина IL-10 (r=0,4; p=0,02 и r=0,37; p=0,04 соответственно), что свидетельствовало о сопряженности подавления активности воспаления с преобладанием симпатических влияний. Установленную закономерность подтверждают и накопившиеся за последнее десятилетие факты, свидетельствующие о селективном супрессивном эффекте катехоламинов на реализацию иммунного ответа Th1-типа (IL-12, IFNg) при одновременной поддержке Th2-типа через повышенную продукцию IL-10, IL-5 (Sanders V.M., Straub R.H., 2002). Второй этап оценки установленных корреляционных связей предусматривал многомерный регрессионный анализ с использованием алгоритма «прямой пошаговой процедуры» включения прогностических (объясняющих) признаков и моделирования количественных выходных параметров-откликов на эти воздействующие факторы. В модель влияния на суммарную активность нейрогуморальных влияний на сердечный ритм (TP) были включены четыре цитокина: IL-1, IL-10, IL-2 и IL-6 (табл. 3).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
