На правах рукописи
| Вид материала | Автореферат |
- Печатная или на правах рукописи, 21.09kb.
- Удк 796/799: 378 , 770.24kb.
- На правах рукописи, 399.58kb.
- На правах рукописи, 726.26kb.
- На правах рукописи, 1025.8kb.
- На правах рукописи, 321.8kb.
- На правах рукописи, 552.92kb.
- На правах рукописи, 514.74kb.
- На правах рукописи, 670.06kb.
- На правах рукописи, 637.26kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Распространенность и клинико-эндоскопическая картина хронических эзофагогастродуоденальных заболеваний. В процессе анализа соответствий выявлена умеренная взаимосвязь между выраженностью СТД и частотой впервые диагностированных эзофагогастродуоденальных заболеваний (φ=0,43; χ2=32,9; p<0,001; n=156). Так, в 1-й и 2-й группах без «гастритического» анамнеза отмечена более высокая частота и степень соответствия с хроническими (74,2% и 67,5%) и эрозивными гастродуоденитами (14,5% и 27% соответственно) в сравнении с группой контроля (52,6% и 3,5% соответственно; p<0,001). С помощью анализа соответствий была установлена умеренная связь (φ=0,3; χ2 =46,3; p<0,017; n=303), позволившая провести описательное сравнение структуры, частоты и взаимосвязи (сопряженности φ) хронических гастродуоденальных заболеваний среди диспластических фенотипов. Оценка этих взаимосвязей представлена на двумерной диаграмме в координатах первых 2-х базисных векторов, имеющих максимальный вклад в объяснение соответствий на 56,3% и на 30,7% (рис. 1). Для больных с признаками СТД были не характерны острые язвы луковицы двенадцатиперстной кишки (8–17%), а максимальная частота отмечена у больных без СТД (32%; p<0,02). Напротив, максимальная частота и соответствие хронической формы язвенной болезни луковицы двенадцатиперстной кишки и острых язв желудка обнаружена у больных с гипермобильным фенотипом (φ=0,5; 29% и 9% соответственно) в сравнении с контролем (10% и 0%; p<0,02). Острые эрозии эзофагогастродуоденальной слизистой оболочки были достоверно чаще отмечены у больных с марфаноподобной внешностью (φ=0,36; 35%) и марфаноподобным фенотипом (φ=0,36; 27%), в меньшей степени с гипермобильным (φ=0,51; 24%) и неклассифицированным фенотипами (φ=0,14; 21%) в сравнении с контролем (10%; p<0,02). Максимальная распространенность и связь хронического гастродуоденита выявлена у больных с первичным ПМК и марфаноподобным фенотипом (54%; φ=0,21 и 72%; φ=0,36 соответственно). Анализ факторов риска показал, что наследственный анамнез язвенной болезни у пациентов с признаками СТД встречался не чаще, чем в контроле (38,3–57,2% против 44,8%). Принимая во внимание то, что у больных с острыми осложнениями ранее обнаружен наименьший вклад наследственного фактора (Голофеевский В.Ю., 1994), можно ожидать более тяжелое течение язвенной болезни при наличии СТД, которая также не имеет четкой генетической детерминированности. Поэтому у пациентов с клинической картиной предъязвенного состояния и повышенной диспластической стигматизацией имеется потенциальная 2-кратная угроза реализации наследственной отягощенности (32%) в сравнении с выраженными формами СТД и контролем (17%; p<0,2). 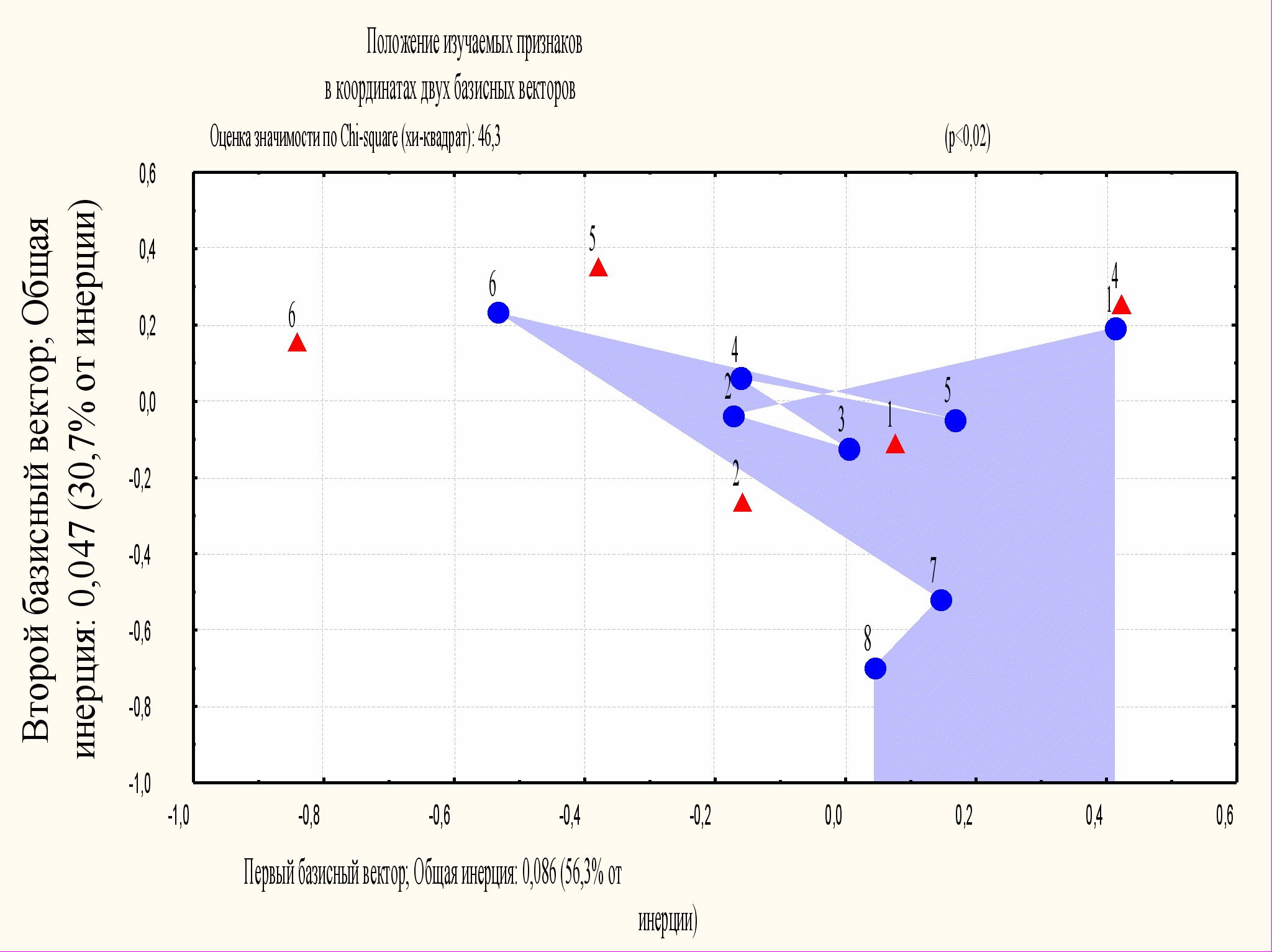    Рис. 1. Диаграмма взаимосвязи по показателю сопряженности φ2 между диспластическими фенотипами и хроническими гастродуоденальными заболеваниями. Примечание: ▲ 1 – хронический гастродуоденит, 2 – острый эрозивный гастродуоденит, 4 – впервые выявленная (острая) язва луковицы двенадцатиперстной кишки, 5 – хроническая язва луковицы двенадцатиперстной кишки, 6 – язва желудка; ● 1 – группа контроля; 2-8 – порядковые номера диспластических фенотипов. Длительность «гастритического» анамнеза достоверно увеличивалась при нарастании выраженности СТД, совпадая с формирующимся в детстве хроническим гастродуоденитом (в среднем – 3 года в сравнении с 1,5 годами в контроле, p<0,05). Характерными особенностями «предъязвенного» состояния и язвенной болезни явилась отчетливая тенденция к нарастанию частоты стрессовых ситуаций, предшествующих госпитализации, психических факторов, совпадающих с выраженным болевым синдромом и формированием язвенных поражений на фоне СТД (50–53% и 30–40% против 17–32%). Особенностью больных с СТД также явилось значимое (χ2=5,2; p<0,02) нарастание частоты рецидивирующего течения дуоденальной язвы (40–42% против 17,5% в контроле). Оценка сроков рубцевания язв выявила их большую продолжительность у пациентов с СТД (18,8±2,6 дней по сравнению с 16,6±3,1 днями в группе контроля, p>0,1). Вероятность иммунопатологических состояний подтверждается более высокой частотой в анамнезе рецидивирующих и хронических инфекций и аллергических реакций у больных с СТД (61–48,1%; p<0,004 и 26–27%; p<0,05) в сравнении с контролем (32,1–9,3% соответственно). Этот факт позволял уже на этапе донозологической диагностики считать таких пациентов иммунологически «компрометированными». Возможная иммунная недостаточность более чем у половины больных с СТД (54%) и сочетание инфекционного и аллергического компонентов в 6–9% случаев в сравнении с 1,1% случаев в контроле (p<0,005) существенно увеличивали вероятность дальнейшего лабораторного доказательства иммунных нарушений. Максимальная частота инфекционного синдрома в анамнезе (p<0,05) имелась у больных хроническими гастродуоденальными заболеваниями с первичным ПМК (68%; φ=0,49) и марфаноподобной внешностью (70%; φ=0,33). Были получены данные о том, что совокупность болевого и диспепсического синдромов имеет существенную диагностическую ценность для прогностически более неблагоприятного варианта течения язвенной болезни. Так, болевой синдром в группе контроля по времени и связи с приемом пищи соответствовал классическим проявлениям язвенной болезни. В контроле имелась тенденция к ночной боли и натощак (до 57%; p<0,07 и 84%; p>0,1), связанные с ваготонией и кислотной гиперпродукцией, тогда как во 2-й группе на фоне преобладания симпатикотонии (p<0,05) боли чаще возникали вскоре после приема пищи (32%; R=0,2; p<0,05), в течение 2-3 последующих часов (55%) в сравнении с контролем (8% и 31%), отличаясь упорством, длительностью и эмоциональной окраской (80%; τ=0,3; p<0,01). Это характеризует «стирание» типичных особенностей рецидива язвенной болезни при СТД. Выраженность болевого синдрома при СТД принимала оттенок ноющих болей, чаще тупого характера (53% против 48%), тогда как в группе контроля – чаще острая (резкая, приступообразная – 60% против 43,3%; p>0,2). Сравнение частоты “атипичного” болевого синдрома (иррадиация или локализация вне эпигастрия, потеря связи с приемом пищи, отсутствие суточной динамики) показало ее различия с контролем (до 60% у больных с СТД, в контроле 20%; χ2=11,3; p<0,01), особенно при гипермобильном фенотипе и изолированном ПМК (до 66%; φ=0,4; p<0,05). Представляется важным одновременная и очевидная дисфункция билиарного тракта в виде рефлюксов и дискинезий желчного пузыря (до 70–90%) при СТД (Буланкина Е.В., 2002) и язвенной болезни. Дисфункция билиарного тракта при СТД проявляется симптомами боли в правом подреберье (до 20%), а у больных с первичным и изолированным ПМК – до 37–25% (χ2=12,6; p<0,04). Отсутствие типичного «язвенного» болевого синдрома или неопределенный абдоминальный дискомфорт в 9–10% случаев при сопутствующей СТД (при гипермобильном фенотипе в 13,3% случаев) наблюдались при хронической форме язвенной болезни (в контроле 3,8%), выявленной случайно при ЭГДФС. Таким образом, "язвенные" особенности боли у лиц с проявлениями СТД утрачивают свою яркость и выраженность, что может маскировать язвенную болезнь и приводить к ее несвоевременной диагностике. Другим ведущим клиническим проявлением был диспепсический синдром (90,2%), а наиболее частыми проявлениями его были изжога (до 63 %) и отрыжка воздухом (43%), отражающий недостаточность нижнего сфинктера пищевода с гастроэзофагеальными рефлюксами. Частота этого синдрома при язвенной болезни достоверно нарастала при выраженной СТД (γ=0,27; p<0,03 и γ=0,4; p<0,001). Полученные нами данные свидетельствуют, что при язвенной болезни у лиц молодого возраста могут преобладать диспепсические жалобы, особенно изжоги (до 80%), с нарастанием частоты диагностики ГЭРБ. Подтверждение этого факта, особенно при высокой распространенности H. pylori, имеется и в литературе (Васильев Ю.В., 2004; Wu J.C.Y. et al., 2001). В целом встречаемость диспепсических жалоб была вариабельной и достоверно нарастала при диспластических фенотипах (при первичном ПМК в 100% случаев) в сравнении с контролем (80%). Эндоскопические признаки нарушений гастродуоденальной моторики совпадали с появлением чувства тяжести и переполнения в эпигастрии после еды у больных с СТД (p>0,1). Следует заметить, что у больных с первичным ПМК частота раннего насыщения встречалась в 71%, чувство тяжести, вздутия и переполнения желудка – в 85%, рвота с предшествующей тошнотой – в 50% (в группе контроля – в 32% и 36% и 25 % случаев соответственно). На фоне СТД закономерно нарастала частота симптомов кишечной диспепсии, таких как метеоризм (34–41%), диарея (15–19%), тенденция к задержке стула (12–15%). При этом у больных с первичным ПМК и при повышенной диспластической стигматизации частота нарушения стула в виде диареи (46%; φ=0,67 и 24%; φ=0,44) превышала таковую в контроле (3,9%; χ2=7,2; р<0,01). Таким образом, течение язвенной болезни на фоне СТД можно характеризовать как атипичное в 60% случаев, с высокой частотой сочетания с ГЭРБ. При анализе болевого синдрома у больных с хроническим и эрозивным гастродуоденитом при наличии СТД частота его была достаточно высокой (58,1–63,6%; p<0,05) в виде диффузной боли (21,1–32,43%; χ2=8,1, р<0,03), тупых болей в правом подреберье (10,5–15,1%; р<0,06) в сравнении с контролем (25,5%; 5% и 0% случаев). Иррадиация боли отмечена у больных с СТД в 6,9–13,2% (p>0,18), но без типичной характеристики. В контроле боли были ограничены эпигастрием и левым подреберьем (15%), не имели иррадиации и отчетливой связи с приемом пищи, с тенденцией к появлению ночью (15%). Постоянные, тупые и распирающие боли отмечены в 1/3 случаев у больных с СТД (39–34,3%) в отличие от контроля (10,0%; р<0,04). У больных с хроническими гастритами, в отличие от язвенной болезни, ведущим был диспепсический синдром в 90,2% случаев. У больных с «предъязвенным» состоянием на фоне СТД частота желудочной диспепсии достоверно нарастала (80–91%; p<0,001), увеличивалась частота симптомов ГЭРБ (52–74%; p<0,03) и билиарной дисфункции (24-28%; p<0,05) в сравнении с контролем (30%, 25% и 5% соответственно). Тяжесть и дискомфорт в эпигастрии после еды, отрыжка воздухом, тошнота, снижение аппетита, как проявления дисмоторных расстройств, чаще наблюдали при неклассифицированном фенотипе и марфаноподобной внешности (от 30% до 63% в сравнении с контролем, 10–15%; p<0,05). Это, вероятно, было связано с более частым развитием у них хронического атрофического гастрита с секреторной недостаточностью. Следует заметить, что при повышенной диспластической стигматизации частота изжоги, снижение качества жизни, при которой сопоставимо с пациентами, имеющими даже эрозивную ГЭРБ (Ивашкин В.Т. и соавт., 2004), достигала 77,7% (φ=0,41; p<0,004), тогда как при марфаноподобном фенотипе и в контроле – не более 25–27% случаев. Больные с изолированным и первичным ПМК часто жаловались на горечь во рту, как проявление возможной билиарной дисфункции (до 28–44%; φ=0,66; p<0,05), что являлось ярким примером ассоциированной патологии «диспластического» сердца и биллиарной системы. Кишечную диспепсию и признаки синдрома малабсорбции (метеоризм, послабления стула и др.) наблюдали у каждого третьего пациента с СТД (32–37%; p<0,05), в особенности с первичным ПМК (до 50%; p<0,05) в сравнении с 5–15% в контроле. Частота атипичных клинических проявлений хронических гастродуоденитов закономерно нарастала у больных с СТД (42–56%) в сравнении с контролем (5%; p<0,001). При этом наблюдали случаи атипичного (бессимптомного) течения катарального эзофагита при марфаноподобной внешности (до 15%) и безболевой формы эрозивной ГЭРБ при гипермобильном и элерсоподобном фенотипах. Таким образом, клинические особенности язвенной болезни и различных вариантов хронического гастрита (гастродуоденита), сочетание их с формированием ГЭРБ и с нарушениями эзофагогастродуоденальной моторики диктуют необходимость выполнения ЭГДФС всем пациентам с признаками СТД с диагностической и профилактической целью даже при отсутствии выраженной клинической симптоматики. Особое внимание обращает тенденция к формированию как неэрозивной, так и эрозивной ГЭРБ у пациентов с СТД. Так, при СТД возрастала частота диагностики катарального (41–56%) и эрозивного рефлюкс-эзофагита (15–24%) у больных с эрозивными гастритами (p<0,1) и дуоденальными язвами (p<0,05), особенно часто при первичном ПМК и гипермобильном фенотипе в сравнении с контролем (27–33% и 5–16% соответственно, p<0,01). Примечательна тенденция к нарастанию частоты объективных (эндоскопических) критериев (до 44%; p<0,07) и симптомов (до 78%; φ=0,56; p<0,004) сопутствующей неэрозивной и эндоскопически негативной ГЭРБ у больных с повышенной диспластической стигматизацией. Тем не менее, обратная закономерность имела место при диспластических фенотипах с преимущественным вовлечением костно-суставной системы (33%; p<0,07 и 27%; φ=0,41; p<0,004), не превышающей таковую в контроле (25%). Это объяснялось конституциональными особенностями марфаноподобной внешности – облигатным астеническим телосложением, находящимся в обратной зависимости от частоты рефлюксной патологии. Так, большая протяженность абдоминального отдела пищевода и более острый угол Гиса могут положительно влиять на запирательную функцию нижнего пищеводного сфинктера. Гипосенситивность эзофагокардиального перехода (до 15%), включая безболевую форму эрозивной ГЭРБ при гипермобильном и элерсоподобном фенотипе, может быть объяснена гиперкатаболическим синдромом – низким индексом массы тела (p<0,05), который наряду с курением, мужским полом, является независимыми факторами риска бессимптомного течения эзофагита (ссылка скрыта T. et al., 2008). При хронических гастродуоденальных заболеваниях частота грыжа пищеводного отверстия диафрагмы, являющейся признаком СТД, нарастала с увеличением выраженности СТД до 17–33% (p<0,01), встречаясь в целом в 6,6–19% и в 2-3 раза чаще при язвенной болезни. Еще более значимые различия касались недостаточности нижнего пищеводного сфинктера. Частота ее выявления увеличивалась с нарастанием фенотипической выраженности СТД (до 57-80%; R=0,25; p<0,001) и в 2–3 раза превышающие в контроле (23–34%; p<0,008), особенно у больных с марфаноподобным и гипермобильным фенотипом, первичным ПМК. Можно полагать роль симпатикотонии (p<0,05), лежащей в основе несостоятельного антирефлюксного механизма у больных с СТД, т.к. проксимальный отдел пищевода отличается особенно высоким содержанием α-адренорецепторов. Признаки дуоденогастрального рефлюкса наблюдали в среднем у каждого второго больного всех групп, особенно при первичном ПМК и неклассифицированном фенотипе (до 60%), однако без значимых различий (p<0,4). Частота зияния привратника нарастала с выраженностью СТД, особенно у больных с первичным ПМК, неклассифицированным и гипермобильным фенотипом (до 62,0%; p<0,002), в три раза чаще встречаясь при язвенной болезни (до 40%), чем при предъязвенных состояниях (13%), в сравнении с контролем (20,8%; p<0,007 и 3%; p<0,05 соответственно). В развитии нарушений замыкательной и антирефлюксной функции сфинктера привратника важную роль играют аномалии формы и расположения луковицы двенадцатиперстной кишки в 8–11,2% до 20,0–63% при диспластических фенотипах (p<0,05). Наиболее частыми патологическими изменениями при эндоскопии были признаки воспаления антропилоробульбарной слизистой оболочки, но без значимых различий. Эндоскопическую картину эрозивного гастрита (острые эрозии) при всех изучаемых нозологиях наблюдали в 12,7–20%, чаще (p<0,04) у лиц с неклассифицированным фенотипом (44%), повышенной диспластической стигматизацией (26,3%) и марфаноподобной внешностью (25%). Примечательна высокая частота выявления острых эрозий в периульцерозной зоне у пациентов с первичным ПМК (70%) и гипермобильным фенотипом (62,5%) в сравнении с контролем (30,0%, p<0,03), что указывало на формирование и рубцевание язвенного дефекта происходило с выраженным фоновым эрозивным бульбитом. При эндоскопии частота острых эрозий с разной локализацией, сопутствующих язвам, на фоне СТД была выше, чем в контроле (62,2–66,7% против 36,7%; p<0,03), особенно у больных с первичным ПМК (80,0%; φ=0,42), гипермобильным фенотипом (62,5%; φ=0,14) и повышенной диспластической стигматизацией (70%; φ=0,42). Важно отметить тенденцию к локализации эрозий одновременно в смежных зонах эзофагогастродуоденальной слизистой оболочки при СТД (27–38%, в контроле 20%; p<0,17), с максимальной вероятностью одновременного их выявления в пищеводе, желудке и двенадцатиперстной кишке при гипермобильном фенотипе и первичном ПМК. Анализ топики язвенных дефектов показал отсутствие различий по частоте локализации отдельных дуоденальных язв с низкой частотой их образования на задней стенке луковицы двенадцатиперстной кишки, но с тенденцией к преобладанию частоты т.н. “зеркальных” язв – 35% на фоне выраженной СТД. Хронические эрозии чаще обнаруживали у больных с марфаноподобной внешностью и гипермобильным фенотипом (6,3–16,7%, в контроле 5%). Полученные нами данные о высокой частоте рефлюксных явлений и дисфункции сфинктеров пищевода и желудка подтверждают точку зрения о ведущей роли эзофагогастродуоденальной дисмоторики в развитии диспепсических явлений, но при СТД эти нарушения становятся особенно выраженными. Особенности вегетативной регуляции у больных с эзофагогастродуоденальными заболеваниями в сочетании с СТД. В целом при изучаемых заболеваниях спектр изменений ВНС без учета сопутствующей СТД носил предсказуемый характер и отражал классические представления о преобладании симпатических влияний при эрозивных гастритах и ваготонической направленности при язвенной болезни. Это выражалось в смещении индекса симпатовагального взаимодействия (p<0,05) с уменьшением парасимпатических влияний (HF) (p<0,02) на общую модуляцию сердечного ритма у больных с эрозивным эзофагогастродуоденитом. У больных язвенной болезнью, напротив, мощность высокочастотных колебаний (HF) значимо увеличивалась на более 45% (p<0,002). Однако на фоне СТД исходные нарушения вегетативной регуляции в целом заключались в виде симпатовагального дисбаланса с преобладанием симпатического компонента. У больных с эрозивными эзофагогастродуоденитами отмечалось снижение общей мощности спектра нейрогуморальной регуляции (TP) в 1-й (4022,9391,3 мс2; p<0,01) и, особенно, во 2-й группе, почти в 2 раза (3645,8428,8 мс2; p<0,001), выходившее за границы 25% процентиля нормативных величин у здоровых лиц (4384,0 мс2/Гц) в сравнении с контрольной группой (7578,851083,3 мс2/Гц), что характеризовало снижение текущего функционального состояния. Кроме того, между уменьшением TP и нарастанием выраженности СТД была установлена отрицательная корреляция (R=–0,4; p<0,001). Снижение показателя SDNN в 1-й (p<0,05) и во 2-й группах в сравнении с контролем свидетельствовало о смещении вегетативного баланса. Оказалось, что индекс, характеризующий баланс симпатических и парасимпатических влияний, достоверно был увеличен в 1-й (1,130,1; p<0,02) и, почти в 2 раза, во 2-й (1,290,1; p<0,002) группе в сравнение с контролем (0,690,1; F-критерий=5,1; p<0,008). Следует отметить значимое увеличение LF/HF во 2-й группе больных в сравнении и со здоровыми лицами (1,11±0,1; p<0,05), что указывало на имеющиеся у них более значимые сосудистые дистонические изменения, негативно сказывающиеся на трофике и резистентности гастродуоденальной слизистой оболочки. Высокочастотные колебания сердечного ритма (HF, мс2), отражающие парасимпатическую активность, были снижены в 1-й (1309,3172,7; p<0,002) и во 2-й (1419,5203,8; p<0,002) группе в сравнение с контролем (3126,9534,9). Различия в спектральном анализе касались уменьшения волны очень медленного порядка до 27% (p<0,02) за счет повышения модулирующего влияния симпатического отдела (F-критерий=2,2; p<0,1) ВНС у больных 2-й группы в сравнении с контролем (до 36%). Низкочастотные колебания (LF, мс2) преобладали также и в 1-й группе (p<0,005). Характер указанных изменений подтверждался и при расчете спектральной мощность низких и высоких частот в нормализованных единицах. В частности, процентный вклад LF в общую мощность спектра (за вычетом мощности VLF-компонента) был повышен в 1-й и во 2-й группе до 50% в сравнении с контролем – 36,5% (p<0,003). Среди диспластических фенотипов с нарастанием их фенотипической выраженности было отмечено резкое снижение суммарной активности нейрогуморальных влияний на сердечный ритм (p<0,05). По другим спектральным параметрам ВРС достоверное отличие выявлено только в уменьшении SDNN у больных с повышенной диспластической стигматизацией (p<0,05). Проведение КВТ позволило количественно оценить функцию сегментарного отдела ВНС в регуляции сердечной деятельности. Реакция на стимуляцию парасимпатического отдела ВНС при дыхательной пробе в группах с СТД была неоднородной. Так, достоверно был снижен показатель Кдых во 2-й группе (1,25±0,08; p<0,05), выходивший за границы доверительного интервала у здоровых лиц (25% процентиля; 1,31) в сравнении с контрольной (1,46±6,85) и 1-й группой (1,48±0,08). Также достоверно был снижен КВальс во 2-й группе (1,38±0,09) в сравнении с контролем (1,64±0,13; p<0,03) и 1-й группой (1,78±0,11; p<0,03). Реактивность парасимпатического отдела ВНС при проведении ортостатической пробы во всех исследуемых группах находилась в пределах условной нормы, не выходившей за границы 25% процентиля здоровых лиц. В реакции с изометрическим напряжением у больных 2-й группы при апостериорном сравнении отмечалась недостаточность симпатической функции – более выраженное снижение артериального давления (-6,772,1; мм рт.ст.) в сравнении с контролем (-0,02,1 мм рт.ст.; p<0,05). Каких либо достоверных отличий по симпатической реактивности (прирост уровня АД) не выявлено. Уровень функционирования физиологической системы, текущее функциональное состояние и суммарная оценка адаптационных резервов организма характеризовались как «сниженный – удовлетворительный» и без статистических различий. Однако индекс напряжения был достоверно увеличен во 2-й группе (152,5±29,4 у.е.) в сравнении с контролем (76,2±9,5 у.е.; p<0,02) и 1-й группой (58,28±10,4 у.е.; p<0,02), что было связано с психоэмоциональным перенапряжении и увеличением стрессовых факторов, у них до 50%. Однонаправленные, но более выраженные изменения, были вывялены у больных с язвенной болезнью. Оценка волновой структуры синусового ритма выявила дисбаланс всех звеньев ВНС с истощением ее адаптационных резервов во взаимосвязи с выраженностью СТД. В структуре спектральной мощности обнаружена тенденция к увеличению доли волн медленного порядка (VLF-компонента) при нарастании выраженности СТД (24–29% в сравнении с 20% в контроле). Это характеризует переход регуляции ВРС на более низкий метаболический уровень и повышение активности гуморально-метаболических влияний с возможным увеличением риска образования стресс-обусловленных острых язв на фоне СТД. Индекс напряжения у больных 1-й группы в сравнении с контролем был достоверно снижен (p<0,05), характеризуя снижение адаптационно-компенсаторных возможностей центрального контура нервной регуляции. В структуре спектральной мощности доля волн высокочастотного компонента (НF, %) в контроле (56,93,6) достоверно превышала показатели 1-й и 2-й групп (39,14,4; p<0,007 и 45,63,5; p<0,01). Мощность высокочастотных колебаний сердечного ритма в контроле была выше 40% от суммарной мощности спектра, что рассматривалось как показатель резкого повышения парасимпатической активности, отражая классическое течение язвенной болезни с преобладанием ваготонических влияний. Кроме того, в контроле имел место явный дефицит симпатической активности со значимым смещением индекса вагосимпатического взаимодействия в сторону парасимпатических влияний (0,42±0,1; p<0,002) в сравнении с больными 1-й (1,051±0,12) и 2-й группы (0,86±0,1). Напротив, у больных 1-й и, меньше, 2-й группы индекс LF/HF приближался к значению у здоровых лиц. Однако в структуре спектральной мощности была обнаружена тенденция к повышению доли волн LF (%) во 2-й и 1-й группе (30,642,9 и 30,982,9) в сравнении контролем (22,72,5, p<0,05), что, позволяло судить об относительном усилении симпатических влияний. Только у больных с выраженной СТД имелись признаки симпатикотонии на фоне относительной периферической симпатической и парасимпатической недостаточности, что проявлялось снижением прироста АДд при проведении пробы с изометрическим напряжением (-6,0±4,9 против 9,3±5,1 мм рт.ст. в контроле (p<0,01) и 6,0±0,7 мм рт.ст. в 1-й группе (р<0,05)) с уменьшением коэффициента К30:15 (p<0,05). Так, реактивность парасимпатического отдела ВНС при ортостатической пробе у больных 1-й группы находилась в пределах условной нормы (1,33±0,14), недостоверно превышая показатели в контроле (1,16±0,04; p>0,2), тогда как во 2-й группе они были снижены (1,14±0,07; p<0,05). Кроме того, на ухудшение парасимпатической функции у больных 2-й группы указывало достоверное снижение Кдых при проведении пробы с глубоким управляемым дыханием (до 1,22) в сравнении с контролем (1,35±0,025; р<0,05). Это еще раз подтверждает, что симпато-парасимпатический баланс не всегда имеет прямолинейную зависимость между активацией симпатического и угнетением парасимпатического отдела ВНС. При проведении фоновой записи ВРС была обнаружена тенденция к снижению общей спектральной мощности (ТР, мс2) у больных 1-й группы (5488,9878,4; p<0,06) и достоверное уменьшение во 2-й группе (4176,0558,4; p<0,04) в сравнении с контролем (6798,41265,4). Среди диспластических фенотипов был выявлен достоверный дефицит спектральной мощности HF (н. ед). только у больных с гипермобильным фенотипом (p<0,01), повышенной диспластической стигматизацией (p<0,003) и изолированным ПМК (p<0,008). В целом, указанные изменения вегетативной регуляции системного кровообращения у больных язвенной болезнью в сочетании с СТД, указывают на снижение положительных проявлений симпатоадреналовой активации вегетативных функций. |
