Патогенетическое обоснование восстановительного лечения нефропатий, сочетанных с нарушениями липидного обмена 14. 00. 51 восстановительная медицина, лечебная физкультура, спортивная медицина, курортология и физиотерапия 14. 00. 16 патологическая физиология
| Вид материала | Автореферат |
СодержаниеРезультаты и обсуждение Модель нефрокальциноза Модель кардиоренальной патологии |
- Структурно-резонансная электромагнитотерапия и жидкие синбиотики в восстановительном, 348.4kb.
- Восстановительное лечение детей первого года жизни с врожденной патологией тазобедренных, 535.09kb.
- Комплексная оценка эффективности патогенетической и восстановительной терапии больных, 611.78kb.
- Стабилометрия в диагностике и лечении детей с гемипаретической формой детского церебрального, 219.34kb.
- Оценка и коррекция функциональных нарушений у детей раннего возраста в зависимости, 319.48kb.
- Восстановительное лечение больных затяжной пневмонией с использованием природного нафталана, 299.26kb.
- Дыхательная гимнастика в комплексной реабилитации детей больных аллергическим ринитом, 264.09kb.
- Аретинский виталий борисович система восстановительного лечения после операций аортокоронарного, 507.23kb.
- Методологические основы и принципы дифференцированного применения технологий восстановительного, 814.91kb.
- Шуляковский владимир владимировыич, 511.31kb.
Из клинически обследованных 1083 человек (709 женщин и 374 мужчин в возрасте 18-69 лет), составивших основную когорту с ДЛП, методом направленного отбора были выделены 360 больных с заболеванием почек, из них 236 женщин (65,5%) и 134 мужчины (34,5%), средний возраст пациентов составил 47,3±2,4 года. Среди обследованных первичный пиелонефрит верифицирован у 86 человек (23,9%), вторичный пиелонефрит – у 274 пациентов (76,1%) (классификация Пытеля А.Я., 1977). Хронический вторичный пиелонефрит, обусловленный МКБ, выявлен у 165 больных (60,2%), дисметаболическими нарушениями - у 37 пациентов (13,5%), врожденными аномалиями почек (удвоение почек и мочеточников, «подковообразная почка») - у 72 больных (26,3%). У 93 пациентов нефропатия сопровождалась заболеваниями ССС, из них стабильная стенокардия напряжения I-II ФК диагностирована у 34 человек, постинфарктный кардиосклероз - у 23 пациентов, ГБ II-III стадии, cтепень АГ 1-2, риск 3-4 - у 21 человека (классификация ВКНЦ, 1983; ВНОК, 2004). Длительность основного заболевания варьировала от 3 до 15 лет. Данные клинико-лабораторного обследования свидетельствовали, что 40,6% пациентов находились в стадии частичной клинико-лабораторной ремиссии. Группы обследованных больных были сопоставимы по полу, возрасту, длительности нефропатии. По окончании первичного обследования пациенты были рандомизированы на 5 подгрупп для проведения 21-дневного курса восстановительной терапии.
В клинических исследованиях использовали энтеросорбент на основе альгиновой кислоты «Марилам» (РУ МЗРФ №001514.Р.643. 08.2000) по 2 капсулы 2 раза в день; ПНЖК морского происхождения в виде БАД из жира лосося «Омега 3 плюс» (РУ МЗРФ №003841.И.81802.2002.), капсула 300 мг ω3ПНЖК содержит эйкозапентаеновую кислоту (ЭПК) -180 мг, докозагексаеновую кислоту (ДГК) – 120 мг; минеральную воду Шмаковского типа (внутрь 1% от массы тела/сут. и общие ванны). Больные контрольной группы получали гиполипидемический препарат группы статинов холетар (KRKA) однократно по 20 мг в сутки.
Материалом в экспериментальных исследованиях служили сыворотка и эритроциты крови, моча, ткань почек, сердца. Материалами клинического исследования являлись индивидуальные «Анкеты тематического больного», сыворотка и эритроциты крови, моча, результаты рентгеноурологического обследования и протоколы ультразвукового исследования почек, электрокардиограммы.
В сыворотке крови и моче определяли электролиты (натрий, калий, кальций, магний, фосфор) на ионометре EF - HK “Fresenins” (Германия); мочевину, креатинин, общий белок и фракции, фибриноген, мочевую кислоту на биохимическом анализаторе FP-901М фирмы “Labsystem” (Финляндия). Содержание общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС ЛПВП), триглицеридов (ТГ) в сыворотке крови определяли на биохимическом анализаторе “Cobas mira” (Австрия-Швейцария). Содержание ХС в липопротеинах низкой и очень низкой плотности (ХС ЛПНП, ХС ЛПОНП), индекс атерогенности (ИА) рассчитывали по формулам Фридвальда (Климов А.Н., 1999).
Экстракцию липидов из эритроцитов проводили модифицированным методом Bligh, Dyer (1959). Разделение фосфолипидов (ФЛ) по классам осуществляли методом двумерной микротонкослойной хроматографии (Svetashev V.I., Vaskovsky V.E., 1972). Количественный анализ отдельных классов ФЛ проводили по методу V.E Vaskovsky et al. (1975). Содержание каждого компонента представляли в процентах от суммы общих ФЛ эритроцитов. Газожидкостную хроматографию метиловых эфиров жирных кислот (ЖК) выполняли на газожидкостном хроматографе “Shimadzu-9A” (Япония) с пламенно-ионизационным детектором. Метиловые эфиры ЖК липидов эритроцитов получали по методу J.P.Carreau et al. (1978), очищали с помощью тонкослойной хроматографии. Идентификацию проводили с помощью стандартных смесей ЖК и по значениям эквивалентной длины цепи (Jamieson G.R. 1975, Stransky K et al., 1992). Количественные расчеты выполняли с помощью стандартного математического обеспечения системы обработки данных Chromatopak-CR 3A.
Ткань почек, сердца животных гомогенезировали при температуре 4-5С в буферном растворе, содержащем 0,05М трис-HCl, 0,15М KCl и 0,001М ЭДТ, рH 7,8. Разделение нейтральных липидов (НЛ) почек, сердца по фракциям (ХС, ТГ, СЖК, ЭХС) осуществляли методом одномерной хроматографии. Количественное определение по классам после разделения на хроматограммах проводили бихроматным методом (Кейтс М., 1975).
Для оценки процессов ПОЛ в эритроцитах определяли содержание малонового диальдегида (МДА) по методу М.С.Гончаренко (1985); диеновых коньюгатов (ДК) и шиффовых оснований (ШО) - по методикам Ю.А.Владимирова, А.Ю.Арчакова (1972) и Shimasaki H. et al.(1988) соответственно. Концентрацию ДК в крови и в почках выражали в нмолях на мг липидов, ШО – в усл. ед. на мг липидов. О состоянии системы антиоксидантной защиты (АОЗ) судили по интегральному показателю АОА плазмы крови (Клебанов Г.И. и др., 1988). В крови количество восстановленного глутатиона (ГЛ) определяли по методу Еllman (1959). Активность глутатионредуктазы (ГР) определяли по скорости окисления НАДФН в присутствии окисленного ГЛ (Habig W.U. et al., 1974). Активность глутатионпероксидазы (ГПО) определяли по изменению поглощения восстановленного ГЛ после инкубации в присутствии перекиси водорода (Mills T.C., 1985). В ткани почек определяли -токоферол (-ТФ) и витамин А (vit А) (Черняускене Р.Ч. и др., 1984; Bidlack K.W. et al., 1973).
Статистическая обработка материала включала методы расчета обобщающих коэффициентов, характеризующие различные стороны каждого из признаков (средняя величина – М, ошибка средней – m, среднее квадратичное отклонение – , коэффициент вариации – С); методы многомерной статистики (факторный, корреляционный, кластерный анализ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экспериментальные исследования. Программа эксперимента была направлена на изучение механизмов формирования метаболических нарушений и их воздействие на функции почек при экспериментальном нефрокальцинозе, как модели собственной почечной патологии обменного генеза и экспериментальной кардиоренальной патологии как варианта сочетанной сердечно-сосудистой и нефрологической патологии, что и определило дизайн биохимических и специальных методов исследования на тканевом и клеточном уровнях. Экспериментальные исследования включали 2 серии опытов. В каждой серии опытов интактные животные, находившиеся на обычном лабораторном рационе, являлись контролем (1-я группа).
Модель нефрокальциноза сопровождалась нарушением функций почек у животных, накоплением продуктов азотистого, пуринового обменов в сыворотке крови: суточный и минутный диурез был снижен (р0,01), концентрация креатинина, мочевины, мочевой кислоты увеличена (р0,01). Диспротеинемия отмечалась за счет снижения фракции альбумина и повышения фракции 2-глобулина (р0,01). Снижение суточной экскреции катионов натрия и калия в моче (р0,05) при повышении концентрации этих электролитов в сыворотке свидетельствовало об их депонировании в клетках в условиях метаболической кальцификации и нарушении K/Na баланса в организме животных. Одними из ведущих патогенетических критериев НФК была развившаяся гипермагниемия и гиперфосфатемия. Формированию модели нефрокальциноза сопутствовало нарушение концентрационной функции тубулярной системы. Нарушения обмена мочевой кислоты, характеризующиеся развитием гиперурикемии на фоне снижения концентрации мочевой кислоты в моче, и выявленные при этом патологические изменения уровня оксалатов являются неблагоприятными прогностическими критериями в отношении ухудшения функции почек и риска развития уратного тубулоинтерстициального нефрита. В условиях повышенного содержания катионов кальция в моче и почечной ткани (р0,01) при сниженной выделительной функции почек в канальцевой системе почек создаются благоприятные условия для формирования процессов кальцификации, что и наблюдалось у животных с НФК. Повышение реабсорбции кальция, имеющего единый транспортный механизм в канальцевой системе с ионами магния, реабсорбция которого также повышена, можно рассматривать как патогенетический механизм формирования метаболических нарушений при НФК.
Модель НФК характеризовалась нарушением липидного спектра сыворотки крови. Количество общих липидов (ОЛ) в крови животных с НФК превышало данные показатели у интактных крыс (р<0,01). Отмечалось повышение атерогенных фракций ХС ЛПНП (р<0,01) при снижении ХС ЛПВП (р<0,05), обладающих антиатерогенным действием.
При исследовании содержания общих фосфолипидов (ОФЛ) выявлено увеличение их уровня в эритроцитах и моче (р<0,01), характеризующих процессы мембранодеструкции в условиях НФК (рис.1). Помимо увеличения содержания ОФЛ менялось и соотношение практически всех фракций фосфолипидов. В эритроцитах происходило увеличение количества фосфатидилсерина (ФС), сфингомиелина (СМ) и фосфатидилэтаноламина (ФЭ) (р<0,01), обусловивших превышение суммарного содержания ФЛ внутреннего слоя мембран эритроцитов (ФС+ФЭ) над наружным (ФХ+СМ).
В моче животных с НФК направленность сдвигов в содержании ФЛ была иная. Выявлено увеличение суммарных компонентов наружного слоя цитомембран эпителия нефрона фракций СМ и ФХ (р<0,01).
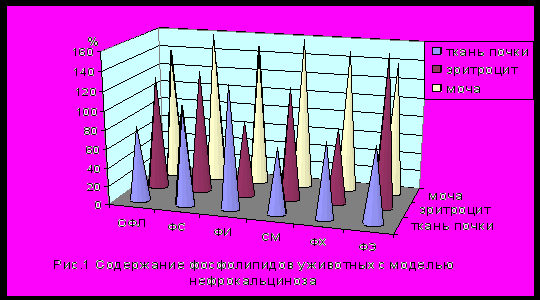
В почечной ткани установлено снижение содержания ОФЛ и практически всех фракций ФЛ на фоне повышения содержания фосфатидилинозитола (ФИ) (р<0,01), обусловивших увеличение суммарного содержания ФЛ внутреннего слоя мембран нефротелия.
Об усилении процессов липогенеза при НФК свидетельствовало накопление нейтральных липидов в почечной ткани: повысился уровень ОЛ (р<0,05) и ОХC (р<0,05). При этом, СЖК, являющиеся источником энергии для цельной перфузируемой почки, в условиях сокращения количества полноценно функционирующей паренхимы у крыс с НФК накапливались в ткани (р<0,01). Нарушение функции почек, усиление липогенеза, структурное перераспределение мембранных липидов отражали процессы интоксикации, мембранодеструкции, протекающие у крыс с НФК.
Активация процессов эндогенной интоксикации у животных с НФК являлась пусковым механизмом липопероксидации. Активно происходило окисление липидов крови, в результате которого уровни ДК, МДА, ШО превысили значения соответствующих показателей в 1-й группе (р0,01). Состояние АОС крови крыс при НФК характеризовалось снижением содержания -токоферола (р0,01) и повышением уровня витамина А (р0,01). При этом ферментативное звено антиперекисной защиты характеризовалось низкой активностью ГПО и ГР – ферментов (р0,01), участвующих в биорегенерации ГЛ при снижении уровня восстановленного ГЛ (р0,01). При этом интегральный показатель АОА, характеризующий суммарную активность ингибиторов свободнорадикального окисления в крови, снизился (р0,01). В ткани почек животных отмечалось достоверное повышение концентрации всех продуктов ПОЛ в условиях экспериментального НФК.
Ответная реакция системы АОЗ почек характеризовалась угнетением ее витаминного звена. В почечной ткани экспериментальных животных с моделью НФК снизилось содержание эндогенных антиоксидантов -ТФ и в большей степени витамина А (р0,01). Состояние АОС крови при НФК характеризовалось ее угнетением и обусловлено интенсификацией процессов ПОЛ. В результате активации процессов пероксидации липидов происходит увеличение потребления эндогенных антиоксидантов, что соответствует их пониженному содержанию в крови по сравнению с интактными животными. Состояние ПОЛ подтверждает активизацию механизмов повреждения структурной и функциональной организации клеточных мембран в биологических средах и тканях почек как главного патогенетического звена при НФК.
Модель кардиоренальной патологии сопровождалась нарушением гомеостатических функций почек: снижением у животных суточного диуреза (p<0,05), повышением концентрации креатинина в сыворотке крови и моче на (p<0,01), сопряженных со снижением канальцевой реабсорбции, почечного клиренса и суточной экскреции (p<0,05). Отмечалось снижение в сыворотке крови концентрации ионов калия и магния (p<0,01), увеличение концентрации кальция. В моче экспериментальных животных определялось увеличение концентрации ионов натрия и снижение концентрации калия, кальция, магния (p<0,05). В 2 раза увеличилась концентрация оксалатов в моче животных (p<0,01) на фоне повышенной суточной экскреции данного метаболита. В условиях электролитного дисбаланса выявлено повышение уровня фосфолипидов в сыворотке крови (p<0,05) и моче (p<0,01).
Дестабилизация мембран эпителия нефрона у крыс с моделью электролитной нефропатии связана с процессами кристаллообразования. Важная роль при этом принадлежит образованию продуктов метаболизма фосфолипидов, оказывающих стимулирующее влияние на процессы кристаллизации солей в моче. Диета, насыщенная электролитами натрия, усугубленная инъекциями гидрокортизона ацетата, при резком дефиците калия и магния, снижающем чувствительность дистальных канальцев к АДГ и нарушающем функции клеточных насосов, вызвала у животных соответствующие патологические изменения электролитного обмена, сопровождающиеся нарушением процессов концентрирования, реабсорбции, снижением детоксикационной и диуретической функций почек.
Модель КРП сопровождалась увеличением уровня общего ХС в сыворотке крови (р0,05), выраженным увеличением ТГ (р0,01), ХС в атерогенных классах липопротеинов ЛПНП и ЛПОНП (р0,05), при этом ИА увеличился в 2,7 раза (р0,01). В тканях сердца и почек наблюдалось накопление общих липидов, свидетельствующее об усилении процессов липогенеза у животных с экспериментальной КРП и имеющее прямую зависимость от увеличения веса этих органов. Данные изменения были наиболее интенсивными в ткани сердца, где содержание ОЛ увеличилось в 4 раза (р<0,01). Отмечалось увеличение фракции нейтральных липидов – ХС и ТГ (р<0,01), при этом снижалось количество СЖК и ЭХС (р<0,05). Наблюдаемое снижение уровня СЖК в сердечной ткани крыс вероятно связано с усиленным включением их в состав ТГ, содержание которых возрастало. Следует предположить, что накопление ТГ в тканях сердца обусловлено уменьшением активности липопротеинлипазы эндотелиальных клеток сосудов. Специфичностью спектра нейтральных липидов почечной ткани было повышение количества ЭХС (р<0,05), СЖК и ЭЖК на фоне снижения количества ТГ (р<0,01) и ХС (р<0,05).
В эритроцитах крыс с КРП наблюдалось снижение ФС (р0,01), увеличение ФЭ и СМ (р0,05), что характеризует изменение вязко-эластических свойств эритроцитов, увеличение жесткости их мембран, приводящее к нарушению функционирования транспортных и ферментных систем клетки (рис.2). При определении фракций ФЛ в моче выявлена модификация ФЛ цитомембран эпителия канальцев, выраженная снижением доли ФЭ и увеличением ФХ (р0,01). Перераспределение фосфолипидного спектра почечной ткани при КРП характеризовалось снижением уровня ФС (р0,05) и увеличением содержания ФИ, ФЭ и ФХ.
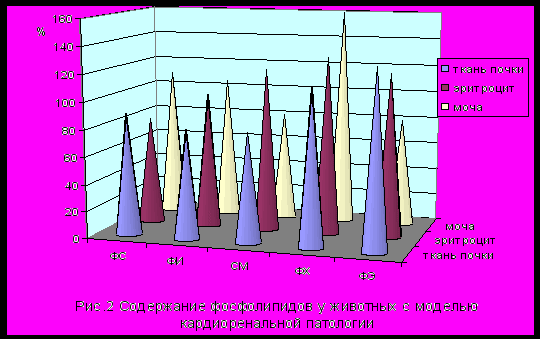
Выявленные особенности обмена мембранных фосфолипидов у животных с моделью КРП свидетельствовали о нарушении структурно-функционального состава липидов клетки в условиях электролитного дисбаланса.
Развитие модели КРП сопровождалось изменением количественного состава ЖК в биологических объектах. В липидах эритроцитов крыс преобладали повышенные уровни насыщенных ЖК: увеличено содержание миристиновой (14:0) (р0,01), наблюдалась тенденция к увеличению стеариновой (18:0) ЖК. Относительное содержание моноеновых кислот менялось разнонаправлено: выявлены повышенные значения для 18:19 (р0,05), пониженные – для 16:17 (р0,01) и 18:17 (р0,01). Среди полиненасыщенных 6 ЖК достоверные изменения выявлены для линолевой 18:2, ее относительное содержание было высоким (р0,01). Уровень арахидоновой ЖК 20:4 снижался и в эритроцитах и ткани почек (р0,01), такая же направленность изменения выявлена и для 22:6 6. Наблюдалось снижение 3 ЖК: эйкозапентаеновой 20:53 в эритроцитах (р0,001), в почках (р0,01) и тенденция к снижению докозагексаеновой 22:63 кислоты. Индекс ненасыщенности (ИН), характеризующий суммарные изменения в составе ЖК, у крыс с КРП был низким в эритроцитах и почечной ткани (р0,01) (табл.1). Причина изменения количественного состава ЖК довольно часто заключается в нарушении их метаболизма.
Таблица 1
Динамика суммарных показателей ЖК у крыс с моделью
кардиоренальной патологии
| Показатель | Интактные, n=10 | Модель КРП, n=10 | ||
| эритроциты | почка | эритроциты | почка | |
| 20-226 | 25,021,83 | 25,31,27 | 20,971,62 | 27,650,61 |
| 20-223 | 4,870,28 | 2,780,35 | 4,050,51 | 2,130,21 |
| 20-223/ 20-226 | 0,180,01 | 0,100,05 | 0,190,01 | 0,110,01 |
| 6 | 34,420,46 | 36,181,26 | 32,001,53 | 41,781,08* |
| 3 | 4,950,28 | 2,780,15 | 4,100,49 | 2,130,35 |
| 3/6 | 0,150,01 | 0,110,02 | 0,130,01 | 0,100,01 |
| ИН | 164,282,51 | 169,413,50 | 144,307,88* | 145,61,78** |
