Получение и использование моноклональных антител в диагностике гриппа птиц 16. 00. 03 ветеринарная микробиология, вирусология, эпизоотология, микология с микотоксикологией и иммунология
| Вид материала | Автореферат |
- Иммунный статус поросят при пневмонии, вызванной вирусом репродуктивно-респираторного, 398.05kb.
- Функциональная и рецепторная характеристика белков суперсемейства иммуноглобулинов, 1127.13kb.
- Эпизоотологический мониторинг и иммунопрофилактика классической чумы свиней и болезни, 755.76kb.
- Совершенствование системы ветеринарно-профилактических мероприятий и её влияние, 471.82kb.
- Темы рефератов для поступления в аспирантуру по научной специальности 06. 02. 02 ветеринарная, 14.27kb.
- Кудряшова жанна Алексеевна Теоретические и практические аспекты новых подходов профилактики, 392.23kb.
- Оптимизация системы контроля эпизоотического процесса некробактериоза крупного рогатого, 1086.61kb.
- Программа вступительного экзамена в аспирантуру по специальной дисциплине 06. 02., 270.79kb.
- Терапевтическая эффективность гинодиксина при эндометритах и маститах у коров, вызванных, 301.79kb.
- Резервуары лиссавирусов на территориях, стационарно неблагополучных по бешенству 16., 223.09kb.
ОСНОВНАЯ ЧАСТЬ
Работа выполнена в течение 2006-2009гг. в Научно-исследовательском институте биотехнологии КАТУ им. С.Сейфуллина.
В основу настоящей диссертационной работы положены материалы, полученные в результате выполнения проекта: «Получение моноклональных антител к вирусу высокопатогенного гриппа птиц и разработка на их основе диагностической тест-системы» в рамках программы «Разработка современных технологий для формирования кластера по биотехнологии в Республике Казахстан на 2006-2008 годы».
Отдельные фрагменты работы проводились в Государственном Учреждении «Национальный референтный центр в ветеринарии» КГИ в АПК МСХ РК (получение аллантоисной жидкости), «Национальном центре биотехнологии» МОН РК (очистка и концентрирование антигена методом ультрацентрифугирования), в Научно-исследовательском институте проблем биологической безопасности НЦБ МОН РК (электронное микроскопирование).
Материалы и методы исследования
В экспериментах были использованы следующие животные: белые мыши беспородные в количестве 125 голов и 30 мышей линии BALB/c 7-8 недельного возраста, 5-7 месячные кролики в количестве 2 головы с живой массой 2,5-3,0 кг.
В работе использован вакцинный препарат из эмульгированной инактивированной вакцины штамма Н5 (г. Владимир), коммерческий антиген Н5N1 (референс-лаборатория по гриппу птиц Института зоопрофилактики, Италия) и антиген из аллантоисной жидкости куриных эмбрионов, зараженных вирусом полевого штамма Н5N1.
При определении специфичности моноклональных антител в иммуноферментном анализе были использованы: панель штаммов референс-антигенов: Н5N1, H1N1, H3N8, H4N8, H5N2, H7N3, H9N7, H10N1, H11N9, H12N5, H13N6, H14N5, H15N6 (референс-лаборатория по гриппу птиц Института зоопрофилактики, Италия), антигены вируса болезни Ньюкасла, антигены вируса болезни Гамборо, инфекционного ларинготрахеита, болезни Ауески штамм «УБ-95».
Коммерческие наборы для диагностики гриппа птиц: ИФА «Influenzu A. IDVET» для выявления антител вируса гриппа птиц конкурентным методом (производство Франция), ИФА для обнаружения специфических антител («Biotech Group» Казахстан), тест-система «Грипп» для выявления вируса гриппа животных и птиц с последующей идентификацией гемагглютининов Н5 и Н7 методом классической полимеразной цепной реакции (ФГУН ЦНИИЭ Роспотребнадзора, РФ), иммунохроматографические тесты для выявления вируса гриппа птиц типа А, подтипа Н5 (фирма Antigen, Корея) и (фирма СerTest, Испания).
Получение антигенных препаратов: Антиген №1. К вакцине эмульгированной, инактивированной против гриппа птиц штамма Н5 (г. Владимир, Россия) добавляли равный объем 96% и 70% этилового спирта, перемешивали в течение 2ч. при комнатной температуре и центрифугировали при 3000 об/мин. В результате наблюдали образование трех фракций, которые использовали в качестве антигенов (соответственно, 1, 2, 3 фракция антигена №1).
Антиген №2. Коммерческий лиофилизированный антиген вируса гриппа птиц штамма Н5N1 (Италия), серия 47/08, который ресуспендировали в 1 мл дистиллированной воды.
Антиген №3. Для получения антигена, осветленную аллантоисную жидкость, концентрировали высокоскоростным центрифугированием (Beckman L8-80M, тип ротора SW 27) при 27 000 об/мин в течение 2 часов при +4º С. Осадок ресуспендировали в ЗФР и продолжали очистку в градиенте плотности сахарозы (20, 40, 60%) с тем же режимом ультрацентрифугирования. Для дальнейшей работы отбирали опалесцирующую фракцию, отмывали от сахарозы. Концентрацию белка определяли по методу Бредфорд (1976).
Электрофорез белковых антигенов проводили в 7% и 10% полиакриламидном геле по методу J. Laemmli et al. (1970). Электрофоретический перенос антигенов из геля на нитроцеллюлозную мембрану осуществляли с помощью прибора для иммуноблотинга по методу Н. Towbin et al. (1979).
Гибридомная техника. Иммунизацию лабораторных животных (мышей) проводили по методу И.И. Фридлянской (1987). Мышам в первый день иммунизации вводили внутрибрюшинно по 100 мкг антигена в 0,1 мл неполного адъюванта Фрейнда (Sigma, США). На 7, 11, 12, 13 дни иммунизации животным инъецировали по 100 мкг антигена в забуференном физиологическом растворе, рН 7,2-7,4.
Гибридомы получали путем слияния лимфоцитов мышей линии BALB/c, стимулированных антигеном вируса гриппа птиц штамма H5N1 с клетками миеломной линии Х63 – Ag 8.653. В качестве сливающего агента использовали раствор полиэтиленгликоля с молекулярной массой 4000 (ПЭГ-4000). Методом лимитирующих разведений (J. Coding et. al., 1980) клонировали гибридные клетки. Методом высаливания насыщенным раствором сульфата аммония, выделяли полученные иммуноглобулины из асцитной жидкости.
Активность и специфичность полученных моноклональных антител определяли в непрямом варианте ИФА. Константу связывания моноклональных антител устанавливали по методу J. Beatty (1987). Класс и подкласс моноклональных антител определяли в реакции двойной иммунодиффузии по методу O. Ouchterlony (1958) с использованием моноспецифических сывороток.
Постановку иммуноферментного анализа проводили по общепринятой методике.
Результаты исследований
Получение и характеристика антигенов гриппа птиц
Проведены исследования по возможности получения антигена вируса гриппа птиц методом спиртовой преципитации из вакцинного препарата. В результате наблюдали образование двух жидких фракций, и осадка. В лабораторных условиях изучали белковый состав двух жидких фракций вакцинного антигена, для чего использовали метод электрофореза. В результате установлено, что во фракциях №2 после обработки 70% и 96% этиловым спиртом, имеются белки, молекулярная масса которых равна 24 кД.
Для получения иммунной сыворотки нами были иммунизированы полученным антигеном лабораторные мыши по схеме Фридлянской (1987). После окончания иммунизации сыворотка мышей была использована при изучении активности полученных фракций антигена в реакции иммунодиффузии.
В реакции иммунодиффузии между фракцией №2 антигена, позитивной референс – сывороткой и сывороткой иммунной мыши, образовался преципитирующий комплекс, выражающийся образованием четкой линии преципитации. Так же наблюдали появление «размытой» линии преципитации между первой фракцией, полученной обработкой 70% этиловым спиртом, и позитивной референс – сывороткой.
В дальнейшей работе была использована вторая фракция антигена, полученного при обработке вакцины 70% этиловым спиртом. Выход вируссодержащий жидкости составил 5,0 мл с концентрацией белка 0,5 мг/мл. Результаты изучения активности белковых фракций в реакции иммунодиффузии приведены в таблице 1.
Таблица 1 – Результаты изучения активности белковых фракций в РИД
| Исследуемый материал | 96% этиловый спирт | 70 % этиловый спирт | ||||
| 1 | 2 | 3 | 1 | 2 | 3 | |
| Сыворотка иммунизированных мышей | - | + | - | ± | + | - |
| Позитивная специфическая референс сыворотка к H5N1 | - | + | - | - | + | - |
| Сыворотка неиммунных мышей | - | - | - | - | - | - |
Примечания: + положительная реакция; ± сомнительная реакция; – отрицательная реакция.
Из результатов исследований следует, что предварительная обработка эмульгированой вакцины против гриппа птиц штамма H5N1 70% этиловым спиртом позволяет получить три фракции. Установлено, что фракция №2 проявляет активность в реакции иммунодиффузии по отношению к положительной сыворотке, что подтверждалось образованием четких линии преципитации. При исследовании этой фракции в непрямом варианте иммуноферментного анализа титры составили 1:800-1600. Для удобства в работе вторую фракцию вакцинного спиртового антигена обозначили как антиген №1.
Перед применением антигена №1 для иммунизации подопытных животных проводили очистку методом диализа против забуферного физиологического раствора (ЗФР) в течение 18 часов. Далее очистку антигена проводили методом ионообменной хроматографии на оборудовании фирмы «Рharmacia», с использованием ДЕАЕ-целлюлозы (Sigma). После хроматографической очистки антигена в ИФА было установлено, что титры антител в сыворотке крови иммунизированных мышей составили 1:25600, тогда как к неочищенному антигену находились в пределах 1:800 – 1:1600.
Таким образом, в результате исследований получен очищенный антиген №1, отличающийся наличием активных серологических свойств.
В качестве антигена №2 использовали коммерческий лиофилизированный антиген вируса гриппа птиц штамма Н5N1 (Италия).
Для получения антигена №3 инактивированную аллантоисную жидкость очистили и концентрировали при помощи высокоскоростной ультрацентрифуги в градиенте плотности сахарозы. Наличие вируса подтверждали с помощью электронно-микроскопического исследования.
После завершения этапа получения и очистки всех антигенов, проведено их сравнительное изучение. Определение антигенной и серологической активности полученных и очищенных нами белковых препаратов вируса гриппа птиц штамма А/Н5N1 проводили в реакции иммунодиффузии и иммуноферментном анализе с позитивной сывороткой к антигенам ВГП. Кроме того, для подтверждения наличия антигенов вируса гриппа птиц в полученных препаратах была использована полимеразно-цепная реакция и реакция иммунохроматографии.
В результате опыта установлено, что все полученные нами антигены – отличались высокой активностью в РИД и ИФА по отношению к положительным сывороткам. При исследовании антигенов в ПЦР анализе и ИХА получили положительные результаты, что доказывает наличие вируса высокопатогенного гриппа птиц или его антигенов в полученных препаратах.
Кроме того, необходимо отметить, что все полученные антигены при введении подопытным животным вызывали индукцию специфических антител в довольно высоких титрах, что позволяет использовать их для получения узкоспецифичных моноклональных антител к детерминантам антигена ВГП. Это послужило основанием для того, что полученные антигены №1, №3 и коммерческий антиген №2 могут быть использованы в дальнейших исследованиях с целью получения моноклональных антител. Результаты исследований приведены в таблице 2.
Таблица 2 – Характеристика белковых антигенов ВГП штамма H5N1
| Антигены | Концентрация белка, мг/мл | Титр специфических антител | ПЦР | ИХА | |
| РИД | ИФА | ||||
| Антиген № 1 | 0,5 | 1:8 | 1:25600 | + | + |
| Антиген № 2 | 4 | 1:32 | 1: 204800 | + | + |
| Антиген № 3 | 4 | 1:32 | 1: 51200 | + | + |
Получение штаммов гибридом, синтезирующих МКА к антигенам вируса гриппа птиц
Для получения иммунных спленоцитов мыши линии BALB/с 8-недельного возраста, массой 12-18г. были разбиты на три группы и иммунизированы внутрибрюшинно. Первая группа мышей была иммунизирована антигеном №1, вторая группа антигеном №2 и третья группа антигеном №3. Оптимальной оказалась двухнедельная схема иммунизации мышей, с концентрацией белка 200 мкг/мл в объеме 100 мкл, по методу Фридлянской (1987).
В качестве положительного контроля использовали позитивную референс-сыворотку к штамму H5N1, в качестве отрицательного контроля сыворотку неиммунизированных мышей.
Тестирование иммунных сывороток проводили с использованием белковых антигенов №1, 2, 3 и антивидовым конъюгатом в непрямом варианте ТИФА на полистироловых планшетах (Nunc, Дания). В результате исследования сыворотки крови мышей линии BALB/c после иммунизации против использованных антигенов титры антител составили от 1:25600 до 1:204800.
Как показали результаты исследований, использованная нами схема иммунизации мышей линии BALB/c вполне пригодна для стимулирования иммунной системы организма подопытных животных на выработку достаточного количества антител против использованных антигенов. Титры специфических антител в сыворотке крови мышей, указывают на активную индукцию клонов В-лимфоцитов, продуцирующих антитела заданной специфичности. Более активным оказался антиген №2.
Для гибридизации отбирали мышей с более высокими титрами антител, извлекали селезенку, в асептических условиях, которая использовалась в качестве источника иммунных лимфоцитов. Слияние клеток миеломы X63Ag8.653 со спленоцитами мышей проводили по методу V.Oi et L.Herzenberg (1980).
Контроль за ростом гибридных клеток проводили ежедневно под микроскопом. Из 1152 засеянных лунок рост клонов наблюдали в 42 лунках, т.е. процент слияния составил 3,64%. Результаты слияния приведены в таблице 3.
Таблица 3 – Результаты гибридизации миеломных клеток со спленоцитами мышей, иммунизированных антигенами гриппа птиц штамма H5N1
| Анти-ген | Кол-во миелом-ных клеток | Кол-во спле- ноци-тов | Соотно-шение миелом к спленоци-там | Кол-во лунок | Выход клонов | Активные клоны | ||
| Кол- во | % | Кол- во | % | |||||
| №1 | 3,5×106 | 14×107 | 1:36 | 384 | 15 | 3,9 | 2 | 13,3 |
| №2 | 6×106 | 5,2×107 | 1:9 | 384 | 22 | 6 | 5 | 22,7 |
| №3 | 75×105 | 14×106 | 1:20 | 384 | 5 | 1,3 | 3 | 60 |
В результате слияния миеломных клеток со спленоцитами мышей, иммунизированных коммерческим антигеном №2, отмечен высокий уровень клонообразования, который составил 6%. Гибридизация спленоцитов мышей иммунизированных антигеном №1 с клетками миеломной линии была менее эффективной, процент образования клонов был равен 3,9%. Наименьший уровень клонообразования (1,3%) отмечен при слиянии миеломных клеток со спленоцитами мышей иммунизированных белковым антигеном №3. При этом всего было отмечено 10 активных клонов, наибольшее количество активных клонов было получено в результате использования антигена №2.
В целях проверки стабильности антительной продуктивности клонов сохранивших свою активность, исследовали их культуральную жидкость в ИФА на наличие специфических антител против белковых антигенов вируса гриппа птиц штамма H5N1 в течении нескольких пассажей. Титры МКА в культуральной среде у испытуемых клонов после пятого пассажа составляли от 1:2 до 1:32 (таблица 4).
По результатам исследования установили, что клоны 3Н3, 1А9, 3В11 и 2F4 на протяжении всего времени опыта сохранили свою антительную продуктивность, которая выражается в показателях высокой оптической плотности. Данные клоны гибридных клеток в течение пяти пассажей практически не снизили своей активности и были отобраны для дальнейшей работы как стабильно синтезирующие МКА заданной специфичности.
Штаммы клеток, продуцирующих МКА, клонировали методом лимитирующих разведений. После второго клонирования 10 субклонов продуцировали антитела к тестируемому антигену. После третьего тестирования титры в непрямом варианте ИФА у 3 клонов (3Н3, 1А9 и 2F4), были достаточно высокие и достигали показателей 1:32 - 1:64. Остальные субклоны потеряли свою активность и не синтезировали МКА. Клетки гибридом были пересеяны на 24-луночные планшеты, затем на матрацы и по мере накопления подвергнуты криоконсервированию.
Таблица 4 – Результаты исследования антительной активности гибридом в непрямом варианте ИФА
| Антиген | Название гибридомы | Тестирование гибридом (оптическая плотность, нм) | ||||
| первое | второе | третье | четвертое | пятое | ||
| I слияние | ||||||
| №1 | 3Н3 | 0,998 | 1,729 | 1,206 | 1,696 | 1,806 |
| II слияние | ||||||
| №2 | 1A9 | 1,569 | 1,409 | 1,094 | 1,742 | 1,666 |
| 1A11 | 0,421 | 0,167 | 0, 105 | 0,116 | 0,104 | |
| 3B11 | 0,767 | 1,642 | 1,509 | 1,670 | 1,422 | |
| III слияние | ||||||
| №3 | 2F4 | 1,444 | 2,823 | 1,656 | 1,361 | 1.384 |
| 4A5 | 0.851 | 0,509 | 0.105 | 0,050 | 0,121 | |
Таким образом, получено 3 штамма гибридных клеток, стабильно продуцирующих моноклональные антитела к антигенам вируса гриппа птиц. Согласно результатам проведенных исследований, клон гибридных клеток 1А9 оказался наиболее активен (1:12800) и был отобран нами для дальнейшей работы.
Иммунохимическая характеристика моноклональных антител
Для изучения иммунохимической характеристики полученных моноклональных антител необходимо наработать препаративное количество иммуноглобулинов. Полученные гибридные клетки штамма 1А9 вводили в концентрации 2×106 внутрибрюшинно мышам линии BALB/c, которым предварительно, за 14 дней до введения гибридомы, был инъецирован пристан – 2,6,10,14 тетраметилпентадекан («Sigma», США) в дозе 0,5 мл на голову. Процесс асцитообразования у линейных мышей показал, что формирование асцитной опухоли штаммами гибридом продуцентов МКА происходит за 15-18 суток. После этого мышь убивали методом цервикальной дислокации и отбирали из брюшной полости асцитную жидкость. Объем полученной асцитной жидкости составил 12 мл. Полученные таким образом 2 серии асцитной жидкости после очистки были тестированы в ИФА, титр 1 и 2 серии асцитной жидкости составил 1:12800, иммунологическая активность повышалась при культивировании in vivo в брюшной полости мышей линии BALB/c, по сравнению с иммунологической активностью в культуральной жидкости.
Далее проведены исследования по определению молекулярной массы полученных МКА в 10% ПААГ в присутствии додецилсульфата натрия на аппарате для вертикального электрофореза. Молекулярная масса составила 66 и 25 кД, что соответствует общепринятым значениям показателей тяжелых и легких цепей иммуноглобулинов.
Изучены иммунохимические свойства МКА методом иммуноблотинга по H. Towbin et al. (рисунок 1).
 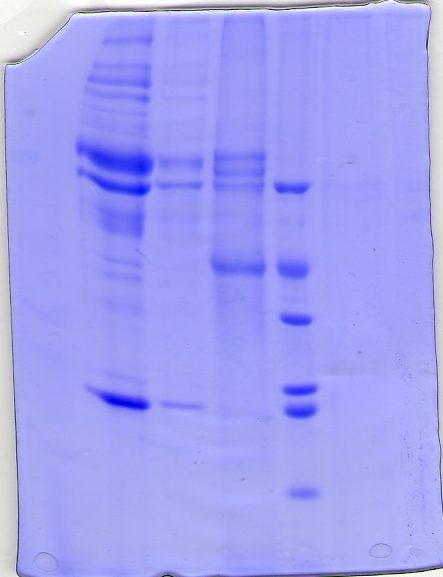 | 66 36 29 24 20 14 |
| 1 2 3 | |
Примечание: 1 - результаты иммуноблотинга; 2 - результаты электрофореза; 3 - молекулярный маркер
Рисунок 1 – Результаты иммуноблотинга МКА
Результаты иммуноблотинга показали, что молекулярная масса антигенной фракции, взаимодействующей с МКА штамма гибридом 1А9, равна 36 кД. Таким образом, МКА штамма 1А9 специфически реагируют с белковой фракцией антигена с молекулярной массой 36 кДа.
Результаты изучения иммунохимических свойств показали, что полученные МКА гомогенны по своей структуре, так как в иммуноблотинге реагировали с вирусным антигеном с образованием одной линии.
Показатель константы связывания моноклональных антител гибридомы по отношению к антигену вируса высокопатогенного гриппа птиц штамма H5N1 составляет 1х109М, что свидетельствует о достаточно высокой степени совпадения конфигураций активного центра антитела и антигенной детерминанты.
Установлено, что синтезируемые штаммом гибридомы моноклональные антитела принадлежат к иммуноглобулинам класса G, подкласса G3.
Для определения специфичности полученных МКА в дальнейших исследованиях проводился контроль специфичности в непрямом варианте ИФА. Для проведения иммуноферментного анализа на 96-луночный планшет сорбировали антигены имеющихся штаммов вируса гриппа птиц (панель коммерческих антигенов гриппа птиц, производства Италия) и антигены близкородственных болезней птиц. Далее постановку реакции проводили в стандартном варианте. Результаты опыта по определению специфичности МКА в непрямом варианте ИФА представлены в таблице 5.
Таблица 5 – Активность и специфичность МКА
| № п/п | Антигены | 3Н3 (1слияние) | 1А9 (2 слияние) | 2F4 (3 слияние) |
| 1 | H5N1 | 1:800 | 1:12800 | 1:800 |
| 2 | H1N1 | 1:100 | 1:200 | 1:100 |
| 3 | H3N8 | 1:100 | РО | 1:100 |
| 4 | H4N8 | 1:100 | 1:200 | РО |
| 5 | H7N3 | 1:3200 | РО | 1:100 |
| 6 | H9N7 | 1:800 | РО | РО |
| 7 | H10N1 | 1:800 | РО | РО |
| 8 | H11N9 | 1:6400 | 1:200 | 1:400 |
| 9 | H12N5 | 1:3200 | РО | РО |
| 10 | H13N6 | 1:3200 | 1:200 | 1:100 |
| 11 | H14N5 | 1:100 | РО | РО |
| 12 | H15N6 | 1:200 | 1:200 | 1:100 |
| 13 | Вирус болезни Нъюкасла | РО | РО | 1:100 |
| 14 | Вирус болезни Гамборо | РО | РО | РО |
| 15 | Вирус инфекционного ларинготрахеита | РО | РО | РО |
Примечание: РО – реакция отрицательная
Как видно из таблицы 5, МКА, продуцируемые штаммом гибридомы 3Н3, 1А9, 2F4 активно взаимодействуют с антигеном вируса гриппа птиц и дают показания титров антител от 1:800 до 1:12800, что свидетельствует об их достаточной активности к возбудителю. Однако штамм гибридомы 3Н3, вступает в перекрестную реакцию с антигенами других штаммов гриппа птиц в довольно высоких титрах, но при этом не реагирует на антигены близкородственных болезней птиц. Этот штамм можно рекомендовать как компонент тест-системы для определения типа гриппа птиц.
В то же время МКА 1А9 практически не вступает в перекрестные реакции с антигенами других штаммов гриппа птиц, что, возможно, является показателем их родоспецифичности, и не вступает во взаимодействие с антигенами близкородственных болезней птиц. МКА 2F4 слабо реагирует по отношению к антигенам вируса гриппа штамма H5N1 и вступает в реакцию с вирусом болезни Нъюкасла, с незначительным титром (1:100).
По результатам исследований наивысшую специфичность показал штамм 1А9, который можно использовать как основной компонент при разработке тест-системы для серологической диагностики гриппа птиц.
Отработка оптимальных условий постановки «сэндвич» варианта иммуноферментного анализа на основе моноклональных антител.
Целью наших дальнейших исследований была отработка оптимальных условий постановки «сэндвич» варианта иммуноферментного анализа на основе моноклональных антител для обнаружения специфических антител в сыворотке крови птиц к антигену гриппа птиц.
При подборе оптимальной концентрации первичных антител в лунки 96-луночного планшета вносили МКА в различных разведениях на бикарбонатном буфере с рН 9,5. В качестве испытуемого антигена использовали референс – антиген H5N1 и антиген из аллантоисной жидкости в убывающих концентрациях от 50 до 1 мкг/мл в ФСБ (рН 7,4). Постановку ИФА осуществляли по вышеописанной методике.
В ходе работы установлено, что оптимальной для «сэндвич» варианта ИФА является концентрация МКА 10 мкг/мл, а концентрация антигена 10 мкг/мл для планшета и 40 мкг/мл для нитроцеллюлозной бумаги. Это позволяет выявлять титры антител лабораторных животных до 1:102400 с показателем оптической плотности спектрофотометра до 1,200 - 3,1.
Для определения специфических антител против возбудителя гриппа птиц в сыворотках крови нами отрабатывался сэндвич вариант ИФА на основе МКА, который ставили на планшете и нитроцеллюлозной мембране. В качестве испытуемого материала использовали сыворотки крови птиц, в качестве положительного контроля коммерческую сыворотку штамма H5N1.
Поэтапная постановка «сэндвич» варианта ИФА включает следующие этапы:
1-й этап – сенсибилизация твердой фазы моноклональными антителами;
2-й этап – внесение антигена;
3-й этап – внесение исследуемой сыворотки крови птиц (специфическое связывание антител с антигеном и образование иммунного комплекса «антитело+антиген +антитело»);
4-й этап – внесение антивидовых антител, меченных ферментом (конъюгат), специфическое связывание с комплексом.
5-й этап – выявление иммунного комплекса ферментативной реакцией, проявляющейся окрашиванием субстрата. Интенсивность окраски прямо пропорциональна количеству антител. Учет результата реакции проводят путем измерения оптической плотности продукта ферментативной реакции непосредственно в лунках планшета, а на нитроцеллюлозной мембране учет реакции визуальный.
Для определения оптимальных параметров каждого этапа ИФА ставили в пяти повторах.
Как показали результаты исследований, оптимальной концентрацией первичных антител, обеспечивающих достаточную чувствительность ИФА, является 10 мкг/мл. Влияние значения рН буферных растворов на адсорбцию первичных антител к поверхности твердой фазы изучали в диапазоне ионной силы от 2,0 до 10,0. В качестве буферной системы испытывали: натрий ацетатный буфер с рН 2,0 и 4,0; забуференный физиологический раствор с рН 7,2 7,4; натрий карбонатный буфер с рН 9,5 и 10,0. Результаты опытов показали, что оптимальным для сенсибилизации первичных антител является натрий карбонатный буфер с рН 9,5, а при проведении остальных этапов ИФА следует использовать забуференный физиологический раствор с рН 7,2 7,4 с добавлением 0,05% твина 20.
Изучение кинетики фиксации первичных антител при температуре +4°С показало, что полное насыщение твердой фазы происходит через 14-18 часов. Дальнейшая экспозиция приводила к повышению "фонового" сигнала реакции на 10-20% и неоправданному расходу МКА.
Оценку кинетики соединения антител с антигеном проводили при температуре +37°С в течение 30 минут, 1, 2, 3 и 4 часов. Из результатов исследования было установлено что, равновесие в реакции антитело+ антиген наступает через 1 час инкубирования. Увеличение экстинкции ведет к повышению «фонового» показателя на 20-40% из-за неспецифического связывания белка с поверхностью твердой фазы.
При оценке результатов связывания комплекса антитело + антиген с исследуемыми образцами показало, что равновесие между системами достигается в течении 1 часа инкубирования при температуре +37°С.
Результаты оценки связывания антивидового пероксидазного конъюгата с комплексом показали, что равновесие между системами достигается также в течение 1 часа инкубирования при температуре +37°С.
Проведенные исследования по изучению влияния физико-химических факторов на чувствительность и специфичность «сэндвич» варианта ИФА позволили оптимизировать условия постановки реакции для обнаружения антител к ВГП.
Для выяснения ценности использования моноклональных антител в точечном ИФА (dot – ИФА) при обнаружении специфических антител осуществляли исследование сывороток крови кур, поступивших из АО «Акмола – Феникс», и из ТОО «Агрофирма Курма».
В качестве положительного контроля использовали референс – сыворотку к вирусу гриппа H5N1 (Италия) и 3 инактивированные сыворотки крови от положительно реагирующих птиц, из очага вспышки гриппа птиц (Северо-Казахстанская область с. Дубровное, 2005г.). В качестве отрицательного - сыворотку крови здоровых цыплят. Для сравнения эти же сыворотки тестировали в планшетном варианте ИФА и в коммерческой иммуноферментной тест-системе для выявления антител к антигенам вируса гриппа птиц конкурентным методом (Influenzu A. IDVET, Франция).
В результате исследований 10 сывороток крови кур специфических антител обнаружено не было. При тестировании 3 заведомо положительных проб по результатам классического ИФА, коммерческой тест-системы и предлагаемого варианта получены аналогичные результаты. В ИФА выявлены титры в первой пробе – 1:6400, во второй пробе – 1:400, в третьей пробе –1:800, показатели коммерческой тест-системы были равны 1:800-1:1600, а в dot - ИФА проявились все 8 точек с окраской различной интенсивности. Все тесты давали реакцию на положительный контроль с высоким титром. По результатам проведенного опыта можно сделать заключение о достаточно высокой чувствительности и специфичности предлагаемой иммуноферментной тест-системы для обнаружения антител к антигену вируса гриппа птиц. Результаты представлены в таблице 6.
Таблица 6 – Результаты сравнительного испытания тест-систем ИФА для обнаружения в сыворотках крови кур антител к ВГП
| Исследуемые сыворотки | Результаты тестирования | ||
| ИФА | Тест-система (Франция) | dot – ИФА | |
| 1 | РО | РО | РО |
| 2 | РО | РО | РО |
| 3 | РО | РО | РО |
| 4 | РО | РО | РО |
| 5 | РО | РО | РО |
| 6 | РО | РО | РО |
| 7 | РО | РО | РО |
| 8 | РО | РО | РО |
| 9 | РО | РО | РО |
| 10 | РО | РО | РО |
| 1 проба (2005) | 1:6400 | 1:1600 | + |
| 2 проба (2005) | 1:400 | 1:800 | + |
| 3 проба (2005) | 1:800 | 1:1600 | + |
| Положительный контроль | 1:25600 | 1:25600 | + |
| Отрицательный контроль | 1: 100 | РО | РО |
Примечание: РО – реакция отрицательная; «+» реакция положительная.
Таким образом, полученные результаты свидетельствуют о возможности использования моноклональных антител в dot - варианте ИФА для обнаружения специфических иммуноглобулинов против вируса высокопатогенного гриппа птиц. Предлагаемый метод прост при проведении исследований, имеет достаточную чувствительность и специфичность, не требует специального лабораторного оборудования.
