План анализ проделанной работы в период последней аттестации
| Вид материала | Анализ |
- План учебно воспитательной работы, 1705.98kb.
- Анализ воспитательной работы за 2010-2011 учебный год, 214.24kb.
- Телефон: +38 (067) 9897165, 42.81kb.
- Рекомендации по составлению отчета о профессиональной деятельности к аттестации, 53.48kb.
- «Старт», 69.38kb.
- Отчет рабочего комитета асоп по Коммерческо-Правовым вопросам ( председатель комитета, 878.43kb.
- Анализ работы моу сош №3 муниципального образования город-курорт геленджик за 2008-2009, 1957.85kb.
- Анализ работы муниципального автономного общеобразовательного учреждения города Калининграда, 1082.29kb.
- Анализ работы районного методического объединения учителей русского языка и литературы, 721.86kb.
- Чулкова Татьяна Александровна доклад, 404.4kb.
ПЛАН
- Анализ проделанной работы в период последней аттестации……….2
- Организация процесса обучения с применением элементов новой инновационной технологии в образовании и формирование познавательной активности на основе учета и удовлетворения потребностей и интересов у учащихся на уроках химии и биологии………………………………………..3
- Активизация деятельности учащихся при изучении нового материала………………………………………………………………7
- Активизация деятельности учащихся при изучении нового материала………………………………………………………………7
2.2. Активизация деятельности учащихся при формировании умений и
навыков………………………………………………………………….8
2.3. Активизация деятельности учащихся при проверке их знаний , уме- ний и навыков……………………………………………………………....14
3. Аналитический урок «Вода в природе и жизни человека»……………..…24
4. Урок –семинар « Природные источники углеводородов и их переработка. Газовая и нефтяная отрасли промышленности»……………………………..36
5. Элективный курс «Генетика и здоровье человека» ……………………….41
6. Школьная экспедиция по экологическим тропам…………………………43
7. Литература …………………………………………………………………..53
I. АНАЛИЗ РЕЗУЛЬТАТОВ О ПРОДЕЛАНОЙ УЧЕБНОЙ
РАБОТЕ ЗА ПЯТЬ ЛЕТ
Я, в качестве учителя биологии и химии, работаю в Калейкинской средней общеобразовательной школе.. Использую традиционную обра-зовательную программу. Работаю над проблемой «Организация процесса обучения с применением элементов новой инновационной технологии в образовании и формирование познавательной активности на основе учета и удовлетворения потребностей и интересов у учащихся на уроках химии и биологии». Постановка данной проблемы вызвана тем, что в настоящее время среди учащихся актуальность химии и биологии, как одним из важных предметов, снизилась. Это объясняется : во-первых малого количества выделяемого времени для изучения предмета; во-вторых мало обеспеченность реагентами, лабораторными принадлежностями; в-третьих – после школы поступают в такие учебные заведения, в которых не надо сдавать вступительные экзамены по этим предметам.
Для осуществления этой цели, изучая материал учебника, мы с учащимися научимся дать оценку, характеристику веществам , растениям, животным; познавать, выявить особенностей , раскрыть появления различных признаков наследственного и ненаследственного характера.
Работая над этой задачей, я часто организую уроки-семинары , конкурсы, игры, познавательные экскурсии в конце учебного года, соревнования в рамках недели химии , биологии и экологии, экологические тропы
Готовясь к уроку, стараюсь досконально продумывать какие средства и методы дадут наибольший эффект при изучении определенного раздела, постоянно слежу за новыми достижениями в методике преподавания и использую при организации различных этапов урока : объяснение нового материала, актуализации ранее изученной темы, при получении знаний и умений.
Результаты моей работы ;
- Увеличение качества преподавания химии на 3 %; биологии –на 5%
- Ежегодные призовые места на районных предметных олимпиадах;
- Участие в различных конкурсах педагогического мастерства и награждение дипломами:1) на конкурсе МО РТ «Подрост» в номинации «За лучшую экологическую тропу» в 2003 году;
2) Международный детский экологический форум «Зеленая планета - 2006»; 3) за представление своего педагогического опыта на Всероссийском фестивале «Открытый урок 2007».
4. Активное участие с докладами на семинарах РМО по темам : в 2003 году «Методы и приемы стимулирования мыслительной деятельности учащихся , используемые учителем на уроках и во внеурочной деятельности (работа с одаренными детьми); в 2007 году «Интегрированные уроки- эффективная форма специализации знаний и способов умственной деятельности учащихся»»;
5. Открытый интегрированный урок в 11 классе на семинаре РМО учителей химии и биологии
6. Элективные курсы в 9 классах: 1) «Генетика и здоровье человека»;
2) «Основы медицинских знаний».
II. ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ С ПРИМЕНЕНИЕМ ЭЛЕМЕНТОВ НОВОЙ ИННОВАЦИОННОЙ ТЕХНОЛОГИИ В ОБАЗОВАНИИ И ФОРМИРОВАНИЕ ПОЗНАВАТЕЛЬНОЙ АКТИВНОСТИ У УЧАЩИХСЯ НА ОСНОВЕ УЧЕТА И УДОВЛЕТВОРЕНИЯ ПОТРЕБНОСТЕЙ И ИНТЕРЕСОВ НА УРОКАХ БИОЛОГИИ И ХИМИИ
Каждый ребенок от природы наделен способностями практически по всем видам человеческой деятельности к овладению естественными и гуманитарными знаниями, к изобразительному искусству, музыке и т.д. Важно только в процессе обучения развить эти способности.
Существующая система образования в значительной степени построена на передаче знаний от учителя к ученику, на пассивной позиции обучающегося. Что не позволяет личности самой строить свое знание, активно и творчески пользоваться им в жизни как своим приобретением. Этот подход к образованию не раскрывает творческий потенциал человека, заложенный при его рождении природой, а закрепляет зависимость от решений, принимаемых другими.
С целью активизации познавательной активности учащихся на уроке я использую различные методические приемы: выполнение индивидуальных заданий познавательного характера, домашние практические занятия, работы с разнообразными источниками информации (словари, справочники), решение занимательных задач и т.д.
1. Активизация деятельности учащихся при изучении нового материала.
К изучению нового учебного материала перехожу плавно, исходя из ранее изученного. Тему урока называю сама или подвожу учащихся к тому, чтобы тему назвали они сами.
С целью повышения интереса к уроку, к изучаемому материалу, изложение материала начинаю с какого – либо интересного факта. Например, в 9 классе урок на тему «Коррозия» начинаю с чтения рассказа поискового характера.
В начале нашего века из Нью-йоркского порта вышла в открытый океан красавица яхта. Ее владелец, американский миллионер, не пожалел денег, чтобы «удивить» свет: корпус яхты был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками. Это было так красиво: сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако не долго наслаждался владелец новой яхты. Через несколько дней, когда в океане поднялось легкое волнение, обшивка корпуса вдруг начала расходиться, и яхта быстро пошла ко дну. Команда едва успела опустить на воду шлюпки, которые также были из алюминия с медью. К счастью, незадачливых мореплавателей подобрало проходившее мимо судно. Что же произошло? Почему обшивка корпуса вдруг начала расходиться? В чем была ошибка владельца яхты? И сможем мы ответить на все эти вопросы, изучив тему: «Коррозия».
Во время объяснения новой темы постоянно обращаюсь с тем или иным вопросом к классу или к отдельным учащимся, пытаюсь вовлечь учащихся в дискуссию по обсуждению предположений, определенных вопросов. Например, при изучении строения метана в 10 классе начинаю свое повествование с просьбы написать схему строения атома углерода, затем электронную формулу и электронно-графическое строение его. Прошу указать валентную возможность атома углерода, исходя из строения атома. Ученики отвечают, что он двухвалентен. Откуда же берутся еще два неспаренных электрона? Ученики отвечают, что S – электроны возможно распариваются за счет наличия свободной квантовой ячейки. Я подтверждаю их предположения и говорю, что углерод при образовании связи переходит в возбужденное состояние.
И даем электронную формулу атома углерода возбужденном состоянии, где ясно видим, что второй энергетический уровень атома углерода в возбужденном состоянии содержит один S – электрон и три Р – электрона. Они и идут на связь. Но тогда связи будут в молекуле метана не равноценны, а методом химического анализа установили, что все четыре связи равноценны. Как же это достигается? И я разрешаю эту проблему, вводя понятие SP – гибридизации.








S

 + P3 S P3
+ P3 S P3С целью поддержания интереса к изучаемой теме, по ходу объяснения стараюсь включить в рассказ или в беседу тот или иной интересный факт. Так, объясняя особенность металлической связи 9 классе и зависимость от этого пластичности материалов, я рассказываю о получении тончайших пластин из золота. Из 1 грамма золота можно раскатать лист площадью 27,85 кв. м., растянуть до 3-х километров проволоки.
Изучение нового материала провожу на основе ранее пройденных тем и в сравнении. Например, в 11 классе при изучении темы «Аминокислоты» сравниваем строение и свойства аминокислот органических амфотерных соединений с неорганическими амфотерными соединениями. На доске и в тетрадях слева пишем строение и свойства неорганических амфотерных соединений, справа – свойства строение аминокислот. Запись ведем в сравнении: устанавливаем сходство и различие в строении, а затем сходства в свойствах, различие даю сама на основе их предположений – разные функциональные группы, отсюда и различие в свойствах.
Одним из видов самостоятельных работ является работа с учебником, с инструкциями для лабораторных работ. В инструкции указания к проведения опытов чередуется с вопросами для размышлении, советами и замечаниями. . пользуясь с инструкциями. Они выполняют лабораторные опыты, изучают текст учебника и самостоятельно подходят к определенным выводам. Приведу для примера инструкцию для выполнения самостоятельной работы на тему: «Соли аммония» . эта инструкция дает возможность самостоятельно ознакомиться со свойствами солей аммония.
Цели урока: 1) ознакомиться со свойствами солей аммония;
2) развить познавательную активность и мыслительную деятельность;
3) раскрыть способности ученика, укрепить взаимоотношенпия.
Ход работы.
- Изучить внешний вид и растворимость солей аммония в воде. Х-9 Стр… Для изучения растворимости прилейте в пробирку с солью 1-2 мл H2O и размешайте содержимое пробирки. Встряхивая ее (пальцем пробирку не закрывать!!!)
I вариант : NH4Cl – хлорид аммония;
II вариант: (NH 4)2 SO4 – сульфат аммония.
Сравнив результаты опытов, сделайте общий вывод.
- Составьте уравнение диссоциации данных солей Х – 9 Стр….Проверьте результаты работы друг о друга, сделайте вывод.
- Исследуйте, как относятся соли аммония прилейте раствор щелочи и осторожно подогрейте. Изучите запах выделяющегося газа (выделяется аммиак, понюхайте, направляя воздух от пробирки к себе, легким движением руки:!).
Сравнив результаты опытов, сделайте общий вывод
- Составьте уравнение реакции молекулярной , полной и сокращенной ионной формах. Х- 9 Стр… Проверьте результаты работы друг у друга, исправьте ошибки.
- Вспомните, как другие соли реагируют с раствором щелочи
Для этого , к раствору соли прилейте раствор щелочи.
I вариант: соль – хлорид меди (II) CuCl2;
II вариант : соль – хлорид железа (III) FeCl3.
Сделайте вывод о признаке реакции. Напишите уравнение реакции в молекулярной и ионной формах. Проверьте результаты работы друг у друга.
- Сравните признаки реакции и отметьте особенность взаимодействия растворов солей аммония с раствором щелочи. Эта реакции между солями аммония и раствором шелочи является качественной реакцией, т.е. служит для распознавания солей аммония, а также для получения аммиака для лаборатории, (запишите это в тетрадь и запомните!!).
- На дом: § 20, Х-9 , упр.№1 к § 20.
При изучении некоторых тем, по ходу работы с классом, составляем схему конспект в тетрадях, а дома учащиеся оформляют все это на картонном листке. На последующих уроках эти конспекты используются как алгоритмы. Например, в 8 классе при изучении темы: «Оксиды, их классификация и свойства» составляем такую схему-конспект:
оксиды


Растворимые
Не растворимые


Na2O, SO2 Na2O, SiO2
Основные (металлы)
Кислотные (не металлы)
N
амфотерные
a2O, Mg O SiO2, SO2
ZnO,Al2O3
СВОЙСТВА
+


 H2O основание +кислота соль + H2O + H2O кислота
H2O основание +кислота соль + H2O + H2O кислота(щелочи)
+
 кислота соль + H2O +основание H2O+основание соль + H2O
кислота соль + H2O +основание H2O+основание соль + H2O(щелочи)
 +основной оксид соль
+основной оксид сольПри работе с учебником в старших классах использую групповой метод обучения. Вначале урока называю тему, ставлю перед учениками цель которую они должны достичь в течении 45 мин: т.е.что они должны знать и уметь к концу урока.
Излагаю новый материал в форме лекции, которая длится 7-10 мин. Материал лекции обычно включает в себя основные законы, теории, понятия. Сопровождаю изложение материала показом на экране конспекты материала через кодоскоп.
Следующий этап урока: класс делю на группы по 4 человека и даю задания для коллективный работы. Каждый ученик из группы, используя учебник, консультация любого ученика (может встать и подойти к любому ученику. Отвечает на поставленный вопрос письменно в своей тетради. На это уходит 15 минут. Затем, ученики, которые получили единые групповые задания, работают коллективно: сравнивают свои ответы, исправляют ошибки друг у друга, дополняют ответы. И только после этого ребята задают свои работы для проверки.
Такая форма работы воспитывать умение работы с учебником. +выбирать главное, анализировать и т.д., то есть является одним из элементов обучения процессу «учиться». Понятно, что эта форма работы имеет не только обучающие и развивающие значения, но играет и воспитывающую роль. Учащиеся испытывают большое чувство ответственности перед своими товарищами, у них воспитывается добросовестность, система в работе.
2. Активизация деятельности учащихся при формировании умений и навыков
Повторение и закрепление знаний и умений, систематизацию изученного материала провожу почти на каждом уроке. Для этого выделяя. И специальные уроки. Какие методы и приемы при этом я использую? Во-первых, большую роль в совершенствовании знаний и развитии самостоятельности учащихся отвожу решению экспериментальных задач. Например, в 8 классе при изучении свойств основных классов неорганических соединений задаю такие задачи:
- Определить опытным путем, в какой из данных пробирок находится раствор кислоты.
- … в какой из данных пробирок находится основной оксид, в какой – кислотный.
- … в какой из данных пробирок находится раствор щелочи, кислоты, соли.
Решаем расчетные задачи, по ходу работы для проверки задач и для консультации привлекаю учащихся, хорошо разбирающихся по данному вопросу, (этому предшествует дополнительная работа с учениками по теме). Привлечение сильных учащихся к проверке заданий имеют не только обучающее и развивающее значения, но и воспитывает в них аккуратность, систему в работе, добросовестность.
Привитию интереса учащихся к изучению химии в 8 классе способствует приемы игрового характера. Например, в 8 классе при изучении темы «Обобщение сведении об основных классах неорганических соединений» использую карточки разных цветов. При изучении состава классов неорганических соединений, заранее обговаривается какой цвет карточки соответствует какому классу соединений. Я называю формулы, а учащиеся должны распределять их по классам и поднимать карточку нужного цвета. Например: оксиды – красный цвет карточки,
кислоты – синий,
основания – зеленый,
соли – желтый.
Эти же карточки можно использовать и при изучении квалификации и свойств всех классов неорганических соединений.
После изучения строения и свойств какого-то вещества можно провести аукцион по продаже изученного вещества.
Класс делим на три группы ( три ряда), назначают трех счетчиков, которые записывают на доске количество полученных группой баллов. Количество баллов по каждому ответу устанавливает распределитель аукциона - учитель. Объявляется вещество на продажу, и учащиеся начинают называть свойства, характеризующие данное вещество и его применение. Когда свойства вещества и его применение полностью перечислены, вещество считается проданным. Группа, набравшая большее число баллов считается победителем. На ответ в каждой группе по очереди дается одна минута. Если свойства вещества повторяются, баллы снимается в качестве штрафа. Те ученики, которые дали наиболее полные и содержательные ответы и активно участвовали в игре, поощряются, их ответы оцениваются. Ученики с увлечением включаются в подобную деятельность, лучше запоминают материал.
3. Активизация деятельности учащихся при проверке их знаний и умений
Главная цель в работе- сделать учащихся активными участниками всех звеньев процесса обучения – от подготовки к восприятии нового материала до проверки результатов усвоения. Поэтому я стараюсь, чтобы у них были навыки контроля и самоконтроля. На уроках учащиеся анализируют ответы своих товарищей у доски, исправляют ошибки, дополняют ответы. Практикую я и самоисправления, т.е. после соответствующих записей на доске при ответе, если ученик допустил ошибки, я прошу его, используя учебник . записи в тетради исправить допущенные ошибки. Кроме этого, я прошу учащихся задавать дополнительные вопросы отвечающим.
Вопросы к изученному материалу учащиеся готовят заранее дома, вопрос могут задать по желанию или по вызову учителя. Если отвечающий не может ответить на поставленный вопрос, то отвечает ученик, задавший вопрос. Если ученик в течении урока активно задавал вопросы, то его работа оценивается.
В конце изучения некоторых тем провожу личный зачет. Дома, при подготовке к личному вопросу, каждый из учащихся готовит вопросы по теме их решение. Затем в классе учащиеся обмениваются карточками и выполняют зачетные работы. Затем проверяют работу друг у друга и оценивают работу. Карточку личного зачета с анализом работы ученика сдают учителю. Учитель проверяет, на сколько глубоко проанализирован ответ проверяющим. И ставит оценку отвечающему и проверяющему ученику.
Так же провожу коллективно-групповую работу. Класс делится на группы по уровню подготовленности и каждой группе дается задание разной трудности. Ученик должен выполнить данное ему задание самостоятельно или коллективно, а оформляет работу каждый индивидуально.
Иногда меняю метод проведения коллективной работы. Ученики уже знают свои группы по уровню подготовки и, когда объявляю групповую работу, они быстро объединяются и получат задания. Каждое задание в работе оценивается определенным количеством баллов, исходя из общей суммы баллов, определяется оценка. Группа учеников обсуждают вопрос коллективно и оформляют работу на отдельном листке. После каждого выполненного задания представитель группы подходит к учителю для проверки и набирает баллы. Такая проверка дает возможность учителю анализировать допущенные ошибки, а ученику учесть данные замечания и не повторять их при дальнейшей работе. Если задание сделано неправильно, учитель разрешает задание переделать. В конце урока по количеству набранных баллов выставляется оценка.
Например, урок в 10 классе
Тема: «Альдегиды, фенол». II вариант (группа №2, средней трудности)
- Укажите электронную формулу строения уксусного альдегида (этаналь). 16.
- Какие основные области использования (формальдегида вы знаете?) 26.
- Какой объем природного газа, в котором 95% метана, необходим для образования такой массы муравьиного альдегида, 9,2 г. муравьиной кислоты? 56.
- Почему фенол проявляет кислотные свойства? 26.
- Каким реактивом можно распознать формалин и глицерин? 26.
На доске записываем количество баллов и возможную оценку.
Если общая сумма баллов 12, оценка «5»
Если общая сумма баллов 10-11, оценка «4»
Если общая сумма баллов 4-9, оценка «3»
Если общая сумма баллов 3-1, оценка «2»
Если общая сумма баллов 0, оценка «1».
В 8 классе провожу химический диктант. Это удобно при проверке и оценки знаний таких тем, как «химические элементы», «валентность», «классификация и номенклатура основных классов неорганических соединений».
Учет и оценивание знаний можно сделать для учащихся интересным и увлекательным, если использовать игровые моменты. Например, я провожу игру Хn-Хо (химический хоккей). Это познавательная игра, урок – соревнование. Перед проведением этого урока класс делю на команды и даю задание: подготовить вопросы по пройденной теме. В состав каждой команды входят 4 нападающих, 3 защитника, 1 вратарь (наиболее эрудированный ученик). Роль арбитра берет учитель. приглашаются для игры первые две команды, остальные в это время являются болельщиками. Игру начинают нападающие одной из команд, они задают свои вопросы, забрасывают шайбу. Защитники другой команды должны отразить шайбу, т.е. ответить на поставленный вопрос. Если защитники не могут ответить, на помощь приходит вратарь. Если не справляется и вратарь, то они могут обратиться за помощью к болельщикам. Тогда у команды один балл минусуется. Затем нападающие другой команды начинают забрасывать шайбы, задавать вопросы, а защитники должны отразить шайбу, т.е. ответить на вопрос. Каждая заброшенная шайба и отраженная шайба фиксируется. По числу заброшенных и отраженных шайб определяется победитель. Фиксируют количества шайб на доске два ученика.
1 команда 2 команда
а) заброшенные шайбы а) отраженные шайбы
1 (задал вопрос) 1 (ответил на вопрос)
1 --- (не ответил)
б) отраженные шайбы б) заброшенные шайбы
--- 1
--- 1
Игре двух команд отводится 17 минут. Затем приступают к игре следующие две команды, а игравшие становятся болельщиками и игра продолжается. 7-10 минут отводится для подведения итогов. При анализе и оценке учитывается глубина и полнота ответа и насколько точно сформулирован вопрос. Также определяется лучший «защитник», «нападающий», «вратарь» и оценивается высшим баллом. Устанавливаем, кто из игроков неточно (формулировал свой вопрос или же дал неполный ответ (неточно отразил шайбу), они оцениваются баллом «3». Допустившие ошибки при защите или отражении оцениваются оценки «4».
Литература
- В. М. Григорьев, Картотека коллективных и ролевых игр, г. Москва, 1993 год.
- Р. Г. Иванова, Система самостоятельных работ учащихся при изучении неорганической химии, г. Москва, 1988 год.
- Н. П. Гаврузейко, Проверочные работы по органической химии, г. Москва, 1988 год.
- В. И. Левашов, Занимательная химия, г. Москва, 1962 год.
II Развитие познавательной активности и самостоятельности учащихся во внеклассной работе по химии.
КВН юных химиков
КВН – это одна из форм внеклассной работы, она очень активизирует учащихся, вызывает у них стремление пополнять и углублять свои знания в области химии.
В порядке обмена опытом приведу некоторые материалы по проведению вечера – КВН.
Тип игры: комплексная.
Форма – состязание.
Цель игры: 1) пополнить и углубить знания учащихся в области химии:
2) развить нестандартность мышления;
3) научить коллективно думать, действовать, побеждать.
Участники КВН были ученики двух параллельных классов – старшеклассники.
До проведения вечера проделана следующая работа: определены команды и их капитаны, подобран ведущий, выпущены юмористические газеты, которые раскрывают суть названия команды, составили программу КВН, список членов жюри, дали домашнее задание – подготовить приветствие, вопросы для разминки, необходимое оборудование.
План проведения вечера
- Открытие вечера. 2) Знакомство жюри. 3) появление команд. 4) Приветствие команд. 5) Разминка. 6) Выполнение первого задания. 7) Второе задание. 8) Конкурс – пантомима. 9) Аукцион зрителей – болельщиков. 10) Третье задание. 11) Конкурс капитанов. 12) Домашнее задание.
Команды получили названия: «Антимоний» и «Алхимик». В состав жюри вошли учителя химии, физики, математики, представители химического кружка.
Председатель жюри – директор школы.
Игровое действие.
Ведущий объявляет вечер открытым и приглашает команды на сцену, объявляет условия игры, представляет жюри. Затем команды приветствуют друг друга.
Приветствие команды «Алхимик»:
От нас, от имени постигших эликсира мудрецов секрет, мы шлем, друзья, Вам самый высший экзотермический привет. Мы Вам желаем в этой встрече быть активными, своими шутками и речью жюри и всех Вас рассмешить.
Напомним Вам из уважения,
Что тот не будет побежден
В таком химическом сражении,
Кто и в алхимии силен.
Приветствие команды «Антимоний»
Капитан подносит жюри склянки натром и серной кислотой и предлагает жюри создать центральную среду при оценке ответов. А команде – сопернице подносит минерал для улучшения настроения и для более быстрого, веселого остроумного ответа. После приветствий начинается «разминка».
Вопросы первой команды «Алхимик»
- Какой элемент в периодической системе Д. П. Менделеева алхимики называли желчью бога Вулкана? (серу).
- Чем отличается нашатырь от нашатырного спирта? (NH4CI, NH4OH)
- Можно ли зажечь снег? (если пропустить газ фтор)
- Какая кислота называется ингибированной? (HCI+ формалин- ингибитор)
- Какой металл называли металлом будущего? (AI)
Вопросы второй команды «Антимоний»
- Какой химический элемент изображали в XVIII веке в виде воина? (Fe)
- Можно ли паять алюминий? (с применением канифоли)
- Что такое растворимое стекло и где оно применяется? (K2SiO3, Na2SiO3-силикатный клей, готовят огнестойкие краски, ткани, в мыловарении).
- Что опасней в пожарном отношении: бочка, доверху наполненная бензином или же заполненная им не полностью? (не полностью).
- Какой металл, широко применяющийся сейчас в промышленности, несколько десятилетий тому назад считался драгоценным? (Al).
После разминки жюри оценивает приветствие команд.
Первое задание (1 часть) дается обеим командам на разных столиках. Предлагается выполнить следующую работу: из имеющихся на столе деталей собрать нужный прибор, получить из имеющихся на столе реактивов аммиак и доказать, что это аммиак (на выполнение этого задания отводится 2.5 мин.).
II часть (тоже для обеих команд). Определить по внешнему виду и другим признакам минеральные удобрения, выставленные на столах, и написать их (формулы (гранулированный суперфосфат, калийная селитра, сульфат аммония). (Время на это задание дается 4 минуты).
Второе задание.
Первой команде предлагается два рисунка См. приложение №1. в первом нужно определить, каким из двух приборов можно получить газы NO, NO2, а во втором указать недостатки в монтаже прибора. Предлагаются рисунки приборов для собирания газов вытеснением воздуха и над водой, а также рисунок прибора для получения углекислого газа: в приборе очень короткая газоотводная трубка.
Второй команде тоже предлагается два рисунка (См. приложение №2). Рисунок 1. Указать недостатки в монтаже прибора, в котором выделяющийся газ – кислород собирается над водой.
Рисунок 2. Указать недостатки в монтаже прибора. Дается рисунок прибора, в котором выделяющийся аммиак собирается в колбу, поставленную горлом вверх.
Время на задание 1 мин.
Предлагается слово жюри оценки первого задания.
Затем идет отгадывание шарад. (См. приложение №3). Ведущий читает вопрос, отвечает команда, первая поднявшая руку.
- Первый слог название химического элемента является также первым у названия класса соединений, молекулы которых состоят из одного атома металла и одной или нескольких гидрооксогрупп, второй имеется у «пожирателя» нейтронов: в целом – это самый тяжелый металл на земле. (основание, кадмий - осмий).
- первые две буквы названия химического элемента является первыми в фамилии ученого, профессора Пражского университета, написавшего главу о редких землях для учебников Д. И. Менделеева «Основы химии»; две последние буквы обозначают единицу сопротивления электрического тока. В целом, это единственный жидкий неметалл. (брауиер, ом-бром).
- Первые три буквы название химического элемента являются также первыми в названии алкалоида – сильнейшего яда, находящегося в табаке; последние три название хвойного дерева; в целом – это металл, применяемый для защиты других металлов от коррозии. (никотин, ель-никель).
Предлагается слово по второму заданию.
Конкурс пантомима (39 сек.)
От команды вызывают по одному представителю на сцену. Ведущий дает задание изобразить мимикой горе – ученика, который не владеет никакими лабораторными навыками.
После этого проводится аукцион зрителей «болельщиков». Купля вещества в обмен на знания. Выставляет ведущий на сцену вещество. Болельщики, которые набирают большее число баллов по информации об этом веществе (строение, состав, свойства, применение, история открытия, получение и т. д.), зарабатывают дополнительный балл своей команде, и вещество является проданным данной команде.
Команда «купившая» вещество, должна тут же в течение минуты подготовить и затем показать творческий «комиссионный сбор» (это песня, сценка и т.д. по поводу приобретенного вещества). Можно выставить любое вещество, например поваренную соль, сахар и т.д.
Слово жюри для оценки пантомимы.
Третье задание дается обеим командам. Объяснить наблюдаемое явление. (Опыт делает ведущий). Задание 1 команде.
Закипевший чай в литровой колбе закрывают пробкой, переворачивают вниз горлышком и закрепляют вверх дном в лапке штатива. После этого поливают дно колбы холодной водой. Горячая вода закипает. Почему?
Ответ: пары воды в колбе конденсируются при охлаждении, давление в колбе понижается, температура кипения воды уменьшается.
Задание второй команде. (Ведущий комментирует опыт во время демонстрации).
Тигель с 1-2 мл. какой-то жидкости покрыт стаканом. Стакан наполняется белым дымом. Объяснить наблюдаемое явление.
Слово жюри: оценка за 1. Аукцион зрителей. 2. Третье задание.
Конкурс капитанов.
1 задание. Капитаны должны выбрать друг друга подарок из числа предметов, предложенных ведущим, и придумать к нему веселую дарственную надпись. (Это может быть склянка с кислотой, с щелочью, с нашатырным спиртом и т.д.).
II задание. Ведущий задает вопрос каждому капитану, о каком металле идет речь. Вопрос капитану команды «Алхимик»
Прославлен всеми именами,
Металл, испытанный огнем,
Маня к себе людей веками,
Алхимик жил мечтой о нем,
Он, как кумир, не свергнут нами,
Уж блеск его нас все манит.
Хоть хорошо мы знаем с вами,
Не все то ценно, что блестит.
Вопрос капитану команды «Антимоний»
Хранят обычно в керосине,
И бегает он по воде.
Отныне знай, в свободном виде
В природе нет его нигде.
В солях его открыть возможно.
Желтеет пламя от него,
И получить из соли можно,
Как Дэви получил его.
Слово жюри для оценки конкурса капитанов.
Домашнее задание:
«Химики обживают новую планету». При формулировке домашнего задания нужно исходить из того, чтобы дать простор для воображения и творчества ребят.
Слово жюри для оценки домашнего задания.
Жюри подводит итоги.
Примечание: между конкурсами, а также во время неожиданных пауз включается музыка.
Такие мероприятия, проводимые во внеклассной работе, углубляют знания, повышают интерес к химии, развивают творческое мышление детей, поднимают эмоциональный тонус и сплачивают коллектив.
III. МЕТОДИКА РЕШЕНИЯ РАСЧЕТНЫХ ЗАДАЧ ПО ХИМИИ
(рекомендуется использовать эти задачи при подготовке к теоретическому туру олимпиады по химии)
Одной из сторон проблемы, поставленной перед школой является «научить учиться», выявлять и развивать интерес к предмету и к возможной будущей специальности. Наиболее распространенной формой развития интереса является олимпиада по предмету. Она позволяет выявить учащихся, проявляющих интерес к изучению химии и связанных с ней естественных наук, углубить знания и развить этот интерес к любимому предмету школьного курса в процессе внеклассной работы.
В процессе решения задач, при подготовке к олимпиаде, происходит уточнение и закрепление химических понятий о веществах и процессах, вырабатывается смекалка в использовании имеющихся знаний. Задачи, включающие определенные химические ситуации, становятся стимулом самостоятельной работы учащихся над учебным материалом.
У учащихся в процессе решения задач воспитываются трудолюбие, целеустремленность, развивается чувство ответственности, упорство и настойчивость в достижении поставленной цели.
В ходе решения задач идет сложный процесс мыслительной деятельности учащихся. Наиболее существенный вклад в подготовку и проведение олимпиад вносит учитель, который непосредственно проводит занятия с учащимися, организует и проводит школьный тур олимпиады, готовит своих учеников к последующим этапам олимпиады. Учителю первым приходится отвечать на все вопросы школьников, которые у них возникли в процессе решения задач, поэтому он должен достаточно хорошо быть ознакомлен с различными задачами и вопросами, которые предлагаются на олимпиадах. И я хочу предложить для разрешения в какой-то степени этих проблем несколько задач и их решение. Эти задачи можно предложить для теоретического тура школьной химической олимпиады, а также порешать при подготовке к районной олимпиаде.
При рассмотрении задач на расчет по уравнениям химических реакции я обращаю внимание учащихся на правильную запись химической и математической части задачи, показать пути анализа задачи, так как правильное использование физических величин и корректное проведение математических расчетов- обязательное условие успешного обучения учащихся решению задач.
А также использую прием подчеркивания формул веществ с известными данными одной чертой, а с неизвестной величиной – двумя чертами с записью под ними количеств веществ по уравнению реакции.
Для решения задач на расчет, например по уравнению реакции, может быть использован следующий алгоритм.
Алгоритм
- Прочтите текс задачи, вникните в ее сущность.
- Выполните химическую часть решения задачи:
 краткая запись условия
краткая запись условияХ

 имическая часть исследование
имическая часть исследованиерешения задачи анализ
3. Выполните математическую часть решения задачи:
 рациональный способ решения
рациональный способ решенияМ
 атематическая часть расчеты
атематическая часть расчеты решения задачи запись ответа
- Проверьте результат.
- Составьте условия обратной задачи.
Кроме того в качестве раздаточного материала использую памятку «требования к оформлению и решению расчетных задач» . Приведу ее содержание.
Памятка
Требование к оформлению и решению расчетных задач
- Сформулировать условие задачи корректно
- Сделать краткую запись условия задачи из двух частей: «Найти», «Дано».
- Обозначать физические величины по правилам ИЮПАК.
- Сделать анализ имеющейся информации на избыток или недостаток данных.
- Записывать все необходимые для решения физические величины в «Дано».
- Решать задачу рациональным способом в общем виде с однократной постановкой числовых значений.
- Предварять каждое действие поясняющей записью.
- Проводить математические действия не только с числами, но и с единицами измерения.
- Давать числовое значение ответа не больше точности наименее точного числа.
- Записывать полный ответ на вопрос задачи без использования формул соединений.
- Проводить проверку полученного результата через составление условия обратной задачи.
13.Необходимо мыслить в категориях молей и определять массу только тогда, когда это действительно необходимо.
Рассмотрим три способа решения задачи .
Какой объем водорода (н.у) выделится при растворении в соляной кислоте 325 кг цинка, содержащего 20 % примесей.7
Согласно первому пункту памятки сформулируем условие задачи корректно
Рассчитайте объем водорода (н.у.),выделившегося при взаимодействии с соляной кислотой 325 кг цинка, содержащего 20% примесей.
Далее решаем задачу, следуя пунктам памятки.
Образец решения задачи
Н а й т и:
V(H2) = V1.
Д а н о :
mобр = 325 кг;
W(Zn)= W = 0,80;
M (Zn) = M = 65 кг/кмоль;
Vn = 22,4м3/кмоль.
Р
 е ш е н и е :
е ш е н и е :Z
 n +2HCl = ZnCl2 + H2
n +2HCl = ZnCl2 + H2 1 моль 1 моль
n n1
По определению
V1 = n1 *Vn. (1)
Из уравнения реакции
n1= n.
По определению
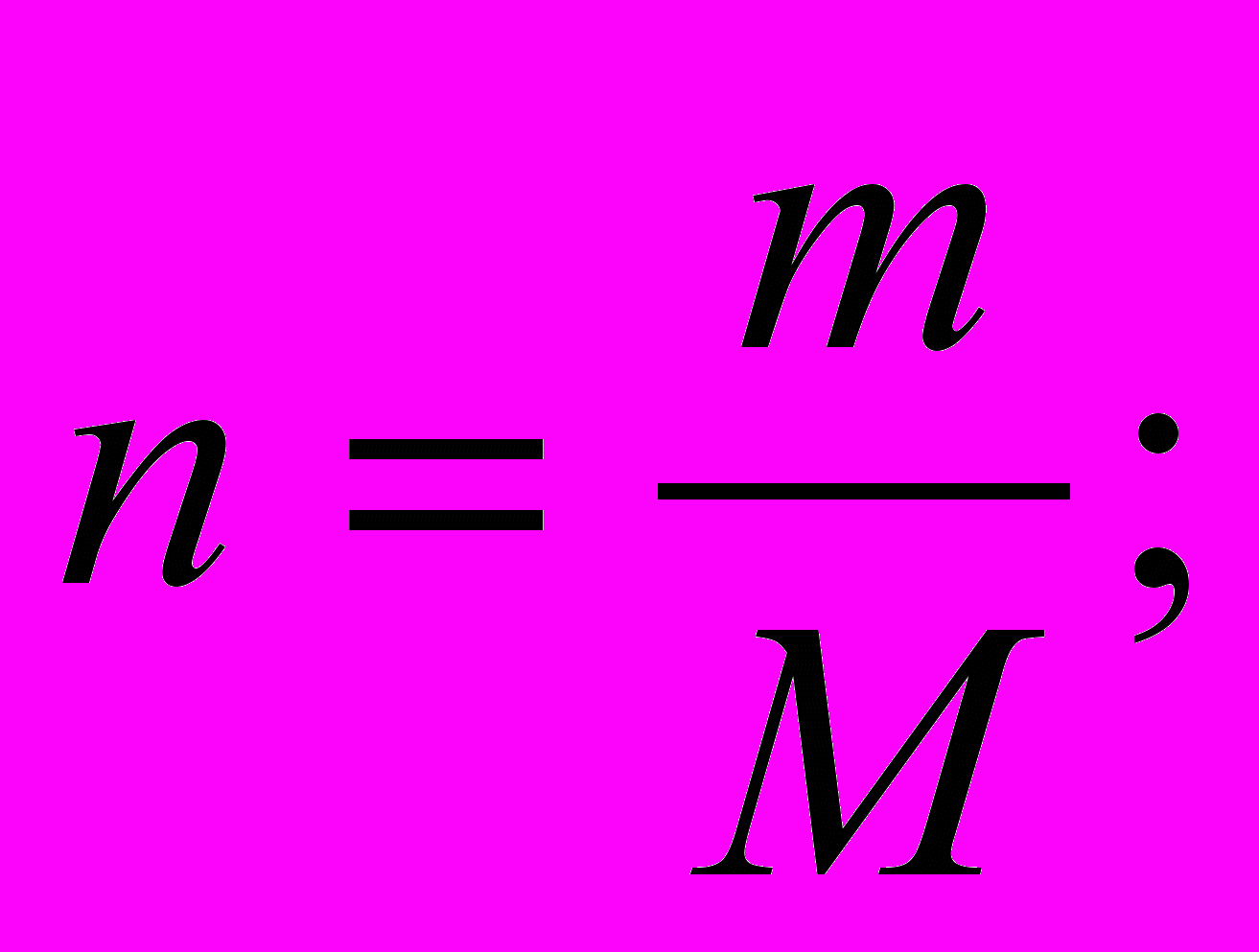 (2)
(2)m = mобр * W. (3)
подставим (3)и (2) в (1):
V1=
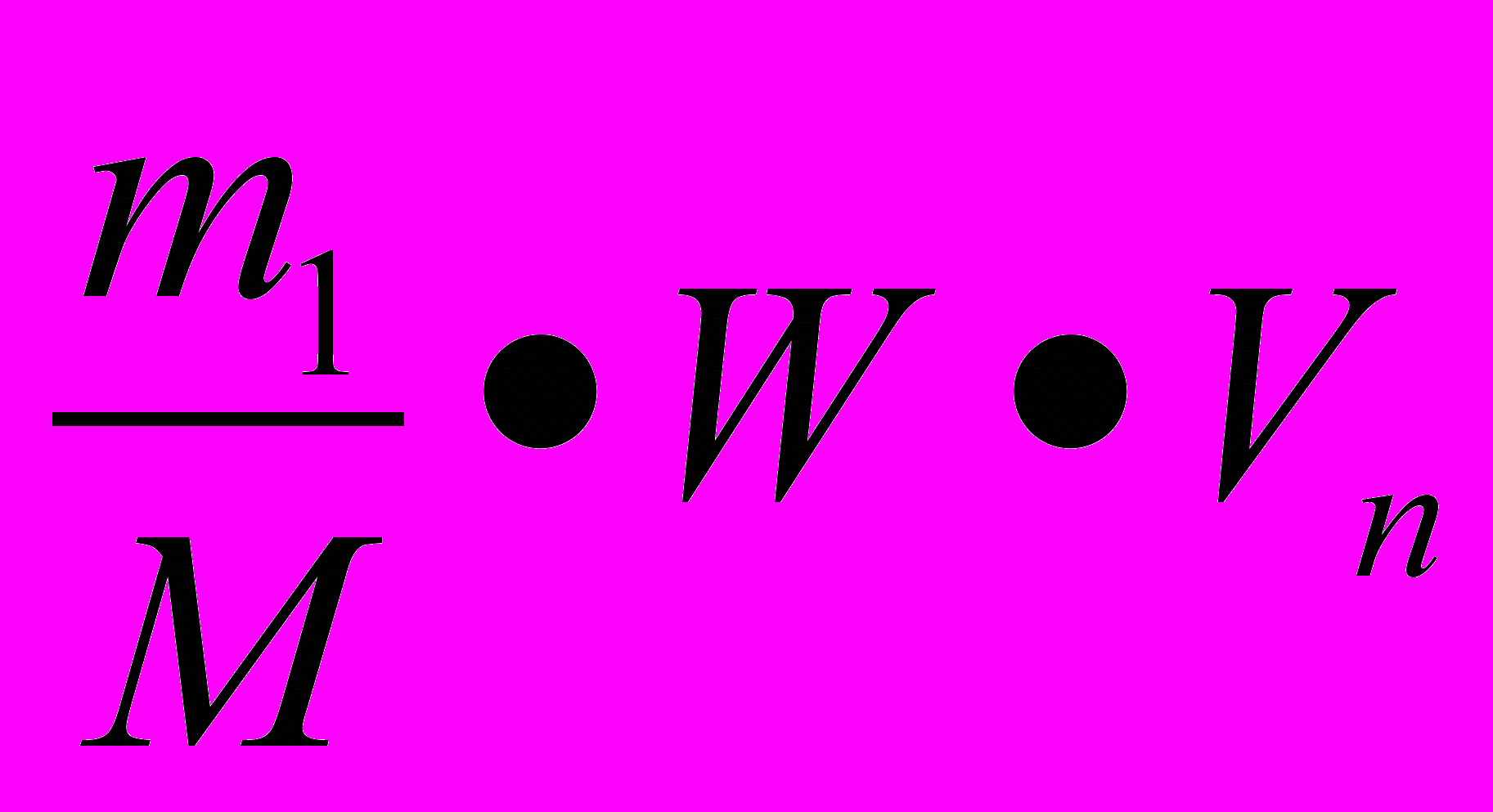 - решение задачи в общем виде.
- решение задачи в общем виде.Проведем расчет:
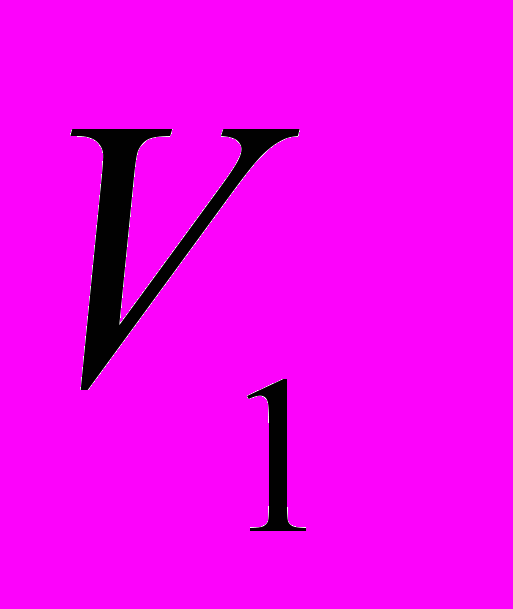 =
=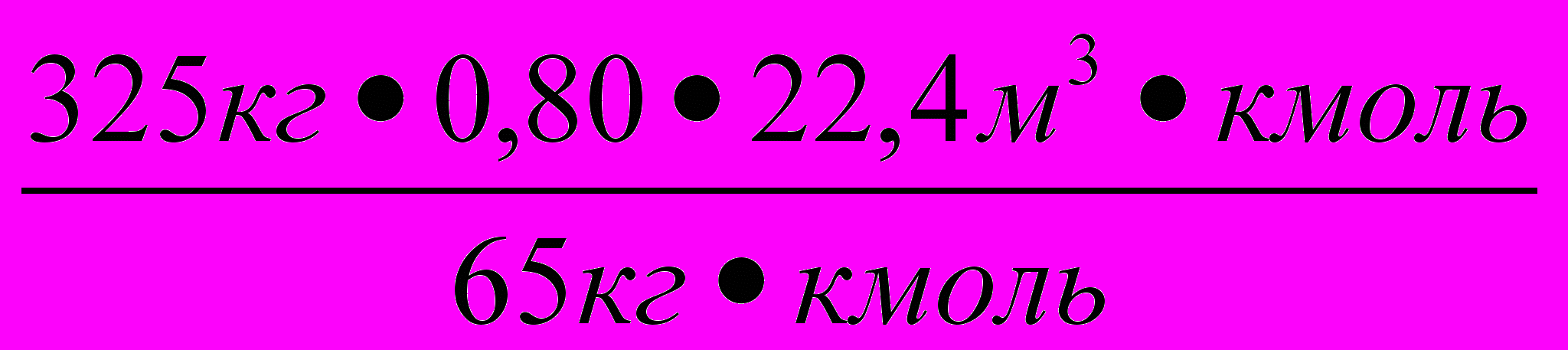 =89,6 м3 ≈ 90 м3.
=89,6 м3 ≈ 90 м3.О т в е т : объем водорода 90 м3.
Образец решения задачи
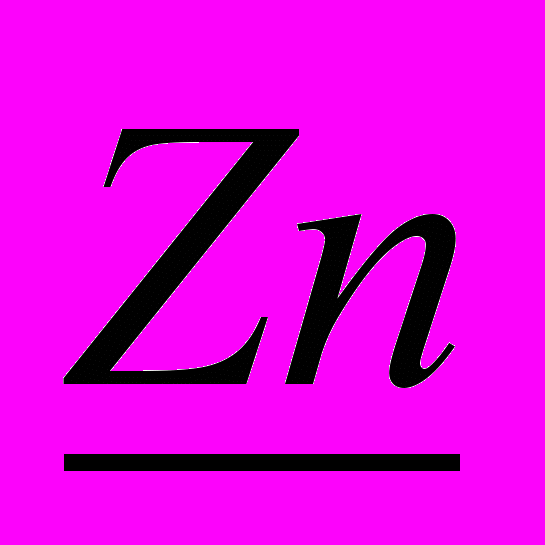
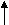 + 2 HCl = ZnCl2 +
+ 2 HCl = ZnCl2 + 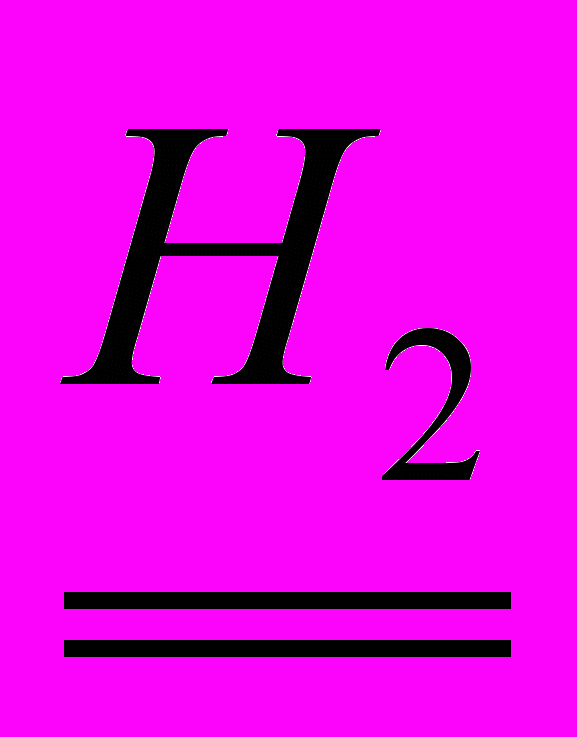
1 моль 1 моль
n n1
По определению
mобр ≈
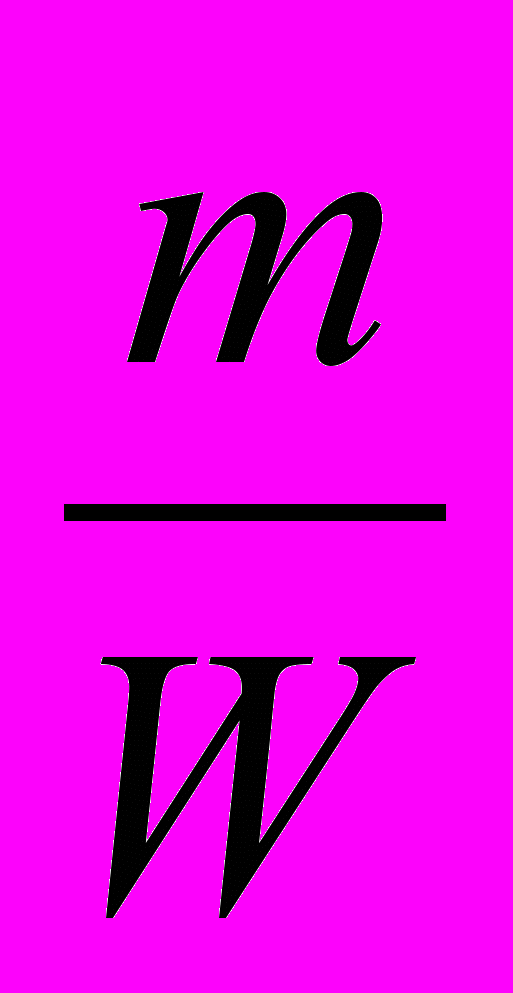 ; (1)
; (1)m = n*M (2)
Отсюда
Из уравнения реакции
n = n1 =
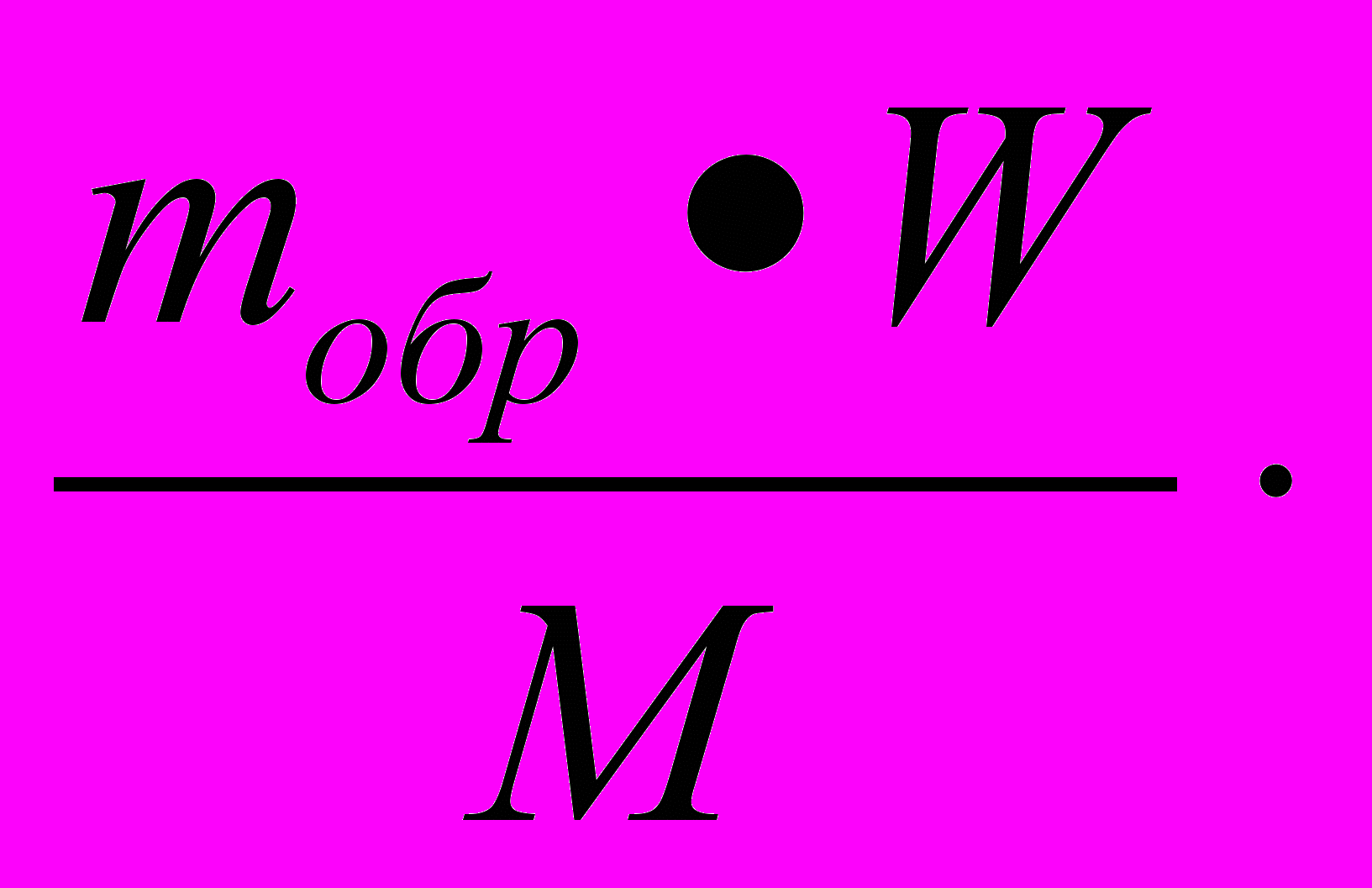 (3)
(3)П о определению n1=
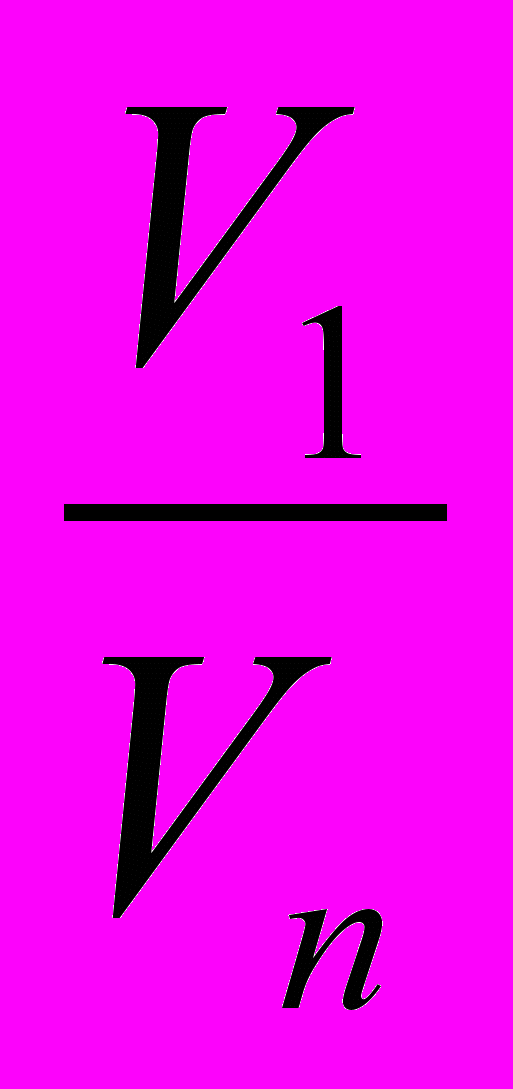 (4)
(4)Отсюда V1 = n1 * Vn (5)
Подставим (3) и (5): V1 =
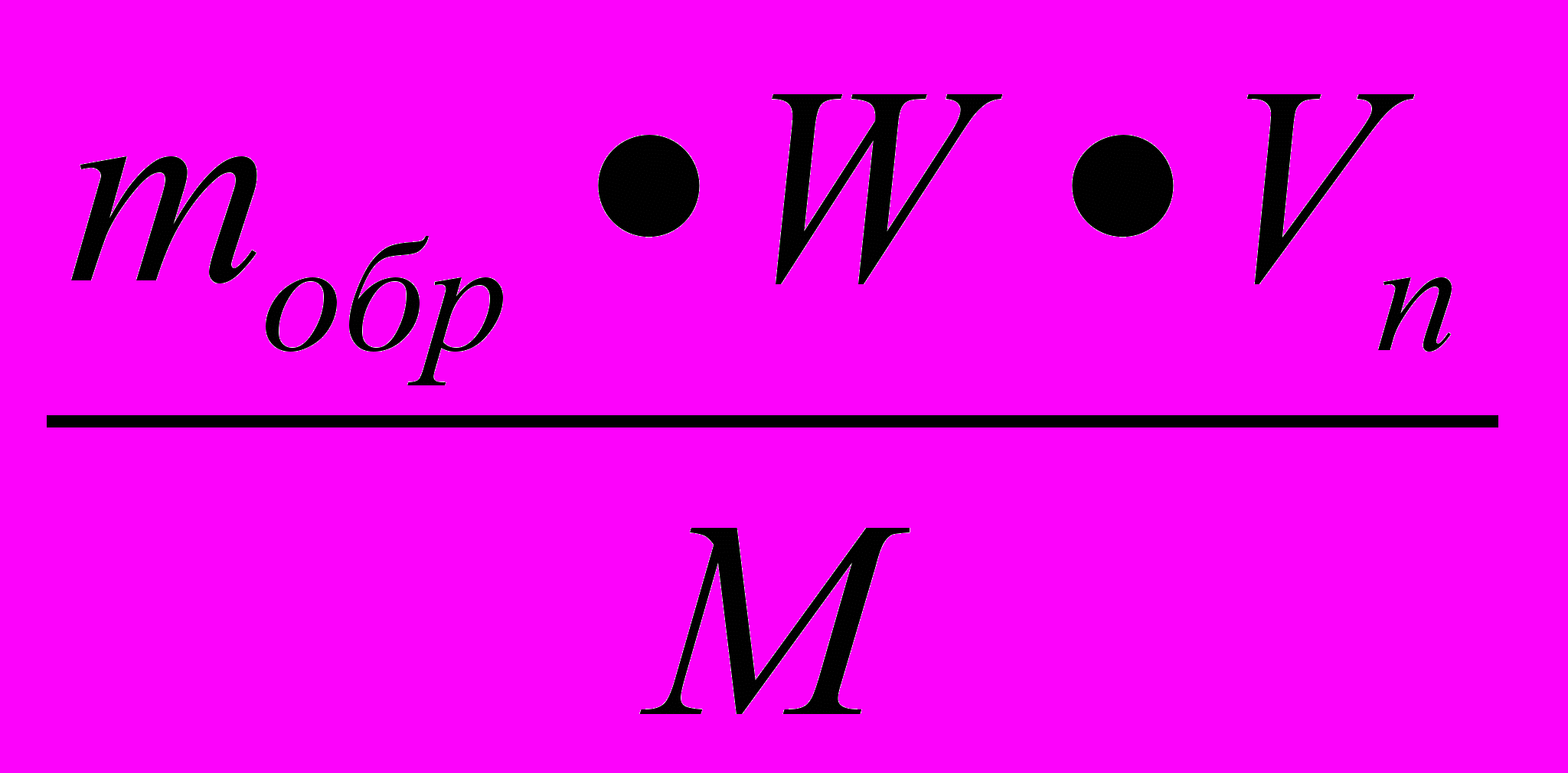 - решение задачи в общем виде.
- решение задачи в общем виде.Образец решения задачи в традиционным способом:
- Составляем уравнение реакции:

Zn + 2HCl = ZnCl2 + H2 .
- Над формулами веществ пишем массу цинка, вступающего в реакцию (ее предварительно рассчитываем, исходя из условий задачи), и искомую величину:
m (Zn) = m обр *W(Zn);
W(Zn) = 1 – W(примеси);
W(Zn) = 1 – 0,2 = 0,8;
W(Zn) = 325 кг * 0,8 = 260 кг.
260 кг х м3
Zn + 2HCl = ZnCl2 +H2 .
- Под формулой цинка пишем массу 1 кмоль, а под формулой водорода – соответственно объем 1 кмоль:
260 кг х м3
Zn + 2HCl = ZnCl2 +H2 .
65 кг 22.4 м3
4. Составляем пропорцию и решаем ее:
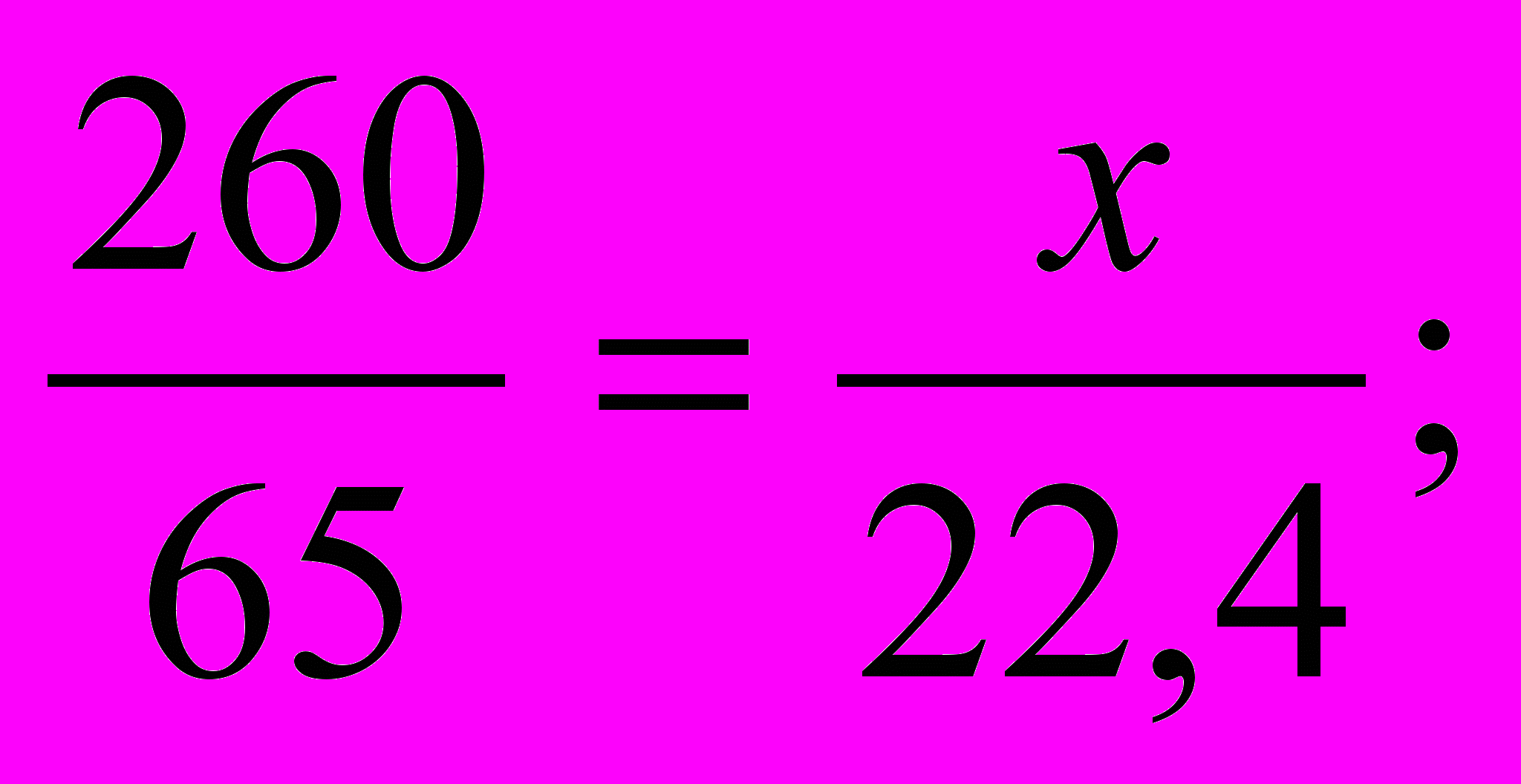
x=
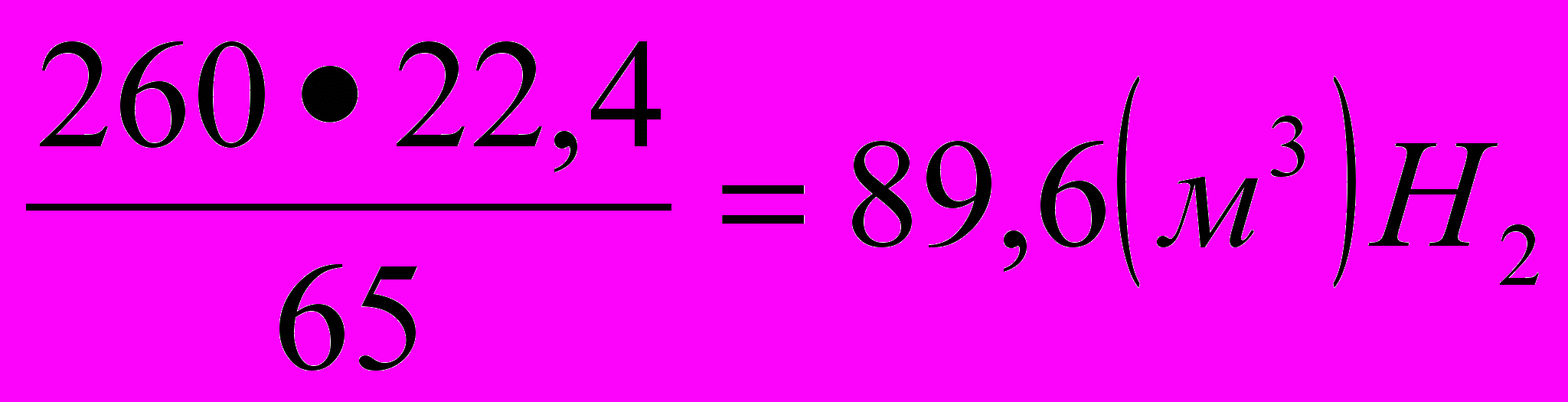
5.Записываем ответ: V(H2) = 89,6 м3
П
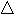
 риведу в качестве примера две карточки из блока «Расчеты по уравнениям химических уравнений» по технологии «Взаимообмен заданиями», составленные для учащихся VIII класса с право- и левополушарным типами познавательной деятельности. Второе задание в карточке содержит три условия разноуровневых задач ( - на «3», - на «4» , - на «5»).
риведу в качестве примера две карточки из блока «Расчеты по уравнениям химических уравнений» по технологии «Взаимообмен заданиями», составленные для учащихся VIII класса с право- и левополушарным типами познавательной деятельности. Второе задание в карточке содержит три условия разноуровневых задач ( - на «3», - на «4» , - на «5»).Блок «Расчеты по уравнениям химических уравнений»
КАРТОЧКА 1
Расчет массы вещества по известной массе другого вещества, содержащего определенную долю примесей
I
Рассчитайте массы жженной извести, образующейся при разложении 500 кг известняка, содержащего 0,20 примесей
Алгоритм решения
- Прочтите условие задачи.
- Проанализируйте его.
- запишите данные
Образец решения для «правополушарных»:
Н а й т и:
m(CaO) = m1.
mизв. = 500 кг;
Wпр =0,20;
M(CaO) = M1 = 56 кг/кмоль;
M(CaCO3) + = 100 кг/кмоль;
Wизв.= 0,80.
Р е ш е н и е:
1. Запишите уравнение реакции:
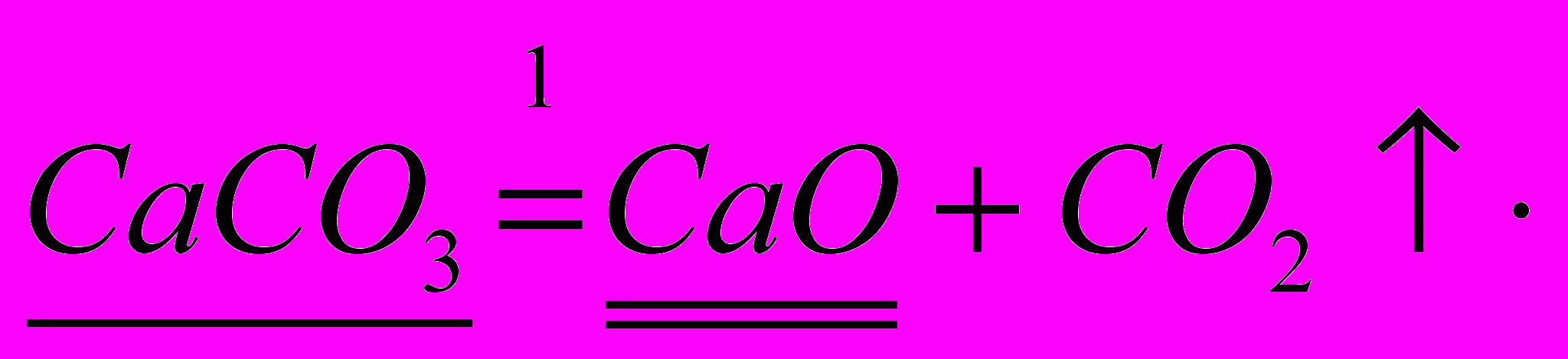
1 моль 1 моль
2. По определению
m1 = n1 . M1. (1)
3.Из уравнения реакции
n1 = n.
- По определению
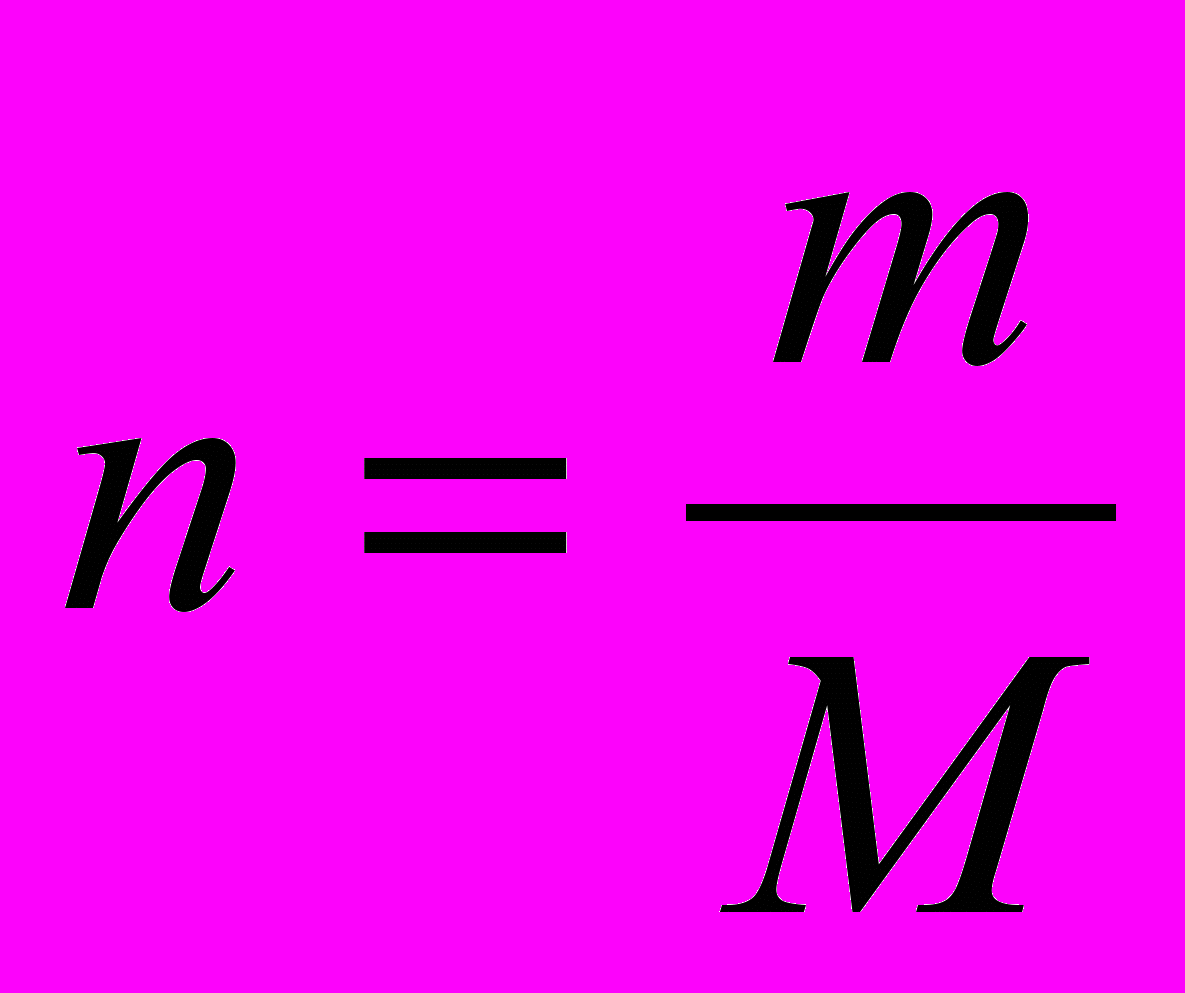 и
и 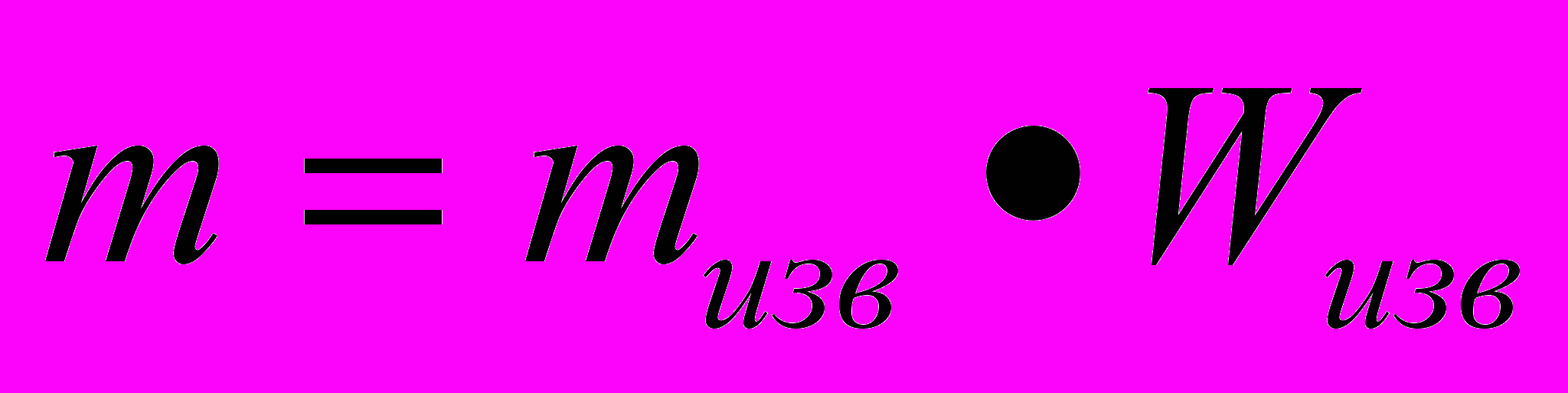
Отсюда
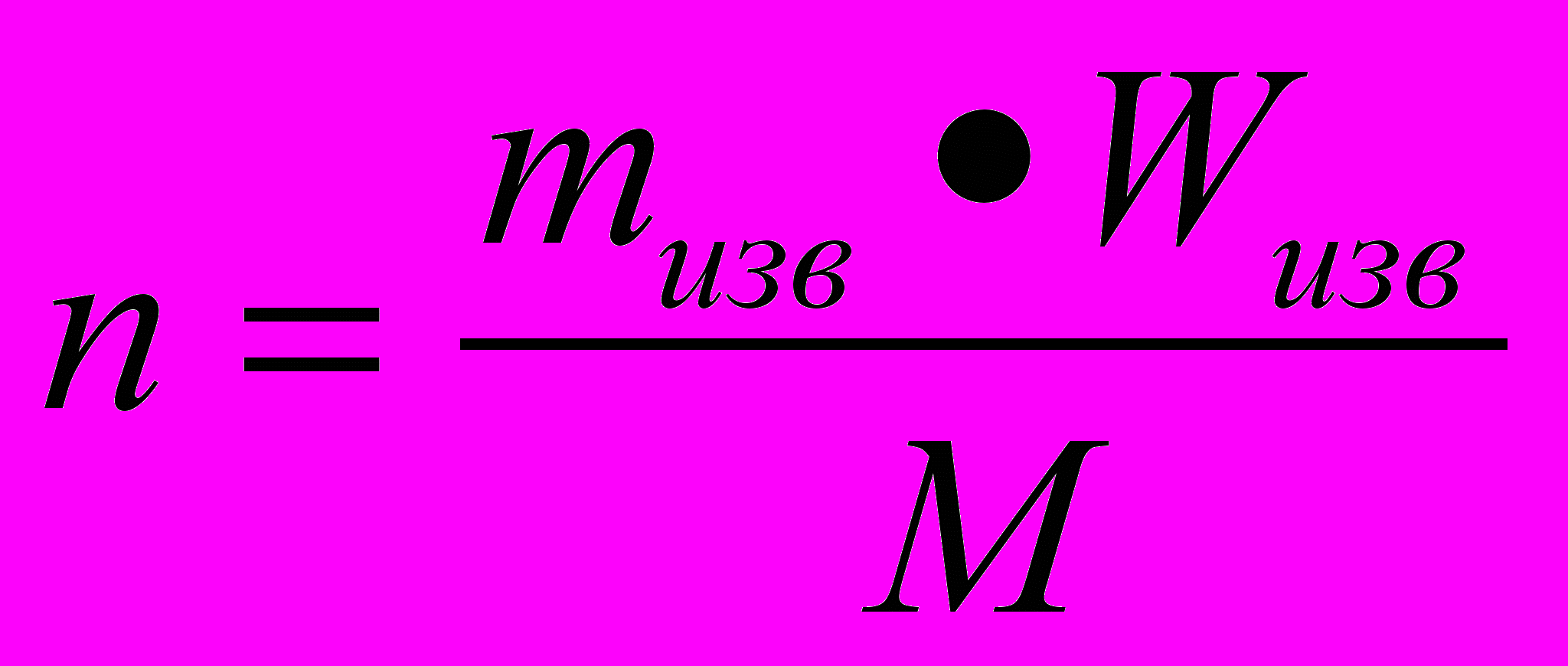 (2)
(2)- Подставьте (2 ) в (1)
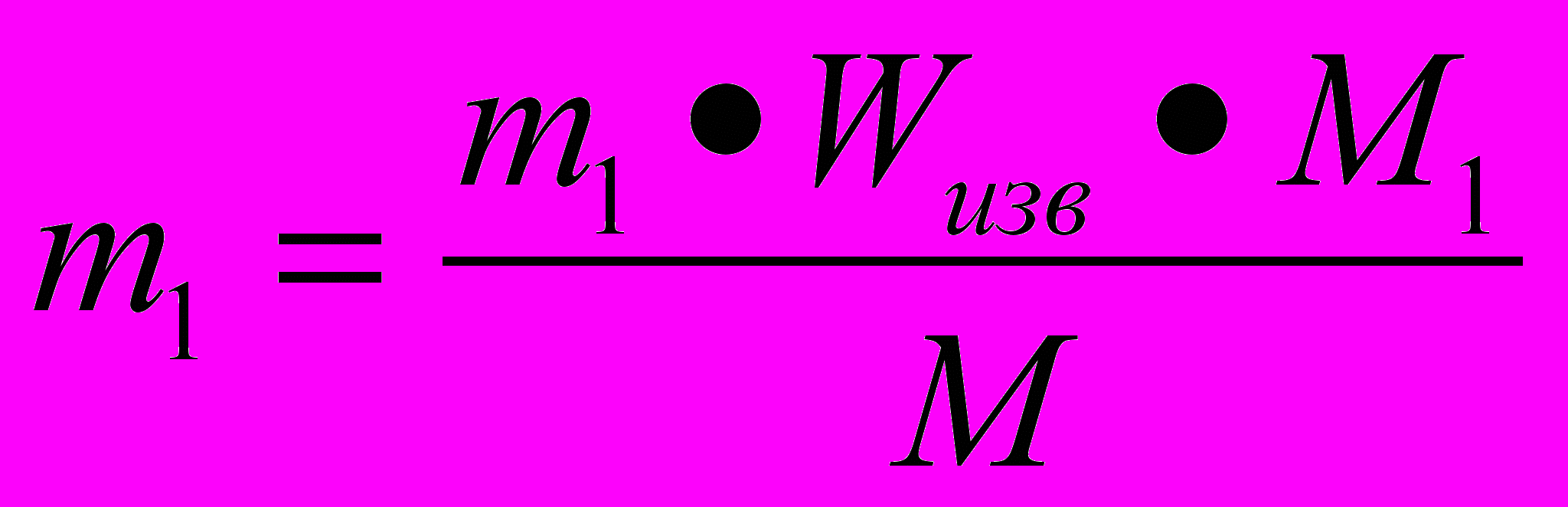 -решение задачи в общем виде.
-решение задачи в общем виде.- Проведите расчет:
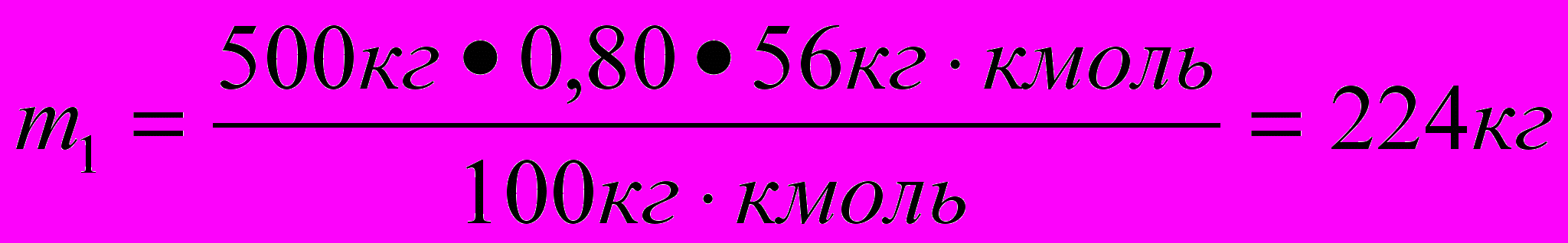 .
.- Запишите ответ.
II
 - Вычислите массу оксида меди (II). Образовавшегося при разложении 200 кг гидроксида меди (II). Содержащего 0,25 примесей.
- Вычислите массу оксида меди (II). Образовавшегося при разложении 200 кг гидроксида меди (II). Содержащего 0,25 примесей. При обработке избытком соляной кислоты природного известняка массой 30 кг получен оксид углерода (IV)массой 14 кг. Рассчитайте массовую долю карбоната кальция в природном известняке.
При обработке избытком соляной кислоты природного известняка массой 30 кг получен оксид углерода (IV)массой 14 кг. Рассчитайте массовую долю карбоната кальция в природном известняке. Массовая доля карбоната меди (II) в малахитеCu2H2CO5 Вычислите массу объем (н.у.) оксида углерода (IV), полученного при разложении 300 г малахита.
Массовая доля карбоната меди (II) в малахитеCu2H2CO5 Вычислите массу объем (н.у.) оксида углерода (IV), полученного при разложении 300 г малахита.Карточка 1 для «левополушарных» содержит тот же материал, за исключением решения.
Образец записи решения для «левополушарных»:
Р е ш е н и е:
1. Напиши уравнение реакции:
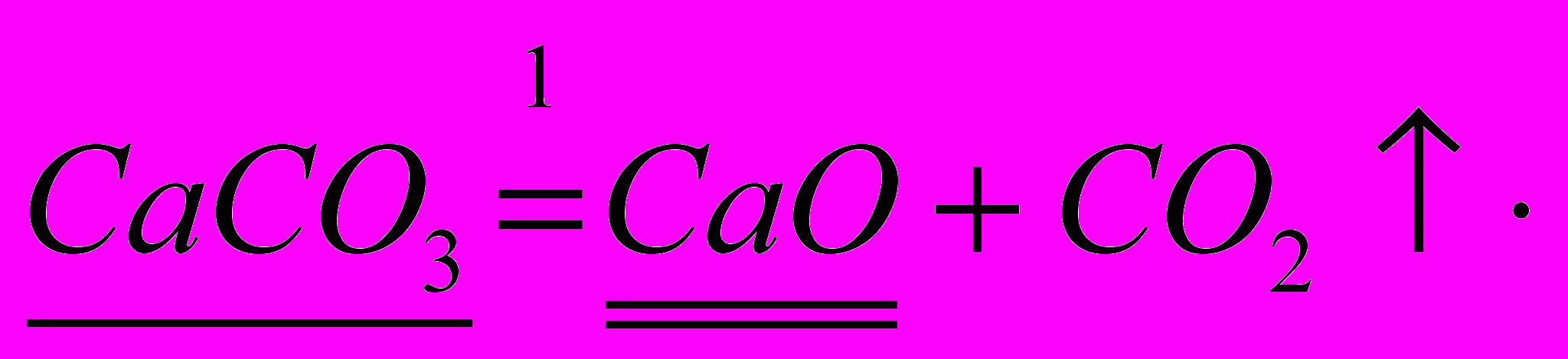
1 моль 1 моль
2. По определению
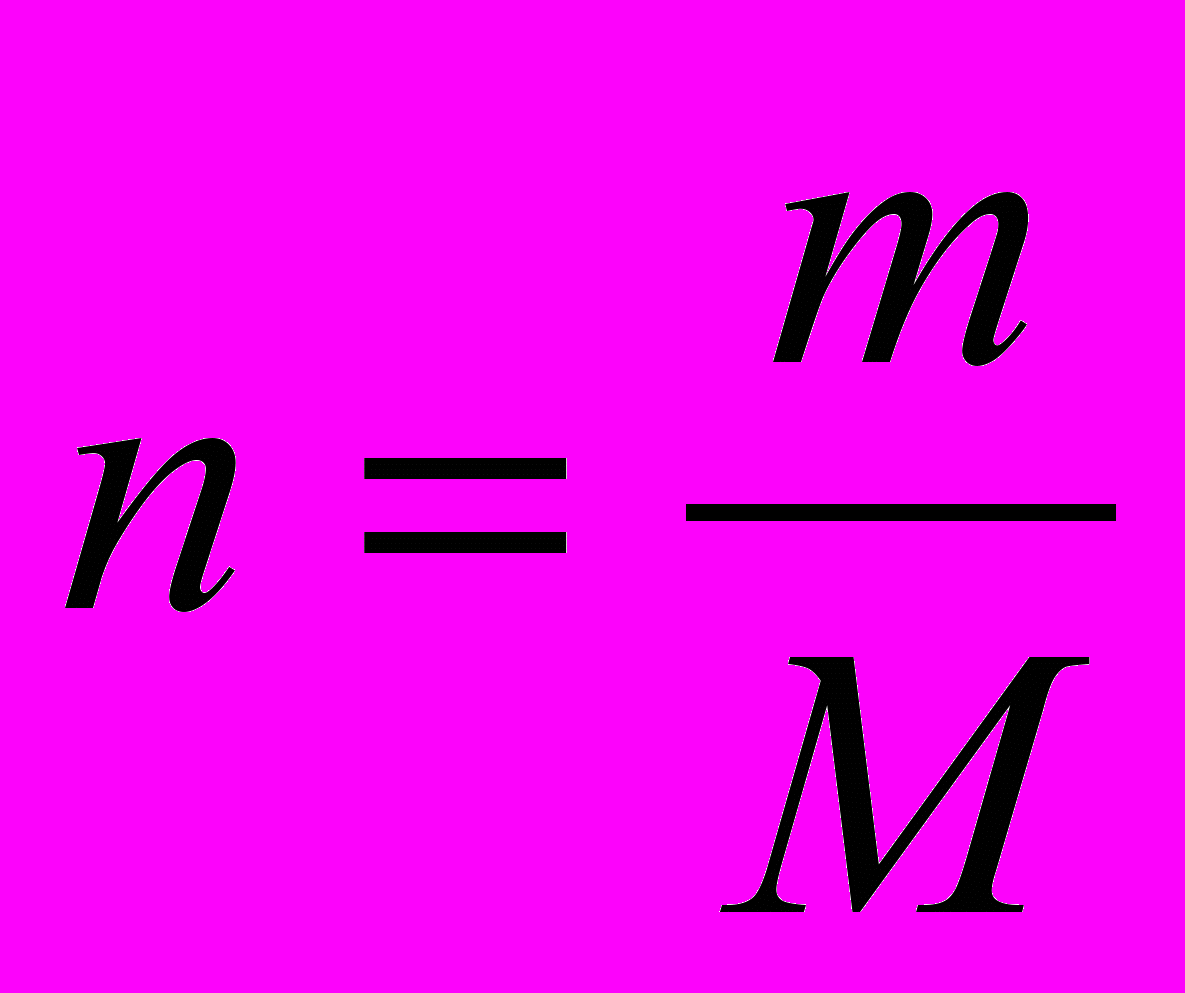 и
и 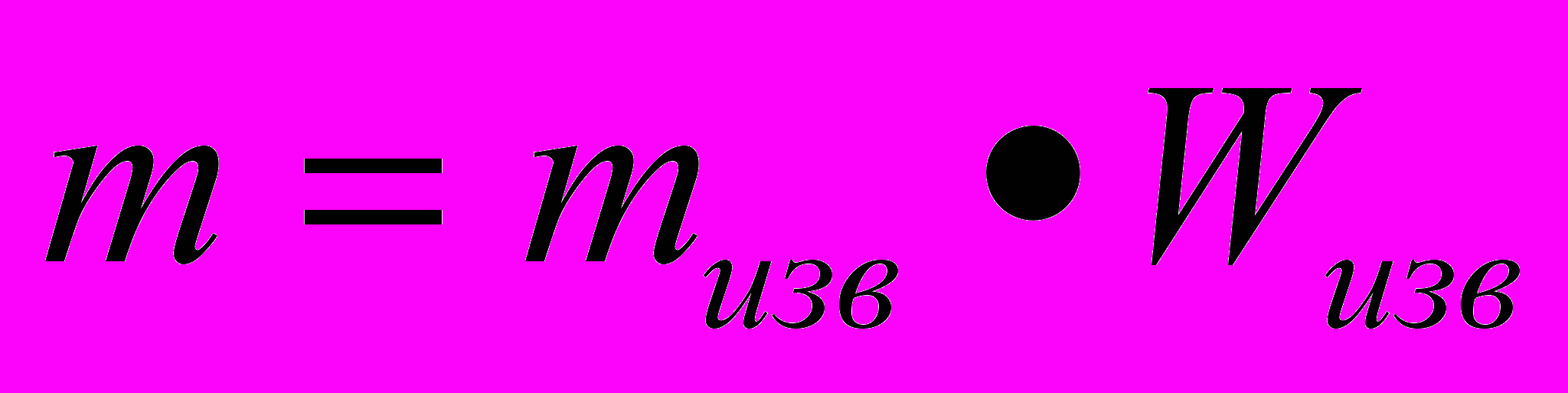
отсюда
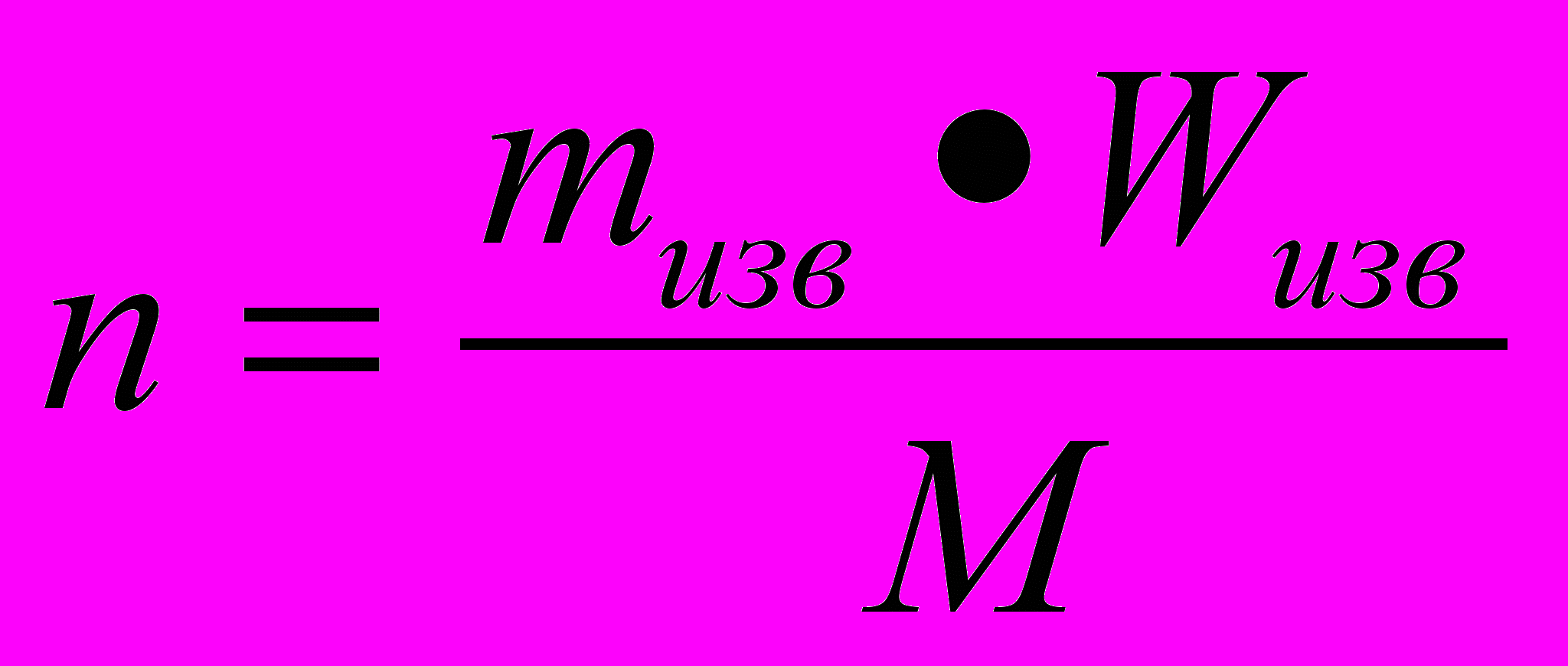 (1)
(1)3. Из уравнения реакции
n = n1.
4. По определению
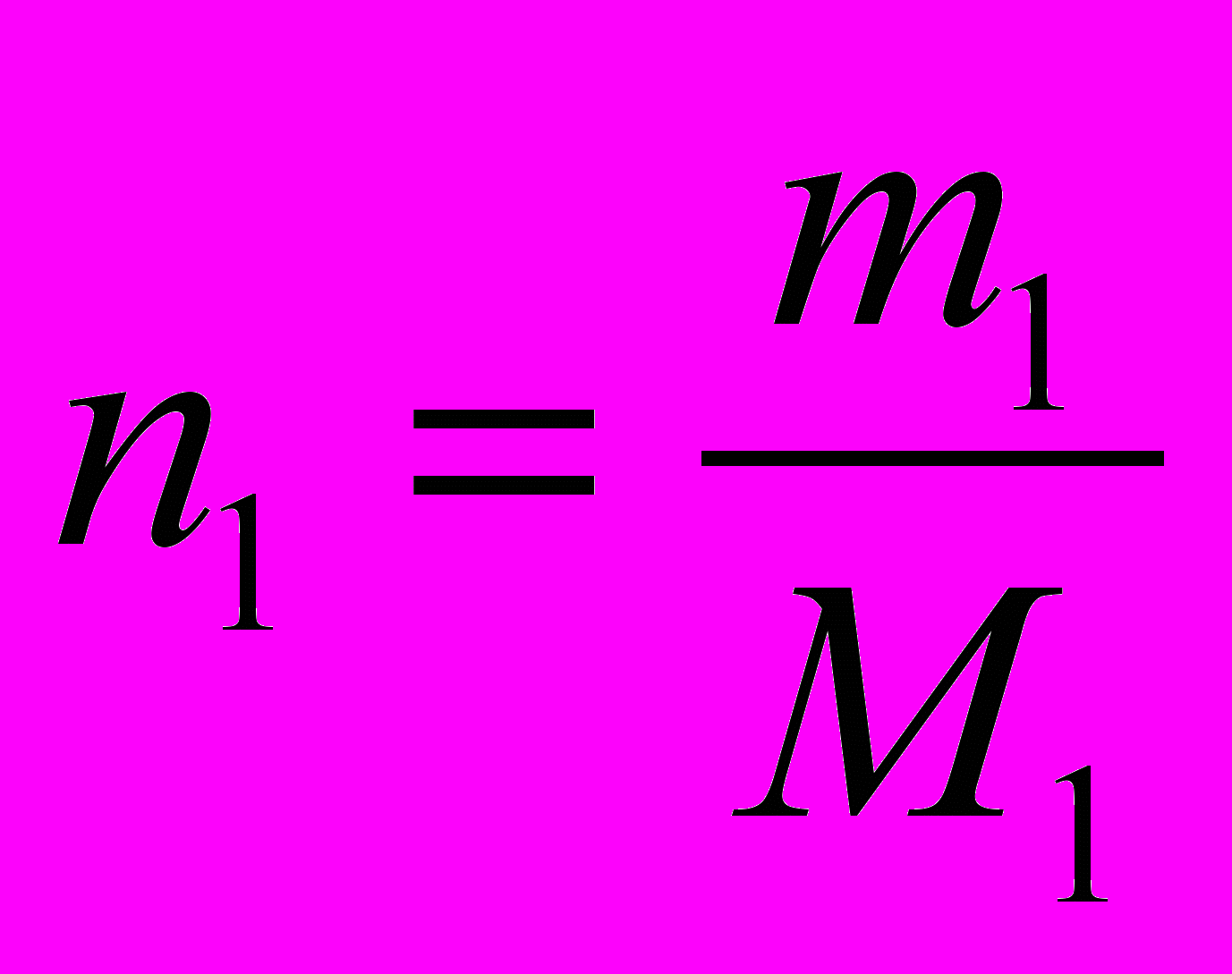 ,
,Отсюда
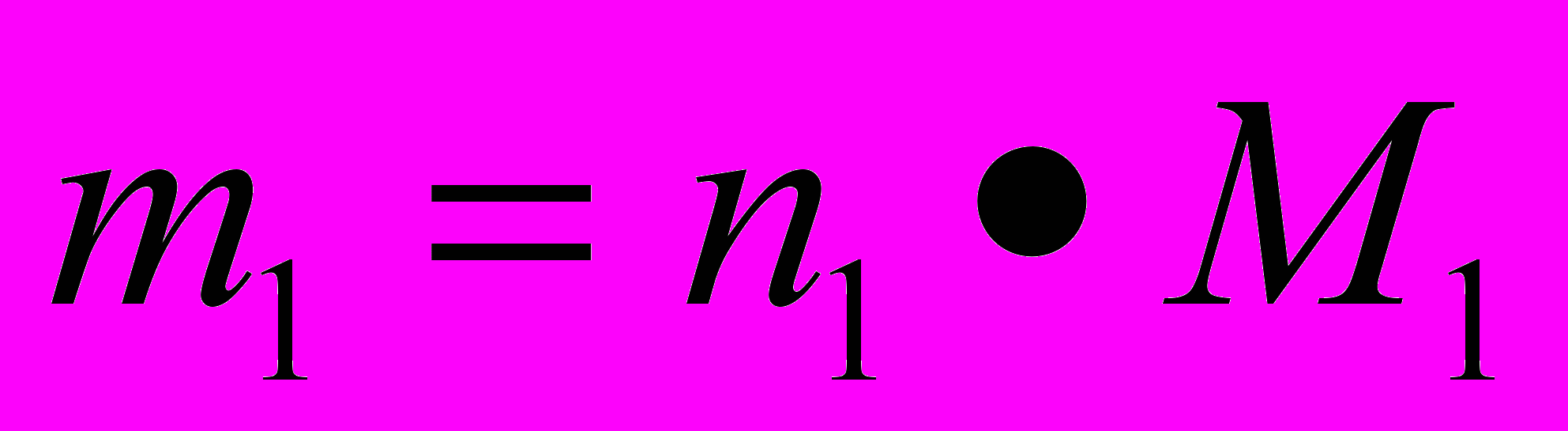 . (2)
. (2) 5. Подставьте (1) в (2):
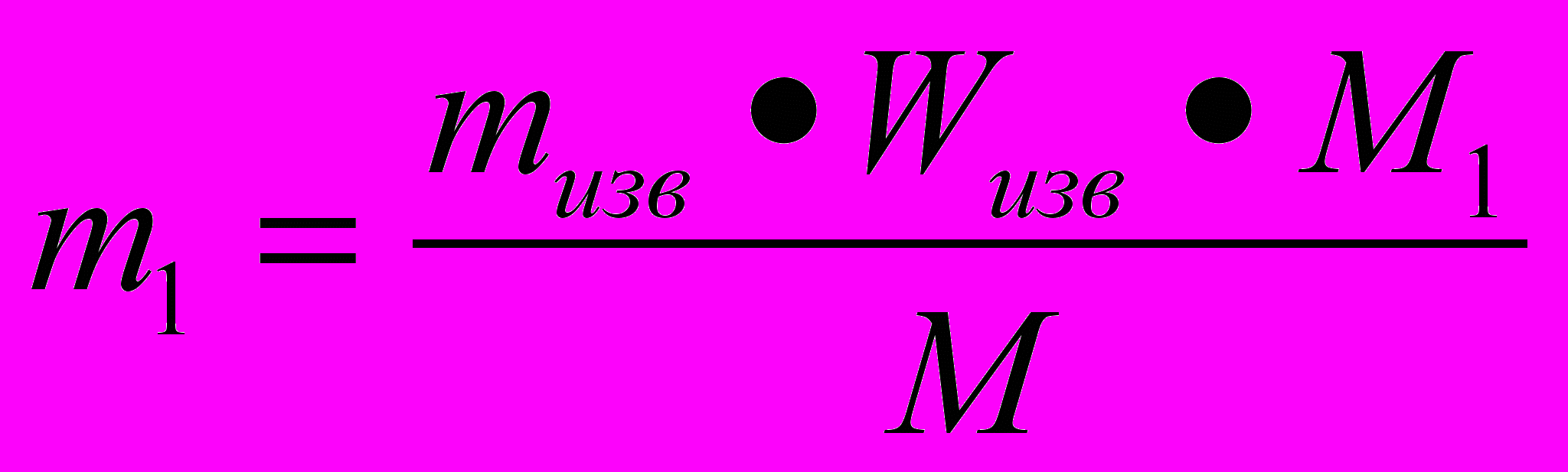 - решение задачи в общем виде.
- решение задачи в общем виде.6.Проведите расчет:
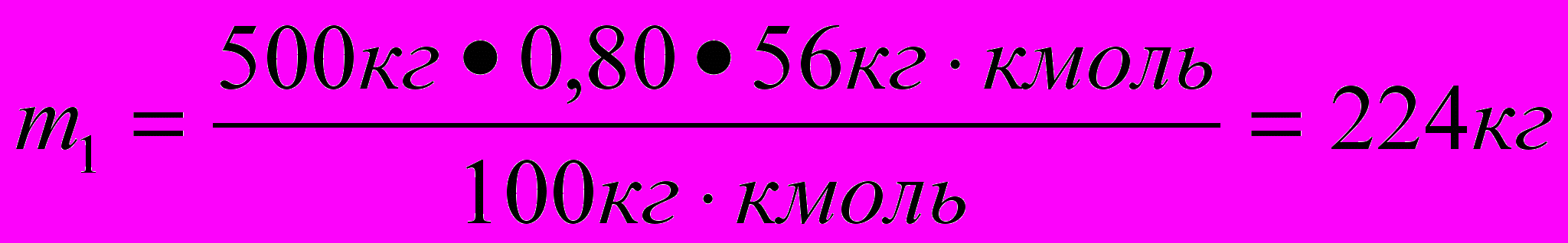
7.Запишите ответ.
КАРТОЧКА 2
Расчет количества вещества продукта реакции по массовой доле исходного вещества в определенной массе раствора.
I
Рассчитайте количество водорода, выделившегося при взаимодействии 730 г 30%-ного раствора соляной кислоты с цинком
Алгоритм решения
- прочитайте условие задачи.
- Проанализируйте его.
- Запишите данные.
Образец записи для «правополушарных»:
Н а й т и :
n(H2) = n1
Д а н о :
mp= 730 г;
W(HCl) = 0,30;
M(HCl) = M = 36,5 г/моль.
Р е ш е н и е:
1. Напишите уравнения реакции:
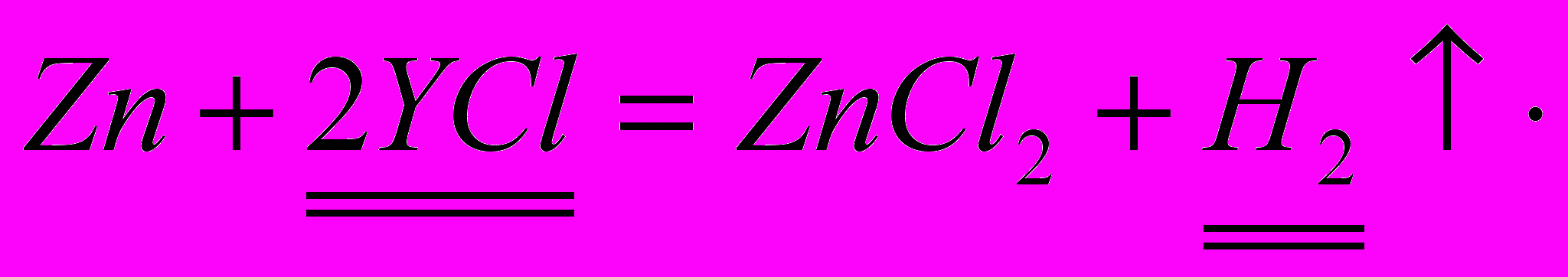
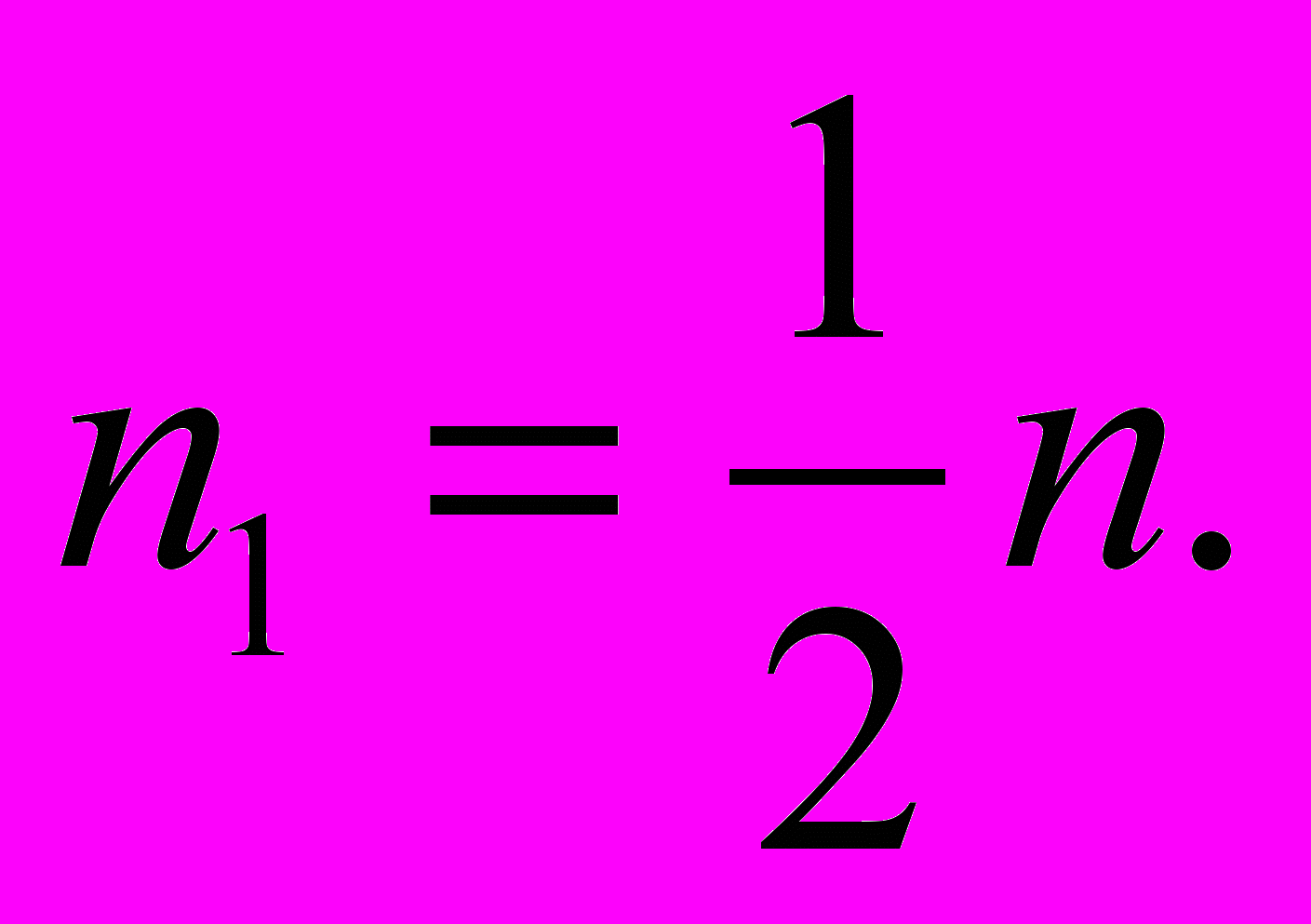
- По определению
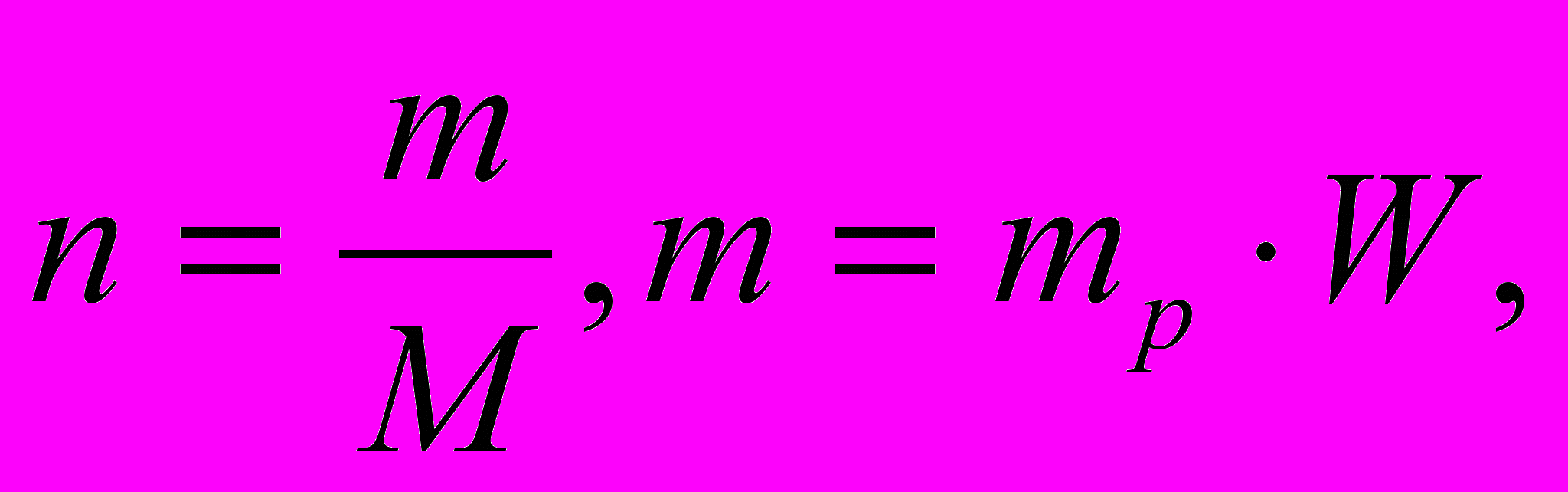
Отсюда
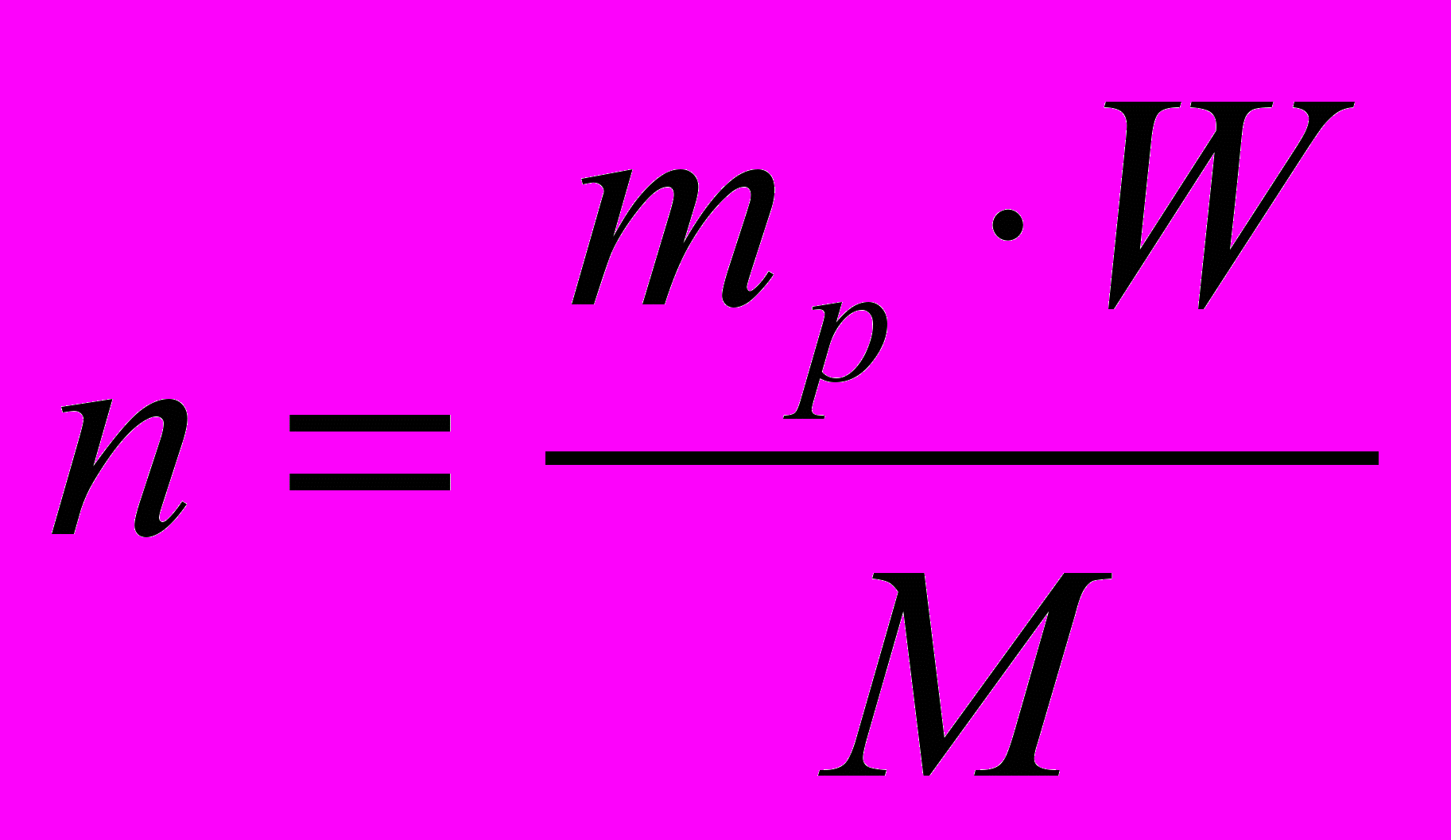 .
.- Подставьте (2) в (1):
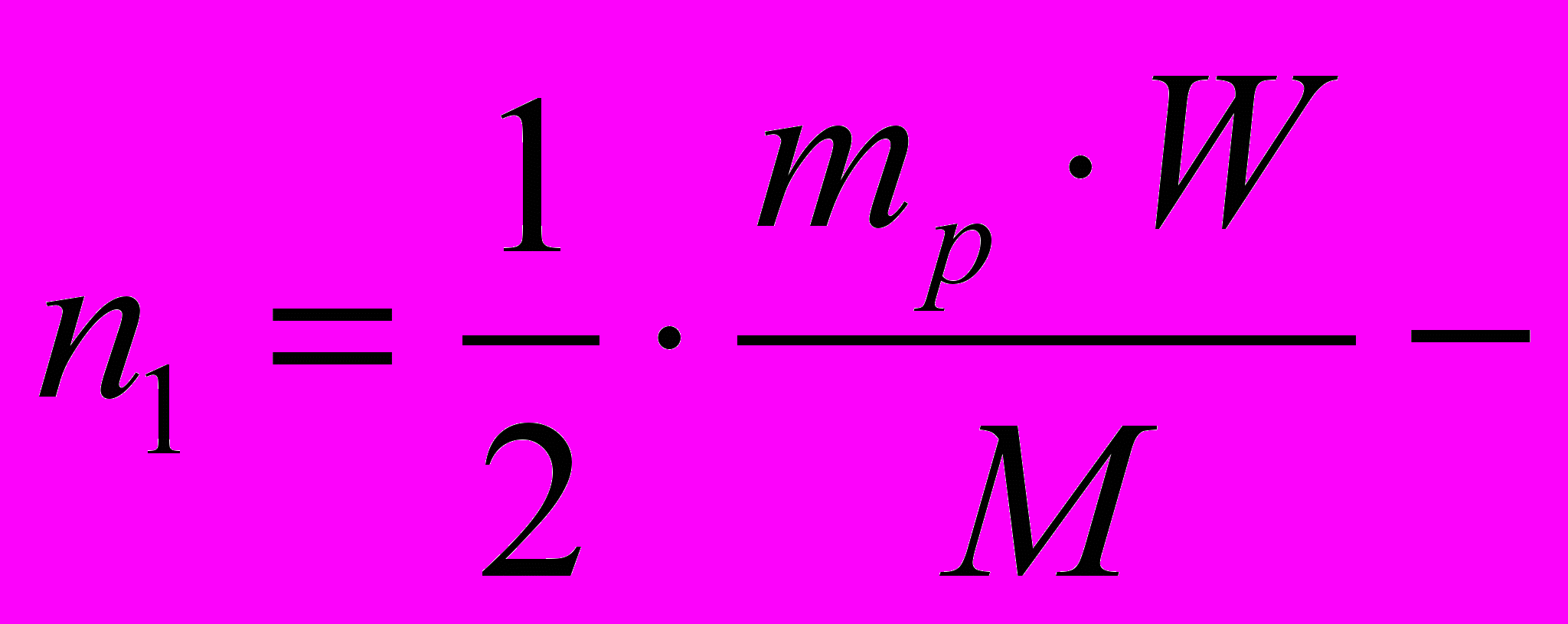 решение задачи в общем виде.
решение задачи в общем виде.- Проведите расчет:
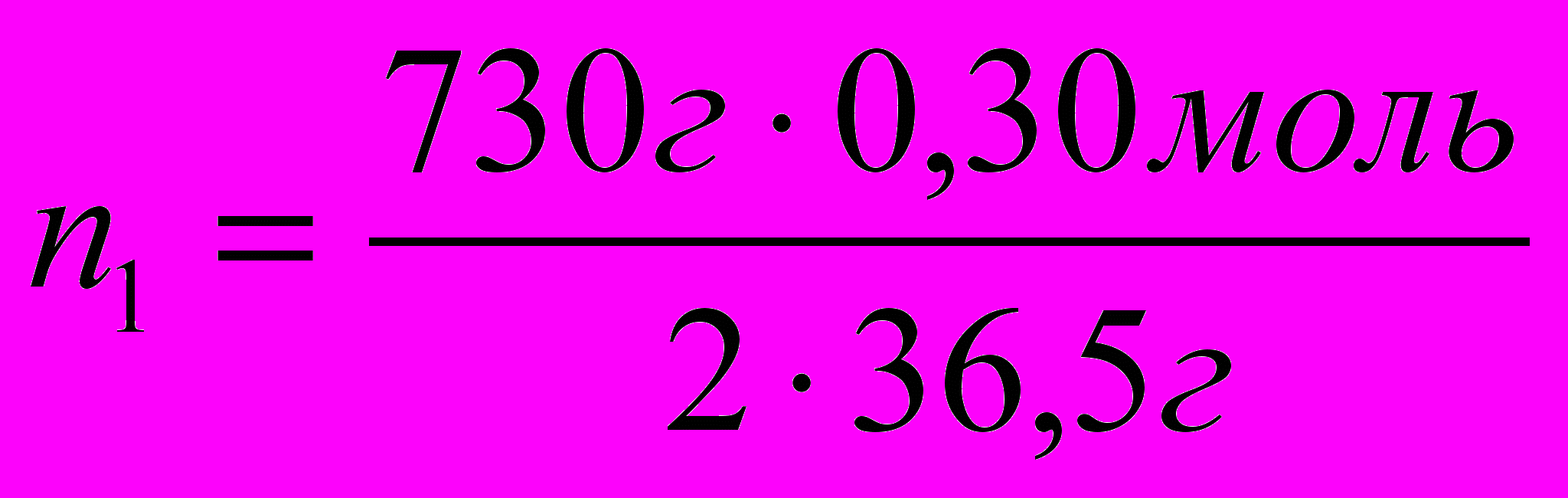 =3 моль
=3 моль- Запишите ответ.
II
 Рассчитайте количество водорода, выделившегося при взаимодействии 196 г 10%-ного раствора серной кислоты с магнием.
Рассчитайте количество водорода, выделившегося при взаимодействии 196 г 10%-ного раствора серной кислоты с магнием. Вычислите количество осадка, выпавшего при добавлении раствора NaOH r 80 г 10%-ного раствора сульфата меди (II).
Вычислите количество осадка, выпавшего при добавлении раствора NaOH r 80 г 10%-ного раствора сульфата меди (II). Определите количество и объем газа, образовавшегося из 98 г 5%-ного раствора серной кислоты и алюминия.
Определите количество и объем газа, образовавшегося из 98 г 5%-ного раствора серной кислоты и алюминия.Карточка 2 для «левополушарных» отличается только решением.
Образец записи решения для «левополушарных»:
Р е ш е н и е:
1. Напишите уравнение реакции:
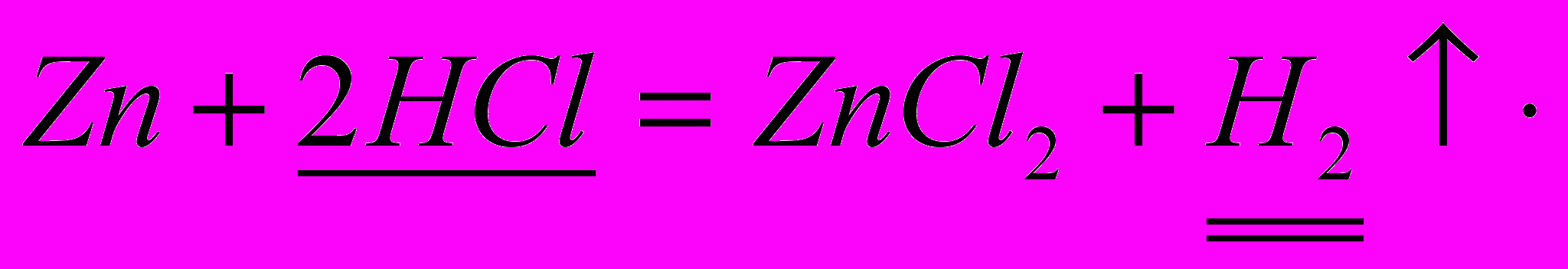
2 моль 1 моль
2. По определению
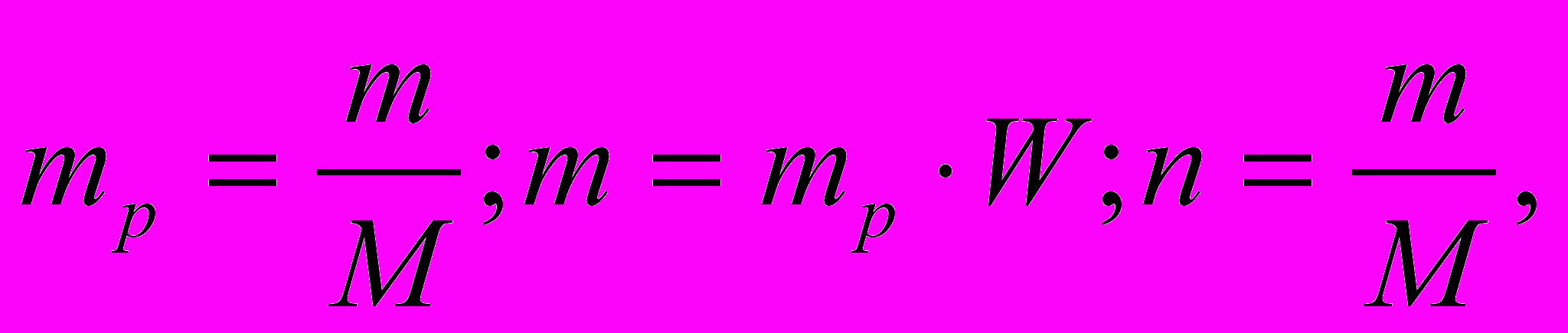
Отсюда
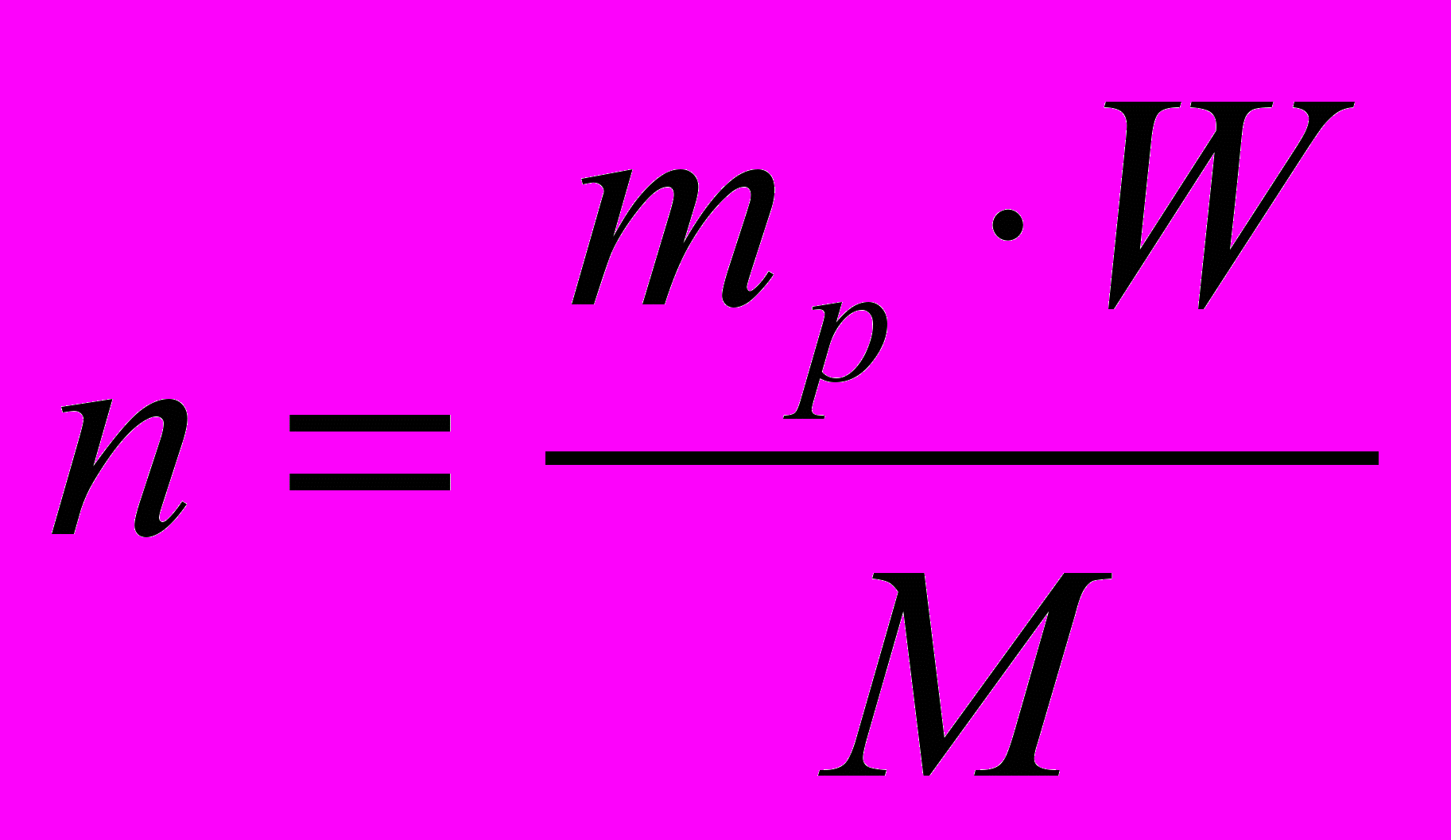 . (1)
. (1)- Из уравнения реакции
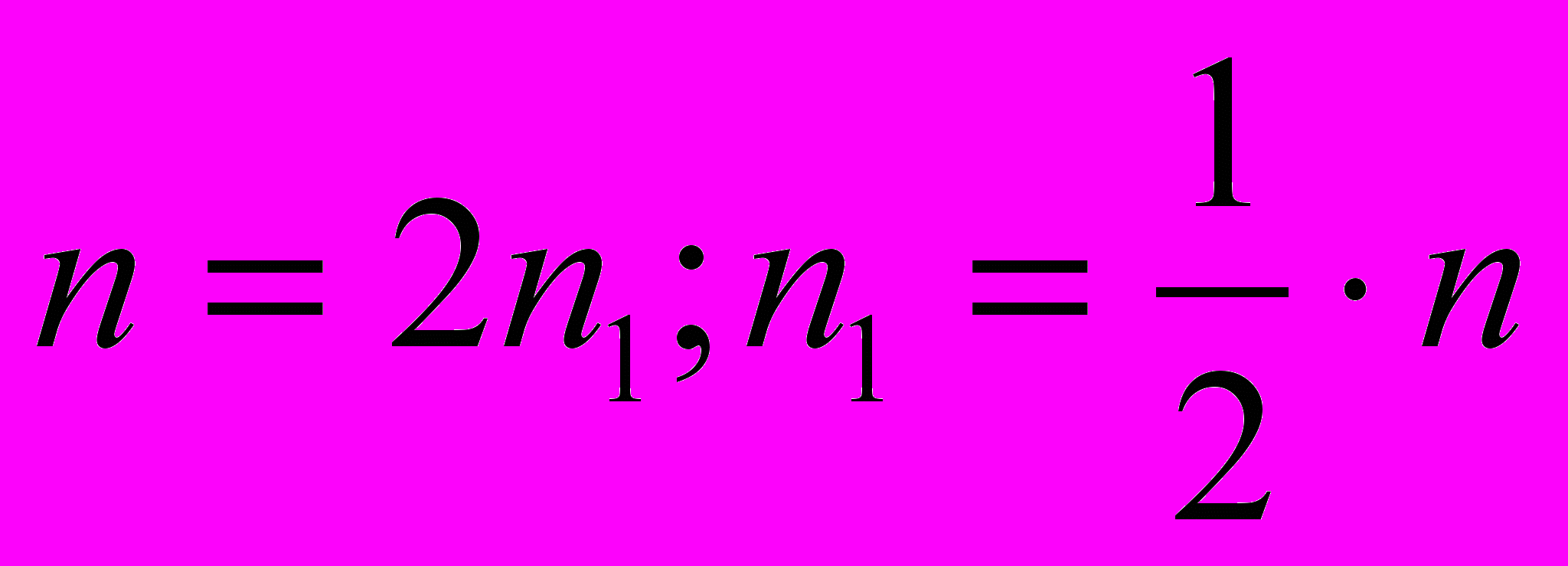 . (2)
. (2)- Подставьте (1) в (2):

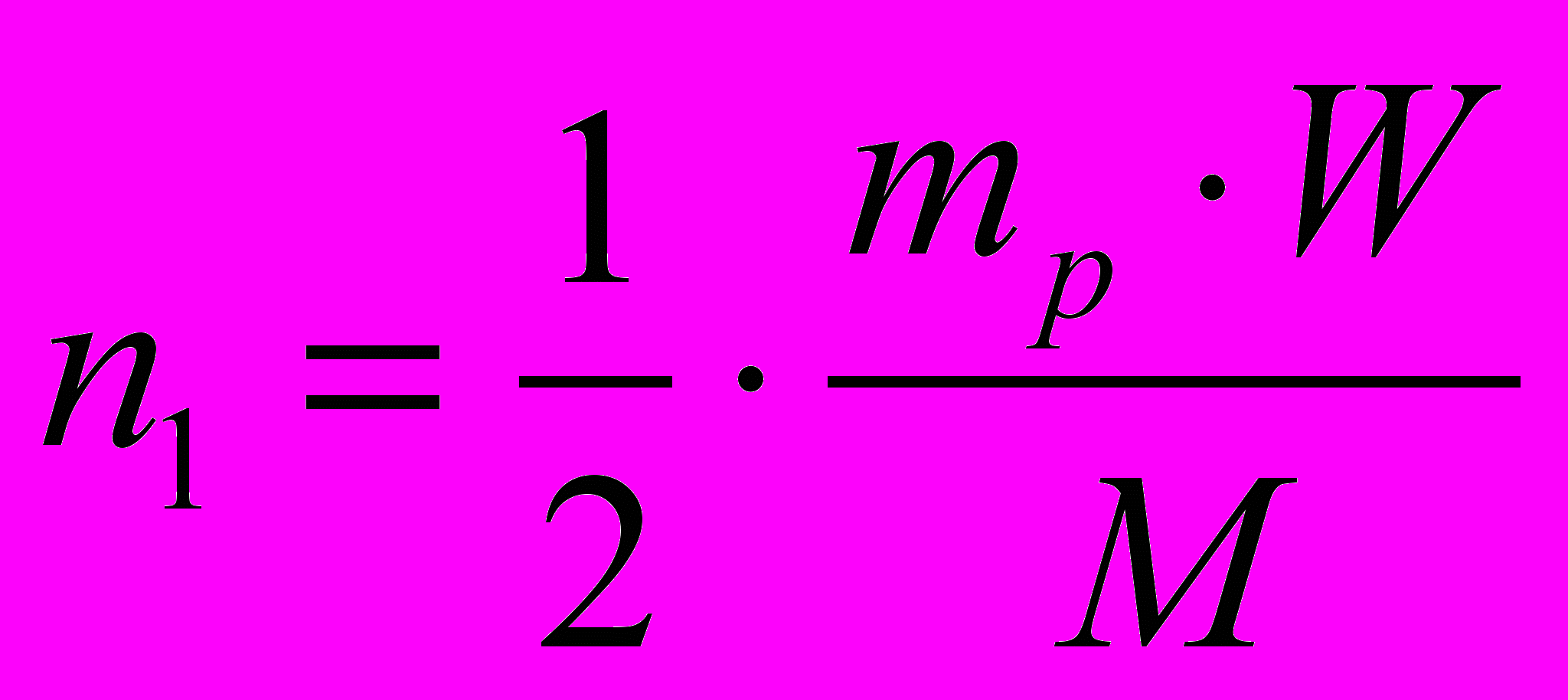 - решение задачи в общем виде.
- решение задачи в общем виде.- Проведите расчет:
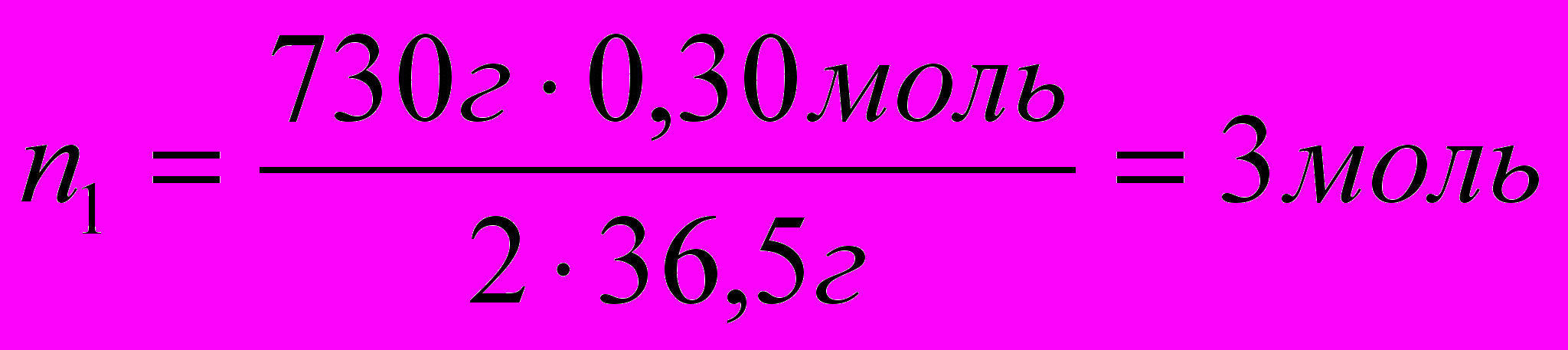 .
.6. Запишите ответ . ▀
9 КЛАСС
Задача №1. при сжигании двух простых веществ получены оксиды, обладающие следующими свойствами: оксид №1 а) твердое вещество белого цвета; б) реагирует с водой, образуя раствор, который имеет щелочные свойства, и на воздухе постепенно мутнеет.
Оксид №2 а) бесцветный газ, без запаха б) растворим в воде, и раствор имеет слабокислую реакцию. При сливании водных растворов №1, №2 выпадает белый осадок. При прокаливании этого осадка вновь получаются оксиды №1, №2.
При действии на осадок кислотой получается оксид №2. оба оксида могут воздействовать друг с другом, образуя соединение того же состава что и осадок, полученный при сливании водных растворов. Какие это вещества? Напишите уравнения указанных реакций.
Решение:
Из указанных свойств следует, сто оксид №1 обладает основными, а оксид №2 – кислотными свойствами. Газообразным кислотным оксидом, не имеющим запаха, может быть только оксид углерода (IV) – CO2.
Получение раствора оксида №1 возможно при взаимодействии с диоксидом углерода, находящемся в воздухе, и образовании нерастворимого карбоната. Таким карбонатом может быть карбонат кальция. Тогда оксид №1 – оксид кальция. Кроме оксида кальция указанным условиям удовлетворяют оксиды стронция и бария. Уравнения реакции:
2Ca+o2=>2CaO C+O2+>CO2
CaO+H2O=>Ca(OH)2 CO2+H2O=>H2CO3
Ca(OH)2+H2CO3=>CaCO3+2H2O
C
 aO+CO2=>CaCO3
aO+CO2=>CaCO3C
 aCO3=>CaO+CO2
aCO3=>CaO+CO2 CaCO3+2HCl=>CaCl2+H2O+CO2
Задача №2. В лаборатории имеется смесь следующих веществ: иод, сульфат бария, оксид свинца (II). Как из этой смеси выделить каждое вещество в чистом виде?
Опишите ход разделения и напишите уравнения соответствующих реакций.
Решение: нужно нагреть смесь и отделить йод возгонкой, остаток растворить в воде и отделить сульфат бария фильтрованием, т.к. BaSO4 и PbO в воде нерастворимо. Два последних вещества можно разделить только химическим путем. Растворить PbO в азотной кислоте, раствор профильтровать и выпарить и прокалить полученную соль.
PbO+2HNO3=>Pb(NO3)2+H2O
2Pb(NO3)2=>2PbO+4NO2+O2
Задача №3. Хорошо растворимый газ имеет плотность по азоту равную 0.607. Какова будет концентрация раствора (в процентах по массе) если 2.5 моль этого газа растворить в 1 литре воды?
Решение: Используя плотность по азоту и (формулу M=m*d, находим молекулярную массу газа). М=28*0.607; М=17 это аммиак NH3 далее находим массу растворенного газа по формуле
m=M*v
m=17г/моль*2,5моль=42.5 г.
Находим массу раствора:
mр-ра=mH2O+ mв-ва
mр-ра=1000г+42.5г.=1042.5г.
Находим концентрацию раствора по формуле:
C= mв-ва / mр-ра * 100% = 42.5 / 1042, * 100% = 4.07%
Задача №4. 3 раствора серной кислоты с массой долей 25% поместили железный шарик массой 10г. Через некоторое время, когда диаметр шарика уменьшится вдвое, массовая для кислоты стала 10%. Найти массу исходного раствора. Решение: железо растворяется в кислоте по реакции
F
 e+H2SO4=>FeSO4+H2
e+H2SO4=>FeSO4+H2Поскольку объем изменяется пропорционально кубу радиуса, масса шарика уменьшилась в 8 раз (23) и равна 10/8=1.25 г. Значит в раствор перешло железо.
10-1.25=8.75 г. по уравнению реакции находим, сколько при этом израсходовалось кислоты:
8,75 г. х г. y
Fe + H2 SO4 => FeSO4 + H2
1моль 1 моль 1 моль
56г. 98г. 2г.
8.75 г Fe ----- x г H2SO4
56 Г------------------98 г
Х = (8.75*98)/56=15.29г.(H2SO4)
по уравнению реакции находим, сколько выделилось водорода:
56г Fe ------- 2г H2
8.75 -----------у г.
у=(8.75*2)/56=0.47г. H2
если массу исходного раствора обозначить через m, то масса конечного раствора будет равна – 0.47+8.75 или m=8.28. откуда получаем уравнение:
0.25m1-0.1(m+8.28)==15.29, решаем уравнение:
0.25m-0.1m-8.28=15.29
0.15m=15.29+8.28
0.15m=23.57
m=23.57/0.15
m=157.13 г.
Задача №5. Сплав лития и магния растворили в разбавленной соляной кислоте. Определите состав сплава в %, если масса выделившегося газа составила 10% от массы сплава.
 Решение: Обозначим массу лития в сплаве через Х, а магния – через Y. Из уравнения реакции 2Li+2HCl=>H2 +2LiCl
Решение: Обозначим массу лития в сплаве через Х, а магния – через Y. Из уравнения реакции 2Li+2HCl=>H2 +2LiCl2 моль 1 моль
14г 2г
Mg+2HCl=>H2+MgCl2
1 моль 1 моль
24г 2г
Видно, что при взаимодействии с кислотой 7г лития выделяется 1г водорода, а значит на 1г лития выделяется 1/7г водорода. Точно также на 1г магния выделяется 1/12г водорода, тогда получаются 2 уравнения:
X+Y=100 %(1) и X/7+Y/12=0.1(X+Y), (II), решив их,
Находим, что содержание лития в сплаве 28%. Решение уравнений:
X+Y=100%
X/7+Y/12=0.1*(X+Y), находим по второму уравнению Y и подставляем значение Y в первое уравнение:
12X+7Y=8.4X+8.4Y
12X-8.4X=8.4Y-7Y
3.6X=1.4Y Y=3.6X/1.4
Подставляем полученное значение в 1 уравнение:
1.4x4-3.6X=140
5X=140
X=140/5; X=28%.
Задача №6 Сколько весит при нормальных условиях 1 литр газовой смеси, содержащей по весу 65% оксида углерода (II) и 35% водорода?
Решение: Найдем объем 1г. оксида углерода (II) и 1 водорода при н.у.
22.4л CO -----28г
х л--------------1г
х=22.4*1/28 :л
22.4л Н2 -----2г
У=22.4*1/2л.
Учитывая процентное весовое содержание СО и Н2, можно записать пропорцию:
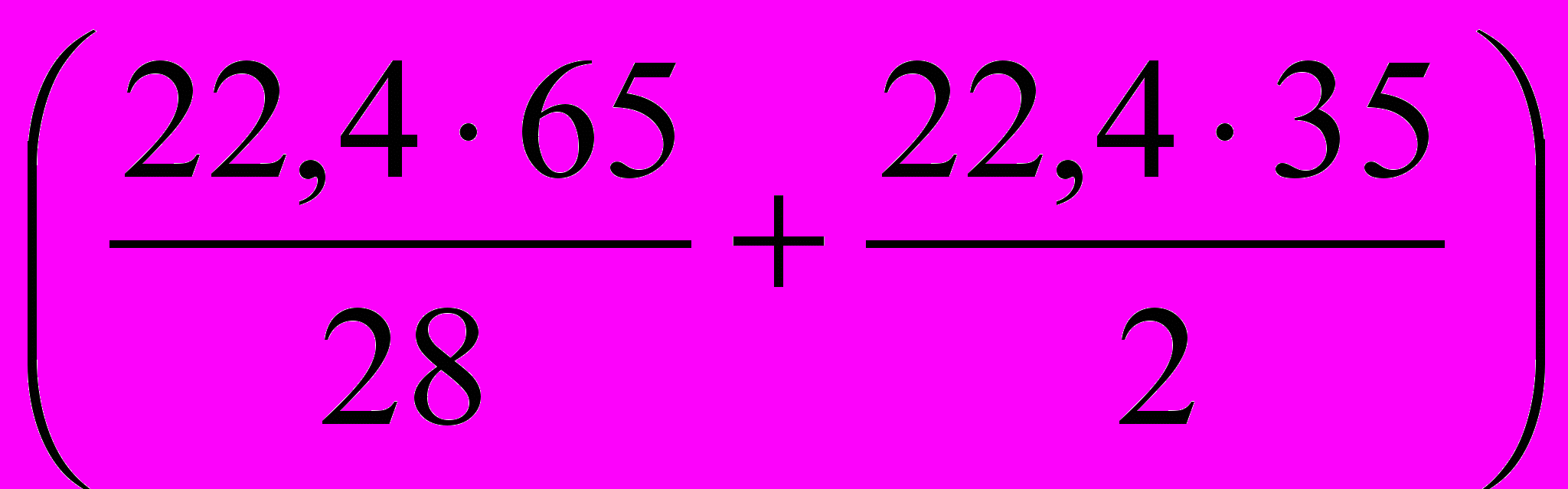 л смеси весят 100 г.
л смеси весят 100 г.1 л-------------------z г.
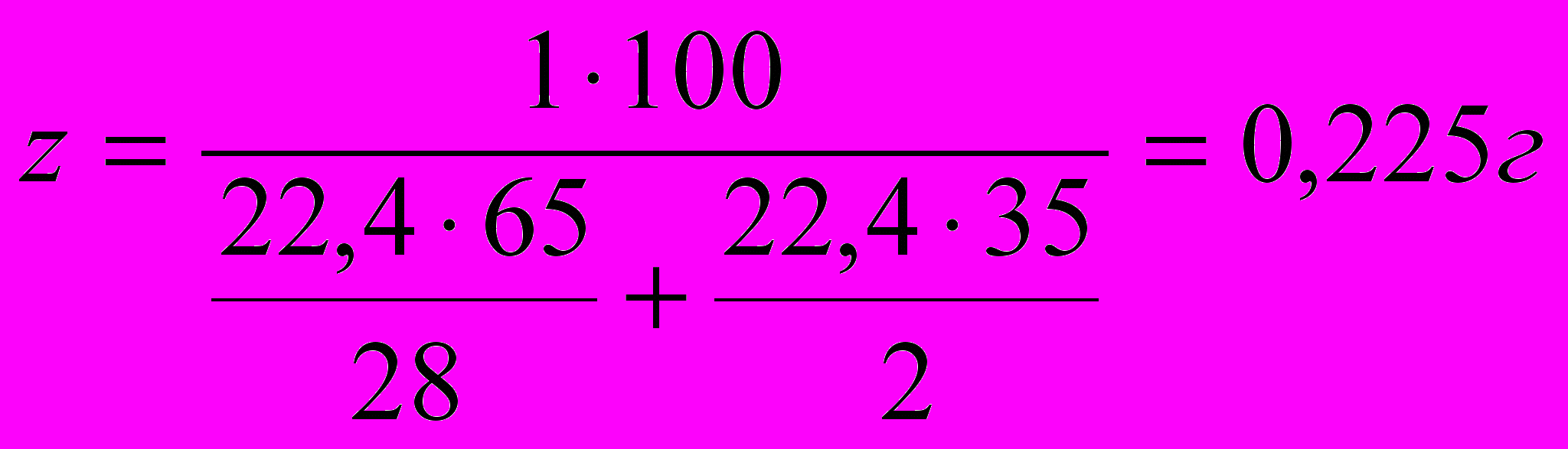 . Один литр газовой смеси 0,225 г.
. Один литр газовой смеси 0,225 г.IV. АНАЛИТИЧЕСКИЙ СЕМИНАР
