Методические указания к самостоятельной работе по общей химии для студентов Iкурса всех специальностей, изучающих химию
| Вид материала | Методические указания |
- Д. И. Менделеева прогнозирование свойств элементов и их соединений методические указания, 611.18kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 1587.03kb.
- Методические указания по выполнению самостоятельной работы по английскому языку для, 491.03kb.
- Б. И. Джинджолия восточная философия XIX-XX веков, 544.15kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 803.64kb.
- Методические указания по подготовке к семинарским занятиям для студентов вечерней формы, 733.5kb.
- Методические указания для студентов Санкт-Петербург 2012, 391.72kb.
- Методические указания к лабораторной работе по органической химии для студентов специальностей, 227.51kb.
- Методические указания Санкт-Петербург 2009 удк 947, 1006.45kb.
- Методические указания и контрольные задания к внеаудиторной самостоятельной работе, 500.1kb.
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего и профессионального образования
«Тихоокеанский государственный университет»
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Методические указания к самостоятельной работе
по общей химии для студентов I курса всех специальностей,
изучающих химию
Хабаровск
Издательство ТОГУ
2007
УДК 541.13 (07)
Электрохимические процессы : методические указания к самостоятельной работе по общей химии для студентов I курса всех специальностей, изучающих химию / сост. Л. Е. Незаментимова. – Хабаровск : Изд-во Тихоокеан. гос. ун-та, 2007. – 27 с.
Mетодические указания составлены на кафедре «Химия» и предназначены для самостоятельной аудиторной и внеаудиторной работы студентов. В них представлены общие вопросы темы «Электрохимические процессы» по разделам «Потенциалы металлических электродов», «Гальванические элементы», «Коррозия металлов» и «Электролиз», приведены примеры решения задач, предложены многовариантные задания для самоподготовки.
Печатается в соответствии с решениями кафедры химии и методического совета факультета математического моделирования и процессов управления.
Ó Тихоокеанский государственный
университет, 2007
ВВЕДЕНИЕ
Особенности структуры металлов приводят к тому, что свойства металлических элементов неразрывно связаны с протеканием окислительно-восстановительных реакций и электрохимическими свойствами системы металл – среда. На практике оказывается необходимым умение оценить активность металлов, характер их взаимодействия с окружающей средой, химическое поведение металлов в составе конструкционных узлов различных технологических систем и установок.
Электрохимические процессы лежат в основе целого ряда важнейших производств, связанных с получением черных и цветных металлов, их сплавов и других химически ценных продуктов; c созданием и применением химических источников тока.
Объем химических знаний для современного инженера определяется также проблемами, которые встречаются при конструкторской разработке деталей, механизмов и установок в связи с выбором специальных, традиционных и новых конструкционных материалов.
Таким образом, изучение темы «Электрохимические процессы» является важной составной частью инженерного образования.
В данных методических указаниях представлены в краткой форме теоретические основы электрохимических процессов по разделам, посвященным потенциалам металлических электродов, гальваническим элементам, электрохимической коррозии металлов и электролизу растворов электролитов. Задания для самоподготовки студентов предваряются примерами с подробными решениями.
Предлагаемые методические указания не только послужат цели проверки знаний, но и помогут студентам найти ответы на многие важные вопросы по изучаемой теме и в итоге более качественно усвоить материал.
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимическими процессами называют процессы взаимного превращения химической и электрической форм энергии.
Электрохимические процессы можно разделить на две основные группы:
1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз).
Простейшая электрохимическая система состоит из двух электродов и ионного проводника между ними. Электроды замыкаются металлическим проводником (проводником 1-го рода). Ионным проводником (проводником 2-го рода) служат растворы или расплавы электролитов, а также твердые электролиты. Электродами называют проводники, имеющие электронную проводимость и находящиеся в контакте с ионным проводником.
Количественные характеристики электрохимических процессов устанавливаются законами Фарадея, открытыми в 1833 г. С учетом современной терминологии эти законы формулируются так:
- Масса вещества, испытавшего электрохимическое превращение на электроде, прямо пропорциональна количеству электричества, прошедшего через электролит.
- При пропускании одинакового количества электричества через растворы или расплавы различных электролитов массы веществ, выделяющихся на электродах, пропорциональны молярным массам их эквивалентов.
Экспериментально установлено, что для выделения на электроде одной молярной массы эквивалента вещества В необходимо затратить одно и то же количество электричества, равное примерно 96500 Кл. Оно получило название постоянной Фарадея F.
Оба закона Фарадея можно объединить одной формулой:
m(В) =
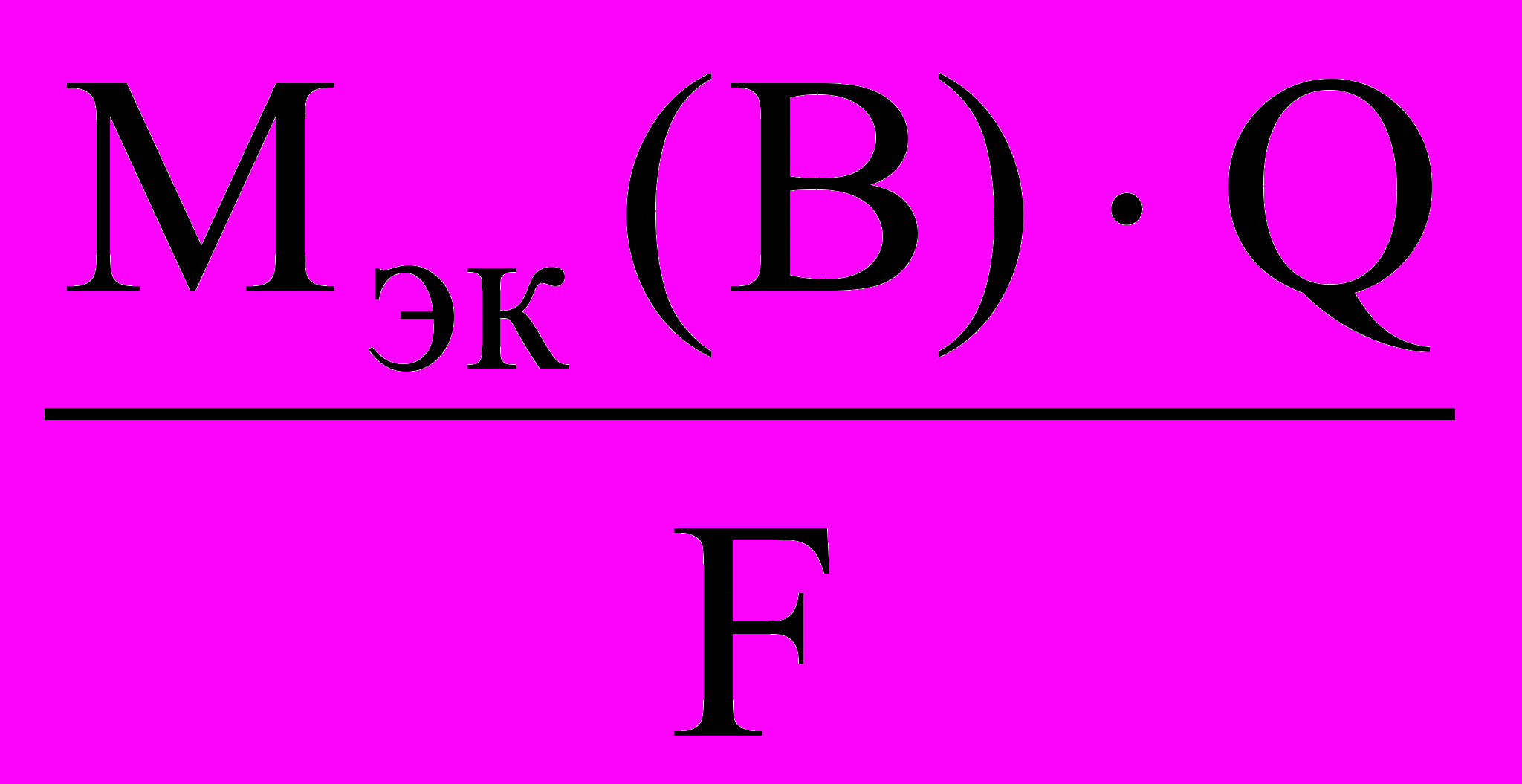 =
= 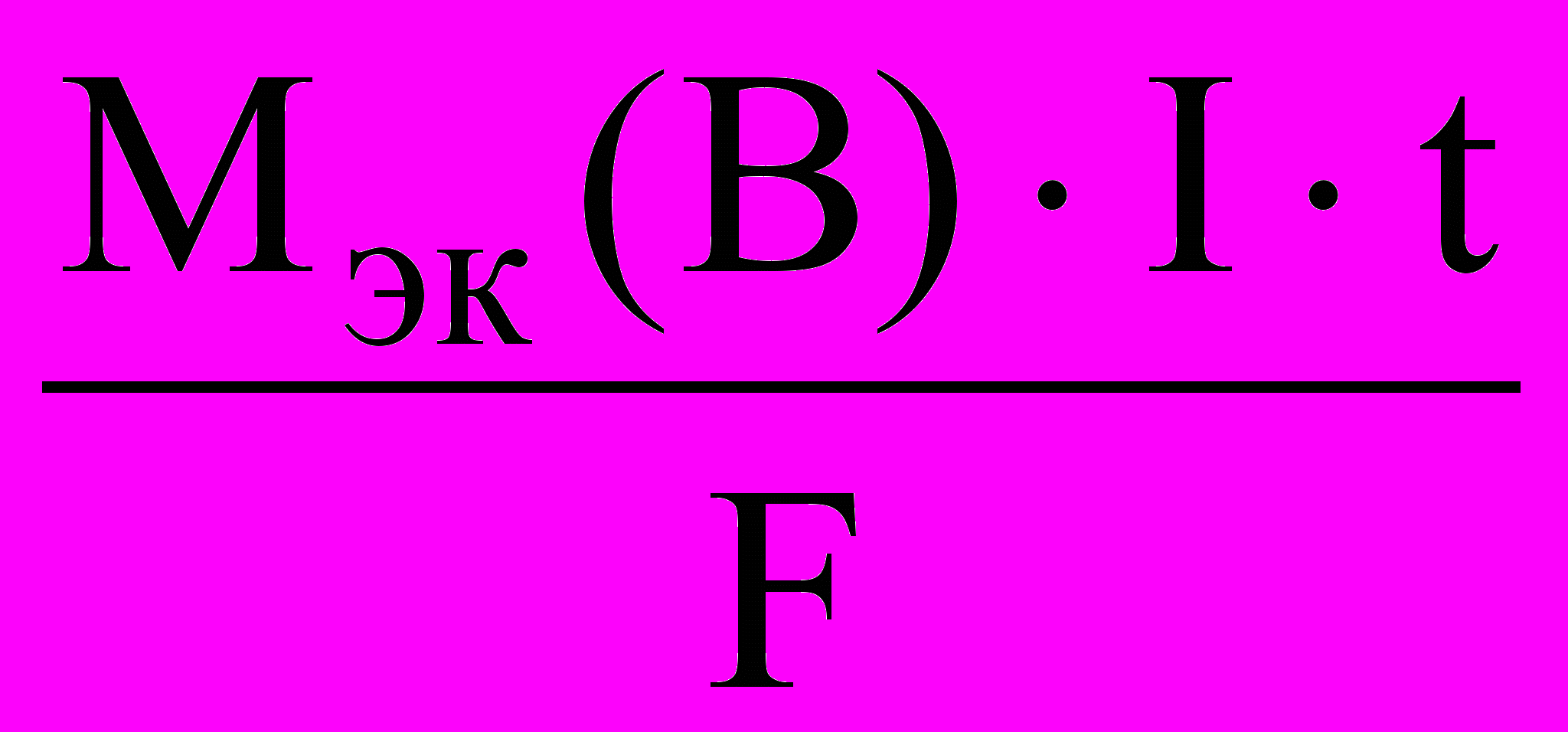 ,
,где m(B) – масса вещества, окисленного или восстановленного на электроде, г; Mэк(В) – молярная масса эквивалентов вещества В, г/моль; Q – количество электричества, прошедшего через электролит, Кл. (Q = It, где I – сила тока, А; t – время, с).
Показателем эффективности электролиза является выход по току (%), определяемый как отношение массы вещества, фактически полученной в данных условиях, mфакт к массе вещества, теоретически вычисленной на основе закона Фарадея, mтеор:
=
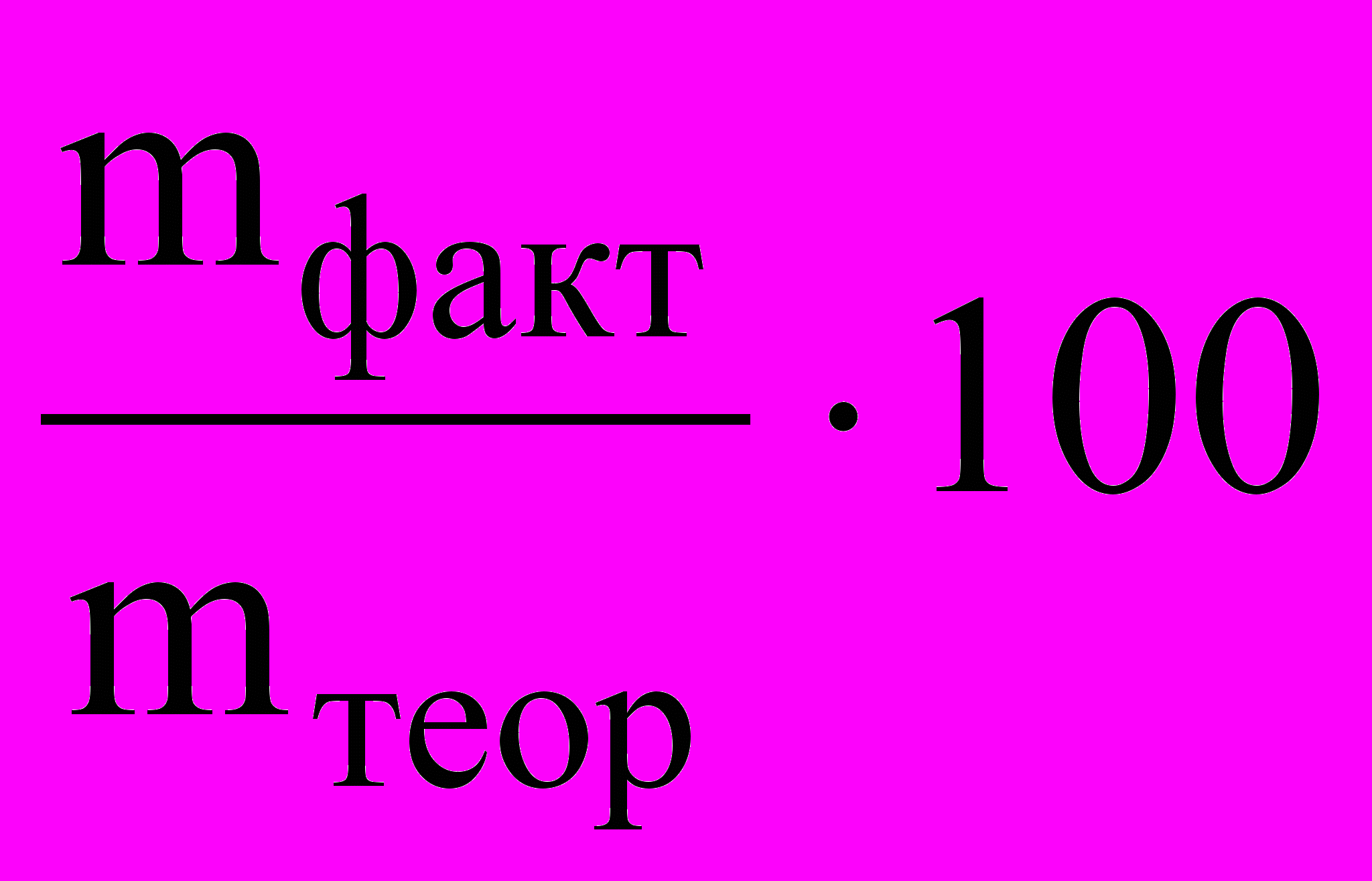 %.
%.ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ
При погружении металлической пластинки в воду или в раствор соли этого же металла между пластинкой и раствором устанавливается окислительно-восстановительное равновесие:
M
 е + mH2О ⇄ Меn+ mН2О + nē.
е + mH2О ⇄ Меn+ mН2О + nē.пластинка пластинка
раствор
На границе раздела двух фаз (металл – раствор) возникает двойной электрический слой, характеризующийся некоторой разностью электростатических потенциалов. При равновесии скорость растворения металла равна скорости восстановления его ионов. Скачок потенциала, устанавливающийся в двойном электрическом слое при равновесии, называется равновесным потенциалом металлического электрода, Е0Men+/ Me.
Схематическое изображение металлического электрода представляет собой дробь, в числителе которой записывают окисленную форму, а в знаменателе – восстановленную форму частиц, образующих двойной электрический слой. Разделительная черточка символизирует границу раздела между проводниками разного рода – металлом и электролитом.
Например:
| структура двойного электрического слоя | схема соответствующего электрода |
| Zn ⇄ Zn2+ + 2ē | Zn2+/ Zn |
| Al ⇄ Al3+ + 3ē | Al3+/ Al |
Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике потенциалы металлических электродов измеряют относительно водородного электрода, принятого за электрод сравнения.
Стандартный водородный электрод изготовлен из платины, покрытой платиновой чернью и погруженной в раствор кислоты с активностью ионов водорода, равной единице. Через раствор при 298 К (25 oС) под давлением 101,325 кПа пропускается газообразный водород. Таким образом, на поверхности платинового электрода устанавливается равновесие:
2H+ + 2ē ⇄ H2,
которое характеризуется определенным значением скачка потенциалов на межфазной границе. Электродный потенциал, отвечающий данным условиям, называют стандартным потенциалом стандартного водородного электрода, а его численное значение условно принято равным нулю:
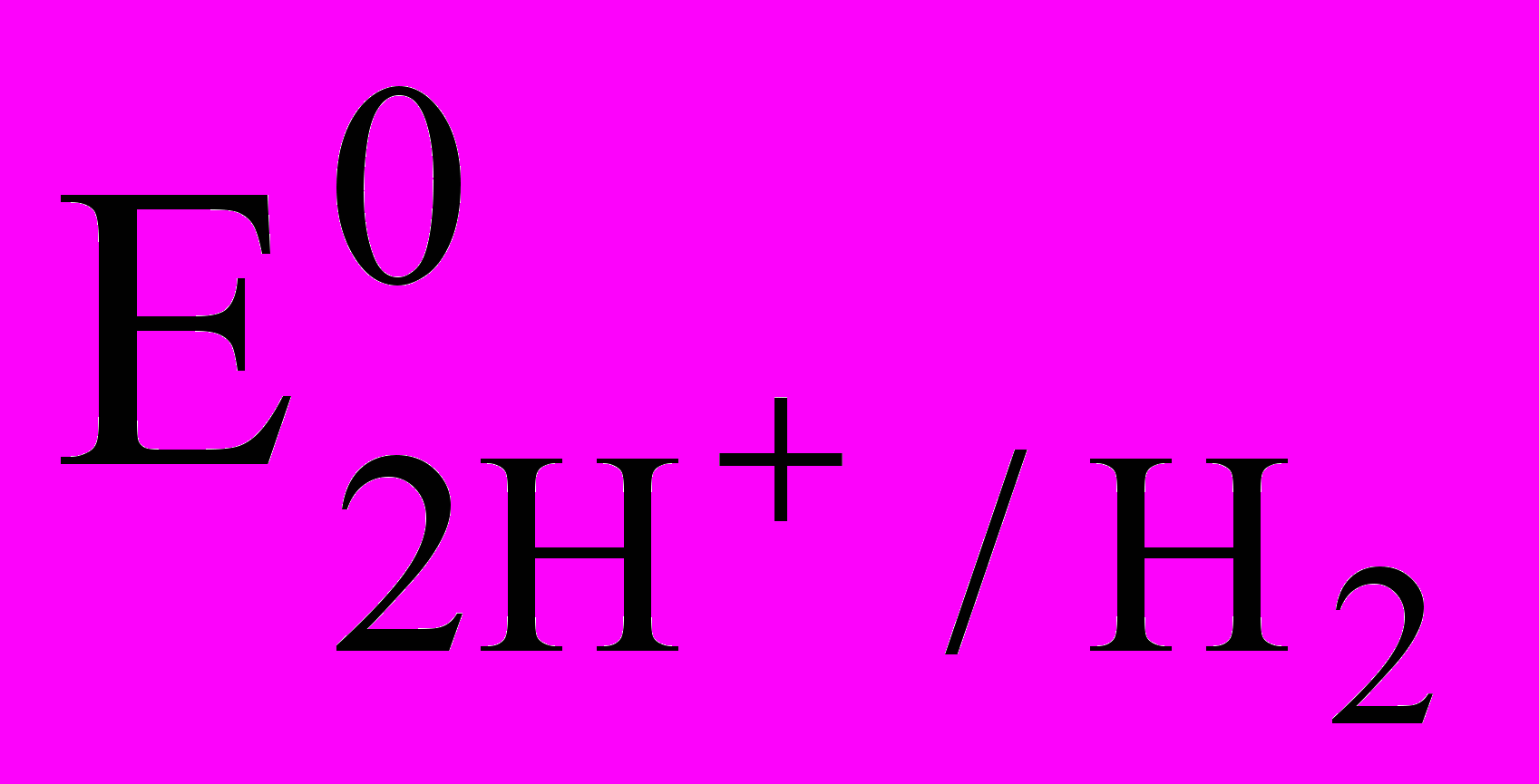 = 0.
= 0.Стандартным потенциалом металлического электрода ЕoMen+/ Me называют потенциал этого электрода в растворе собственных ионов с их концентрацией, равной 1 моль/дм3, измеренный относительно стандартного водородного электрода. (При точных определениях и расчетах вместо аналитической концентрации используют активность электролитов).
Значения стандартных потенциалов электродов приводятся в справочной литературе [3, 4, приложение]. Располагая окислительно-восстановительные системы типа Mеn+/Mе в порядке возрастания стандартных потенциалов, получают электрохимический ряд напряжений металлов.
Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:
- чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов;
- металлы, имеющие отрицательные электродные потенциалы, т. е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;
- каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
При условиях, отличающихся от стандартных, численное значение равновесного электродного потенциала для окислительно-восстановительной системы, записанной в форме Ох + nē ⇄ Rеd, рассчитывают по уравнению Нернста:
ЕOх / Red = Е0Oх / Red +
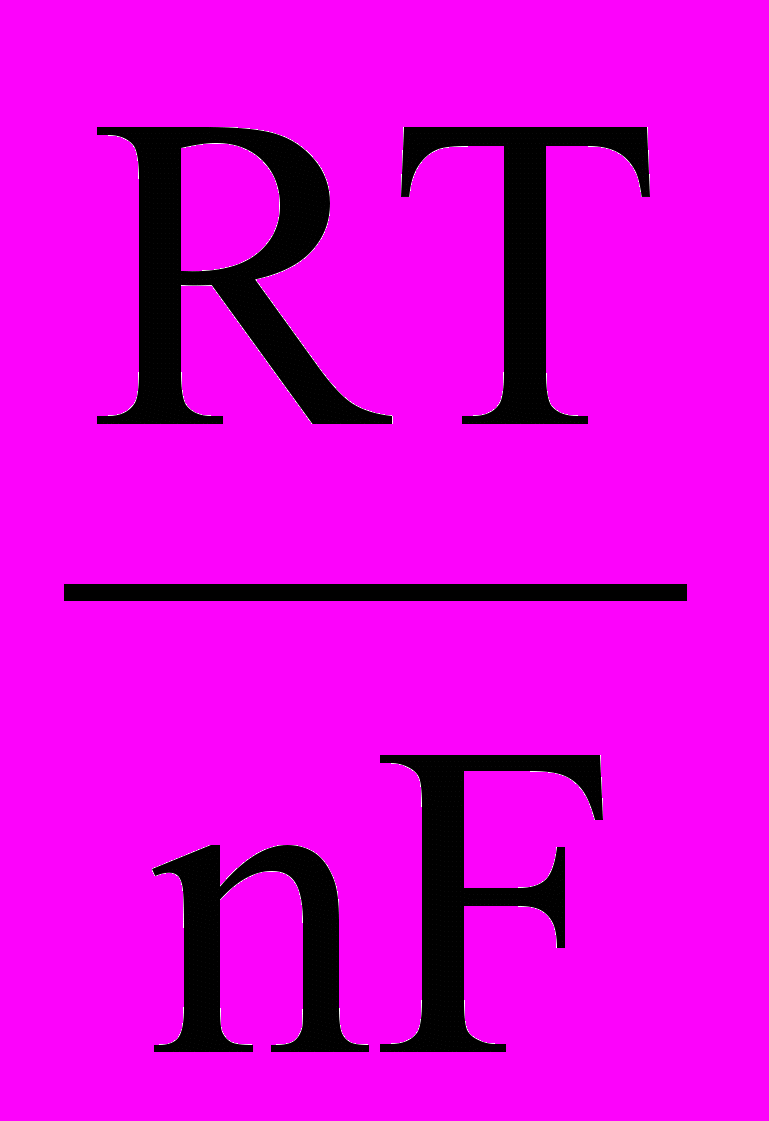 ln
ln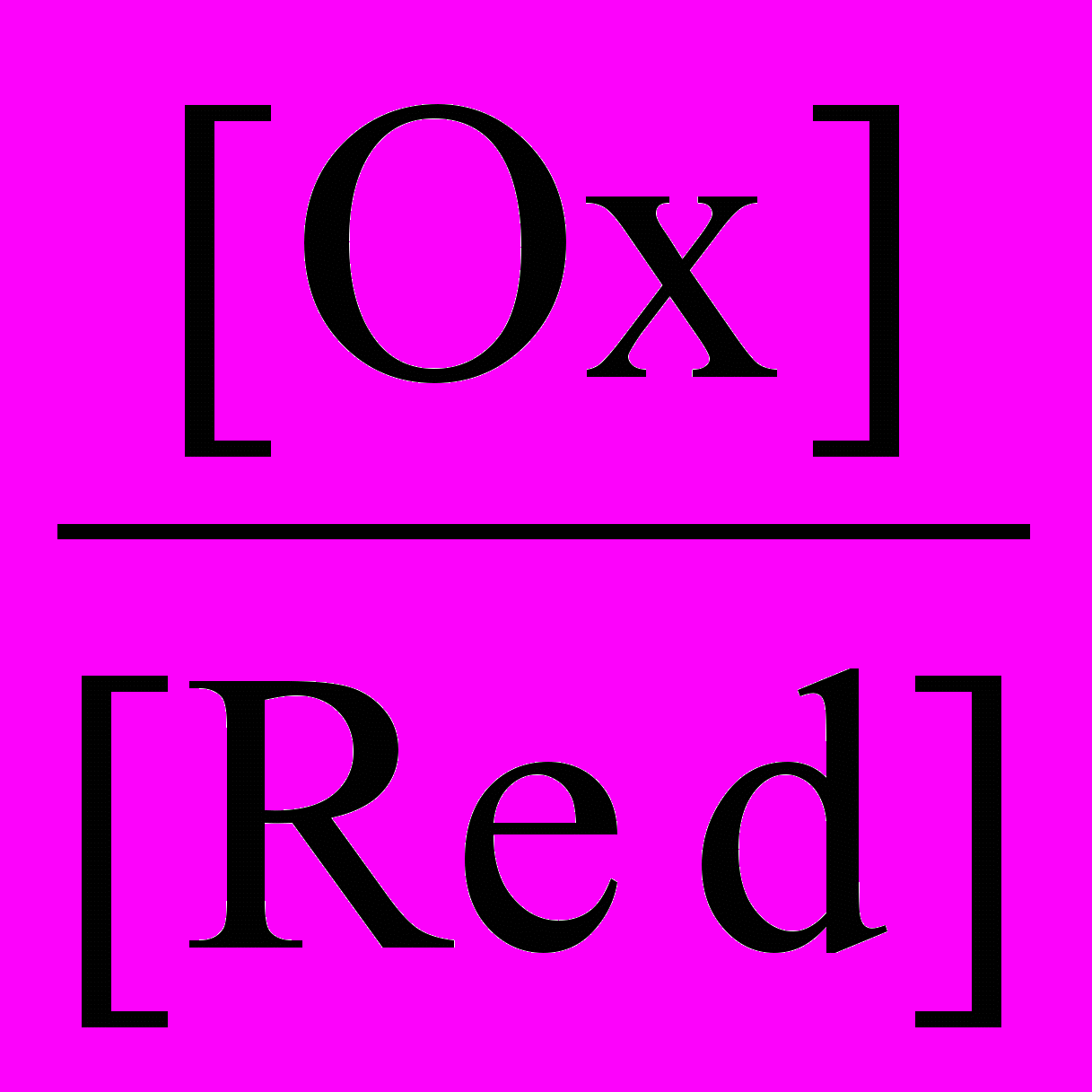 ,
,где ЕOх / Red – электродный потенциал системы в заданных условиях, В; Е0Oх / Red – стандартный электродный потенциал, В; R – универсальная газовая постоянная, равная 8,31 Дж/(мольК); Т – абсолютная температура, К; F – постоянная Фарадея, Кл/моль; n – число электронов, участвующих в электродном процессе; [Ох], [Rеd] – молярные концентрации частиц, участвующих в электродной реакции в окисленной и восстановленной формах, моль/л. При точных расчетах вместо аналитической концентрации используют активность электролитов.
Из анализа уравнения Нернста следует, что значение потенциала электрода определяется природой его материала, температурой и концентрациями (активностями) частиц, участвующих в электродной реакции.
Применяя уравнение Нернста к металлическим электродам и учитывая, что [Rеd] = [Ме] = 1, получим
ЕМеn+/ Ме = E0Меn+/ Ме +
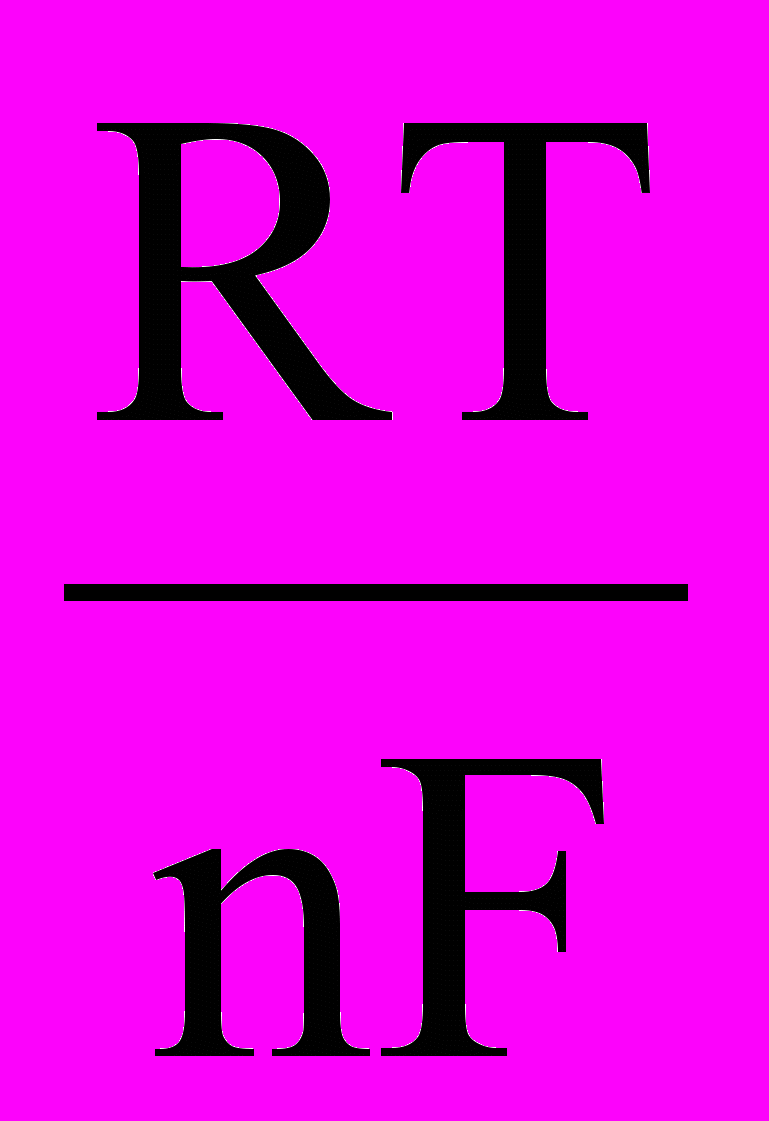 ln[Mеn+].
ln[Mеn+].Переходя от натурального логарифма к десятичному и подставляя в уравнение Т = 298 К и соответствующие значения R и F, получаем:
ЕМеn+/ Ме = E0Меn+/ Ме +
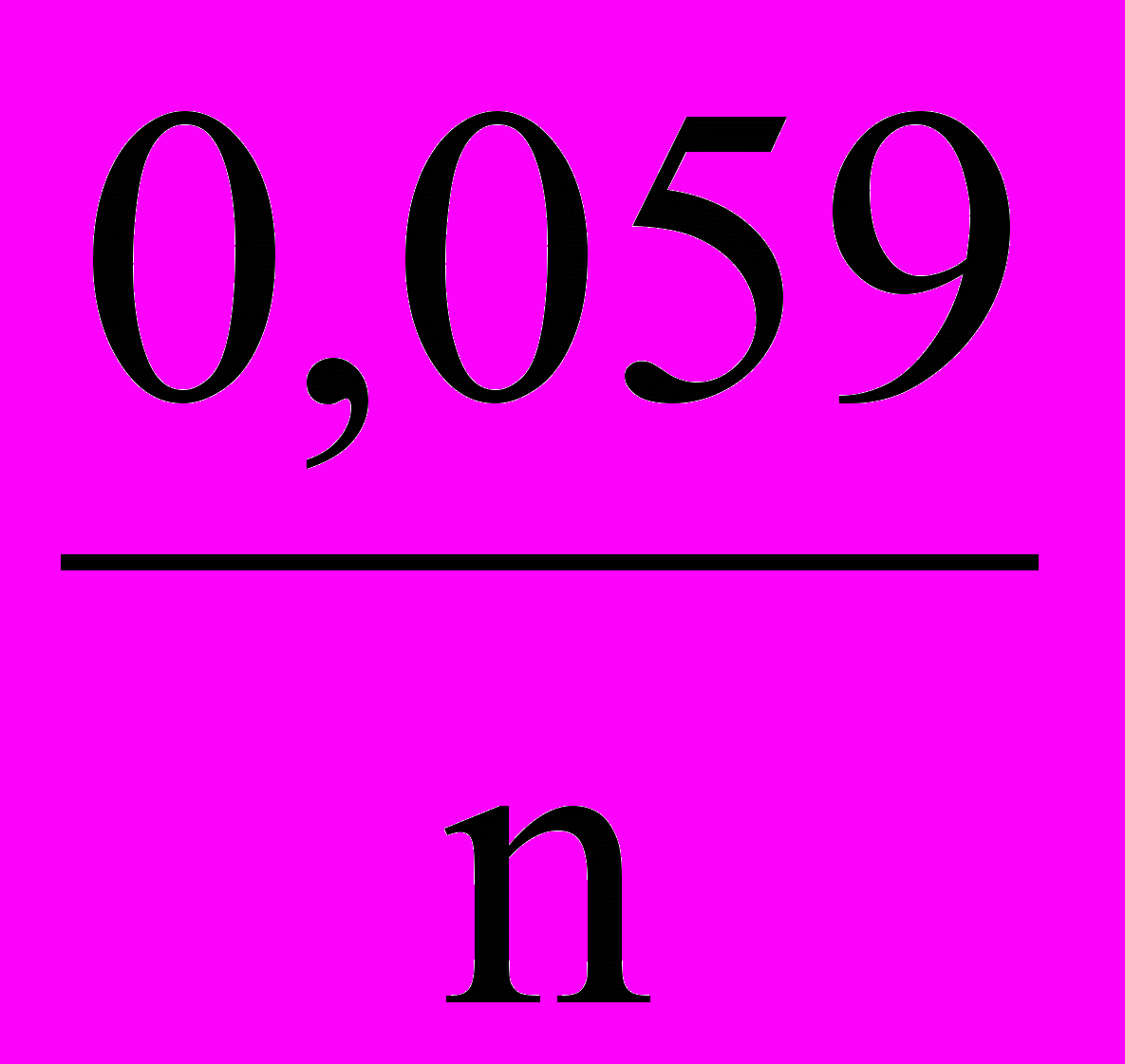 lg[Mеn+].
lg[Mеn+].Примеры решения задач
Пример 1
В какой пробирке происходит реакция при внесении медных пластинок в растворы сульфата железа(), нитрата серебра, разбавленной серной кислоты?
Решение
По таблице приложения (с. 27) найдем значения соответствующих стандартных электродных потенциалов и сравним их. Поскольку Е0Сu 2+/ Сu = +0,33 В имеет большую алгебраическую величину, чем Е0Fе2+/ Fе = 0,44 В, медь менее активна, чем железо, и не способна вытеснить его из раствора соли. Взаимодействия меди с сульфатом железа() не произойдет: Cu + FeSO4 .
Стандартный электродный потенциал меди Е0Сu2+/ Сu = +0,33 В имеет большую алгебраическую величину, чем Е0Ag+/ Аg = +0,80 В, следовательно, медь активнее серебра и будет вытеснять его из раствора соли:
Cu + 2АgNO3 = 2Аg + Cu(NО3)2.
С
 u – 2ē = Сu 2+ 1 окисление, восстановитель;
u – 2ē = Сu 2+ 1 окисление, восстановитель;Аg+ + ē = Аgо 2 восстановление, окислитель.
Поскольку Е0Сu2+/ Сu = +0,33 В больше, чем Е 0Н+/ Н = 0, медь не способна вытеснять водород из разбавленных кислот. Взаимодействия меди с разбавленной серной кислотой не произойдет: Сu + Н2SO4 (разб.) .
Пример 2
Стандартный потенциал никеля больше, чем кобальта (см. приложение). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциал кобальта – в растворе с концентрацией 0,1 моль/л ?
Решение
Электродный потенциал металла зависит от концентрации его ионов в растворе по уравнению Нернста. Определим электродные потенциалы никеля и кобальта при заданных концентрациях:
ENi2+/ Ni = E0 Ni2+/ Ni +
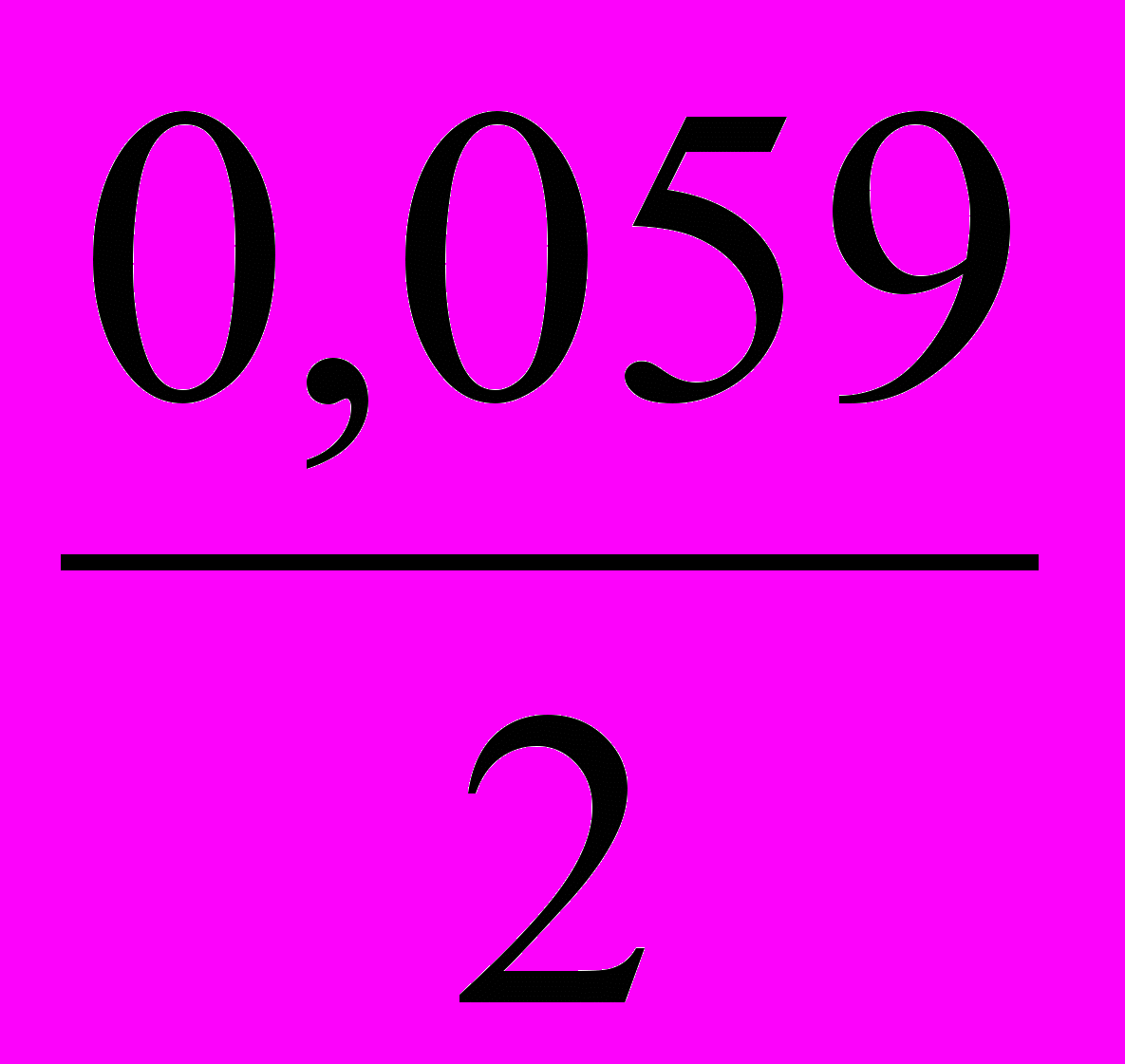 lg[Ni2+] = 0,25 +
lg[Ni2+] = 0,25 +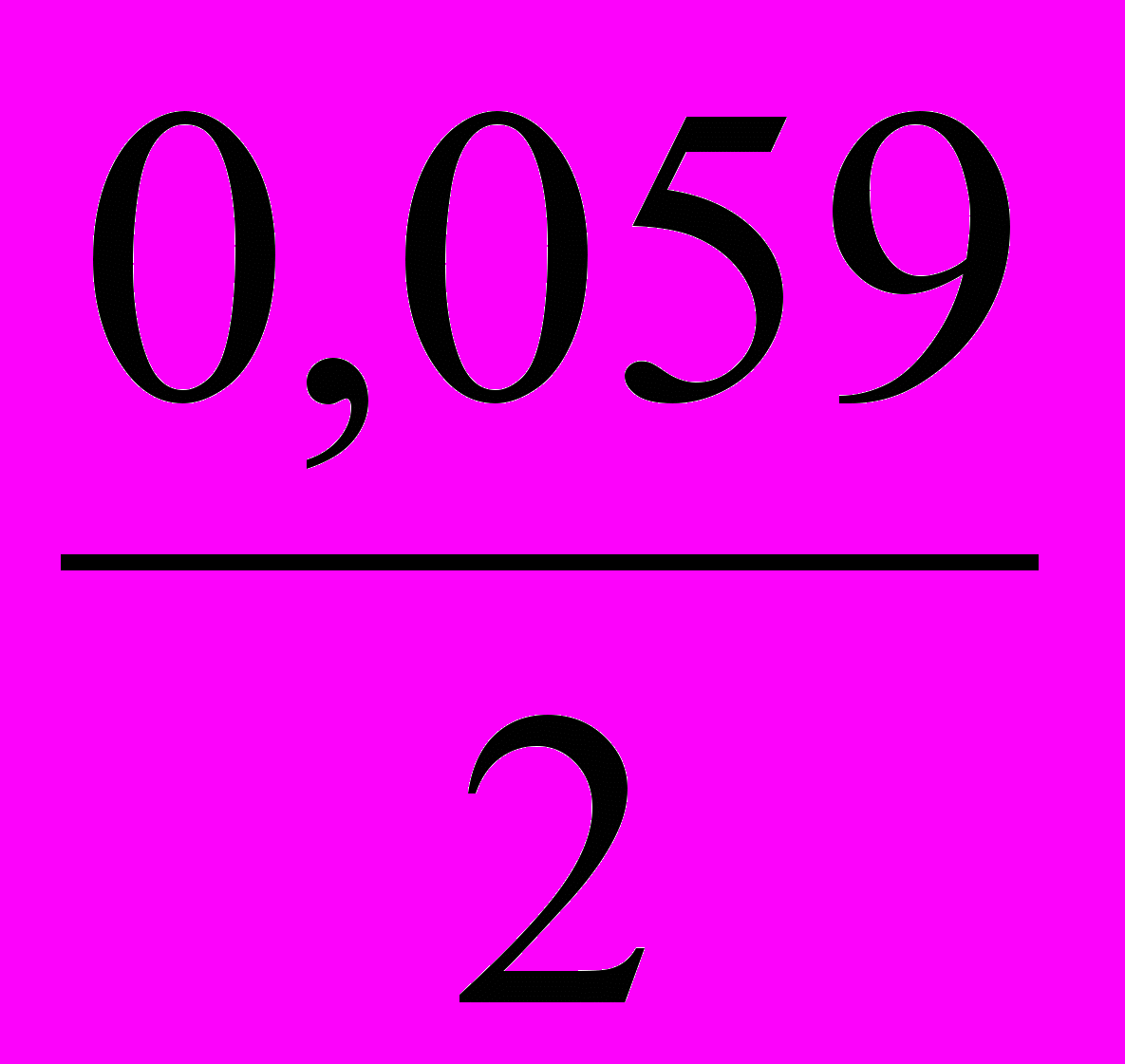 lg10-3 = 0,339 В;
lg10-3 = 0,339 В;ЕCo2+/ Со = Е0Co2+/ Со +
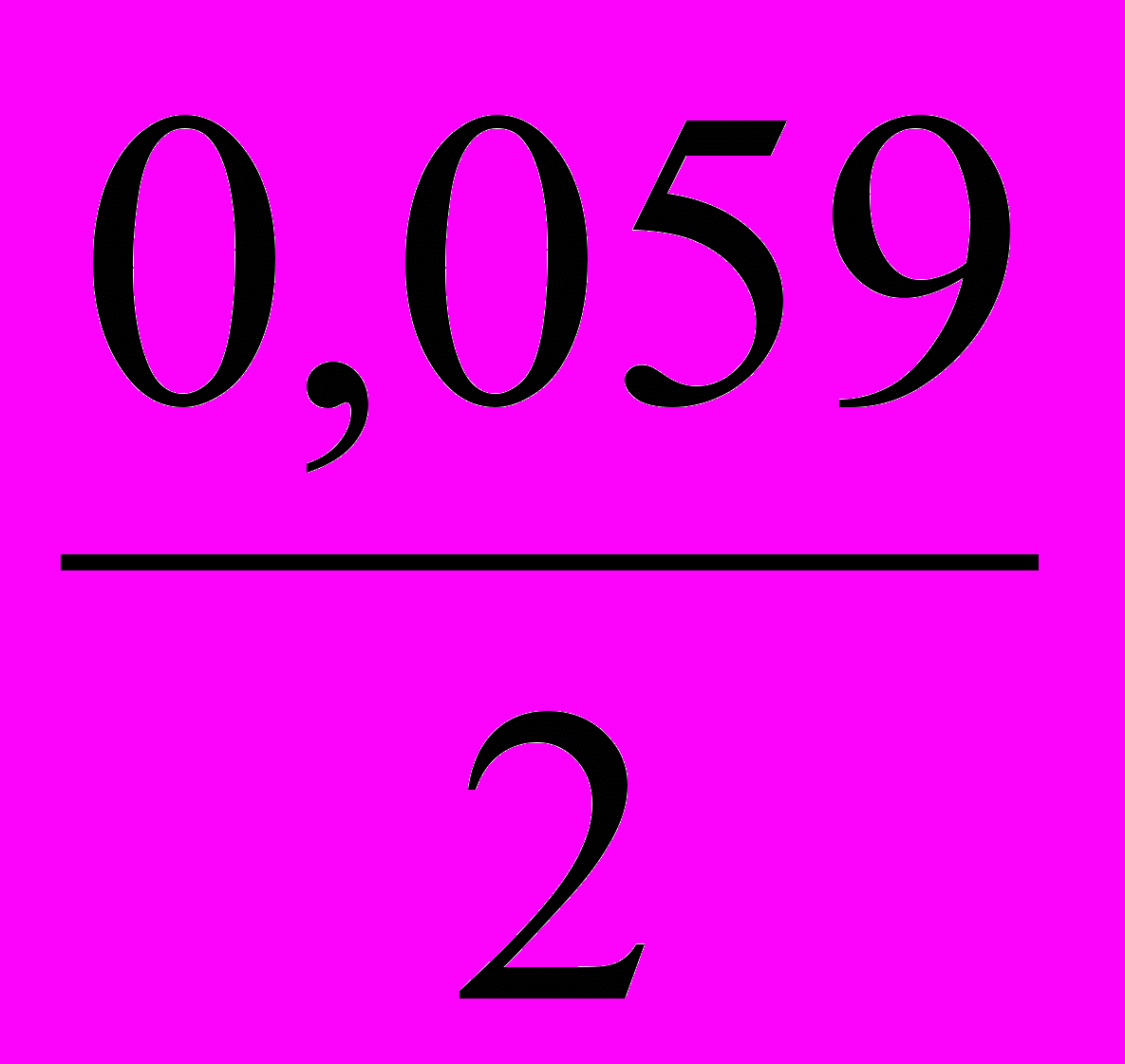 lg[Со2+] = 0,277 +
lg[Со2+] = 0,277 + 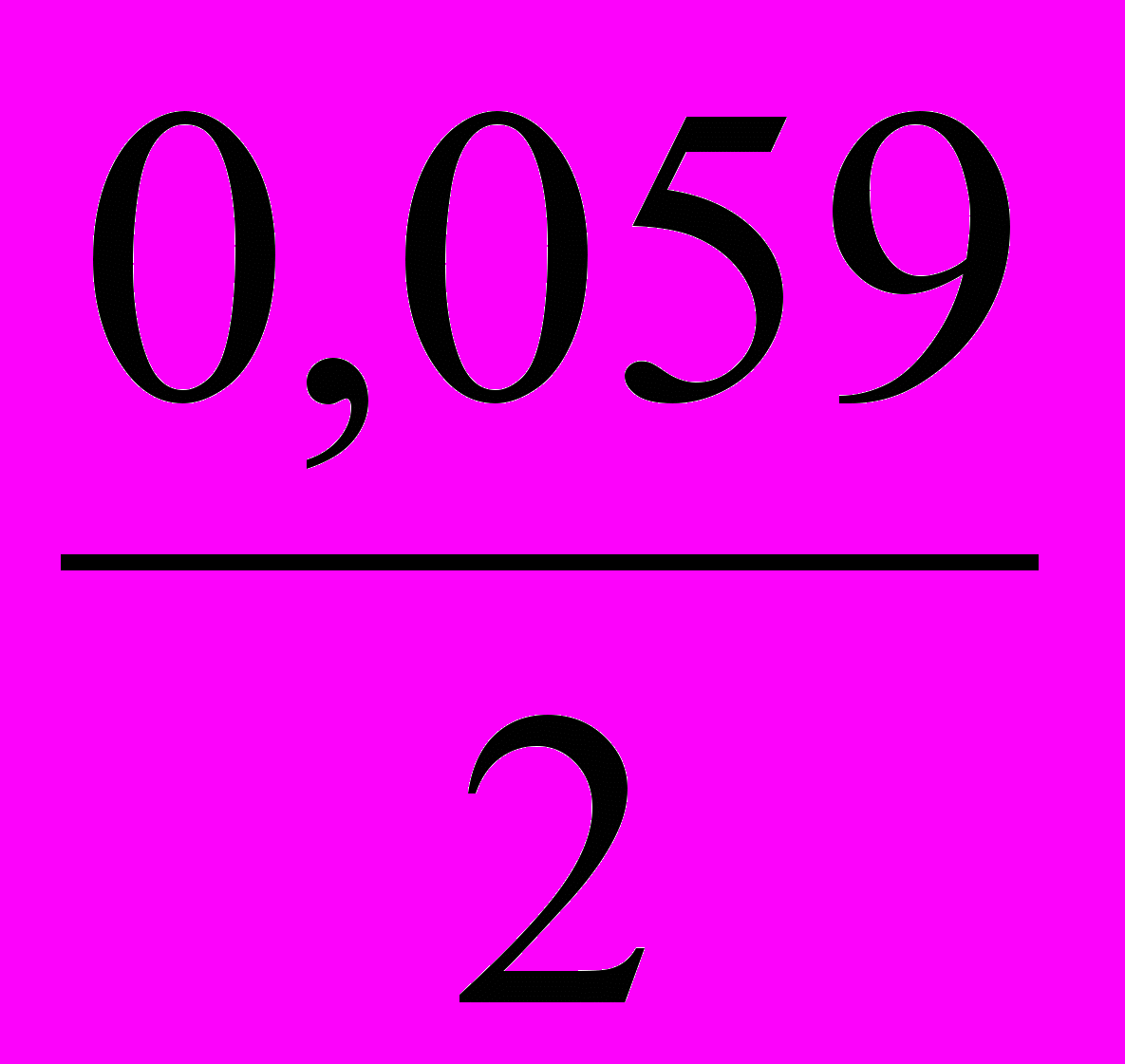 lg10-1 = 0,307 В.
lg10-1 = 0,307 В.Таким образом, при изменившейся концентрации ионов потенциал кобальта стал больше потенциала никеля.
