Методические указания к самостоятельной работе по общей химии для студентов Iкурса всех специальностей, изучающих химию
| Вид материала | Методические указания |
| Таблица 6 Варианты задания 6 Электролиз растворов Катодные процессы Анодные процессы Примеры решения задач Задания для самоподготовки Таблица 7 Варианты задания 7 Таблица 8 Варианты задания 8 |
- Д. И. Менделеева прогнозирование свойств элементов и их соединений методические указания, 611.18kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 1587.03kb.
- Методические указания по выполнению самостоятельной работы по английскому языку для, 491.03kb.
- Б. И. Джинджолия восточная философия XIX-XX веков, 544.15kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 803.64kb.
- Методические указания по подготовке к семинарским занятиям для студентов вечерней формы, 733.5kb.
- Методические указания для студентов Санкт-Петербург 2012, 391.72kb.
- Методические указания к лабораторной работе по органической химии для студентов специальностей, 227.51kb.
- Методические указания Санкт-Петербург 2009 удк 947, 1006.45kb.
- Методические указания и контрольные задания к внеаудиторной самостоятельной работе, 500.1kb.
Задание 6
Для металла Ме (табл. 6) выберите из перечня металлов-покрытий:
а) анодные покрытия; б) катодные покрытия.
Составьте электронные уравнения анодного и катодного процессов, протекающих при атмосферной коррозии металла Ме, покрытого первым из металлов-покрытий при нарушении покрытия.
Таблица 6
Варианты задания 6
| № п/п | Ме | Металлы- покрытия | № п/п | Ме | Металлы- покрытия |
| 1 | Fе | Be, Сu, Ag | 16 | Mg | Cr, Al, Ni |
| 2 | Сu | Al, Be, Au | 17 | Cu | Sn, Pt, Mo |
| 3 | Sn | Zn, Bi, Pt | 18 | Zn | Cd, Be, Cu |
| 4 | Cu | Ti, Au, Cd | 19 | Co | Fe, W, Pt |
| 5 | Cd | Co, Fe, Cu | 20 | Sn | Ti, Pb, Ni |
| 6 | Zn | Al, Pb, Sn | 21 | Mn | Pb, Ti, Co |
| 7 | Co | Mn, Ni, Pb | 22 | Cd | Zn, Mo, Cu |
| | | | | Окончание табл. 6 | |
| № п/п | Ме | Металлы- покрытия | № п/п | Ме | Металлы- покрытия |
| 8 | Fе | Cu, Cr, Al | 23 | Fе | Ni, Au, Sn |
| 9 | Cd | Zn, Mo, Cr | 24 | Cu | Pb, Fe, Ag |
| 10 | Co | Fe, Ni, Pb | 25 | Ni | Zn, Pb, Cr |
| 11 | Cr | Al, Fe, Co | 26 | Рb | Ti, Zn, Pt |
| 12 | Fе | Cu, Ag, Zn | 27 | Co | Mo, Cr, Au |
| 13 | Ni | Pb, Mn, Ti | 28 | Fе | Cr, Bi, Be |
| 14 | Mn | Al, Pt, Ni | 29 | Mn | Al, Ni, Sn |
| 15 | Fе | Mn, Co, Bi | 30 | Cd | Mn, Ni, Pb |
ЭЛЕКТРОЛИЗ
Электролиз – это окислительно-восстановительные процессы, протекающие при прохождении постоянного электрического тока через раствор или расплав электролита.
При электролизе энергия электрического тока превращается в химическую энергию, осуществляется процесс, обратный по характеру происходящему в гальваническом элементе. Как в любой электрохимической системе, при электролизе на аноде происходит окисление, а на катоде – восстановление. Анодом является положительный, а катодом – отрицательный электрод. Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, напряжение, плотность тока и др.).
При электролизе расплавов протекают три одновременных процесса: направленное движение катионов электролита к катоду, а анионов к аноду; восстановление катионов на катоде; окисление анионов на аноде.
Электролиз растворов электролитов более сложен из-за возможности участия в электродных процессах молекул воды:
восстановление на катоде 2Н2O + 2ē = H2 + 2OH
и окисление на аноде 2Н2O – 4ē = O2 + 4H+.
В тех случаях, когда на одном и том же электроде возможно протекание двух или большего числа процессов, наиболее вероятен тот, осуществление которого связано с минимальной затратой энергии. Это означает, что на катоде восстанавливаются в первую очередь окисленные формы окислительно-восстановительных систем с наибольшим электродным потенциалом, а на аноде окисляются восстановленные формы с наименьшим электродным потенциалом.
В реальных процессах этот порядок выделения (разряда частиц) часто нарушается из-за перенапряжения на электродах, вызванного их поляризацией и другими побочными процессами. Поэтому для определения порядка протекания окислительно-восстановительных процессов на электродах при электролизе водных растворов можно руководствоваться следующими практическими правилами.
Катодные процессы
- В первую очередь восстанавливаются катионы металлов, имеющих стандартный электродный потенциал, больший, чем у водорода (EoH+/ Н = 0), в порядке уменьшения Еo.
- Катионы металлов с малым стандартным электродным потенциалом (от Li+ до Al3+ включительно) не восстанавливаются, а вместо них восстанавливаются молекулы воды (в кислой среде – ионы Н+).
- Катионы металлов, имеющих стандартный электродный потенциал, меньший, чем у водорода, но больший, чем у алюминия, восстанавливаются одновременно с молекулами воды.
Анодные процессы
Характер окислительных процессов зависит от материала анода. Различают нерастворимые (инертные) и растворимые (активные) аноды.
Инертные электроды изготавливаются обычно из графита, угля, платины. В процессе электролиза они химически не изменяются, а служат лишь для передачи электронов во внешнюю цепь. При использовании инертных анодов надо помнить, что:
- В первую очередь окисляются простые анионы (за исключением F) в порядке возрастания их стандартных электродных потенциалов (S2, J, Вr, Сl)
- Анионы кислородсодержащих кислот (СО32, NO3, SO42, РО43 и др.) на аноде не окисляются; идет окисление молекул воды.
- В щелочных растворах на аноде окисляются ионы ОН:
4OH 4ē = O2 + 2H2O.
При использовании растворимых анодов, изготовленных из меди, цинка, серебра, никеля и других металлов, источником электронов является сам анод за счет окисления его материала:
Me – nē = Men+.
Примеры решения задач
Пример 7
Приведите уравнения процессов, происходящих на электродах при электролизе водного раствора СuCl2, если: а) электроды инертные; б) электроды медные.
Решение
В водном растворе СuCl2 содержатся ионы Сu2+, Сl и молекулы воды.
- В случае инертного анода окислению могут подвергаться ионы СI или молекулы H2O. Поскольку галогенид-ионы разряжаются в первую очередь, то окисляться будут именно они.
Анодный процесс: 2Cl 2ē = Cl2.
На катоде возможно восстановление катионов Сu2+, либо молекул Н2О. Поскольку ЕоСu2+/ Сu= 0,33 В больше, чем у водорода, EoH+/ Н = 0, то восстанавливаться будут только ионы меди.
Катодный процесс: Сu2+ + 2ē = Cu.
б) В случае медного анода речь идет о растворимом (активном) аноде. Окисляться будет материал анода.
Анодный процесс: Cuo 2ē = Cu2+.
Катодный процесс при этом не зависит от материала анода и заключается в восстановлении ионов Сu2+ , как и в случае а).
Катодный процесс: Сu2+ + 2ē = Cu.
Пример 8
В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации нитраты никеля, серебра, меди?
Решение
В результате диссоциации солей в растворе будут присутствовать ионы металлов: Ni2+, Ag+, Сu2+.
Сравним значения стандартных электродных потенциалов соответствующих металлов.
ЕoNi2+/ Ni = 0,25 В; ЕoАg+/ Аg = +0,80 В; ЕoCu2+/Cu = +0,34 В.
В первую очередь восстанавливаются катионы металлов, имеющих стандартный электродный потенциал, больший, чем у водорода, в порядке уменьшения ЕoMen+/Ме.
Следовательно, первыми будут восстанавливаться ионы серебра:
Ag++ ē = Ag.
Затем будет протекать восстановление ионов меди:
Cu2++ 2ē = Cu.
В последнюю очередь будут восстанавливаться ионы никеля, причем одновременно с молекулами воды:
Ni2++ 2ē = Ni;
2Н2О + 2ē = Н2 + 2ОН.
Пример 9
При какой силе тока проводили электролиз, если при электролизе раствора в течение 1 ч 40 мин 25с на катоде выделилось 0,7 л (н.у.) водорода при 50 %-ном выходе по току?
Решение
Из формулы объединенного закона Фарадея с учетом выхода по току следует:
I =
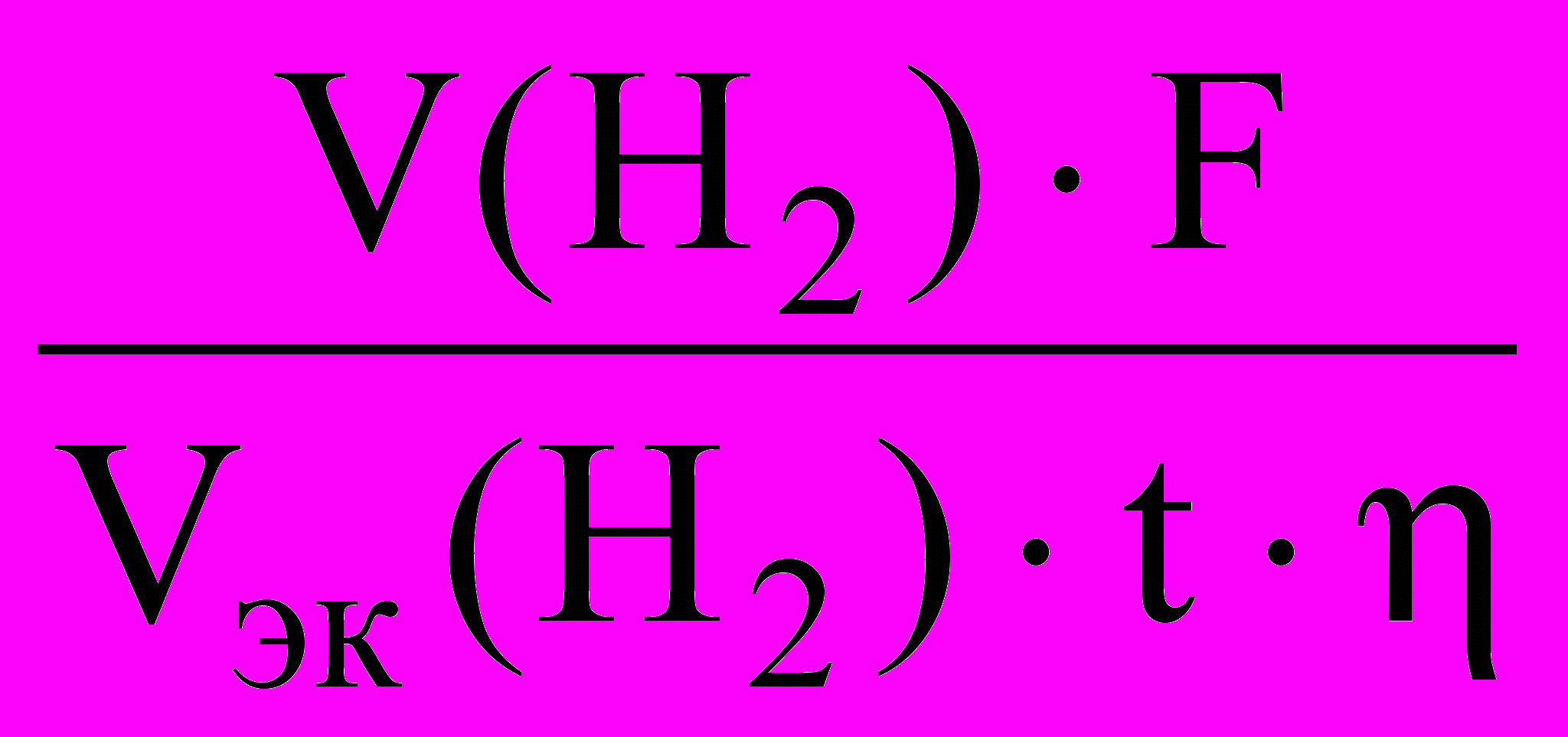 .
.Эквивалентный объем водорода при н.у. Vэк(Н2) =
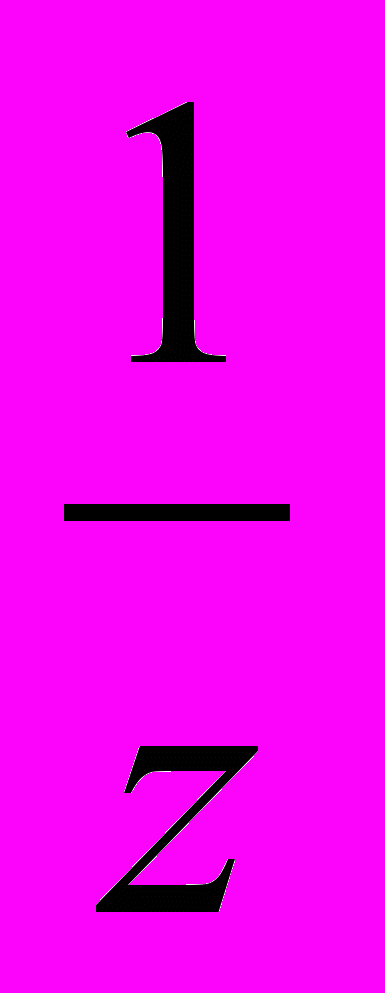 Vм(Н2)=
Vм(Н2)= 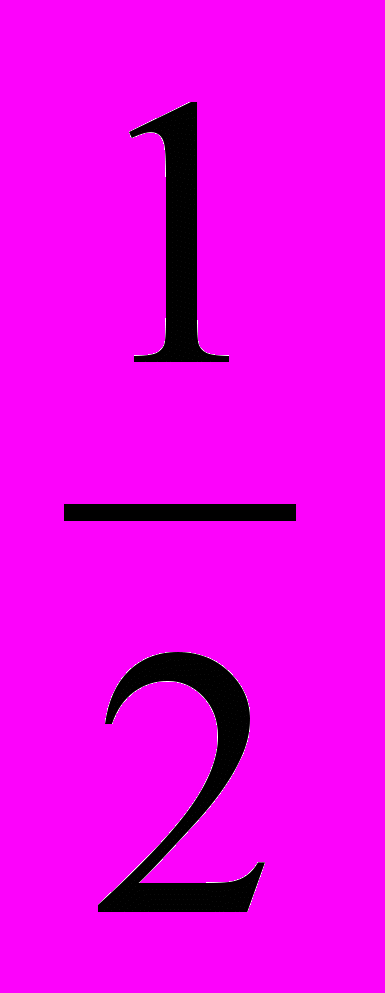 22,4 = 11,2 л/моль. Время электролиза 1 ч 40 мин 25 с = 6025 с.
22,4 = 11,2 л/моль. Время электролиза 1 ч 40 мин 25 с = 6025 с.I =
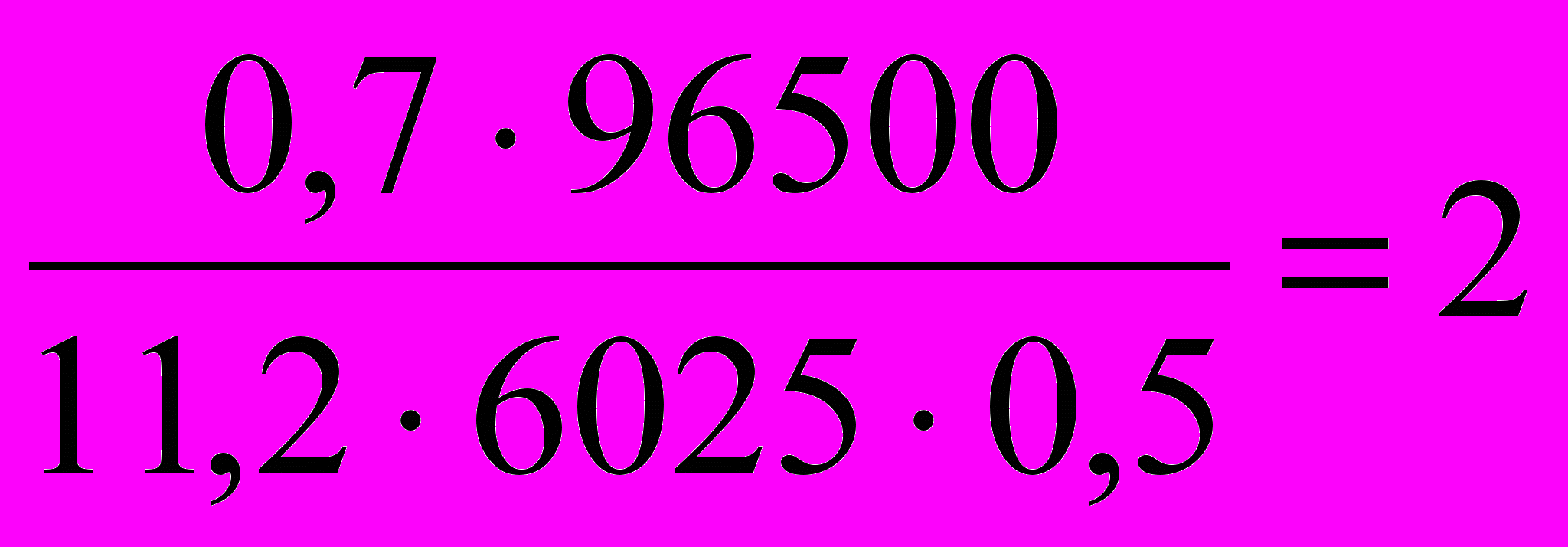 А.
А.Электролиз проводили при силе тока 2 А.
Пример 10
При электролизе раствора СuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
Какое вещество и в каком количестве образовалось в прианодном пространстве?
Решение
Так как SO42 – анион кислородсодержащей кислоты, на аноде будут окисляться молекулы воды.
Процесс на аноде: 2H2O – 4ē = O2 + 4H+.
Процесс на катоде: Сu2+ + 2ē = Сu.
Согласно закону Фарадея, на электродах выделяются равные эквивалентные количества веществ, кислорода и меди.
nэк(О2) = nэк (Cu) или

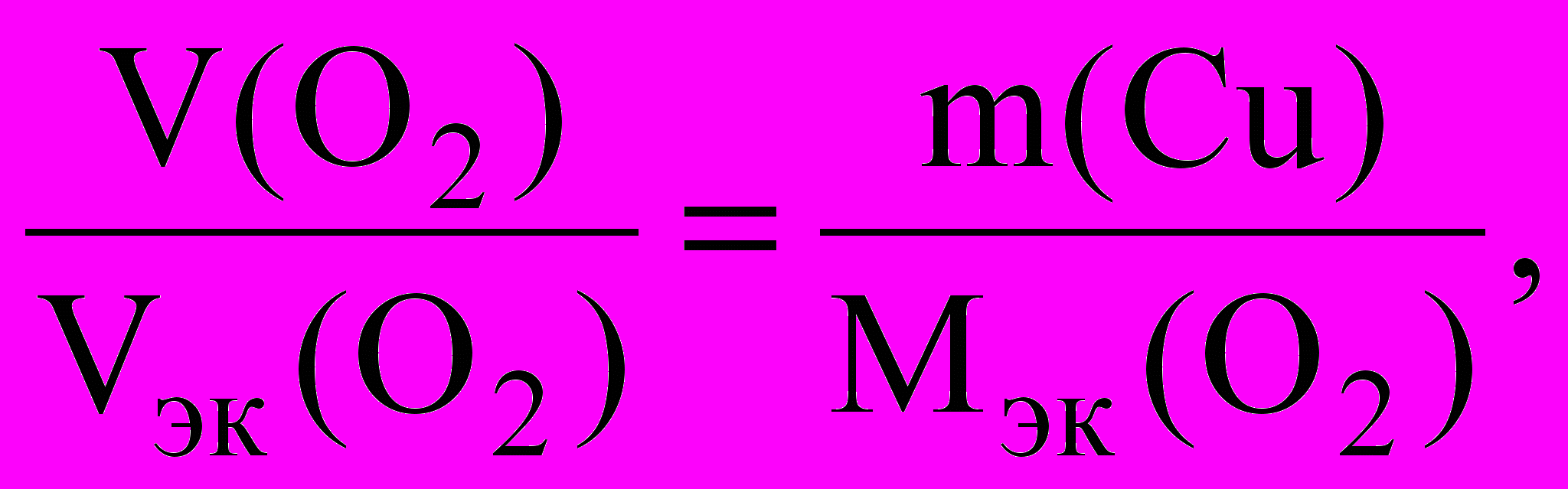 откуда
откудаm (Сu) =
 г.
г.Отрицательно заряженные ионы SO42 будут направляться к аноду электролизера, но из-за высокого потенциала разряда окисляться не будут. Вместе с образующимися в анодной реакции ионами Н+ они образуют в прианодном пространстве серную кислоту. Количество образовавшейся Н2SO4 эквивалентно количествам всех других продуктов электролиза:
nэк(H2 SО4) = nэк (O2) = nэк (Cu).
Масса серной кислоты
m (H2SO4) =
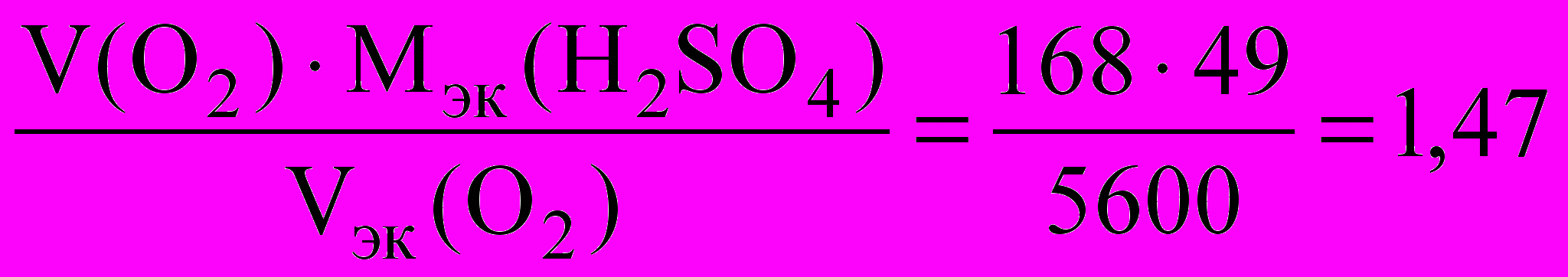 г.
г.Задания для самоподготовки
Задание 7
Составьте уравнения процессов, протекающих на электродах при электролизе водного раствора заданного электролита с электродами из указанного материала (табл. 7).
Таблица 7
Варианты задания 7
| № п/п | Раствор электролита | Материал электродов | № п/п | Раствор электролита | Материал электродов |
| 1 | FeCl3 | Fe | 16 | SnCl2 | Sn |
| 2 | CuCl2 | Cu | 17 | Ni(NO3)2 | C-графит |
| 3 | CdSO4 | C-графит | 18 | Cu(NO3)2 | Cu |
| 4 | CdCl2 | Cd | 19 | ZnSO4 | Zn |
| 5 | Cr2(SO4)3 | Cr | 20 | АgNO3 | Аg |
| 6 | Co(NO3)2 | C- уголь | 21 | ZnCl2 | C-уголь |
| 7 | Ni(NO3)2 | Ni | 22 | Cd(NO3)2 | Рt |
| 8 | МnCl2 | Рt | 23 | CdSO4 | Cd |
| 9 | NiCl2 | Ni | 24 | CuCl2 | Cu |
| 10 | Cu(NO3)2 | C- уголь | 25 | ZnSO4 | Рt |
| 11 | CoSO4 | Cо | 26 | МnCl2 | Mn |
| 12 | Pb(NO3)2 | Рb | 27 | SnCl2 | C-графит |
| 13 | Zn(NO3)2 | Zn | 28 | CrCl3 | Рt |
| 14 | CoSO4 | Рt | 29 | MnSO4 | Mn |
| 15 | АgNO3 | C-графит | 30 | Co(NO3)2 | Co |
Задание 8
Водный раствор, содержащий ионы электролитов (табл. 8) в одинаковой концентрации, подвергли электролизу с инертными электродами.
8.1. Укажите, какие частицы способны подвергаться окислению, а какие – восстановлению.
8.2. Составьте уравнения возможных анодных и катодных процессов с указанием последовательности их протекания.
Таблица 8
Варианты задания 8
| № п/п | Ионы электролитов | № п/п | Ионы электролитов |
| 1 | Be2+, Сu2+, NO3, Ag+ | 16 | Ba2+, OH, Сl, NO3 |
| 2 | Al3+, NO3, Hg2+, Fe2+ | 17 | Hg2+, Pb2+, +, NO3, Ni2+ |
| 3 | SO42-, Cd2+, Сl, Мg2+ | 18 | J, Nа+, Co2+, Ag+ |
| 4 | Тi2+, Sn2+, Cl, NO3- | 19 | Mn2+, Fe2+, SO42, Вr |
| 5 | Co2+, SO42, J, Сu2+ | 20 | Cd2+, Сl, Ca2+, Fe2+ |
| 6 | Сr3+, SO42, Ni2+, Na+ | 21 | SiO32, К+, Na+, Сl |
| 7 | Рb2+, Zn2+, NO3, Сl | 22 | Sr2+, S2, К+, Сl |
| 8 | SO42, Сu2+, Al3+, К+ | 23 | Cr3+,SO42, Сu2+, J |
| 9 | Nа+, SO42, OH, Br | 24 | Bi3+, NO3, Ag+, Ca2+ |
| 10 | Ag+, NO3, Zn2+, Ca2+ | 25 | Ва2+, Na+, OH, CI |
| 11 | Сr3+, Co2+, SO42, NO3 | 26 | NO3, Сu2+, Мg2+, Bi3+ |
| 12 | Hg2+, Сu2+, NO3, Ba2+ | 27 | Al3+, J, Cr3+, Fe2+ |
| 13 | Sn2+, Сl, Ni2+, K+ | 28 | Ca2+, Сl, SO42,Mn2+ |
| 14 | S2, Na+, K+, J | 29 | Zn2+, Сu2+, SO42, Br |
| 15 | Мg2+, Cl, Sn2+, SO42, | 30 | Fe3+, Fe2+, NO3, Сl |
