Методические указания к самостоятельной работе по общей химии для студентов Iкурса всех специальностей, изучающих химию
| Вид материала | Методические указания |
| Таблица 2 Варианты задания 2 Гальванические элементы Примеры решения задач |
- Д. И. Менделеева прогнозирование свойств элементов и их соединений методические указания, 611.18kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 1587.03kb.
- Методические указания по выполнению самостоятельной работы по английскому языку для, 491.03kb.
- Б. И. Джинджолия восточная философия XIX-XX веков, 544.15kb.
- Методические указания по подготовке к семинарским занятиям для студентов дневной формы, 803.64kb.
- Методические указания по подготовке к семинарским занятиям для студентов вечерней формы, 733.5kb.
- Методические указания для студентов Санкт-Петербург 2012, 391.72kb.
- Методические указания к лабораторной работе по органической химии для студентов специальностей, 227.51kb.
- Методические указания Санкт-Петербург 2009 удк 947, 1006.45kb.
- Методические указания и контрольные задания к внеаудиторной самостоятельной работе, 500.1kb.
Задание 2
Рассчитайте равновесный потенциал электрода, состоящего из металла Ме, погруженного в раствор электролита В с концентрацией С(В) (моль/л) (табл. 2).
Изменится ли потенциал электрода, если электролит разбавить в 10 раз?
Таблица 2
Варианты задания 2
№п/п | Ме | В | С(В), моль/л | № п/п | Ме | В | С(В), моль/л |
| 1 | Ni | NiSO4 | 0,01 | 16 | Co | CoCl2 | 0,1 |
| 2 | Ag | AgNO3 | 0,001 | 17 | Al | AlCl3 | 0,01 |
| 3 | Sn | SnCl2 | 0,1 | 18 | Cr | Cr2(SO4)3 | 0,001 |
| 4 | Zn | ZnSO4 | 0,1 | 19 | Sn | SnSO4 | 0,0001 |
| 5 | Fe | FeCl2 | 0,001 | 20 | Zn | ZnJ2 | 0,001 |
| 6 | Mn | Mn(NO3)2 | 0,01 | 21 | Mn | MnSO4 | 0,01 |
| 7 | Ti | TiCl2 | 0,0001 | 22 | Ni | NiCl2 | 0,1 |
| 8 | Cu | CuSO4 | 0,01 | 23 | Bi | Bi(NO3)3 | 0,01 |
| 9 | Pb | Pb(NO3)2 | 0,1 | 24 | Fe | FeCl3 | 0,001 |
| 10 | Аl | Al2(SO4)3 | 0,001 | 25 | Mg | MgSO4 | 0,0001 |
| 11 | Zn | ZnCl2 | 0,01 | 26 | Cu | Cu(NO3)2 | 0,1 |
| 12 | Cr | CrCl3 | 0,1 | 27 | Sn | SnBr2 | 0,001 |
| 13 | Fe | FeSO4 | 0,01 | 28 | Cr | Cr(NO3)3 | 0,0001 |
| 14 | Mg | Mg(NO3)2 | 0,001 | 29 | Zn | Zn(NO3)2 | 0,01 |
| 15 | Pb | Pb(CH3COO)2 | 0,001 | 30 | AI | AlBr3 | 0,001 |
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток.
Гальванический элемент состоит из двух электродов, соединенных металлическим проводником и находящихся в среде электролитов. Электрод, на котором происходит процесс окисления, называется анодом (отрицательный полюс гальванического элемента), а электрод, на котором происходит восстановление – катодом (положительный полюс). Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов.
Процессы, происходящие на электродах, записывают в виде электронных уравнений. Суммарное уравнение, получаемое при сложении электронных уравнений анодной и катодной реакций, представляет собой уравнение реакции, лежащей в основе работы гальванического элемента (токообразующей реакции).
При схематическом изображении гальванического элемента граница раздела между поверхностью электрода и электролитом обозначается вертикальной чертой, граница между двумя электролитами – двойной вертикальной чертой.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Еэ (ЭДС) элемента. Если реакция осуществляется в стандартных условиях, то ЭДС называется стандартной электродвижущей силой данного элемента (ЭДСo). ЭДС гальванического элемента определяется общей формулой:
Еэ = Eк EA,
где Ек и EА – потенциалы, отвечающие электродным процессам, происходящим на катоде и аноде.
Как известно, термодинамическим условием самопроизвольного протекания химического процесса является отрицательное значение изменения изобарно-изотермического потенциала (энергии Гиббса), т. е. G
G = n F Еэ,
где n – число электронов, участвующих в суммарном окислительно-восстановительном процессе.
Из анализа выражения для G следует, что термодинамическим условием самопроизвольного протекания окислительно-восстановительной реакции в гальваническом элементе является положительное значение ЭДС (Еэ), когда система с более высоким значением электродного потенциала выступает в качестве окислителя, т.е. восстанавливается.
Примеры решения задач
Пример 3
Гальванический элемент состоит из кадмиевого и серебряного электродов, погруженных в раствор соляной кислоты.
Составьте схему гальванического элемента, напишите электронные уравнения электродных процессов и токообразующей реакции. Укажите направление движения электронов во внешней цепи.
Решение
Поскольку стандартный потенциал кадмиевого электрода Е0Cd2+/ Cd = 0,40 В
меньше, чем стандартный потенциал серебряного электрода Е0Ag+/ Ag = 0,80 В, анодом будет кадмий, а катодом – серебро.
Схема заданного гальванического элемента имеет вид
() A Cd | HCI | Ag K (+) или () А Сd | H+ | Ag K (+).
Составим электронные уравнения электродных процессов и токообразующей реакции.
На аноде: Cd0 2ē = Cd2+ окисление; восстановитель.
На катоде: 2Н+ + 2ē = H02 восстановление; окислитель;
Cd0 +2Н+ = Сd2+ + Н02.
В молекулярной форме токообразующая реакция имеет вид
Cd0 + 2HCl = CdCI2 +H2 .
Во внешней цепи движение электронов происходит от анода к катоду, то есть от кадмиевого электрода к серебряному.
Пример 4
Гальванический элемент составлен из кадмиевого и серебряного электродов, погруженных в растворы нитрата кадмия и нитрата серебра с концентрациями 0,01 моль/л и 0,001 моль/л соответственно.
Составьте схему гальванического элемента, напишите уравнения реакции, лежащей в основе работы данного гальванического элемента и определите направление ее протекания.
Решение
Схема заданного гальванического элемента имеет вид:
() A Cd | Сd (NO3)2 || Ag NO3 Ag K(+) или
() А Сd | Сd2+ || Ag+ Ag K (+).
Анодом является кадмиевый электрод, так как значение стандартного потенциала кадмия значительно меньше стандартного потенциала серебра и различие в концентрациях электролитов не приведет к принципиальному изменению соотношения потенциалов электродов.
Запишем уравнения электродных процессов и на их основе реакции, лежащей в основе работы гальванического элемента (токообразующей реакции).

Н
 а аноде: Cd0 2ē = Cd2+ 1 окисление; восстановитель.
а аноде: Cd0 2ē = Cd2+ 1 окисление; восстановитель.На катоде: Ag+ + ē = Ag0 2 восстановление; окислитель.
Cd0 + 2Ag+ = Сd2+ + 2Аg0 или в молекулярной форме
Cd0 + 2AgNO3 = Cd(NO3)2 + 2Ag0.
Вычислим равновесные потенциалы электродов по уравнению Нернста:
ЕК = ЕАg+/ Аg = Е0 Аg+/ Аg + 0,059 lg[Ag+] = 0,80 + 0,059 lg10-3 = 0,68 В.
ЕA = ЕCd2+/ Cd = Е0 Cd+/ Cd +
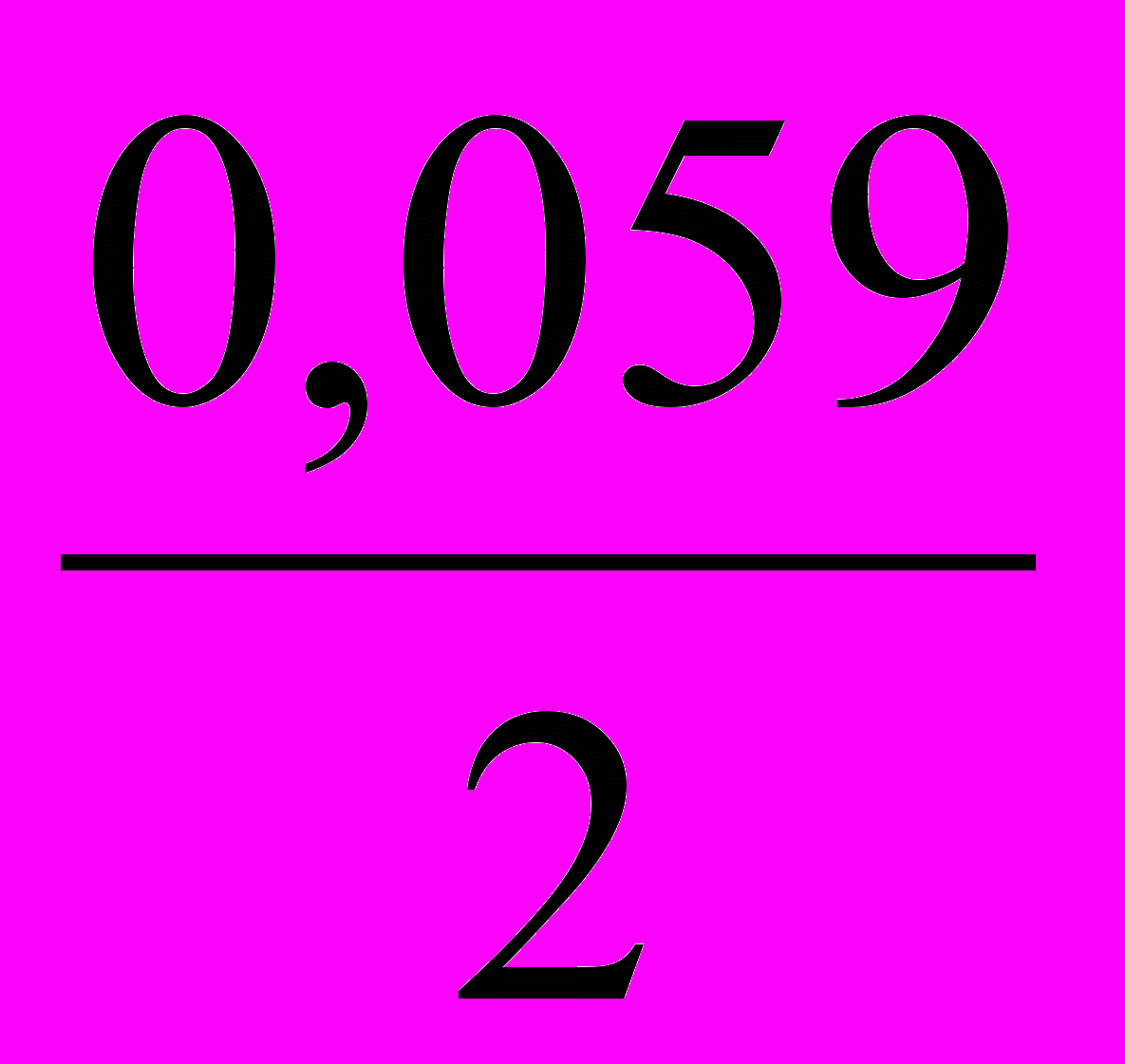 lg[Cd2+] = 0,40 + 0,03 lg10-2 = 0,46 В.
lg[Cd2+] = 0,40 + 0,03 lg10-2 = 0,46 В.Найдем значение ЭДС и установим направление протекания токообразующей реакции.
ЭДС = Еэ = EК EА = 0,68 – (0,46) = 1,14 В.
Поскольку ЭДС > 0, то G < 0 и токообразующая реакция протекает самопроизвольно в прямом направлении, кадмий окисляется, а серебро восстанавливается.
