Выбор лечебной тактики у больных различными формами акне 14. 00. 11 кожные и венерические болезни
| Вид материала | Автореферат |
| St. aureus Staphylococcus spp. Традиционные препараты Нетрадиционные препараты Staphylococcus aureus Staphylococcus aureus N33 |
- Разработка комплексных методов лечения и формирование условий стойкой ремиссии у больных, 772.19kb.
- Комплексная терапия акне у женщин с метаболическими нарушениями 14. 01. 10 Кожные, 395.48kb.
- Задачи по оказанию доврачебной помощи при неотложных состояниях 43 акушерство, 1884.21kb.
- Оптимизация лечения варикозной экземы, ассоциированной с микотической инфекцией,, 427.97kb.
- Комбинированные лазерные технологии в восстановительном лечении постакне 14. 03., 291.32kb.
- Изучение влияния клинико-социальных факторов на психические расстройства у больных, 464.61kb.
- Эпидемиология, диагностика и лечение больных эрозивно-язвенным баланопоститом, ассоциированным, 309.4kb.
- Усовершенствование метода терапии угревой болезни на основе коррекции дисфункциональных, 338.75kb.
- Практикум для студентов лечебного и педиатрического факультетов, 2007. П. Д. Гуляй, 16.95kb.
- Клиническая, медико-правовая оценка дефектов оказания дерматовенерологической помощи, 171kb.
Результаты микробиологических исследований
Видовая принадлежность стафилококков на коже, определенная в 1-й группе больных акне (n=61), представлена на рис.3.
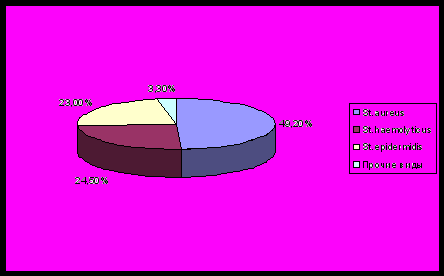
Рис.3. Видовая принадлежность стафилококков
Обращает на себя внимание превалирование штаммов St. aureus - 49,2% при данной нозологии. Возможно, что эта особенность присуща именно российской популяции [Арзуманян В.Г с соавт., 2004], тогда как в других странах преобладающим видом даже при акне является St. epidermidis - свыше 90% [Nishijima S. et al., 2000; Dreno B. et al., 2001]. Смена одного вида стафилококков на другой может быть обусловлена изменением режима ухода за кожей в связи с увеличением частоты использования моющих и косметических средств, содержащих такие вещества, как триклозан. Кроме этого, наличие микроповреждений кожи в области поражения при акне обусловливает более высокую частоту встречаемости St. aureus [Кабаева Т.,2005]. У всех полученных изолятов стафилококков оценивали чувствительность к ряду антибиотиков и антисептиков (табл.3). Из таблицы видно, что чувствительность к традиционно используемым антибиотикам варьирует от 13,1% до 47,9%, причем наибольшую резистентность стафилококки проявляли по отношению к эритромицину (85,2%) и левомицетину (81,4%). По данным B. Dreno et al.(2001) St. epidermidis также обладали высокой устойчивостью к эритромицину, при этом 71,4% изученных штаммов были чувствительны к высоким концентрациям препарата - свыше 512 мкг/мл. Клиндамицин - препарат, традиционно используемый для наружной терапии акне, лишь в половине случаев проявлял эффективность in vitro. Значительно большее количество препаратов, активных в отношении стафилококковой микрофлоры, обнаружено среди нетрадиционных. К ним относятся: амикацин, цефобид, клафоран, гентамицин, офлоксацин и соли цинка. Чувствительность в данной подгруппе варьировала от 67,2% до 93,4%, причем максимальной активностью обладали амикацин и цефобид.
Таблица 3
Оценка чувствительности штаммов Staphylococcus spp.,
выделенных с кожи лица больных акне(n=61).
| Препарат | % от общего числа штаммов | ||
| Чувствительны | Ум/устойчивы | Устойчивы | |
| Традиционные препараты | |||
| Клиндамицин | 47,9 | 8,3 | 43,8 |
| Доксициклин | 41,2 | 11,8 | 47,1 |
| Линкомицин | 27,9 | 6,6 | 65,6 |
| Левомицетин | 13,6 | 5,1 | 81,4 |
| Эритромицин | 13,1 | 1,6 | 85,2 |
| Нетрадиционные препараты | |||
| Амикацин | 93,4 | 3,3 | 3,3 |
| Цефобид | 93,2 | 5,1 | 1,7 |
| Клафоран | 82,0 | 4,9 | 13,1 |
| Гентамицин | 68,9 | 4,9 | 26,2 |
| Офлоксацин | 67,2 | 9,8 | 22,9 |
| Норфлоксацин | 54,5 | 13,6 | 31,8 |
| Оксациллин | 37,7 | 8,2 | 54,1 |
| Азитромицин | 10,9 | 1,8 | 87,3 |
| Клацид | 10,2 | 3,4 | 86,4 |
| Томицид | 0 | 0 | 100 |
| Фурациллин | 41,0 | 3,3 | 55,7 |
| Диоксидин | 14,8 | 1,6 | 83,6 |
| Соли цинка | 73,8 | 13,1 | 13,1 |
| Соли серебра | 29,5 | 13,1 | 57,4 |
| Соли свинца | 0 | 0 | 100 |
Низкую эффективность антибактериальной терапии акне традиционно связывают с увеличением резистентности причинно-значимых штаммов стафилококков и пропионовых бактерий [Nishijima S. et al., 2000; Dreno B. et al., 2001]. Полученные данные подтверждают это мнение, поскольку именно наиболее часто используемые препараты обладают наименьшей противостафилококковой активностью. Таким образом, очевидна нецелесообразность применения традиционных антибиотиков для лечения акне вввиду увеличения антибиотикорезистентности. Из этого следуют выводы: перед назначением антибактериальной терапии необходимо исследование микробного пейзажа с последующим определением антибиотикочувствительности; в случае невозможности определения антибиотикочувствительности следует учитывать полученные результаты и препаратами первого выбора считать амикацин, цефобид и клафоран.
В клинической практике рутинно определять чувствительность микроорганизмов к антибиотикам. При легкой степени тяжести акне предпочтительным является назначение наружных средств, содержащих антибиотики. Готовых наружных форм амикацина, цефобида и клафорана на отечественном рынке лекарственных препаратов нет, в связи с чем нами для лечения папулопустулезных акне легкой степени тяжести был выбран Базирон АС гель. Отмечено отсутствие развития у бактерий резистентности к бензоилпероксиду, что, очевидно, связано с неспецифическим механизмом его действия [Goulden V., 2003]. Бензоилпероксид, входящий в состав Базирон АС геля, нами был изучен более пристально.
Впервые методом двукратных микроразведений изучали действие бензоилпероксида (БП) на рост 9 клинических штаммов Staphylococcus aureus, 8 - Staphylococcus epidermidis, 3 - Staphylococcus haemolyticus, а также 20 культур оппортунистических дрожжей: 11 изолятов Candida albicans, 3 – Malassezia sрр., 2 - Rhodotorula sрр., 2- Trichosporon -sрр. и 2 – Geotrichum s рр.
Установлено, что Минимальные Ингибирующие Концентрации (МИК), независимо от рода (вида) микроорганизмов, находились в пределах 625-2500 мкг/мл.
Скорость отмирания клеток за первые полчаса инкубации с БП при его концентрации в среде 5000 мкг/мл составляла (% клеток/мин): 2,27 для Malassesia furfur; 2,48 - для Candida albicans; 3,06 - для Malassesia globosa. У всех трех штаммов дрожжей наблюдали полную гибель клеток через 2,5 часа (рис.4).
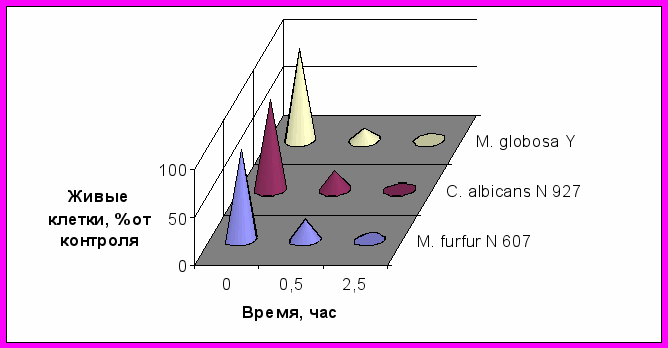
Рис.4. Динамика гибели клеток дрожжей под действием бензоилпероксида:
Исходное содержание живых клеток-примерно 107 КОЕ/мл;
Концентрация БП-5000 мкг/мл
Таким образом, БП является перспективным препаратом для лечения поверхностных микозов, поскольку весьма активен в отношении клинически значимых дрожжевых грибов.
Определена зависимость МИК бензоилпероксида в отношении Staphylococcus aureus N33 от плотности клеточной суспензии: при плотности клеток в диапазоне 102-108 КОЕ/мл МИК БП для культуры Staphylococcus aureus составила 1250 мкг/мл, а при 109 КОЕ/мл - 2500 мкг/мл. Установленный характер взаимосвязи между концентрацией клеток и МИК связан, очевидно, с неспецифическим механизмом действия БП. Как и прочие перекисные соединения, БП вызывает деструкцию клеточной стенки, окисляя двойные связи в ненасыщенных жирных кислотах мембран. По всей вероятности, не имеет особого значения, будет ли в данной микробной клетке под действием БП образовано, условно говоря, 10 или 10000 пор: клетка все равно погибает. Скорость гибели должна зависеть от концентрации БП.
При обычной плотности популяции микроорганизмов на поверхности кожи (не более 10-10 клеток/см2) МИК БП составляет 1250-2500 мкг/мл. Простой расчет показал, что при использовании 5%-ного геля на 1 см2 кожи наносится всего 5-10 мкл, т.е. 250-500 мкг БП, что в 5-10 раз меньше МИК. Повышение концентрации БП, однако, чревато побочными эффектами - цитотоксичность и аллергенность этого препарата известны [Bester M.J. et al., 2003].
Учитывая, что возраст популяции микробных клеток на коже может значительно превышать возраст и активность клеток стафилококков, выращенных in vitro, можно небезосновательно предположить, что МИК для клеток in vivо будет гораздо меньшей. Эти предположения подтверждаются клиническими данными результатов применения Базирон АС геля при папулопустулезных акне легкой степени тяжести (n=42) (рис.5).

Рис.5. Сравнение клинической эффективности терапии Базирон АС
гелем через 1 и 4 недели лечения
Через 4 недели терапии Базирон АС гелем отсутствие эффекта не отмечалось ни у одного пациента. Значительное улучшение отмечено у 69% пациентов, что значительно выше показателей, полученных через 1 неделю (р<0,05); улучшение имело место у 31% больных. Самооценка эффективности лечения показала, что пациенты дали позитивную характеристику переносимости Базирон АС геля через 4 недели терапии. Так, 13 пациентов (38%) оценили переносимость как очень хорошую, 21 пациент (62%) - как хорошую. Наиболее выраженные изменения касались воспалительных элементов, преимущественно пустул. Подсчет воспалительных акне элементов до и после лечения показал, что количество пустул через месяц терапии уменьшилось втрое (р<0,001). Количество закрытых комедонов практически не изменилось, в результате чего пациентам с наличием закрытых комедонов был рекомендован в дальнейшей терапии дифферин (крем или гель). Таким образом, применение Базирон АС геля наиболее оптимально при папулопустулезных акне легкой степени тяжести с преобладанием пустулезных элементов.
Оценка состояния кожи к моменту окончания терапии показала, что у многих пациентов улучшилась текстура кожи (она стала более ровной и равномерно окрашенной).
Результаты иммунологических исследований
Оценка иммунологических показателей проведена до начала лечения у 73 пациентов 2-й, 3-й и 4-й групп (табл.4). Характерным признаком для больных папулопустулезными акне было снижение ниже нормальных значений относительного и абсолютного содержания Т-супрессоров с маркером CD8+ в периферической крови у 71,2% и 54,8% соответственно, относительного и абсолютного содержания В-лимфоцитов с маркером СD72+ у 52,1% и 61,6% больных. У 50,7% больных выявлено снижение абсолютного содержания общих Т-лимфоцитов с маркером CD3+, а у 52,1% больных - Т-хелперов с маркером CD4+ при нормальных показателях общего содержания лейкоцитов и лимфоцитов крови. В системе гуморального звена иммунитета у 61,6% пациентов выявлено снижение содержания общего иммуноглобулина класса А (IgA) и повышение общего иммуноглобулина класса М (IgM) у 42,5% больных. Из показателей мукозального иммунитета выявлено повышение уровня секреторного иммуноглобулина А (sIgA) у 35,6% пациентов. Содержание иммуноглобулина А (IgA) и иммуноглобулина G (IgG) в слюне у большинства пациентов было в пределах нормальных значений.
При проведении анализа результатов в зависимости от стадии заболевания выявлены определенные особенности в характере иммунологических показателей. При 2-й стадии заболевания выявлено угнетение клеточных и гуморальных факторов иммунитета, так же как и в целом по группе, что проявлялось в снижении ниже нормальных значений субпопуляций лимфоцитов CD8+, CD4+, снижении уровня IgA, повышении уровня IgM в сыворотке крови, однако при более глубоких изменениях в В-клеточном звене. Так, содержание СD72+ при 2-й стадии заболевания составляло (10,5±0,6)%. При более тяжелом течении заболевания (3-я стадия) выявлено снижение CD8+ и CD4+ и гиперпродукция sIgA в слюне, что может быть связано с повышенной антигенной нагрузкой, обусловленной персистенцией микроорганизмов в кишечнике (табл.4).
Таблица 4
Характеристика иммунологических показателей у пациентов с акне
в зависимости от стадии заболевания
| Показатель | Единица измерения | Норма | Среднее значение по группе (n=73) | Стадия заболевания | |
| 2-я (n=53) | 3-я (n=20) | ||||
| CD3+ | % | 60-76 | 67,5±1,3 | 68,3±1,5 | 65,9±2,2 |
| абс.,х109/мл | 1100-1700 | 1278±61,4 | 1395±100 | 1182±89 | |
| CD4+ | % | 38-46 | 41,0±1,1 | 40,7±1,3 | 42,0±1,8 |
| абс.,х109/мл | 700-1100 | 6 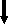 23±32 23±32 | 6 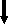 12±39,3 12±39,3 | 6 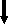 50±53 50±53 | |
| CD8+ | % | 31-40 | 2 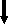 8,7±0,8 8,7±0,8 | 2 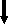 8,8±1,1 8,8±1,1 | 2 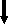 8,5±1,3 8,5±1,3 |
| абс.,х109/мл | 500-1000 | 550±42 | 560±56 | 522±44 | |
| ИРИ | У.е. | 1,2-2,0 | 1,53±0,06 | 1,52±0,08 | 1,49±0,13 |
| CD16+ | % | 10-19 | 15,3±0,9 | 14,9±1,1 | 16,4±1,6 |
| абс.,х109/мл | 200-400 | 305±26 | 292±32 | 339±43 | |
| CD72+ | % | 11-16 | 11,1±0,5 | 1 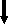 0,5±0,6 0,5±0,6 | 12,9±1,2 |
| абс.,х109/мл | 200-400 | 211±13,8 | 207±17,5 | 220±20 | |
| IgA1) | мг/мл | 1,79-5,0 | 1 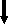 ,71±0,10 ,71±0,10 | 1 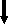 ,57±0,10 ,57±0,10 | 2,03±0,24 |
| IgM1) | мг/мл | 1,4-2,4 | 2,30±0,2 | 2 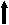 ,45±0,17 ,45±0,17 | 1,91±0,30 |
| IgG1) | мг/мл | 7,14-17,0 | 11,7±0,3 | 11,5±0,3 | 12,3±0,6 |
| sIgA2) | мг/мл | 70-250 | 252±25 | 225±20 | 3  23±71 23±71 |
| IgA2) | мг/мл | 30-160 | 58,4±4,0 | 56,6±4,1 | 62,9±9,4 |
| IgG2) | мг/мл | До 50 | 30,7±2,5 | 30,9±2,9 | 30,1±4,9 |
П
 римечание: 1) - в сыворотке крови; 2) - в слюне.
римечание: 1) - в сыворотке крови; 2) - в слюне.-
 повышение по сравнению с нормой; - снижение по сравнению с нормой.
повышение по сравнению с нормой; - снижение по сравнению с нормой.При этом степень тяжести заболевания наиболее заметно коррелировала со следующими показателями: IgA, IgM сыворотки крови и sIgA слюны.
В качестве особенностей отметим, что значения IgA крови не различались при 2-й и 3-й степени тяжести при высыпаниях только на лице (1,8±0,2 и 1,5±0,2 соответственно), однако при распространенном процессе различия показателя были достоверными (1,4±0,2 и 2,7±0,4 соответственно, р=0,002). При этом у 75% пациентов с акне 2-й степени тяжести с распространенным поражением уровень IgA был ниже 1,6мг/мл. Напротив, у 75% пациентов 3-й степени тяжести этот показатель был от 1,8 мг/мл и выше. Таким образом, у больных с распространенным поражением уровень IgA, близкий к 1,8 мг/мл, следует считать пороговым, отражающим степень тяжести заболевания.
Содержание sIgА в слюне у пациентов 2-й и 3-й степени тяжести с распространенным поражением достоверно различалось (р=0,05) (медианы 185г/л и 350 г/л соответственно),тогда как при локализованных высыпаниях различий не выявлено (медианы 180 г/л и 178 г/л соответственно).
При наличии в анамнезе заболеваний верхних дыхательных путей и носоглотки выявлены существенные различия показателя IgМ крови в зависимости от степени тяжести акне. При 3-й степени тяжести акне IgМ был значительно ниже, чем при 2-й степени (1,4±0,2 и 2,8±0,4)(р=0,009). Таким образом, заболевания верхних дыхательных путей были взаимосвязаны со снижением IgМ крови и зависели от степени тяжести акне
Таким образом, доля пациентов с пониженными значениями показателя IgM в крови и повышенными значениями показателей IgA крови и sIgА слюны возрастала при увеличении степени тяжести заболевания больных с акне. Поэтому их можно использовать в качестве прогностических маркеров определения степени тяжести заболевания и оценки эффективности лечения.
Показатели, определенные до лечения, - sIgA и IgA слюны, IgA, CD72+ abs, CD8+ abs - увеличивались, а показатели ИРИ и CD4+% - уменьшались по мере повышения степени дисбиоза кишечника, особенно при 3-й степени, что свидетельствует об антигенной нагрузке микробиоты кишечника. При этом выявили достоверное снижение показателя CD4+% (р=0,018) и показателя ИРИ (р=0,025) по мере увеличения степени дисбиоза кишечника и достоверное (р=0,05) повышение показателя IgA слюны.
Изучили связь длительности акне с иммунологическими показателями. Длительность заболевания влияла на уровень некоторых иммунологических показателей (CD4+ abs, IgA крови,s IgA слюны) при более тяжелых формах акне.
Оценили влияние наследственной отягощенности акне на значения иммунологических показателей. Сильная тенденция к различию выявлена у показателя sIgA слюны до лечения в общей группе пациентов (медиана при отсутствии наследственной отягощенности составила 180 и при ее наличии - 290, р=0,054).
При распространенных формах акне показатель CD3+ abs был ниже,чем при локализованных (1100,0±60,3 и 1373,3±102,6 соответственно, p=0,03). Наиболее низкие значения CD3+ abs выявлены у пациентов с акне при отсутствии сопутствующих заболеваний, а максимальные - при заболеваниях верхних дыхательных путей в анамнезе (857,2±94,5 и 1365,3±94,8 соответственно, р=0,006).
Полученные данные подчеркивают значимую роль иммунного дисбаланса в патогенезе акне, а также указывают на то, что дисбактериоз - это не только микробиологическая, но и иммунологическая проблема. Это подтверждает данные литературы о том, что одной из важных функций желудочно-кишечного тракта является участие в формировании общей иммунобиологической реактивности организма [Онищенко Г.Г., Алешкин В.А.,2002]. Анализируя это, необходимо учитывать значительное взаимное влияние между микробиоценозом кишечника, системой местного иммунитета и изменением общего иммунного статуса в целом. Это диктует необходимость динамического контроля за состоянием иммунной системы у больных акне и важность коррекции изменений в составе кишечной микрофлоры в сочетании с коррекцией иммунных нарушений.
Для коррекции иммунных нарушений был выбран новый отечественнный иммуннокоррегирующий препарат Гепон. В отличие от большинства иммунномодуляторов Гепон применяется местно. Он легко всасывается эпителиями и слизистыми оболочками и активизирует местный иммунитет, эффективно повышая способность тканей к защите от инфекции и к регенерации.
Оценивали действие иммуномодуляторов на повышение исходно низких и снижение исходно высоких значений показателей клеточного и гуморального звеньев иммунитета (деление проведено условно вне зависимости от нормальных значений показателей). В основной группе (2) при использовании пробиотиков и Гепона выявлено иммуномодулирующее действие препаратов на показатели клеточного и гуморального звеньев иммунитета после лечения. Это проявлялось в снижении условно высоких исходных значений абсолютного содержания субпопуляций лимфоцитов с маркерами CD3+, CD4+, CD8+, CD72+ и sIgA в слюне, а также в повышении относительного содержания CD72+ и содержания IgA в сыворотке крови. У пациентов с низким уровнем отмечена тенденция к увеличению CD3+, CD4+, CD16+ и существенное увеличение CD72+ и IgA в крови. При использовании пробиотиков (без Гепона) в 3-й группе отмечались повышение относительного и абсолютного содержания исходно низких значений CD3+, CD4+, абсолютного содержания CD8+, а также снижение исходно высоких значений абсолютного содержания CD16+ и sIgA. Таким образом, как в основной группе, так и в группе сравнения выявлено иммуномодулирующее действие препаратов на показатели гуморального и клеточного звеньев иммунитета. При использовании обоих методов лечения, основанных на непарентеральном введении иммуномодулярующих препаратов, выявлено иммунокоррегирующее их действие на такой важный показатель мукозального иммунитета, как содержание sIgA в слюне.
Достигнутый результат лечения при обеих схемах сопровождался стабилизацией показателей, заметно уменьшался разброс показателей. У больных 2-й степени тяжести исходно высокие и низкие значения показателей чаще достигали значения нормы, чем у пациентов 3-й степени тяжести. При лечении по обеим схемам различия показателей в целом были слабо выражены, однако во 2-й группе исходно низкие значения чаще стабилизировались, а исходно нормальные чаще оставались таковыми после лечения. В 3-й группе исходно высокие значения снижались интенсивнее. Таким образом, как в основной группе, так и в группе сравнения выявлено иммуномодулирующее действие препаратов на показатели гуморального и клеточного звеньев иммунитета. Определение показателей до лечения позволит выбрать подходящую схему лечения.
Следует также отметить,что во 2-й группе число пациентов с полным излечением дисбактериоза кишечника составило 20% по сравнению с 3-й группой (11,1%), что примерно в 2 раза больше. Регресс условно-патогенной флоры в результате лечения наблюдался во 2-й группе в 1,4 раза чаще, чем в 3-й. Однако различия статистически недостоверны, возможно, из-за небольшого числа наблюдений (р=0,5 в первом случае и р=0,16 - во втором), так как повторный анализ кала на дисбактериоз через месяц после окончания терапии сдали только 50% пациентов.
«Факторный» анализ показателей крови и слюны и степени тяжести после лечения не показал изменения структуры связей между ними, выявленной до лечения у пациентов с акне, что подтверждает рецидивирующий характер заболевания.
Результаты лечения
У пациентов 2-й группы, получавших лечение роаккутаном в сочетании с Гепоном и пробиотиками, улучшение уже наступило через 1 неделю у 30%, через 2 недели - у 45% и через 3 недели - у 25% пациентов, что составляло в среднем 2,2±0,3 недели. Медиана клинического выздоровления составила 16 единиц (минимальное и максимальное значения составили 6-24 единицы, среднее - 14,2±1,0 недели).
Улучшение клинических проявлений акне в 3-й группе через 1 неделю отметили у одной пациентки, через 2 недели - у 8 пациентов, через 3 недели - у одного пациента, через месяц – у 17 пациентов, через 2 месяца – у одного пациента. Средний срок наступления улучшения в 3-й группе составил 3,2±0,2 недели, в 4-й группе - 9,8±1,0 недели; клинического выздоровления - 15,6±0,7 недели и 22,2±1,0 недели соответственно. Таким образом, у всех находящихся под наблюдением пациентов, принимавших роаккутан, было достигнуто клиническое выздоровление, но в разные сроки (табл.5).
Таблица 5
Статистические характеристики результатов лечения у больных акне
в группах с различными схемами лечения
| Схема лечения | (n) | Улучшение | Значительное улучшение | Клиническое выздоровление | |||
| M±m недели | Медиана, (пределы колебания) | M±m недели | Медиана (пределы колебания) | M±m недели | Медиана (пределы колебания) | ||
| 2 группа | 38 | 2,2±0,3 | 2 (1-4) | 6,1±0,7 | 4 (2-12) | 14,2±1,0 | 16 (6-24) |
| 3 группа | 22 | 3,2±0,2 | 4 (1-4) | 6,9±0,3 | 8 (4-8) | 15,6±0,7 | 16 (8-20) |
| 4 группа | 13 | 9,8±1,0 | 12 (4-12) | 14,7±1,2 | 16 (8-20) | 22,2±1,0 | 20 (16-24) |
Достоверно различались сроки наступления улучшения во 2-й и 3-й группах (р=0,025), высокодостоверно с 4-й группой (р=0,000001). Срок наступления значительного улучшения во 2-й и 3-й группах статистически не различался (р=0,3), однако высокодостоверно различался в 4-й группе (р=0,00001). Срок клинического выздоровления статистически не различался во 2-й и 3-й группах (р=0,2), однако высокодостоверно был больше в 4-й группе (р=0,0001), что связано с более длительным приемом роаккутана: во 2-й и 3-й группах (14,2±1,0 и 15,6±0,7 недели ) и 4-й группе (22,2±1,0 недели) (рис.6).
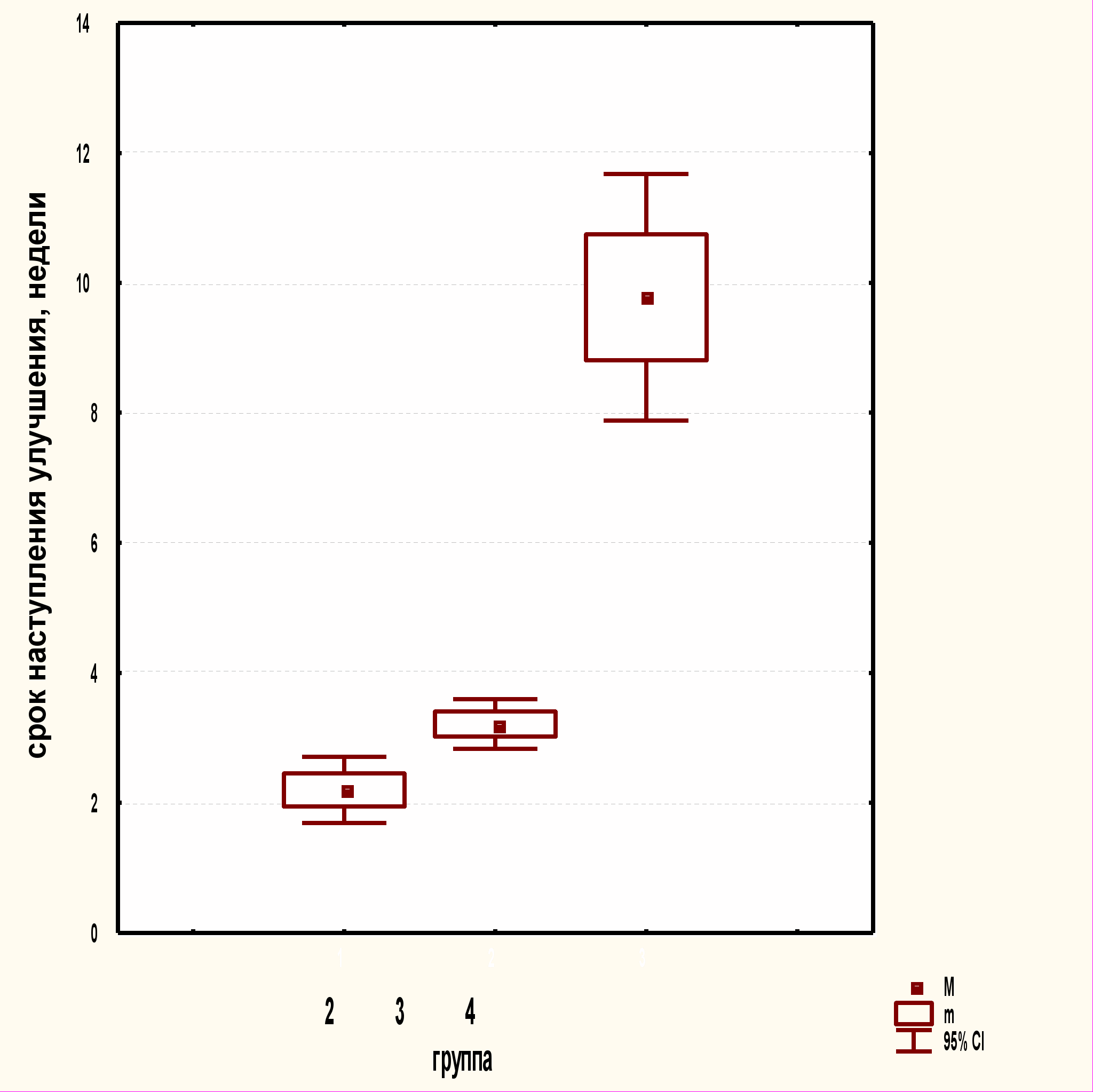
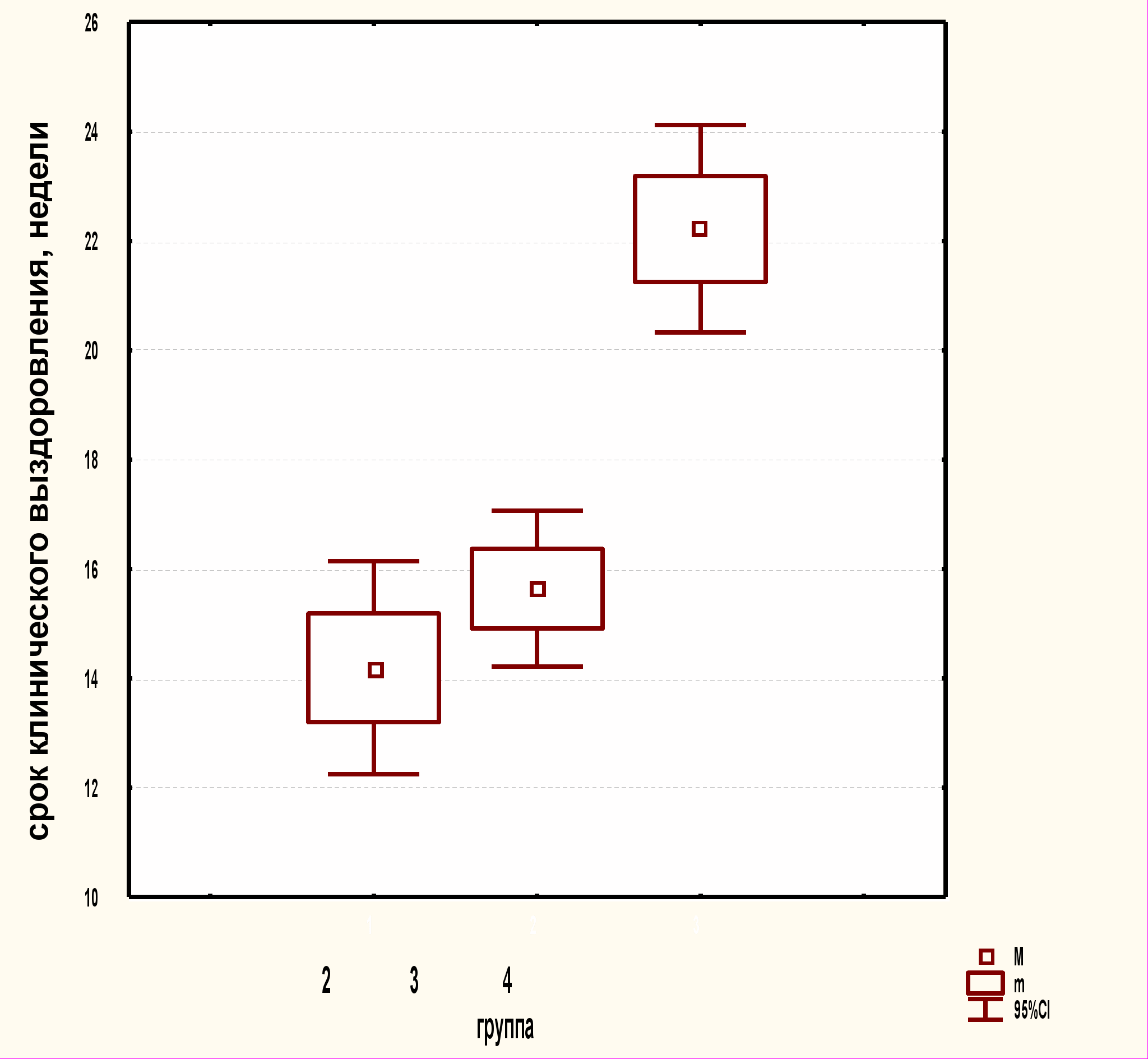
Рис.6. Сроки наступления улучшения и клинического выздоровления
у пациентов в различных группах (среднее значение, его ошибка
и 95% доверительные интервалы)
Обострение кожного процесса в течении первого месяца лечения имело место у 4-х пациентов (20%) 2-й группы, у 18 (64,3%) пациентов 3-й группы и у 9 (69%) 4-й группы. Сроки наступления улучшения и наличие или отсутствие обострений на фоне приема роаккутана сказываются на комплаентности терапии. Пациенты с менее тяжелыми формами акне могут хуже, с уменьшением комплаентности, переносить терапию роаккутаном по сравнению с пациентами с тяжелыми формами акне. Комплаентность терапии изотретиноином таким образом выше во 2-й группе, где были наименьшее число обострений и самый короткий срок наступления улучшения и клинического выздоровления. Это подчеркивает важность и целесообразность комплексной терапии больных папулопустулезными акне с применением пробиотиков, Гепона и роаккутана.
Суммарная доза роаккутана во 2-й, 3-й и 4-й группах различалась. Так, у пациентов 2-й и 3-й групп она составляла 52,75±2,4, медиана 52,2 (пределы 40-76), в то время как у больных 4-й группы - 120,95±4,5 , медиана 121 (пределы 106,4–139,7). Различия в группах высоко достоверны (р=0,0000001). Более низкие дозы роаккутана не оказывали отрицательного влияния на продолжительность лечения и выраженность эффекта во 2-й группе. Более того, при оценке эффективности терапии необходимо учитывать, что во 2-й группе наблюдалось больше пациентов с тяжелым течением акне.
Важной клинической характеристикой при назначении дозы и оценке переносимости роаккутана являются побочные эффекты, что во многом объясняет отказ пациентов от приема препарата, с одной стороны, и осторожное применение роаккутана врачами клинической практики, - с другой. Побочные эффекты были наиболее выражены у пациентов 4-й группы, в меньшей степени - у пациентов 2-й и 3-й групп, что является объективным клиническим критерием целесообразности комбинированной терапии пациентов указанных групп по сравнению с монотерапией роаккутаном (рис.7).
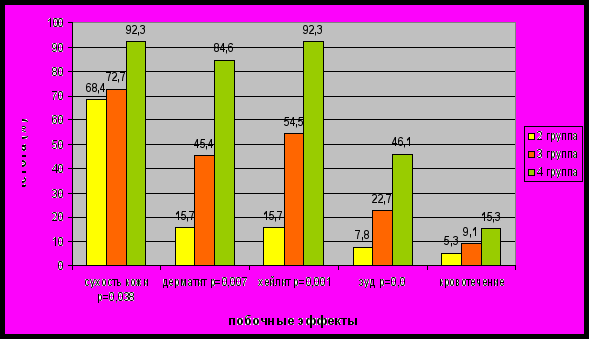
Рис.7. Частота выявления различных осложнений в группах с разными
схемами лечения
Системных побочных эффектов, которые послужили бы поводом для отмены препарата, не было ни в одной группе. Наиболее показательным является низкое число больных во 2-й группе с проявлениями хейлита (15,7%) по сравнению с показателями больных 3-й (54,5%) и 4-й (92,3%) групп и ретиноидного дерматита (15,7%,45,4% и 84,6% соответственно).
Достоверность различий частоты развития осложнений во 2-й, 3-й и 4-й группах составила: симптом сухость кожи (р=0,038); дерматит ( р=0,007); хейлит (р=0,001); зуд ( р=0,02).
Эффективность лечения во 2-й группе, по данным отдаленных результатов лечения, составила 89,5%, в 3-й – 77,3%, в 4-й – 77% (табл.6).
Таблица 6
Статистические характеристики сроков наступления рецидива
у больных акне в группах с различными схемами лечения до 18 месяцев
| Группы | Срок наступления рецидива | ||
| Число больных | M±m (недель) | Медиана, (пределы колебания) | |
| 2 | 4 (10,5%) | 36,9±2,7 | 40 (20-48) |
| 3 | 5 (22,7%) | 30,7±2,7 | 28 (28-36) |
| 4 | 3 (23%) | 38,6±1,8 | 39 (37-41) |
Достоверно реже выявляли наступление рецидива во 2-й группе по сравнению с 3-й и 4-й группами ( р=0,02).
На основании полученных данных достоверно показано, что комбинированная терапия роаккутаном с применением Гепона и пробиотиков позволила сократить его суммарную дозу, снизить процент обострения в начале лечения, существенно уменьшить число побочных эффектов, сократить длительность лечения, нормализовать иммунологические и дисбиотические нарушения, а также добиться длительной клинической ремиссии у 89,5 % больных, что является доказательством обоснованного включения Гепона и пробиотиков в комплексную терапию больных папулопустулезными акне.
