Оптимизация инновационных технологий трансфузионного пособия пациентам регионального детского онкогематологического центра 14. 00. 29 Гематология и переливание крови 14. 00. 09 Педиатрия
| Вид материала | Автореферат |
- Красняков Владимир Кириллович Совершенствование донорства крови и ее компонентов, 921.41kb.
- Аллогенная трансплантация гемопоэтических стволовых клеток в лечении врожденных и приобретенных, 1375.99kb.
- Молекулярно-генетическая диагностика и дифференцированная терапия гистиоцитарных пролиферативных, 1448.67kb.
- Прямое переливание крови (методические рекомендации), 154.15kb.
- Факторы риска и контроль вирусных инфекций после трансплантации гемопоэтических стволовых, 767.07kb.
- Неопухолевые лимфаденопатии. 14. 00. 29 гематология и переливание крови, 1061.02kb.
- Обеспечение качества получения и клинического применения компонентов крови в субъекте, 404.49kb.
- кальцинированный аортальный стеноз-состояние системного гемостаза и реологических, 538.36kb.
- Молекулярно-генетическая природа первичных гемофагоцитарных лимфогистиоцитозов в россии, 381.26kb.
- Цитологические особенности вторичных миелодисплазий при лимфомах 03. 00. 25 гистология,, 526.98kb.
Оптимизация, внедрение и оценка мероприятий по повышению биобезопасности реципиентов при клиническом использовании компонентов и препаратов крови
Для профилактики иммунологических реакций и осложнений любая трансфузия крови должна быть изосерологически совместимой, но не всегда просто подобрать пару донор-реципиент. За 4 года были изучены все протоколы по определению группы крови и резус-принадлежности у пациентов в ЧОДКБ. Как оказалось, сложности при определении групповой принадлежности по АВО (наличие разновидности антигена А – А1 и А2, определение неспецифических и АВО-антител, трансфузионная химера и др.) встречаются с такой же частотой, как резус-отрицательная принадлежность. Таким образом, риск развития изосерологических осложнений имеет место более чем в 31% случаев.
На современном программном лечении у детей с заболеваниями крови и злокачественными новообразованиями значительно повысились как продолжительность жизни (в зависимости от заболевания и его стадии), так и общая выживаемость. В связи с этим возрастает значение мер, направленных на минимизацию иммунологических последствий гемотрансфузий, которые могут возникнуть во время лечения или через какое-то время после него.
В целях профилактики изосерологических осложнений пациентам ЧДОГЦ все плановые переливания эритроцитсодержащих трансфузионных сред в последние 10 лет по возможности проводятся с подбором по фенотипу эритроцитов или с индивидуальным подбором при каждой повторной трансфузии. Среднегодовой показатель доли переливаний с индивидуальным подбором более 75% (от 64% до 88,3% в разные годы) позволил не допустить случаев появления иммунологических осложнений.
В ЧДОГЦ всегда предпочтительно используются эритроцитсодержащие ТС, минимально контаминированные лейкоцитами (эритроцитная масса, размороженная и отмытая, ЭМОЛТ и эритроцитная масса фильтрованная). Доля их от общего количества эритроцитсодержащих ТС зависит от текущих запросов ЧДОГЦ (от 84% в 1998 г. до 94% в 2007 г.), в итоге более 90% эритроцитов, перелитых пациентам ЧДОГЦ, прошли различной степени лейкодеплецию.
СЗП в практике ЧДОГЦ применяется в ограниченных объемах – за последние 10 лет около 105 + 46 трансфузий в год, при этом среднегодовой объем потребленной пациентами плазмы 22 725 + 11 250 мл. Среднегодовые объемы СЗП сократились в связи с применением ФСК IX и рекомбинантного VII фактора. В 2004 г. ЧОСПК смогла приступить к карантинизации плазмы и с 2005 г. ЧДОГЦ получает для своих пациентов только карантинизованную СЗП.
В ходе предыдущего исследования в 2003 г. методом «анализа полезности затрат» была доказана экономическая целесообразность замены КП на препараты ФСК VIII, значительно более биологически безопасные (плазменные, не менее чем дважды вирусинактивированные, или рекомбинантные). Постепенно, к 2006 г. препараты ФСК VIII и IX уже полностью заменили КП и СЗП в заместительной терапии у больных гемофилией А и В, а ЧОСПК прекратила выпуск КП - препарата высокого гемотрансмиссивного риска, высвободив этим значительные донорские ресурсы и производственные мощности.
Методом «анализ эффективности затрат» также в ходе предыдущего исследования были экономически обосновано приобретение сепараторов клеток крови для заготовки ТК методом непрерывного донорского тромбоцитафереза. Неоспоримые клинические преимущества данное внедрение имеет перед ТК, приготовленным из дозы заготовленной крови: наибольшая клиническая эффективность и значительный посттрансфузионный прирост, повышение биобезопасности реципиентов за счет уменьшения контакта пациента с большим числом доноров и уменьшения уровня контаминирования лейкоцитами ТС, экономия и перераспределение донорских ресурсов и др. Так, на 2007 г. в ЧДОГЦ уже 79,4% ТК, перелитого детям с онкогематологическими заболеваниями, было заготовлено на сепараторах клеток крови. В результате значительно повысились степень удовлетворения потребности в ТК и качество заместительной терапии. Уменьшение контактов больного с большим количеством доноров и сепараторная лейкоредукция уменьшили риск развития иммунологических и гемотрансмиссивных осложнений от трансфузий ТК. Для пациентов ЧДОГЦ максимально проводится подбор ТК по системе НLА и индивидуальной совместимости. В результате за весь период наблюдения антитромбоцитарные антитела были обнаружены только у трех трансфузионнозависимых пациентов с диагнозами: ан. Фанкони, ПАА, ОМЛ в рецидиве).
В продолжение работы по повышению биобезопасности реципиентов гемокомпонентов в ЧДОГЦ приобретена и запущена в эксплуатацию установка RADGIL для гамма-облучения крови и ее производных. Впервые в регионе на базе ЧДОГЦ начато облучение клеточных компонентов крови для профилактики клинически значимой посттрансфузионной РТПХ в стандартном режиме 25 Грей за 30 минут на установке RADGIL. Источником гамма-облучения в этом виде оборудования является рентгеновская трубка.
В настоящее время отсутствуют утвержденные медицинские стандарты для данной технологии. Существующий радиологический контроль не подтверждает эффективность воздействия гамма-излучения на витальные функциии Т-лимфоцитов, для этого применяются дорогостоящие и трудоемкие культуральные и генетические исследования, неприемлемые для скрининга гемокомпонентов. В связи с этим было проведено пилотное исследование по биомониторингу витальности лимфоидных клеток в гемотрансфузионных средах до и после гамма-облучения (табл. 30). В качестве модели была взята эритроцитная масса (нефильтрованная), индикативной методикой была апробирована проточная четырехцветная цитометрия с «7-Amino-actinomycin D».
Таблица 30. Содержание иммунокомпетентных клеток в образцах периферической крови доноров до и после воздействия гамма-облучения (в режиме СОД 24 Грей за 25 мин.)
| Показатели (единицы измерения) | До облучения | Через 24 ч | |
| Опыт (после облучения) | Контроль (без облучения) | ||
| n=25 | n=25 | n=25 | |
| Живые клетки (7AAD-) (%) | 99,43±0,01 * ** | 79,4±0,49 | 77,75±1,19 |
| Лейкоциты (абс.) | 6,7±0,07 * ** | 5,6±0,11 | 5,85±0,09 |
| Лимфоциты (7AAD-CD45+CD14-) (абс.) | 1,84±0,09 * ** | 1,23±0,06** | 1,42±0,07 |
| Т-лимфоциты (7AAD-CD45+CD3+CD19-) (абс.) | 1,44±0,08 * ** | 1,01±0,07 | 1,18±0,08 |
| Т-хелперы (7AAD-CD45+CD3+CD4+CD8-) (абс.) | 0,94±0,05 * ** | 0,62±0,03** | 0,74±0,04 |
| Т-NK-клетки (7AAD-CD45+CD3+(CD16+CD56)+) (абс.) | 0,06±0,01 * ** | 0,02±0,001** | 0,03±0,002 |
Примечания: в таблице приведены только значения, имеющие достоверные отличия с пробой до облучения и контролем; использовали критерий Манна-Уитни; применяли поправку Бонферрони для множественных сравнений; отличия считали достоверными при р<0,017; * - достоверные отличия от показателей через 24 ч после облучения; ** - достоверные отличия от показателей контрольной группы через 24 ч без предварительного облучения.
Через 24 ч после гамма-облучения образцов периферической крови доноров достоверно снизились процентное число живых клеток (7AAD- клетки) (р=0,000001) и абсолютное количество жизнеспособных лейкоцитов (р=0,000001), лимфоцитов (CD45+CD14-) (р=0,000001), Т-лимфоцитов (CD45+CD3+CD19- клетки) (р=0,000001), В-лимфоцитов (CD45+CD3+CD19- клетки) (р=0,000001), Т-хелперов (CD45+CD3+CD4+CD8- клетки) (р=0,000001), Т-цитотоксических (CD45+CD3+CD4-CD8+ клетки) (р=0,0006) и Т-лимфоцитов с функциями естественных киллеров (CD45+CD3+(CD16+CD56)+ клетки) (р=0,000001), естественных киллеров (CD45+CD3-(CD16+CD56)+ клетки) (р=0,007).
Наибольшая чувствительность к воздействию ионизирующего облучения отмечена у Т-хелперов и Т-лимфоцитов с функциями естественных киллеров, непосредственных участников РТПХ, что проявилось в значимом снижении абсолютного количества данных субпопуляций лимфоцитов не только по сравнению с опытными образцами периферической крови (до облучения), но и по сравнению с контрольными (через 24 ч без предварительного облучения) (р=0,003 и р=0,0004, соответственно). Не отмечено существенного влияния ионизирующего облучения на Т-цитотоксические лимфоциты, В-лимфоциты и естественные киллеры (р>0,017).
Гамма-облучение гемокомпонентов, позволяющее снизить риск развития посттрансфузионной РТПХ и аллоиммунизации у иммунокомпромитированных пациентов, стало то не только следующей ступенью в повышении качества трансфузионного пособия в регионе, но и необходимым этапом на пути внедрения клеточных технологий.
Оценка эффективности применения стимуляторов гемопоэза и ИГВВ в региональном Челябинском детском онкогематологическом центре
А) Использование эритропоэтина:
За период с 1.01.2002 г. по 31.12.2007 г. в ЧДОГЦ для купирования анемического синдрома 38 пациентов с онкогематологическими заболеваниями получили курсы эритропоэтина (EPO).
В структуре пациентов, получавших EPO по поводу анемического синдрома в качестве частичной или полной альтернативы гемотрансфузиям наибольшую долю составили пациенты с ОЛЛ (табл. 16).
Таблица 16. Структура пациентов, получавших лечение ЕРО (2002-2007 гг., ЧДОГЦ)
| № п/п | Диагноз | Количество пациентов | Доля в процентах |
| 1 | Острый лимфобластный лейкоз (ОЛЛ) | 25 | 65,78% |
| 2 | Миелодиспластический синдром (МДС) | 1 | 2,6% |
| 3 | Анемия Блекфана-Дайемонда | 2 | 5,27% |
| 4 | Саркома Юинга/ПНЭО | 4 | 10,54% |
| 5 | Нефробластома | 2 | 5,27% |
| 6 | Нейробластома | 4 | 10,54% |
| Всего | 38 | 100% | |
Результаты лечения ЕРО были в значительной степени зависимыми от нозологии. В 6 случаях (4 - с ОЛЛ и 2 - с солидными опухолями) EPO составил переливаниям крови полную, для остальных 30 детей - частичную альтернативу. В числе последних 30 были пациенты, получившие от 1 до 4 трансфузий эритросодержащих гемокомпонентов по жизненным показаниям, тяжесть анемического синдрома и основное заболевание не позволяли дожидаться клинического ответа на ЕРО - тогда эти пациенты уже не нуждались в донорских эритроцитах. У пациентов с анемией Блекфана-Дайемонда (2 случая) EPO был не эффективен.
Б) Применение препаратов гранулоцитарного колониестимулирующего факторов:
В ЧДОГЦ программное лечение детей с онкогематологическими заболеваниями проводится с 1992 г., и для первичной и вторичной профилактики нейтропении систематически применяется G-CSF. В ходе изучения опыта использования G-CSF в ЧДОГЦ был проведен анализ всех эпизодов его применения за 4 года (2003-2006 гг., всего – 466 эпизодов). За указанный период 136 пациентов получили разное количество курсов G-CSF вариабельных по дозам и продолжительности. Пациенты были в возрасте от 6 мес. до 15 лет (медиана - 7 лет 9 мес.), они составили 61% от впервые выявленных онкогематологических больных, соотношение мальчиков и девочек 1,15 : 1. Средняя продолжительность курса составляла 5-7 дней и зависела от сроков достижения необходимого/безопасного абсолютного количества нейтрофилов в контрольном анализе крови. При тяжелой нейтропении параллельно G-CSF с целью профилактики или лечения «фебрильной нейтропении» назначалась заместительная терапия ИГВВ.
Количество курсов G-CSF у пациентов было от 1 до 15, в среднем на 1 больного 3-4 курса, около трети пациентов (43 человека) получили по 1 курсу, остальные получали G-CSF повторно. Пациентами, получившими более 5 курсов G-CSF были больные с остеогенной саркомой, саркомой Юинга/ПНЭО и нейробластомой. Пациенты с лимфомами, острым миелобластным лейкозом, герминогенными опухолями получали по 2-4 курса G-CSF, по 1-2 курса - пациенты с острым лимфобластным лейкозом. Последним G-CSF назначался только при подтвержденной ремиссии основного заболевания, кроме того все эти пациенты были рецидивные или из группы высокого риска на протоколе МВ-2002. Лечение остальных опухолей, таких как ретинобластома, нефробластома, не-В-клеточная лимфома, б-знь Ходжкина и некоторые другие, редко сопровождалось тяжелыми нейтропениями с использованием G-CSF. Продолжительность курсов у каждого пациента зависела от степени миелотоксичности цитостатической терапии, состояния костного мозга на данном этапе течения заболевания, тяжести и порядкового номера нейтропении.
За исследуемый период не было зарегистрировано случаев, когда препараты G-CSF были не эффективны или вызвали побочные реакции. Использование G-CSF при проведении интенсивной ПХТ (эскалация доз, уменьшение интервалов между курсами) позволяет сократить сроки восстановления гемопоэза, снизить частоту и тяжесть инфекционных осложнений (Welte K. et all., 1996; Строяковский Д.Л., 2006), что соответственно сокращает объемы сопроводительной терапии, в том числе и потребление гемокомпонентов (Engelhardt M. et al., 1999; Масчан А.А, 2006; Самочатова Е.В., 2007).
Главным итогом применения G-CSF для лечения первичной или вторичной нейтропении у детей с онкогематологическими заболеваниями в ЧДОГЦ является то, что в сочетании с/без заместительной терапией ИГВВ G-CSF составил полную альтернативу лейкоконцентрату.
В) Опыт применения иммуноглобулина внутривенного в практике регионального детского онкогематологического центра
ИГВВ используется в лечении пациентов ЧДОГЦ с 1998 г. Начиная с 2003 г., объем его потребления вырос с 60 до 6 000 граммов сухого вещества в 2008 г.
За 2004-2007 гг. был зарегистрирован 1181 эпизод применения ИГВВ - перелито 157 900 мл ИГВВ (7895 граммов сухого вещества). Расчет сделан на сухое вещество, т.к. были использованы препараты разных производителей «ИГВВ» (Микроген, Нижний Новгород), «Хумаглобин» (А/О ХУМАН, Венгрия), «Иммуновенин» (Уфа), «Октагам» (Октафарма, Австрия), «Пентаглобин» (Биотест Фарма, Германия).
ИГВВ, как препарат, обладающий широким спектром опсонизирующих и нейтрализующих антител, в практике ЧДОГЦ применяется в следующих ситуациях: при лечении иммунной тромбоцитопенической пурпуры (ИТП), для профилактики гнойно-септических осложнений (при нейтропении) и их лечения (рис. 17).
Наиболее часто им лечили гнойно-септические осложнения.
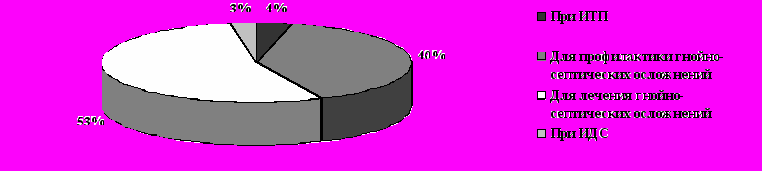 Рис. 17. Структура эпизодов применения ИГВВ (2003-2007 гг., ЧДОГЦ)
Рис. 17. Структура эпизодов применения ИГВВ (2003-2007 гг., ЧДОГЦ)ИГВВ в профилактике и лечении гнойно-септических осложнений:
Основным показанием для заместительной терапии препаратами внутривенных иммуноглобулинов в онкогематологии является состояние фебрильной нейтропении, на фоне которого быстро развивается неуправляемая бактериемия. В таких ситуациях принято применять комплекс антибактериальных, антимикотических и противовирусных препаратов системного и локального действия, стимулировать гранулоцитопоэз G-CSF. Всего в ЧДОГЦ имели место 472 случая применения ИГВВ для профилактики гнойно-септических осложнений у пациентов с онкогематологическими заболеваниями в состоянии нейтропении, это составило около 21% от всего потребленного ИГВВ (1736 г). Длительность курса ИГВВ в таких ситуациях зависела от длительности нейтропении (от 3-х до 5 дней).
Для лечения гнойно-септических осложнений ИГВВ в ДОГЦ стали применять с 2004 г. В этих целях при продолжительности курса 5-7 дней было израсходовано всего 4606,25 г ИГВВ, что составило 58% от общего объема. В случае применения ИГВВ сокращается длительность применения G-CSF, противогрибковых и антибактериальных средств.
Результаты применения ИГВВ при иммунной тромбоцитопенической пурпуре:
Сложное блокирующее действие ИГВВ на клетки ретикулогистиоцитарной системы уже более 20 лет используется для лечения иммунной патологии, в том числе – при ИТП. Ретроспективно проанализированы все случаи применения ИГВВ в ЧДОГЦ за 2002-2007 гг. у детей с острой и хронической ИТП, изучен режим его дозирования и введения, эффективность. Группа составила 27 человек. Больные были в возрасте от 1 до 12 лет (медиана – 3,5 года), соотношение мальчиков и девочек было 1,4 : 1. Всего на лечение ИТП было использовано 19% от общего объема (1552,75г).
Методика терапевтического протокола была постоянной: применялся ИГВВ из расчета 2 грамма сухого вещества на 1 кг массы тела за 24 часа внутривенно со скоростью от 8 до 12 мл в час. Уже в первые сутки от начала инфузии ИГВВ у всех пациентов отмечалась положительная динамика – прекращалась кровоточивость. На 3 сутки, после окончания инфузии ИГВВ у всех пациентов было зарегистрировано повышение числа тромбоцитов до 50 х 109/л и более. В последующем у 21 пациента из 27 - полная гематологическая ремиссия сохранялась 12 и более мес., у 3 пациентов - через 6-9 мес. наблюдения отмечено снижение тромбоцитов ниже нормы до 70 х 109/л (без клинических проявлений), у 3 пациентов - ИТП приняла хроническое течение с рецидивами геморрагических проявлений и снижением тромбоцитов до единичных. Однако и у последних трансфузии ИГВВ имели положительный клинический эффект – купировали клинику тяжелого геморрагического синдрома.
Анализ отдаленных результатов показал, что в 77,8% случаев применения ИГВВ при острой (тяжелой) иммунной тромбоцитопенической пурпуре у больных достигнута полная гематологическая, в 22,2% - клиническая ремиссия.
Динамическая оценка частоты посттрансфузионных реакций/осложнений у пациентов ЧДОГЦ и реактогенности трансфузионных сред (1998-2007 гг.)
За 1998-2007 гг. в ЧДОГЦ абсолютные количества трансфузий и посттрансфузионных реакций/осложнений были разными, частота последних колебалась от 4,13% до 1,32% (M + m = 2,72 + 1,4%) (табл. 17).
Таблица 17. Количество трансфузий и посттрансфузионных реакций (ЧДОГЦ, 1998–2007 гг.)
| Год | Количество трансфузий | Посттрансфузионные реакции и осложнения | |
| абсолютное число | % случаев | ||
| 1998 | 1335 | 31 | 2,32 |
| 1999 | 1458 | 29 | 1,99 |
| 2000 | 1109 | 21 | 1,89 |
| 2001 | 1063 | 22 | 2,11 |
| 2002 | 922 | 19 | 2,01 |
| 2003 | 848 | 35 | 4,13 |
| 2004 | 944 | 23 | 2,44 |
| 2005 | 1279 | 24 | 1,88 |
| 2006 | 1217 | 19 | 1,56 |
| 2007 | 1289 | 17 | 1,32 |
| Всего | n = 11464 | n = 240 | 2,09 (M + m = 2,72 + 1,4) |
В последние годы этот показатель стал достоверно снижаться за счет перехода на препараты ФСК и нарастания объема тромбоконцентрата, производимого на сепараторах клеток крови.
По своему характеру все остальные можно отнести к так называемым «посттрансфузионным реакциям». Среди них пирогенные реакции составили - 53%, аллергические – 45,3% и анафилактические 1,7% (табл. 18).
Таблица 18. Посттрансфузионные реакции (ЧДОГЦ, 1998–2007 гг.)
| № | Виды посттрансфузионных реакций | Абсолютное число | % от общего числа |
| 1 | анафилактическая реакция | 4 | 1,67 % |
| 2 | отек Квинке | 15 | 6,25 % |
| 3 | крапивница | 48 | 20 % |
| 4 | аллергический дерматит | 37 | 15,41 % |
| 5 | лихорадка (в т. ч. с ознобом) | 121/29 | 50,42 % |
| 6 | головная боль | 6 | 2,5 % |
| 7 | прочие (боли в животе, рвота, др.) | 9 | 3,75 % |
| 8 | всего | n = 240 | 100 % |
Переливание компонентов и препаратов крови было в разной степени реактогенным, причина - в технологии изготовления трансфузионной среды и степени контаминации лейкоцитами (табл. 19).
Таблица 19. Реактогенность трансфузионных сред (ЧДОГЦ, 1998–2007 гг.)
| № | Наименование ТС | Количество посттрансфузионных реакций | РеактогенностьТС (на 100 трансфузий) | |
| абсолютное | % от общего | |||
| 1 | Эритроцитная масса | 7 | 2,92 | 2,201 |
| 2 | ЭМОЛТ | 24 | 10 | 0,9036 |
| 3 | СЗП | 23 | 9,58 | 2,0683 |
| 4 | Тромбоконцентрат | 127 | 52,91 | 3,6768 |
| 5 | Криопреципитат | 59 | 24,59 | 2,734 |
| 6 | ФСК | 0 | 0 | 0 |
| 7 | Всего | n = 240 | 100% | 2,0936 |
Низкая реактогенность зарегистрирована у препаратов ФСК (0%), ЭМОЛТ (0,9%) и аппаратного ТК (только 3 случая, у пациентов с фебрильной нейтропенией). Наибольшее количество посттрансфузионных реакций было зарегистрировано после переливания ТК из дозы заготовленной крови (52,9%) и КП (24,6%) – трансфузионных сред, применение которых характеризуется самым высоким «полидонорством». Замена полидонорских КП и ТК на концентраты ФСК и аппаратный (монодонорский) ТК повысила трансфузионную безопасность наших реципиентов за счет ограничения контактов больного с кровью большого числа доноров и более эффективной лейкофильтрации. Более чем в 2,4 раза высокая реактогенность эритроцитной массы (2,2%) по сравнению с ЭМОЛТ (0,9%) также демонстрирует корреляцию реактогенности и уровня контаминирования ТС лейкоцитами.
Гемотрансмиссивные инфекции в практике ЧДОГЦ
Применение гемокомпонентной заместительной терапии при лечении онко- и гематологических заболеваний мера необходимая, но не всегда безопасная. Доказать гемотрансмиссивный путь заражения всегда не просто, т. к. не исключаются и другие пути инфицирования (Голосова Т.В., 2006).
В ЧДОГЦ имеются пациенты, успешно закончившие программное лечение по поводу ОЛЛ (3) и ОМЛ (1) в период с 1990 по 1995 гг. На 2008 г., уже в возрасте 21-29 лет, они имеют тяжелые клинические проявления гепатита С. Зарегистрированы и другие, серопозитивные по HBV и/или HCV пациенты, получившие в анамнезе многократные гемотрансфузии, но без клиники тяжелого гепатита.
После того, как в ЧДОГЦ была введена в 1995 г. сплошная вакцинация пациентов от гепатита В (для иммунокомпромитированных пациентов - двойной дозой вакцины Engerix B), ситуация с инфицированностью HBV изменилась. Позже эта вакцинация стала декретированной и включена в национальный календарь профилактических прививок.
Если в ЧДОГЦ на 1.01.2000 г. заместительную терапию КП регулярно получали до 75% от диспансерных пациентов с гемофилией А, то маркеры одного из гепатитов хотя бы однократно обнаруживались у 52,5% из них. С 1995 г. у пациентов с ВК выявлено только 5 случаев инфицированности (НВV – 2, HCV – 3), и это были пациенты, получавшие в анамнезе заместительную терапию КП или СЗП. Больным с ВК, диагностированными позже 2003 г., заместительная терапия проводилась только вирусинактивированными препаратами ФСК, всех их вакцинировали против гепатита В. На конец 2007 г., при обследовании методом ИФА 1-2 раза в год, гемотрансмиссивных инфекций (HIV, HBV и HCV) в этой подгруппе не обнаружено. Случаев инфицирования пациентов HIV в ЧДОГЦ не зарегистрировано, но был доказан один случай гемотрансмиссивной передачи CMV, закончившийся генерализованной инфекцией у иммунокомпромитированного больного.
Фармакоэкономический анализ трансфузионной помощи пациентам ЧДОГЦ
В борьбе за качество и безопасность компонентов и препаратов крови наше государство законодательно ограничило деятельность по заготовке, хранению и переработке крови только государственными учреждениями. Заботой о качестве трансфузионной помощи пациентам продиктовано и то, что все препараты крови для лечебных учреждений через систему «госзаказа» с 2008 года оплачиваются из бюджета. Раздел посвящен фармакоэкономике трансфузионного обеспечения регионального стационара для детей и подростков с онкогематологическими заболеваниями, включает в себя анализ финансовых затрат и донорских ресурсов, наглядную демонстрацию применения методов доказательной медицины для улучшения качества медицинского обслуживания группы больных с социально значимой патологией.
Анализ прямых материальных затрат на трансфузионное обеспечение пациентов ЧДОГЦ (1998-2007 гг.):
Проведенное исследование позволило изучить объемы, стоимость и структуру затрат на гемокомпонентную терапию у пациентов ЧДОГЦ за 1998–2007 гг.
Общие прямые затраты на трансфузионные среды, потребовавшиеся пациентам ЧДОГЦ за исследуемый период в ценах на 31.12.07 г. составили 51 085 424,50 рублей (табл. 20).
Таблица 20. Объемы и стоимость трансфузионных сред (1998–2007 гг., ЧДОГЦ)
| Наименование ТС | Объем за 10 лет | Цена (на 31.12.07) | Стоимость | % от общ. суммы |
| Эритроцитная масса | 72,46 л | 3311,08 руб./л | 23 992,85 руб. | 0,05 % |
| ЭМОЛТ | 658,7 л | 4804,80 руб./л | 3 164 921,70 руб. | 6,2 % |
| Тромбоконцентрат | 14 548 доз (727,4 л) | 1716 руб./доза | 24 964 368,00 руб. | 48,9 % |
| СЗП | 227,245 л | 5987,52 руб./л | 1 360 633,95 руб. | 2,7 % |
| Криопреципитат | 9901 дозы | 792 руб./доза | 7 841 592,00 руб. | 15,3 % |
| ФСК VIII | 924130 EД | 13,20 руб./ЕД | 12 198 516,00 руб. | 23,85% |
| ФСК IX | 98 800 ЕД | 15,5 руб./ЕД | 1 531 400,00 руб. | 3 % |
| Итого | 51 085 424,50 руб. | 100 % | ||
Из общих затрат на трансфузионные средства 48,9% пришлось на ТК, 6,25% - на эритроцитсодержащие среды, а на все корректоры гемостаза (СЗП, КП и ФСК) - 44,85 % .
Затраты на компоненты крови для каждой из нозологических групп неравные (табл. 21).
Таблица 21. Затраты на гемокомпоненты в разных нозологических группах (ЧДОГЦ, 1998–2007 гг.)
| № | Нозологическая группа | больных | затраты на ТО (рублей) | % от общего | из них на 1 б-го (руб.) | |
| Абс. (n) | % | |||||
| 1 | Геморрагические заболевания | 299 | 31 % | 21 843 420,60 | 42,8 % | 73 054,92 |
| 2 | Острые лейкозы | 327 | 34 % | 18 927 824,00 | 37,0 % | 57 883,25 |
| 3 | Анемии и др. | 135 | 14 % | 5 727 427,90 | 11,2 % | 42 425,40 |
| 4 | Лимфомы | 70 | 7,3 % | 2 470 812,30 | 4,9 % | 35 297,30 |
| 5 | Солидные опухоли | 132 | 13,7 % | 2 115 939,70 | 4,1 % | 16 029,85 |
| | ВСЕГО | 963 | 100 % | 51 085 424,50 | 100 % | 53 048,21 |
Максимальные затраты на трансфузионное обеспечение - 21 843 420,60 руб. (42,8% от общих) и затраты на одного больного - 73 054,92 руб. были в группе детей с геморрагическими заболеваниями. Самые низкие затраты на трансфузионное обеспечение оказались в группе солидных опухолей (в 4,5 раза меньше, чем при геморрагических заболеваниях).
За изученный период получены данные о среднегодовых потребленных объемах и стоимости каждой ТС (табл. 22).
Таблица 22. Среднегодовое потребление гемокомпонентов и ФСК (ЧДОГЦ, 1998–2007 гг.)
| № | Наименование ТС | Объем (мл, дозы в год) | Стоимость* (руб.) |
| 1 | Эритроцитная масса | 7 246 мл | 23 992,10 руб. |
| 2 | ЭМОЛТ | 65 870 мл | 316 492,20 руб. |
| 3 | СЗП | 2272,45 мл | 13 606,35 руб. |
| 4 | Тромбоконцентрат | 1455 доз | 2 496 780,00 руб. |
| Итого (без факторов свертывания крови) | 2 850 870,65 руб. | ||
| 5 | ФСК VIII | 231 032 ЕД | 3 049 628,80 руб. |
| 6 | ФСК IX | 16 000 ЕД | 248 000,00 руб. |
| Итого (с факторами свертывания крови) | 8 999 370,00 руб. | ||
* в ценах на 1.01.2008 г.
Полученные данные использованы для прогнозирования предстоящих потребностей в гемокомпонентах и ФСК, а также планирования затрат на их приобретение.
Определить прогнозируемые денежные затраты или потребности в гемокомпонентах на следующий год можно по следующей формуле: З общ = З ср х k, где: З общ - затраты общие (рублей или мл компонента крови), З ср - среднегодовые затраты (рублей или мл), k - коэффициент инфляции.
Так можно определить ожидаемые затраты на любой промежуток времени или ТС, при расчете на N-ное количество лет формула будет выглядеть несколько иначе: З общ = (З ср х N) х ( k х N). Реальный рост цен на компоненты крови за последние 5 лет более чем в 2 раза превышал темпы инфляции, следовательно, k не должен быть менее 30.
В 2008 г. был произведен расчет предполагаемых потребностей и затрат на 2009 г. с учетом расширения стационара ЧДОГЦ: коечный фонд должен увеличиться с 35 до 56 (на 60%), структура больных значительно не изменится. Имеющиеся показатели среднегодовой потребности позволили составить заявку, реально отражающую предполагаемую потребность ЧДОГЦ в 2009 г. по компонентам крови и факторам свертывания (табл. 23)
Таблица 23. Предполагаемая потребность ЧДОГЦ в гемокомпонентах и факторах свертывания крови на 2009 г. с учетом расширения коечного фонда
| № | Наименование ТС | Расчетный объем | Расчетная стоимость (руб.) |
| 1 | Эритроцитная масса | 11 590 мл | 49 887 руб. |
| 2 | ЭМОЛТ | 105 390 мл | 658 291 руб. |
| 3 | СЗП | 3 635 мл | 28 294 руб. |
| 4 | ТК | 2 330 доз | 5 193 764 руб. |
| Итого (без факторов свертывания крови) | 5 930 236 руб. | ||
| 5 | ФСК VIII | 369 651 ЕД | 6 343 211 руб. |
| 6 | ФСК IX | 25 600 ЕД | 515 840 руб. |
| Итого (с факторами свертывания крови) | 12 789 287 руб. | ||
Таким образом, при расширении коечного фонда на 60% и существующих за время исследования темпах роста цен, общие материальные затраты на трансфузионное обеспечение ЧДОГЦ в 2009 г. возрастут на 42% (с 8 999 370 до 12 793 287 рублей), а затраты на гемокомпоненты вырастут в 2 раза (с 2 850 870 до 5 930 236 рублей).
Анализ затрат донорских ресурсов на гемотрансфузионное обеспечение ЧДОГЦ
Донорские ресурсы относятся к категории затрат «трудно исчисляемых», поскольку содержат прямые и непрямые медицинские, немедицинские и социальные составные. Их трудно оценить в денежных единицах, но дефицит их реален и повсеместен. Экономия донорских ресурсов имеет и клинический аспект – «полидонорство» ( всего за 10 лет 963 реципиента получили 11464 трансфузии, в год на одного реципиента от 1 до 397, среднее - 11,9 трансфузии на одного реципиента) с проблемами гемотрансмиссивных инфекций и аллоиммунизации.
Затраты донорских ресурсов на трансфузионное обеспечение ЧДОГЦ за 1998-2007 гг. значительны (26 653 донора). По разным нозологическим группам на одного реципиента пришлось от 1 до 397 доноров, среднее арифметическое 27 (по годам M + m = 22,5 + 12,5) (табл. 24).
Таблица 24. Затраты донорских ресурсов на ТО по нозологических группам (ЧДОГЦ, 1998–2007 гг.)
| Нозологическая группа | Количество доноров | % от общего | Среднее на 1-го реципиента |
| Острые лейкозы | 10212 | 38,3% | 31 |
| Лимфомы | 1271 | 4,8% | 18 |
| Геморрагические заболевания | 10426 | 39,1% | 35 |
| Солидные опухоли | 1382 | 5,2% | 10 |
| Анемии и др. | 3362 | 12,6% | 25 |
| Всего | n = 26653 | 100% | 27 (M + m = 22,5 + 12,5) |
Безусловный лидер в донорских затратах за 10 лет - геморрагические заболевания, на них использована половина всех донорских ресурсов. Как видно из табл. 24, наибольшие донорские ресурсы 39% и 38% затрачены на группы больных с геморрагическими заболеваниями и острыми лейкозами, по количеству доноров на одного реципиента лидируют эти же группы (35 и 31 донор на одного реципиента из группы в среднем). Меньше всего доноров на 1 пациента (10) - в группе солидных опухолей. Обращает на себя внимание и другой показатель: за первые 5 лет исследованного периода 494 реципиента из ЧДОГЦ стали потребителями донорского материала от 17635 доноров, а за последние 5 лет – на 469 реципиентов затрачен материал от 9018 доноров (соответственно на 1 реципиента было за первые 5 лет – 36 доноров, а за последние - 19). При более подробном анализе потребления донорских ресурсов можно отметить резко отрицательную динамику в последние годы (рис. 18).
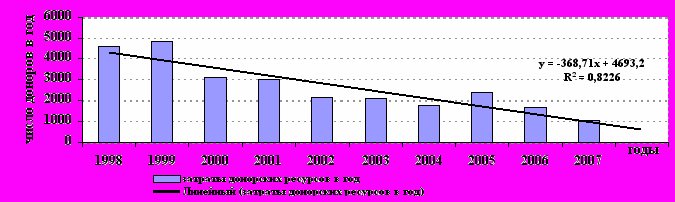
Рис. 18. Потребление донорских ресурсов (ЧДОГЦ, 1998–2007 гг.)
Внедрение сберегающих донорские ресурсы технологий позволило за второе пятилетие периода наблюдения почти в 2 раза сократить потребление донорских ресурсов. За годы исследования проспективно удалось получить снижение полидонорской нагрузки на одного реципиента (рис. 19).
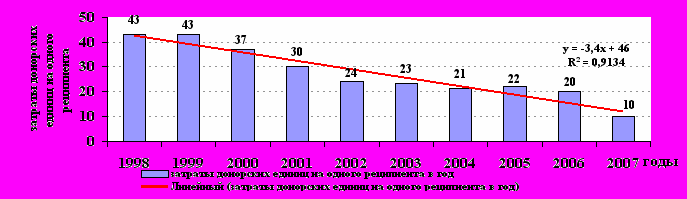 Рис. 19. Затраты донорских единиц на одного реципиента в год (1998-2007 гг., ЧДОГЦ)
Рис. 19. Затраты донорских единиц на одного реципиента в год (1998-2007 гг., ЧДОГЦ) За последние 10 лет масштабы «полидонорства» в ЧДОГЦ уменьшились более чем в 4 раза (тренд резко отрицательный): в 1998 г. на 1 реципиента приходилось 43 донора, а в 2007 г. - всего 10. Это сначала (1998-2001 гг.) происходило только за счет ограничения показаний к трансфузиям. В 2002-2003 гг. имело место уменьшение числа трансфузионнозависимых пациентов (лечились в других клиниках), и одновременно началась замена КП на ФСК. С 2004 по 2006 гг. на фоне роста численности реципиентов и их потребности в ТК показатель оставался прежним. Он сдерживался за счет частичной заготовки ТК методом непрерывного донорского тромбоцитафереза на сепараторе клеток крови в ЧДОГЦ. В 2007 г. показатель контактов реципиентов с большим количеством доноров уменьшился еще в 2 раза за счет перехода на сепараторную заготовку ТК на ЧОСПК.
Совместная согласованная работа ЧДОГЦ и ЧОСПК по удовлетворению потребностей в гемокомпонентах детей с онкогематологическими заболеваниями благодаря внедрению ресурсосберегающих технологий позволила в условиях дефицита перераспределить и более эффективно использовать 4-кратную экономию донорского ресурса. Наибольшая экономия донорских ресурсов получена за счет замены КП на препараты ФСК при заместительной терапии у больных с ВК и внедрения заготовки ТК методом непрерывного тромбоцитафереза на сепараторах клеток крови.
Необходимо также отметить, что в группе реципиентов с геморрагическими заболеваниями из потребленных за 10 лет ТС от 10 426 доноров, за 2 последних года были перелиты ТС только от 20 доноров. Такой результат получен после перехода на заместительную терапию препаратами ФСК VIII и IX при ВК, а также применения в нескольких случаях при геморрагических заболеваниях фактора VII и антитромбина III. Разумеется, из препаратов ФСК лишь небольшая часть была рекомбинантными, подавляющая – препаратами плазмы. Однако не требует доказательств то, что по степени очистки от примесей и инфекционной безопасности плазменных ФСК на порядки превышает КП и СЗП.
Внедрение заготовки тромбоконцентрата методом непрерывного аппаратного тромбоцитафереза на сепараторе клеток с помощью «анализа минимизации затрат»
ЧОСПК традиционно готовила ТК из лейкотромбоцитарного слоя методом центрифугирования из дозы свежезаготовленной консервированной крови. Доза такого ТК теоретически содержит заявленные 0,56 ± 0,1 х1011/л тромбоцитов в 50 ± 5 мл плазмы, витальность которых составляет максимально 72 часа. После получения результатов всех анализов, подтверждающих безопасность, реально такой ТК выдается для трансфузии реципиенту только на третьи сутки. Витальность кровяных пластинок в нем - уже менее суток, что сказывается на их терапевтической эффективности.
Гравитационная методика позволяет на сепараторах клеток крови от одного донора во время непрерывного тромбоцитафереза получить 3,0-6,0х1011/л тромбоцитов, минимально контаминированных лейкоцитами, с витальностью в 120 часов. При этом в 5-10 раз уменьшается потребность в донорах, анализах, значительно сокращается количество трудозатрат, отпадает необходимость в дополнительном использовании лейкофильтров, значительно уменьшается риск аллоиммунизации и гемотрансмиссивных инфекций. «Лечебная доза» ТК для ребенка рассчитывается с учетом клинических и лабораторных данных (в зависимости от тяжести геморрагического синдрома, исходного и желаемого уровней тромбоцитов, необходимости инвазивных манипуляций и т. д.). Обычно она составляет 5х109/л тромбоцитов на кг массы тела пациента. Для пациента с массой тела 50 кг «лечебная доза» составляет 10 доз «традиционного» ТК от 10 доноров, но на сепараторе эквивалентная «лечебная доза» может быть получена от 1 донора за 1 процедуру.
Стоимость расходных материалов для получения такого количества тромбоцитов на сепараторе клеток крови около 240 долларов США. Традиционный ТК, с использованием эффективных прикроватных лейкофильтров без учета непрямых медицинских затрат (на анализы, индивидуальный подбор, выбраковку и прочее) в эквивалентном количестве также стоит 230 долларов США. Таким образом, с помощью фармакоэкономического метода «анализа минимизации затрат» на первом этапе исследования нами было доказано, что затраты на две разные по эффективности и качеству разновидности ТК практически одинаковы. Однако, преимущества сепараторной методики в таких аспектах, как качественные характеристики, сопутствующие затраты, потребность в донорских ресурсах, сроки хранения, лечение гемотрансфузионных реакций и осложнений – очевидны.
Практическим результатом доказательного теоретического этапа исследования стало приобретение сепаратора клеток крови для ЧДОГЦ в конце 2003 г. Клиническая эффективность сепараторного ТК и экономия донорских ресурсов в условиях их дефицита при этом оказались настолько очевидны, что региональная служба крови последовала примеру ЧДОГЦ. На конец 2007 г. ЧОСПК организована система «компонентного» донорства, постоянно функционируют не менее двух сепараторов клеток крови.
Доля сепараторного в общем объеме ТК, потребленного пациентами ЧДОГЦ в 2006 г. - более 40%, а в 2007 г. уже 79,4%. Это позволило не только в значительно большей степени удовлетворить потребности больных в лечении геморрагических тромбоцитопенических состояний, но и снизило частоту посттрансфузионных реакций на ТК с 3,7% до 0,17%.
Экономию донорских ресурсов по ТК, использованному в ЧДОГЦ, можно выразить следующим образом: за 2006 г. от 79 доноров на сепараторах приготовили такое количество ТК, для заготовки которого традиционным методом понадобились бы 424 донора (соотношение 1:5,4 или 81,4% экономии донорских кадров); за 2007 г. – от 427 доноров заготовили 1804 доз (соотношение 1:4,23 или 76,4% экономии донорских кадров). Таким образом, в производственной трансфузиологии эта методика заготовки ТК позволяет получать значительную (около 80%) экономию донорских ресурсов.
Для клинической трансфузиологии внедрение сепараторной заготовки ТК уже на данном этапе значительно повысило биобезопасность реципиентов: в 5 раз уменьшились контакты реципиентов с большим количеством доноров, в 20 раз снизилась реактогенность ТК как трансфузионной среды (в первую очередь за счет лейкоредукции). Соответственно значительно снизились риски аллоиммунизации и инфицирования гемотрансмиссивными агентами. Кроме того, повысилась степень удовлетворения потребности пациентов в ТК, что значительно уменьшило угрозу критических геморрагических тромбоцитопенических состояний.
Фармакоэкономический анализ сравнительной биобезопасности гемотрансфузионных сред, различных по степени контаминации лейкоцитами
Известно, что присутствие лейкоцитов в ТС расценивается как «признак, связанный с повышенной вероятностью развития нежелательных посттрансфузионных последствий» для организма реципиента. Лейкоциты, содержащиеся в ТС, являются «фактором риска» биологической опасности, который имеет четкую количественную характеристику и при сравнительном анализе позволяет присваивать ему относительное числовое значение. Эти данные были получены в результате качественного систематического анализа 38 публикаций о научных исследованиях, в которых изучалась лейкодеплеция. Мнение о том, что она повышает биобезопасность гемокомпонентов, хотя и не является единственно достаточной для предотвращения всех нежелательных воздействий крови на организм реципиента, однозначно. Обсуждаются только вопросы качества и рентабельности. Такой подход позволил провести фармакоэкономическое исследование с целью обосновать переход на лейкодеплеционные технологии приготовления эритроцитсодержащих сред и тромбоконцентрата.
Анализ эритроцитсодержащих ТС, доступных для ЧДОГЦ, показал значительные различия как по абсолютным количествам лейкоцитов, так и по составу их субпопуляций (гранулоцитов и лимфоцитов). Соответственно, имеет место разный уровень рисков биологической опасности (пирогенных и иммунологических реакций, гемотрансмиссивного инфицирования, РТПХ и т. д.). Сравнение средних показателей абсолютного содержания лейкоцитов и их субпопуляций в эритроцитсодержащих ТС позволило получить достаточно наглядные коэффициенты соотношения «риска». При этом наибольшее значение, равное 1,0, было присвоено ТС с наибольшим количеством лейкоцитов - эритроцитной массе (табл. 25). Идеальной ТС могла бы стать эритроцитсодержащая среда с нулевой примесью лейкоцитов.
Таблица 25. Расчет риска гемотрансфузионных реакций и осложнений при использовании эритросодержащих гемокомпонентов
| Наименование ТС | Абс. (среднее) кол-во лейкоц. | Коэффициент соотношения «риска» по лейкоцитам | Из них | |||
| Абс. (ср.) кол-во гранулоц. | Показатель соотношения пироген. «риска» | Абс. (ср.) кол-во лимфоц. | Коэффициент соотношения иммунол. «риска» | |||
| Эритроцитная масса | 5,0х109/л | 1,0 | 3,25х109/л | 1,0 | 1,75х109/л | 1,0 |
| ЭМОЛТ | 1,5х109/л | 0,3 | 0,53х109/л | 0,166 | 0,970х109/л | 0,55 |
| Эритроцитная масса фильтрованная | 0,5х109/л | 0,1 | 0,160х109/л | 0,05 | 0,340х109/л | 0,19 |
Чтобы доказать целесообразность выбора между наиболее дешевой, но биологически опасной, эритроцитной массой и более дорогими и безопасными фильтрованными эритроцитами, был проведен расчет соотношений стоимости и рисков. Показатель «стоимость с поправкой на риск», равный 1,0 показывает минимальную стоимость при максимальном риске, чем он ниже, тем рациональнее денежные затраты на понижение риска т. н. «биологической опасности» ТС (табл. 26).
Таблица 26. Соотношение цена/риск для эритроцитсодержащих компонетов крови
| Наименование ТС | Стоимость (руб./литр) на 31.12.07 г. | Коэффиц. соотнош. цен | Коэффициент соотношения «риска» по лейкоцитам | Показатель стоимости с поправкой на риск |
| Эритроцитная масса | 3311,08 руб./л | 1,0 | 1,0 | 1,0 |
| ЭМОЛТ | 4804,80 руб./л | 1,45 | 0,3 | 0,435 |
| Эритроцитная масса, фильтрованная | 5270,00 руб./л | 1,59 | 0,1 | 0,159 |
Таким образом, экономические затраты на единицу риска у ЭМОЛТ и фильтрованной эритроцитной массы значительно меньше, чем у эритроцитной массы нефильтрованной (в 2,3 и в 6 раз соответственно). Сделать выбор в пользу наиболее безопасной и менее затратной эритроцитсодержащей ТС можно с помощью «анализа принятия решений» (рис. 20).
Лейко-редукция (-)
Эритроцитная масса

