Структурно-функциональные особенности запасных и защитных белков растений и их использование в генетических исследованиях
| Вид материала | Автореферат |
- Структурные и функциональные свойства цитокинин-связывающих белков растений Arabidopsis, 249.12kb.
- Педагогическая пресса в россии во второй половине XIX в.: Генезис, предметно-тематические, 302.96kb.
- Рабочая учебная программа по нормальной физиологии Электив «Структурно-функциональные, 112.81kb.
- Нп «сибирская ассоциация консультантов», 169.41kb.
- Календарно-тематический план практических занятий по биологии для студентов медико-биологического, 71.39kb.
- Названия экзотических растений в английском и русском языках (структурно-словообразовательный, 378.31kb.
- Программа 9 16 ноября 2010 г г. Москва Место проведения конференции: Учреждение Российской, 265.18kb.
- Добриева Зейнаб Израиловна структурно-семантические и функциональные особенности приставочных, 2630.63kb.
- Структурно-семантические и функциональные характеристики английского лингвокультурного, 562.68kb.
- Программа для поступающих в нввкус по специальности «Психология», 284.28kb.
На правах рукописи
Одинцова Татьяна Игоревна
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ЗАПАСНЫХ И ЗАЩИТНЫХ БЕЛКОВ РАСТЕНИЙ И ИХ ИСПОЛЬЗОВАНИЕ В ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЯХ
Специальности: 03.00.15 – генетика
03.00.04 – биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Москва - 2010
Работа выполнена в лаборатории генетики растений Учреждения Российской академии наук Института общей генетики им. Н.И. Вавилова РАН
Официальные оппоненты: доктор биологических наук О.А. Огаркова
доктор биологических наук А.А. Соловьев
доктор биологических наук М.А. Белозерский
Ведущая организация: кафедра генетики Московского государственного университета им. М.В. Ломоносова
Защита состоится «_24_»__июня__2010 г. в_14 час. 00 мин.
На заседании диссертационного совета Д 002.214.01 при Учреждении Российской академии наук Институте общей генетики им. Н.И. Вавилова РАН по адресу: 119991, ГСП-1, Москва, ул. Губкина 3. Факс: (499)132-12-89, электронная почта: iogen@vigg.ru, Интернет: www.vigg.ru
С диссертацией можно ознакомиться в библиотеке Учреждения Российской академии наук Института общей генетики им. Н.И. Вавилова РАН.
Автореферат разослан «___»_______________2010 г.
Ученый секретарь диссертационного совета,
кандидат биологических наук Т.А. Синельщикова Т.А. Синельщикова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Секвенирование ряда геномов в последнее десятилетие позволило установить последовательности огромного числа генов, однако не решило всех вопросов, связанных с их функциями и регуляцией экспрессии. Исследование протеома – совокупности белков клетки, составляющих транслируемую часть генома, открывает новые возможности для идентификации генов, связанных с определенными функциональными состояниями отдельной клетки и организма в целом. Изучение белков - продуктов генов - с использованием современных методов анализа позволяет получить важную информацию о тонкой структуре генов и дополняет геномные исследования. Протеомный анализ растений уже сейчас с успехом используется для решения разнообразных генетических задач, таких как экспрессия генов в различных органах растения и на различных стадиях развития, при симбиозе, в ответ на биотический и абиотический стресс или иные воздействия), сравнение генотипов (характеристика мутантов, дифференциация линий, установление филогенетических взаимоотношений), изучение структуры генетической изменчивости в природных популяциях (Алтухов, 1989).
Запасные белки пшеницы, представленные мономерными глиадинами и полимерными глютенинами, контролируются несколькими локусами, состоящими из тесно сцепленных между собой генов. (Созинов, 1985). Наиболее полиморфными являются глиадинкодирующие локусы. И хотя генетический контроль глиадинов изучен, различия в структуре кодируемых ими белков в большинстве случаев неизвестны. Исследования первичной структуры глиадинов позволят понять структуру и эволюцию генов глиадинов, а также глиадинкодирующих кластеров в целом.
Сравнительный анализ глиадинов полиплоидной пшеницы и предполагаемых диплоидных доноров геномов предлагает подходы к решению проблемы филогении пшениц. Известно, что геном гексаплоидного вида T. aestivum состоит из трех геномов предковых диплоидных видов – доноров геномов АА, ВВ и DD. Вопрос о происхождении геномов, особенно генома В, до сих пор окончательно не решен (Feldman et al., 2001; Гончаров, 2007). В связи с этим исследования глиадинов диплоидных видов являются чрезвычайно актуальными, поскольку могут пролить свет на этот вопрос.
Интерес к изучению проламинов пшеницы связан также с уникальными физико-химическими свойствами этих белков, обусловливающими вязкоэластичные свойства клейковины. Несмотря на то, что проламины пшеницы интенсивно изучаются в последние десятилетия, структура клейковинного комплекса до сих пор не установлена (Shewry, 2009; Shewry and Halford, 2002). В этой связи особое значение имеет дисульфидное картирование проламинов, так как дисульфидным связям принадлежит решающая роль в формировании структуры клейковины (Wieser, 2007). Помимо фундаментального значения для выяснения организации и функционирования надмолекулярных белковых комплексов, структурно-функциональные исследования проламинов пшеницы важны для целенаправленной селекции на создание высокоурожайных сортов, обладающих улучшенными технологическими качествами (Salekdeh and Komatsu, 2007; Shewry et al., 2008).
Наряду со структурными исследованиями запасных белков, не меньшую роль играют и исследования их генетически детерминированного полиморфизма, который широко используется в филогенетических и популяционных исследованиях, а также в селекции для идентификации сортов, проверки их чистоты, выявления гибридов и др. (Созинов, 1985). Однако для ряда культур, в частности, для представителей семейства тыквенных, полиморфные белковые системы слабо изучены. Выявление таких систем является чрезвычайно актуальным, поскольку позволит использовать их в селекционной практике.
Другой важнейшей группой генов растений являются гены защитных белков, которые определяют устойчивость растений к патогенам и абиотическому стрессу. Изучение защитных белков – продуктов этих генов - имеет фундаментальное значение для выяснения молекулярных механизмов врожденного иммунитета растений. Кроме того, такие исследования имеют и большое практическое значение для поиска кандидатных генов, способных усилить защитный потенциал растений, которые могут быть использованы при трансформации растений для повышения их устойчивости к патогенам и абиотическому стрессу. Усиление устойчивости растений может быть достигнуто как путем повышения уровня экспрессии собственных генов, участвующих в защитных реакциях, так и путем встраивания генов, кодирующих белки и пептиды с антимикробными свойствами, из других видов растений. Все это требует детального анализа защитного арсенала растений, который слабо изучен. В растениях идентифицированы гены устойчивости (R гены), обеспечивающие защиту от определенных рас патогенов (Keller et al., 2000). Однако молекулярные процессы, инициируемые продуктами R генов, в большинстве случаев детально не исследованы. Роль важнейших компонентов защитной системы растений - PR-белков, также изучена недостаточно. Обнаружение в 90х годах в растениях антимикробных пептидов, обладающих широким спектром антимикробного действия, открыло новые возможности для создания устойчивых форм растений, поскольку гены антимикробных пептидов могут быть непосредственно встроены в геномы чувствительных к патогенам растений с использованием методов генетической трансформации (Carlini, Grossi-de-Sa, 2002). Кроме того, антимикробные пептиды растений рассматриваются в качестве альтернативы традиционно используемым антибиотикам и антимикотикам, что особенно актуально в эпоху появления большого количества устойчивых форм патогенов (De Lucca, 2000; Hancock, 2000; Marshall and Arenas, 2003). В связи с этим поиск новых высокоактивных пептидов и разработка методов их получения, в частности путем гетерологичной экспрессии, представляются чрезвычайно актуальными.
Цель и задачи исследования
Цель настоящей работы состояла в структурно-функциональном исследовании двух важнейших групп белков растений – запасных и защитных, для решения фундаментальных проблем генетики (эволюция генов проламинов, структура глиадин-кодирующих кластеров генов, филогения пшениц, генетический контроль субъединиц кукурбитина, механизм действия генов устойчивости, исследование индуцированной устойчивости трансгенных растений, экспрессирующих двунитевую РНК), селекции (контроль сортовой чистоты, выявление гибридов и др.) и биохимии (структура и свойства запасных и защитных белков).
В связи с поставленной целью решались следующие конкретные задачи:
1. разработка методологии выделения высокоочищенных проламинов пшеницы, пригодных для структурных исследований;
2. изучение структурных особенностей глиадинов различных глиадинкодирующих локусов гексаплоидной пшеницы, а также видов рода Aegilops – предполагаемых доноров геномов полиплоидных пшениц;
3. изучение локализации дисульфидных связей в белках суперсемейства проламинов (глиадинов и 2S альбуминов);
4. разработка методологии выделения, разделения и структурного анализа субъединиц и полимерных глютенинов;
5. исследование полиморфизма запасных белков у представителей семейства Cucurbitaceae: разработка методов идентификации сортов и изучение генетического контроля субъединиц кукурбитина
6. изучение PR-белков и структурно-функциональных изменений хлоропластов у растений родов Nicotiana и Lycopersicon с разными генами устойчивости при вирусной инфекции и перекрестной защите;
7. изучение вирусоустойчивости и белков при инфекции ВТМ у трансгенных растений табака, несущих конструкцию, детерминирующую синтез двуцепочечной РНК.
8. разработка методологии выделения антимикробных пептидов из семян однодольных растений на примере семейства злаковых. Изучение их разнообразия, структуры и свойств, установление структуры предшественника и регуляции экспрессии гена нового гевеиноподобного пептида пшеницы;
9. разработка системы гетерологичной экспрессии генов новых антимикробных пептидов растений.
Научная новизна
Впервые разработана методология разделения и очистки различных запасных и защитных растительных белков: мономерных и полимерных проламинов (сем. Poaceae), 2S альбуминов (сем. Asteraceae) и глобулинов (сем. Cucurbitaceae), PR-белков (сем. Solanaceae) и антимикробных пептидов (сем. Poaceae). Впервые изучены структурные особенности глиадинов гексаплоидной пшеницы Triticum aestivum, кодируемых одним кластером генов (1D1 и 1B1), а также кластерами гомеологичных хромосом (D и B). Впервые установлено, что компоненты одного кластера генов значительно различаются по N-концевым аминокислотным последовательностям. Выявлено существование трех типов N-концевых аминокислотных последовательностей у ω-глиадинов. Показано, что N-концевые аминокислотные последовательности ω-глиадинов, кодируемых геномом D, заметно дивергировали от аналогичных последовательностей генома В. Высказано предположение о том, что гены ω- и γ- глиадинов произошли в результате многократных дупликаций коротких нуклеотидных последовательностей ДНК. Выявлен значительный консерватизм аминокислотных последовательностей γ-глиадинов, кодируемых хромосомами А, В и D геномов. Впервые проведено исследование глиадинов двух видов эгилопсов Ae. tauschii и Ae. longissima – предполагаемых доноров геномов полиплоидных пшениц и выявлена высокая внутривидовая изменчивость этих видов. Впервые определены N-концевые аминокислотные последовательности основных компонентов глиадинов Ae. tauschii и показано, что, как и у гексаплоидных пшениц, у эгилопсов встречаются те же типы N-концевых аминокислотных последовательностей глиадинов. Выдвинута гипотеза о том, что геном В культурных пшениц является сложным геномом, который модифицировался в ходе эволюции за счет интрогрессивной гибридизации с различными диплоидными видами, а также что генетический состав ныне существующих диплоидных видов не идентичен составу тех видов, которые участвовали в создании тетра- и гексаплоидных пшениц. Впервые для двух представителей суперсемейства проламинов - глиадина γ-46 и 2S альбумина подсолнечника, проведено дисульфидное картирование. Впервые выделены и охарактеризованы ряд субъединиц глютенина. Получены новые данные в пользу участия D субъединиц глютенина в терминации роста полимерной цепи глютенинов. Впервые методом светорассеяния установлены молекулярные массы полимеров глютенина. Разработаны электрофоретический и хроматографический методы анализа полиморфизма запасных белков тыквенных культур. Впервые изучен генетический контроль субъединиц кукурбитина – основного глобулина семян тыквенных растений. Впервые исследованы PR-белки растений томатов с разными генами устойчивости (Tm-1, Tm-2 и Tm-22) к ВТМ инфекции и выявлены специфические белки, характерные для каждого генотипа, которые могут быть использованы в качестве маркеров соответствующих генов в селекционном процессе. Исследованы белки хлоропластов листьев томатов с разными генами устойчивости к ВТМ при вирусной инфекции и выявлено снижение активности фотосистемы II и транскрипционной активности пластид. Выявлено наличие интерфероноподобных белков в листьях томатов различного генотипа. Впервые показано влияние экспрессии вставки, детерминирующей синтез двунитевой РНК, не имеющей гомологии с геномами вируса и растений табака, на уровень устойчивости трансгенных растений к тобамовирусам. В инфицированных трансгенных растениях выявлен индуцируемый синтез двух новых полипептидов, относящихся к семейству β-эндоглюканаз растений. Высказано предположение об участии этих белков в системе антивирусной защиты растений. Впервые проведен систематический анализ антимикробных пептидов семян вида Triticum kiharae. Выделено 24 новых пептида, относящихся к 6 семействам антимикробных пептидов растений, и установлена первичная структура 12 из них. Изучена биологическая активность в системе in vitro 6 новых антимикробных пептидов. Обнаружено новое семейство глицин-богатых пептидов растений и новый структурный тип гевеиноподобных пептидов. Определена структура предшественника нового гевеиноподобного пептида. Исследована регуляция экспрессии гена этого пептида биотическими и абиотическими факторами среды. Разработана система гетерологичной экспрессии в прокариотической системе нового гевеиноподобного пептида Triticum kiharae. Впервые изучены дефензины предполагаемых доноров геномов полиплоидных пшениц и установлена геномная локализация генов дефензинов у гексаплоидной пшеницы. Показано, что в отличие от пшеницы, в семенах другого вида растений - Taraxacum officinale - основными детерминантами антифунгальной активности являются не антимикробные пептиды, а запасные 2S альбумины. Выдвинута гипотеза о специфичности «защитного арсенала» у разных видов растений.
Практическая ценность работы
Разработанные в ходе выполнения работы методы выделения ω-глиадинов путем иммобилизации на тиопропил-сефарозе и разделения полимеров глютенина в агарозном геле могут быть использованы при массовом анализе образцов, что имеет большое значение в таксономических и селекционных исследованиях, а также в исследованиях молекулярно-весового распределения полимеров глютенинов в зависимости от технологических характеристик клейковины и более детального исследования структуры полимеров глютенинов. Электрофорез полимеров глютенинов может найти и более широкое применение для исследования полимеров белков сходного размера.
Полиморфизм альбуминов и глобулинов семян тыквенных культур, выявляемый с помощью электрофоретических и хроматографических систем, разработанных в ходе проведенных исследований, может быть использован в селекции, поскольку позволяет идентифицировать генетически отдаленные образцы огурца и районированные сорта тыкв. Созданный каталог аллельных вариантов субъединиц кукурбитина позволяет идентифицировать сорта тыкв отечественной селекции и является экспресс-методом определения сортовой чистоты семян тыкв в сравнении с традиционно используемым грунтконтролем.
Специфические белки, синтезирующиеся в растениях томатов с разными генами устойчивости к ВТМ (Tm-1, Tm-2 и Tm-22) в ответ на инфицирование, могут быть использованы в качестве маркеров соответствующих генов в селекционном процессе. Гены выделенных в ходе выполнения настоящей работы антимикробных пептидов могут быть использованы для трансформации растений с целью повышения их устойчивости к фитопатогенным бактериям и грибам с использованием методов генетической инженерии. Сами пептиды могут найти применение в качестве безопасных консервантов пищевых продуктов в пищевой промышленности, поскольку они являются природными компонентами семян пшеницы. Серьезной проблемой практического применения растительных АМП является высокая стоимость производства. Получение растительных АМП с помощью методов генетической инженерии является перспективным путем решения этой проблемы. Предложенную нами систему гетерологичной экспрессии генов цистеинбогатых АМП в клетках прокариот предполагается использовать для разработки технологии производства АМП.
Основные положения, выносимые на защиту
1. глиадины, кодируемые генами одного кластера, локализованного на коротких плечах хромосом первой гомеологичной группы: хромосомы 1D (блок 1D1) и хромосомы 1В (блок 1В1), существенно различаются по N-концевым аминокислотным последовательностям. Это означает, что в процессе эволюции у предков пшеницы произошло объединение в один кластер генов, кодирующих ω- и γ-глиадины. N-концевые аминокислотные последовательности ω-глиадинов, кодируемых геномом D, значительно дивергировали от последовательностей ω-глиадинов генома В. В то же время аминокислотные последовательности γ-глиадинов, кодируемых хромосомами А, В и D, существенно более консервативны. Хромосомы шестой гомеологичной группы, по всей видимости, кодируют проламины, значительно отличающиеся от проламинов хромосом первой гомеологичной группы.
2. расположение дисульфидных связей – важнейших пост-трансляционных модификаций белков- в двух группах запасных белков суперсемейства проламинов, глиадинах и 2S альбуминах, сходно, но отличается от такового у других членов суперсемейства - ингибиторов α-амилаз и трипсина злаков. Эти различия, по всей вероятности, связаны с необходимостью взаимодействия между ингибиторами и активными центрами ферментов-мишеней;
3. полиморфизм субъединиц кукурбитина, основного запасного глобулина семян тыквенных культур, контролируемого четырьмя локусами, выявляемый с помощью электрофореза, может эффективно использоваться в качестве экспресс-метода определения сортовой чистоты представителей семейства Cucurbitaceae;
4. у растений табака и томатов, содержащих различные гены устойчивости к ВТМ (гены N и N΄ табака и гены Tm-1, Tm-2 и Tm-22 томата), в ответ на вирусную инфекцию синтезируются специфические PR-белки, относящиеся к защитной системе растений и отражающие особенности действия генов устойчивости, которые могут быть использованы в качестве маркеров соответствующих генов в селекционном процессе;
5. высокий молекулярный полиморфизм защитных пептидов у вида пшеницы Triticum kiharae Dorof. et Migusch, реализуемый как на генном, так и на пост-транскрипционном уровнях, обеспечивает эффективную защиту от разнообразных патогенов и стрессовых факторов среды, что обусловливает адаптацию пшеницы к неблагоприятным условиям окружающей среды и объясняет ее широкое распространение по всем континентам и климатическим зонам Земного шара. Детерминанты антифунгальной активности дефензинов семейства Poaceae локализованы в С-концевой области их молекул;
6. набор защитных полипептидов, участвующих в борьбе растений с патогенами и абиотическим стрессом («защитный арсенал» растений), видоспецифичен и уникален для каждого вида растений.
Апробация работы
Основные материалы диссертации были представлены на I национальной конференции по иммуногенетике растений (София, Болгария, 1986), III международном совещании по белкам клейковины (Будапешт, Венгрия, 1987), III международном симпозиуме по биохимической идентификации сортов (Ленинград, 1987), VI Всесоюзном симпозиуме «Молекулярные механизмы генетических процессов» (Москва, 1987), Всероссийской конференции “Физиолого-биохимические основы иммунитета” (Уфа, 1988), II съезде биохимического общества РАН (Москва, 1997), международной конференции «Биология клеток растений in vitro, биотехнология и сохранение генофонда» (Москва, 1997), международном симпозиуме по взаимодействиям белковых комплексов (Берлин, Германия, 1997), VII международной конференции по белкам клейковины (Бристоль, Великобритания, 2000), II международной конференции «Геномика, протеомика и биоинформатика для медицины» (Москва, 2004), III сьезде общества биотехнологов России (Москва, 2005), VIII чтениях, посвященных памяти академика Ю.А. Овчинникова (Москва, 2006), международном симпозиуме "Сигнальные системы клеток растений: роль в адаптации и иммунитете" (Казань, 2006), II Российском симпозиуме «Белки и пептиды» (Пущино, 2007), III международном симпозиуме «Проблемы биохимии, радиационной и космической биологии» (Дубна, 2007), международной конференции «Современная физиология растений: от молекул до экосистем» (Сыктывкар, Россия, 2007), международной конференции. «Научное наследие Н.И. Вавилова - фундамент развития отечественного и мирового сельского хозяйства» (Москва, 2007), 2-й Вавиловской международной конференции «Генетические ресурсы культурных растений в XXI веке» (С.-Петербург, 2007), Отчетных сессиях по программе Президиума РАН «Биоразнообразие и динамика генофондов» (подпрограмма II «Динамика генофондов») (Москва, 2005, 2006, 2007, 2008), IV съезде Российского общества биохимиков и молекулярных биологов (Новосибирск, 2008), V съезде общества биотехнологов России им. Ю.А. Овчинникова (Москва, 2008), II Всероссийской конференции «Современные проблемы иммунитета растений к вредным организмам» (С.-Петербург, 2008), IV Российского симпозиума «Белки и пептиды» (Казань, 2009), V съезде ВОГИС (Москва, 2009), V международном конгрессе «Биотехнология: состояние и перспективы развития» (Москва, 2009), международном симпозиуме по взаимоотношениям растений с патогенами (Квебек, Канада, 2009).
Декларация личного участия автора
В диссертационной работе использованы экспериментальные материалы, полученные лично автором. Автор лично принимал участие в разработке методологии, а также в разделении и структурном анализе всех представленных в диссертации групп белков: проламинов пшеницы, альбуминов и глобулинов тыквенных культур, PR-белков и антимикробных белков и пептидов. Автор лично проводил биохимический анализ хлоропластов при вирусной инфекции и анализ трансгенных растений, экспрессирующих двунитевую РНК. Автор принимал активное участие в разработке системы гетерологичной экспрессии антимикробных пептидов и клонировании гена одного из них. Автор лично оформлял результаты своих исследований в виде статей. Суммарное личное участие автора составило ~85%.
Публикации
По теме диссертации опубликовано 49 статей, глава в зарубежной монографии, один патент и два авторских свидетельства.
Структура и объем работы
Диссертационная работа изложена на 454 страницах, содержит 74 рисунка и 41 таблиц, имеет традиционную структуру и состоит из введения, обзора литературы, объектов и методов исследования, результатов и их обсуждения, заключения, выводов, списка цитируемой литературы, включающего 813 источников, и приложения.
СОДЕРЖАНИЕ РАБОТЫ
Глава I. Запасные белки
1. Выделение глиадинов
Поскольку белки зерновки пшеницы представляют собой чрезвычайно сложную смесь, которая состоит из сотен гомологичных полипептидов в молекулярно-весовом диапазоне от 15 до 100 кДа, разработка методологии выделения индивидуальных полипептидов, пригодных для структурного анализа, было первоочередной задачей. В качестве объекта исследования был выбран сорт озимой мягкой пшеницы Безостая 1. Электрофоретический профиль распределения глиадинов при двумерном разделении в ПААГ представлен на рис. 1.
Молекулярные массы основных полипептидов ω-глиадинов пшеницы Безостая 1 составили 67, 63, 62, 60 и 56 кДа. Молекулярные массы остальных глиадинов варьируют от 32 до 42 кДа.
Рис. 1. Распределение глиадинов пшеницы сорта Безостая 1 при двумерном электрофорезе в ПААГ. Направление I: 6%-ный ПААГ, рН 3,1; направление II: 10%-ный ПААГ, содержащий 0,1% ДДС-Na.

Для разделения глиадинов была использована иммобилизация белков спиртового экстракта на тиопропил-сефарозе 6В, в основе которой лежит реакция тиол-дисульфидного обмена между SH-группами белка и активными группами носителя (рис. 2). Белок иммобилизуется на тиопропил-сефарозе 6В (рис. 2) по остаткам цистеина, а затем может быть переведен в раствор восстановлением. Если смесь белков инкубировать с тиопропил-сефарозой, то с ней свяжутся только те из них, которые содержат свободные SH-группы. Поскольку по имевшимся данным ω-глиадины не содержат цистеина и (или) цистина, мы предположили, что эти белки не свяжутся с тиопропил-сефарозой, тогда как все остальные проламины содержат дисульфидные связи, которые после восстановления образуют свободные SH-группы, способные вступать в реакцию дисульфидного обмена.
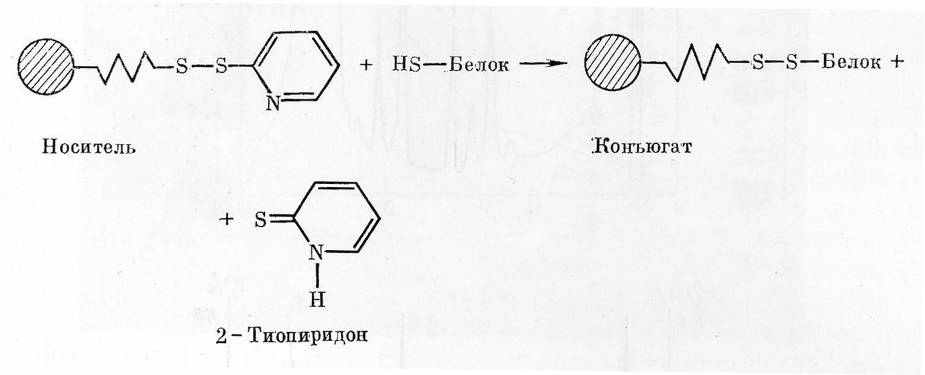
Рис. 2. Схема иммобилизации белков зерновок пшеницы на тиопропил-сефарозе 6В.
В результате глиадины пшеницы сорта Безостая 1 были разделены на 2 фракции: ω-глиадины, не содержащие остатков цистеина (фракция I), и цистеинсодержащие глиадины (фракция II) (рис. 3).
Рис. 3. Профиль электрофоретического распределения белков фракций I и II, полученных в результате иммобилизации на тиопропил-сефарозе 6В. А – 6%-ный ПААГ, рН 3,1: 1 – глиадины пшеницы, 2 – белки фракции I; Б – (10-17%)-ный ПААГ+0,1% ДДС-Na, рН 8,8: 1 – белки фракции II, 2 – белки спиртового экстракта, 3 – белки фракции I.

Разработанный нами метод позволил отделить ω-глиадины от других спирторастворимых белков пшеницы. Этот метод имеет ряд преимуществ по сравнению с описанными в литературе: 1) он позволяет сразу выделить всю группу ω-глиадинов, свободных от примесей других глиадинов; 2) в отличие от хроматографии на колонках, он позволяет работать с микроколичествами белков; 3) метод достаточно прост. Последнее дает возможность использовать метод при массовом анализе образцов, что имеет большое значение при генетических, таксономических и селекционных исследованиях.
Предложенный метод ковалентной хроматографии дает возможность оценить содержание и распределение свободных SH-групп и дисульфидных связей в различных фракциях глиадинов, кроме того, он открывает возможности для исследования первичной структуры проламинов, в частности, для выделения и анализа цистеинсодержащих пептидов, полученных при расщеплении белков, что и было нами успешно использовано при выделении цистеинсодержащих пептидов глиадина γ-46 (см. ниже).
После разделения глиадинов методом ковалентной хроматографии для выделения индивидуальных глиадинов ω-глиадины (фракция I) и цистеинсодержащие глиадины (фракция II) подвергали дальнейшему разделению с использованием различных хроматографических методов. В результате в высокоочищенном виде были получены ряд глиадинов, структурный анализ которых представлял интерес для решения проблем генетики, селекции и филогении пшениц.
2. Исследование структурных особенностей глиадинов пшеницы и родственных видов
2.1. Определение N-концевых аминокислотных последовательностей проламинов различных глиадинкодирующих локусов пшеницы
Для исследования структуры глиадинкодирующих кластеров генов, а также решения проблемы происхождения и эволюции генов проламинов из пшеницы сорта Безостая 1 был выделен ряд ω- и γ-глиадинов, кодируемых одним кластером генов, а также кластерами гомеологичных хромосом и определены их N-концевые аминокислотные последовательности. Среди проанализированных глиадинов были ω0, ω1, ω2, и γ2, кодируемые кластером генов хромосомы 1D (блок 1D1 по генетической классификации; Созинов, 1985), а также ω5 и γ3, кодируемые кластером генов хромосомы 1В. Особенно важно, что эти компоненты входят в наиболее распространенный у районированных сортов озимых и яровых пшениц блок 1В1. Были выделены также глиадин γ1, кодируемый хромосомой 1А, и γ5 – белок, контролируемый хромосомой 6В (блок 6В1), a priori наименее связанный с глиадинами, кодируемыми хромосомой первой гомеологичной группы. N-концевые аминокислотные последовательности выделенных глиадинов приведены в табл. 1. Анализ полученных результатов свидетельствует о том, что у ω-глиадинов есть три типа N-концевых аминокислотных последовательностей: KEL, ARE, SRL. У всех изученных ω-глиадинов обнаружены два участка гомологии, которые свидетельствуют об общности их происхождения, а также ряд повторяющихся олигопептидов типа PQQPY, которые могли образоваться в результате единичных замен в кодонах и многократных дупликаций коротких нуклеотидных последовательностей ДНК. Была выявлена бόльшая гомология между ω-глиадинами, кодируемыми геномом D, чем между ними и ω-глиадинами, кодируемыми геномом В.
Таким образом, N-концевые аминокислотные последовательности ω-глиадинов, кодируемых геномом D, заметно дивергировали от аналогичных последовательностей генома В. Все изученные γ-глиадины, кодируемые хромосомами А, В и D, имели высокий уровень гомологии N-концевых аминокислотных последовательностей (табл. 1). Столь высокая гомология исследованных последовательностей γ-глиадинов свидетельствует о значительной консервативности соответствующих участков кодирующих их генов. В то же время глиадины, кодируемые хромосомой 6В (γ5), существенно отличаются от γ-глиадинов, кодируемых хромосомами первой гомеологичной группы, и имеют N-концевую последовательность, идентичную α-глиадинам.
Таблица 1.
N-концевые аминокислотные последовательности ω- и γ-глиадинов пшеницы сорта Безостая 1*
-
Блок
Глиадин
N-концевая аминокислотная последовательность
1D1
ω0, ω1
KELQSPQQSFSHQQQPFPQQPYPQ
1D1
ω2
ARELNPSNKELQSPQQSFSPQQQPFXQQ
1B1
ω5
SRLLSPRGKELHTPQQQFPPQQQQFPQQQQFPQQQFPXSPXXQF
1D1
γ2
NIQVDPSGQVQWLQQQLVPQ
1B1
γ3
NMQVDPSGQVQWPQQQLVPQPQQPLQQQQ
1A4
γ1
NIQVDPSGQVQWPQQQPVPQFPQ
6B1
γ5
VRVPVPQLQPQNPSQQPQEQVPLVQQQQFL
-
γ**
NMQVDPSSQVQWPQQQPVPQPHQPFSQQPQQ
*Светло-серым цветом выделены идентичные аминокислотные остатки ω-глиадинов; темно-серым – идентичные остатки γ-глиадинов. **Последовательность γ-глиадина, определенная по структуре гена, включена для сравнения (Bartels et al., 1986).
К началу нашей работы было известно, что группы компонентов проламинов, кодируемых одним кластером генов, наследуются сцепленно – блоками, как моногенный признак, причем рекомбинации в пределах блока наблюдаются редко (Созинов, Попереля, 1979). Можно было предположить, что гены одного кластера кодируют близкие по структуре белки. Однако нами установлено, что компоненты одного кластера генов, локализованного на коротком плече хромосомы 1D и 1В, существенно различаются по N-концевым аминокислотным последовательностям. Наиболее вероятно, что в процессе эволюции у предков пшеницы произошло совмещение в один кластер генов, кодирующих различающиеся по структуре белки - ω- и γ-глиадины. Хромосомы шестой гомеологичной группы, по всей видимости, кодируют проламины, существенно отличающиеся от проламинов хромосом первой гомеологичной группы, несмотря на то, что на электрофоретическом спектре γ-глиадины обеих групп хромосом располагаются в одной зоне. Полученные результаты свидетельствуют о том, что эти глиадины имеют N-концевую аминокислотную последовательность, идентичную α–глиадинам, кодируемым хромосомами 6А и 6В.
2.2. Выделение и характеристика глиадинов семян Ae. squarrosa
Обнаруженные нами геном-специфичные различия между ω-глиадинами гексаплоидной пшеницы, позволили перейти к исследованию проламинов предполагаемых доноров В и D геномов – двух видов эгилопсов Ae. squarrosa и Ae. longissima, что представляет интерес для решения проблем филогении пшениц.
Исследование молекулярной гетерогенности глиадинов семян Ae. squarrosa показало высокую изменчивость этого вида. Разделение глиадинов образца Ae. squarrosa из Грузии путем ОФ-ВЭЖХ приведено на рис. 4.

 Сочетание ОФ-ВЭЖХ с использованием высокочувствительного газофазного секвенатора позволило нам впервые для Ae. squarrosa определить N-концевые аминокислотные последовательности основных компонентов глиадинов (табл. 2.)
Сочетание ОФ-ВЭЖХ с использованием высокочувствительного газофазного секвенатора позволило нам впервые для Ae. squarrosa определить N-концевые аминокислотные последовательности основных компонентов глиадинов (табл. 2.)Рис. 4. А. ОФ-ВЭЖХ белков спиртового экстракта Ae. squarrosa на колонке Pro-RPC 5/10; Б –электрофоретический анализ фракций.
Таблица 2.
N-концевые аминокислотные последовательности глиадинов Ae. squarrosa
| Глиадин | N-концевая аминокислотная последовательность |
| ω1+ω2 | XXLPSPQ ARQLNPQNQELQSPQQ |
| ω4 | SRQLSPRGKELQT/PQQEQFPQ |
| ω5 ω5 ( T. aestivum) | SRQLSPRGKELQTPQEQFPQQQFPQQQQI SRLLSPRGKELHTPQQQFPQQQQFPQQQFPQQQFPXSP |
| ω1,2* | XE/QLQ/PSPQQSF |
| γ2 | NIQVDPSGQVQWLQQQLVPQLQQQLQQ |
| β | VRVPVPQLQPQNPSQQQPQEQ |
*Kasarda et al., 1983.
Оказалось, что глиадины ω4 и ω5 имеют практически одинаковую N-концевую аминокислотную последовательность, которая начинается с SRQ. Эта последовательность обладает высокой гомологией с N-концевой аминокислотной последовательностью этих белков у пшеницы Безостая 1. В связи с этим высказывалось предположение, что такой тип последовательности специфичен для генома В. Однако полученные нами данные свидетельствуют о том, что у Ae squarrosa, предполагаемого донора D генома, есть гомологичная последовательность. Хотя ω1 и ω2 нельзя былоразделить путем ОФ-ВЭЖХ, нам удалось вычленить последовательность, начинающуюся с ARQ. Гомологичная последовательность была обнаружена у T. aestivum. Секвенирование основного компонента γ-фракции, содержавшегося во фракции XI при элюции с колонки с обращенной фазой, показало, что он соответствует γ2-последовательности, обнаруженной у T. aestivum. У β-Фракции был выявлен лишь один тип N-концевой последовательности, соответствующий α-типу глиадинов.
2.3. Выделение и характеристика глиадинов семян Ae. longissima
Поскольку Ae. longissima считался одним из возможных доноров В генома полиплоидных пшениц (Конарев, 2001), представляло интерес исследовать глиадины этого вида. В литературе подобного рода сведения отсутствовали.
Электрофоретический и хроматографический анализ выявил существенную внутривидовую гетерогенность Ae. longissima (рис. 5,6). Исследованные образцы значительно различались как по числу компонентов, так и по их хроматографической подвижности (рис. 6).
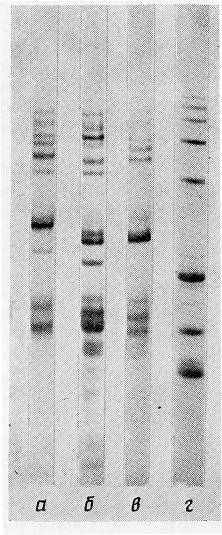 | Рис. 5. Электрофоретическое распределение глиадинов Ae. longissima и Ae. squarrosa в ПААГ (рН 3,1): а – к-202, б – к-908, в – к-1297, г – Ae. squarrosa. |


Рис. 6. ОФ-ВЭЖХ белков спиртового экстракта Ae. longissima. А – к-202, Б – к-907, В – к-908, Г – к-1297.
Высокая специфичность профилей разделения глиадинов при ОФ-ВЭЖХ позволяет использовать этот метод наряду с электрофорезом для изучения внутривидовой изменчивости Ae. longissima и характеристики образцов различного происхождения. N-концевые аминокислотные последовательности выделенных глиадинов Ae. longissima приведены на рис. 7.
| Ae. longissima к-202 Фракция 1 SRQLSPIGK Фракция 2 SRQLSPIGKELQTP Фракция 3 SRQLSPRGQEL/QXTPQ Фракция 4 блокирована Фракция 13 VRVPVPQLQPQNPSQQQP |
| Ae. longissima к-907 Фракция 1΄ SRQLSPI Фракция 2΄ SRQISPIGKELXXP |
| Ae. longissima к-1297 Фракция 2΄΄ блокирована |
| Ae. squarrosa ω5 SRQLSPRGKELQTQQEQFPQ T. aestivum ω5 SRLLSPRGKELHTPQQQFPQQQQFPQQQFPQQQFPXS |
| T. aestivum α/β VRVPVPQLQPQNPSQQQPQEQVPLVQQQQFL |
Рис. 7. N-концевые аминокислотные последовательности глиадинов видов Ae. longissima, Ae. squarrosa и T. aestivum.
Установлено, что среди ω-фракции у всех проанализированных образцов обнаружены несколько глиадинов с SRQ-типом N-концевой последовательности, который выявлен также у гексаплоидных пшениц и Ae. squarrosa. Таким образом, N-концевые последовательности ω-глиадинов консервативны: гомологичные белки разных видов эгилопсов и гексаплоидных пшениц различаются лишь единичными аминокислотными заменами.
Помимо ω-глиадинов нами был просеквенирован β-глиадин образца Ae. longissima к-202 (фракция 13, рис. 6). Его последовательность оказалась идентичной N-концевой последовательности β-глиадина Ae. squarrosa и мягкой пшеницы Безостая 1. По всей видимости, в ходе эволюции на структуру глиадинов α/β-типа накладывались более жесткие ограничения, чем на структуру ω-глиадинов.
3. Дисульфидное картирование глиадинов
Для более детального исследования структурных особенностей глиадинов, и в частности для локализации в них дисульфидных связей, играющих ключевую роль в формировании надмолекулярной структуры клейковинного комплекса, был выбран глиадин γ-46 пшеницы сорта Харди. Предварительно с помощью масс-спектрометрии была определена молекулярная масса белка, которая составила 35191,3 Да и было показано, что все восемь остатков цистеина в молекуле образуют четыре дисульфидные связи.
Путем секвенирования восстановленного и алкилированного глиадина γ-46 была определена его N-концевая аминокислотная последовательность (29 аминокислотных остатков), которая оказалась идентичной N-концевой аминокислотной последовательности глиадина клона pW1621 и глиадина γ-2, но отличалась рядом аминокислотных замен от других глиадинов.
В результате гидролиза иммобилизованного на тиопропил-сефарозе 6В глиадина γ-46 трипсином были выделены цистеинсодержащие пептиды глиадина γ-46, полная или частичная структура которых была установлена путем автоматической деградации по Эдману. В результате было просеквенировано 207 аминокислотных остатка. Дисульфидсодержащие пептиды глиадина γ-46 были получены путем ограниченного протеолиза интактного белка химотрипсином с последующим перевариванием дисульфидсодержащих фрагментов трипсином и химотрипсином. Расположение дисульфидных связей устанавливали путем секвенирования дисульфидсодержащих фракций и составляющих их пептидов и сравнения полученных последовательностей с предварительно определенной частичной первичной структурой глиадина γ-46. В результате в глиадине γ-46 было установлено расположение дисульфидных связей: Cys-173—Cys-192, Cys-212—Cys291, Cys-165—Cys-199, Cys-165—Cys-199 (или Cys-200), Cys-283 –Cys-200 (или -Cys-199).
4. Дисульфидное картирование альбумина семян подсолнечника: консервативные и вариабельные дисульфидные связи в суперсемействе проламинов злаков
Суперемейство проламинов злаков включает 3 основные группы белков: запасные проламины пшеницы, ржи и ячменя, ингибиторы альфа-амилаз и трипсина злаков, а также 2S запасные альбумины двудольных растений (Kreis, Shewry, 1989). Эти белки характеризуются консервативно расположенными остатками цистеина. Было высказано предположение, что этот консерватизм отражает ключевую роль остатков цистеина в стабилизации структуры белка за счет образования дисульфидных связей. Это утверждение нуждалось в подтверждении и проверке. В связи с этим, помимо дисульфидного картирования проламинов пшеницы, было определено расположение дисульфидных связей в другой группе белков, относящихся к суперсемейству проламинов - 2S запасных альбуминах, а именно, в метионин-богатом альбумине подсолнечника SFA8 (рис. 8).
| А. Аминокислотная последовательность SFA8 1PYGRGRTESGCYQQMEEAEMLNHCGMYLMKNLGERSQVSPRMREEDHKQLCCMQLKNLDEKCMCPAIMMMLNEPMWIRMRDQVMSMAHNLPIECNLMSQPCQM103 |
| В. Расположение дисульфидных связей в SFA8  |
Рис. 8. Дисульфидное картирование альбумина SFA8 подсолнечника. А – Аминокислотная последовательность белка SFA8. В – Дисульфидная карта белка SFA8.
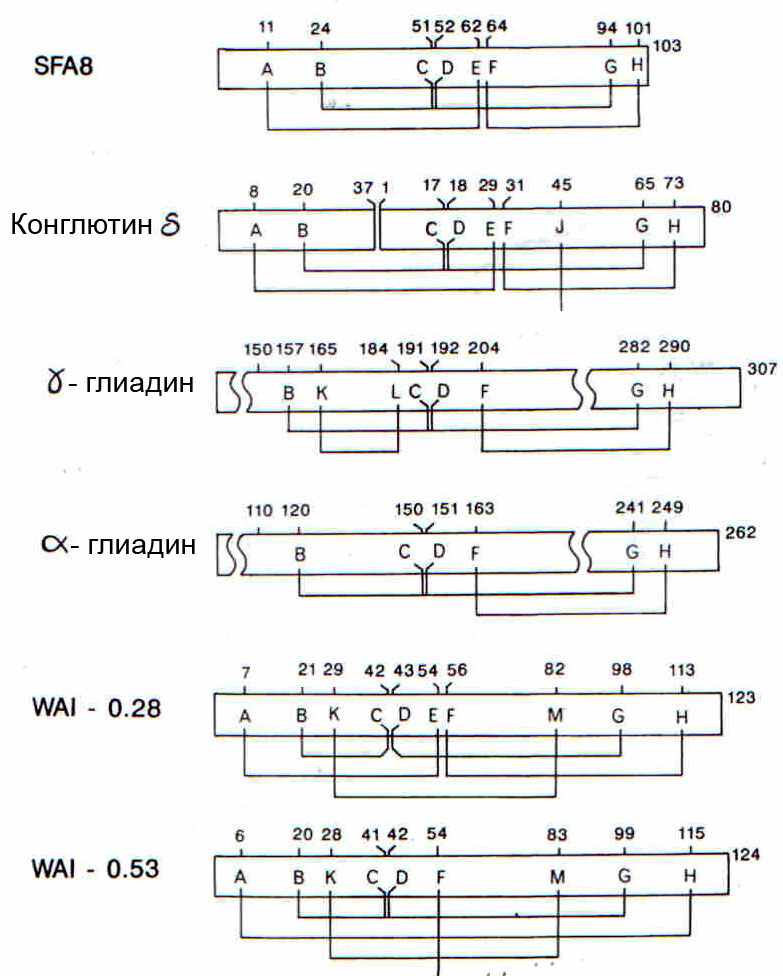
Сравнение расположения дисульфидных связей в белках семейства проламинов представлено на рис. 9. Полученные результаты свидетельствуют о высоком консерватизме в расположении дисульфидных связей в запасных белках как между глиадинами и 2S альбуминами, так и в пределах каждой из этих групп белков. Однако только две дисульфидные связи с участием двух соседних остатков цистеина (C/D) сохраняют свое положение в ингибиторах. Различия в расположении дисульфидных связей у ингибиторов по сравнению с запасными белками могут быть связаны с необходимостью поддерживать структуру активных центров для взаимодействия с ферментами-мишенями.
Рис. 9. Расположение дисульфидных связей в молекулах 2S альбуминов, глиадинов и ингибиторов ферментов злаков. Остатки цистеина обозначены буквами А-М. Дисульфидные связи в конглютине δ, WAI-0,28, WAI-0,53, α- и γ-глиадинах приведены в работах (Maeda et al., 1983; Lilley, Inglis, 1986; Strobl et al., 1995; Егоров, Одинцова и др. 1999).
5. Выделение и структурный анализ глютенинов
К началу наших исследований было известно, что качество клейковины зависит от нескольких параметров: размера полимеров глютенина, содержащих как низкомолекулярные (LMW), так и высокомолекулярные (HMW) субъединицы, соединенные, в отличие от глиадинов, межцепочечными дисульфидными связями (чем длиннее полимеры, тем лучше качество клейковины), а также от количества и состава HMW субъединиц. Было высказано предположение, что терминаторами роста полимерной цепи являются D субъединицы, которые являются глиадиноподобными белками, образовавшимися в результате мутаций генов ω-глиадинов, не содержащих остатков цистеина.
Был проведен поиск и выделение D субъединиц и родственных им ω-глиадинов из пшеницы сорта Чайниз Спринг. В результате было выделено 3 D субъединицы и несколько ω-глиадинов и показано, что D субъединицы имеют N-концевую последовательность, соответствующую ω-глиадинам, и содержат по одному остатку цистеина в молекуле, что подтвердило гипотезу о происхождении D субъединиц в результате мутаций генов ω-глиадинов. Кроме того, сравнительный анализ фракций глютенина, разделенных по размеру путем эксклюзионной жидкостной хроматографии, позволил выявить постепенное уменьшение содержания HMW субъединиц глютенина по мере уменьшения их молекулярного веса одновременно с увеличением содержания D субъединиц. Полученные результаты служат новым lдоказательством того, что D субъединицы играют роль терминаторов роста цепи глютенинов.
Были исследованы также HMW субъединицы изогенной линии L88-31, которая содержит только 2 субъединицы – 17 и 18, являющиеся аллельными вариантами субъединиц 7 и 9, соответственно. Наличие этих субъединиц коррелируют с хорошими технологическими характеристиками муки. Определение числа остатков цистеина в молекулах HMWx17 и HMWy18 выявило наличие 3,5 и 6,5 остатков, соответственно, что согласуется с числом остатков цистеина в субъединицах 1Вх17 (4 остатка) и 1By9 (7 остатков).
Для более детального исследования первичной структуры субъединиц 17 и 18 были выделены и секвенированы их цистеинсодержащие пептиды. Полученные данные представлены в табл. 3.
Таблица 3.
N-концевые аминокислотные последовательности цистеинсодержащих триптических пептидов HMWx17 и HMWy18
| Фракция | N-концевые аминокислотные последовательности | Гомологичная HMW |
| 4 | 27DVSPGXXPI35; 13ELQE16 | 1Bx7; 1By9 |
| 6 | 540QLGQ543 | 1By9 |
| 7 | 747AQQLAAQ753; 661VQQPAXQ667 | 1Bx7; 1By9 |
| 8 | 1EGEA4 | 1Bx7; 1By9 |
Полученные результаты свидетельствуют о том, что аминокислотные последовательности в окружении остатков цистеина в HMWx17 и HMWy18 консервативны и сходны с аналогичными последовательностями аллельной пары субъединиц 1Вх7 и 1By9. Таким образом, полученные нами данные свидетельствуют о том, что сходные технологические характеристики муки, обусловленные аллельными парами HMWx17 и HMWy18, с одной стороны, и 1Вх7 и 1By9, с другой, связаны с одинаковыми дисульфидными связями, которые они образуют в полимерах.
Для определения размеров полимеров глютенина нами был разработан метод, сочетающий в себе разделение полимеров глютенина в агарозном геле (рис. 10), элюцию белков из геля и определение размеров полимеров методом светорассеяния. В результате были определены молекулярные массы полимеров глютенина (табл. 4).

Рис. 10. Электрофоретическое разделение белков клейковины пшеницы сорта Chinese Spring в агарозном геле (A). Гель, аналогичный представленному на рис. А, разрезали на 8 частей, белки экстрагировали из агарозы и подвергали электрофорезу в тех же условиях (В).
Полученные нами результаты по измерению светорассеяния фракций глютенинов подтверждают, что электрофорез в агарозном геле разделяет полимеры глютенинов по Mr и показывают, что Mr этих полимеров варьирует от 500000 до 5 миллионов. Таким образом, нами предложен простой метод фракционирования глютенинов, а также других высокомолекулярных полимеров.
Таблица 4.
Вычисленные молекулярные веса фракций 1-8 (рис. 10А) полимеров глютенина
| Фракция | Rh (нм) | Полидисперс-ность (нм) | Mr x 105 |
| 1 | 22,6 | 12,5 | 56,3 |
| 2 | 19,6 | 10,9 | 39,7 |
| 3 | 16,6 | 8,1 | 26,3 |
| 4 | 13,0 | 7,2 | 14,7 |
| 5 | 12,4 | 6,9 | 12,9 |
| 6 | 9,5 | 5,3 | 6,9 |
| 7 | 10,2 | 5,7 | 8,2 |
| 8 | 9,3 | 5,2 | 6,6 |
