Структурные и функциональные свойства цитокинин-связывающих белков растений Arabidopsis thaliana L., Hordeum vulgare L., Oryza sativa L. 03. 00. 05 -ботаника
| Вид материала | Автореферат |
- Структурно-функциональные особенности запасных и защитных белков растений и их использование, 2418.56kb.
- Программа 9 16 ноября 2010 г г. Москва Место проведения конференции: Учреждение Российской, 265.18kb.
- Рабочей программы учебной дисциплины ботаника уровень основной образовательной программы, 95.26kb.
- Николаева Мария Андреевна, доктор технических наук, профессор, заведующий кафедрой, 367.89kb.
- Рабочая программа дисциплины «ботаника» Код дисциплины по учебному плану опд., 301.75kb.
- Библиография и ссылки «Анатомия и морфология растений», 6.79kb.
- Тема обмен белков. Вопросы лекции, 90.92kb.
- Биосинтез белков Интегрированный урок в 10-м классе(химия и биология). Цель урока, 27.63kb.
- Видовой состав лекарственных растений местной флоры, 396.37kb.
- Задачи я поставила следующие: -познакомиться с видами лекарственных растений,, 182.31kb.
На правах рукописи
ПРОКОПЦЕВА Ольга Сергеевна
Структурные и функциональные свойства цитокинин-связывающих белков растений Arabidopsis thaliana L., Hordeum vulgare L., Oryza sativa L.
03.00.05 –ботаника
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Астрахань – 2008
Работа выполнена в Институте физиологии растений им. К.А. Тимирязева РАН, г. Москва и в Астраханском государственном университете, г. Астрахань
Научный руководитель:
доктор медицинских наук, Епинетов Михаил
профессор Александрович
Научный консультант:
кандидат химических наук Кондаков Сергей Эмильевич
Официальные оппоненты:
доктор биологических наук, профессор Дудин Геннадий Петрович
доктор сельскохозяйственных наук, Смашевский Николай
доцент Дмитриевич
Ведущая организация: Российский государственный аграрный университет – МСХА им. К.А. Тимирязева
Защита состоится «6» ноября 2008г. в 10-00 часов на заседании совета по защите докторских и кандидатских диссертаций ДМ 212.009.10 при Астраханском Государственном Университете: г.Астрахань, пл. Шаумяна, 1, Актовый зал.
С диссертацией можно ознакомиться в библиотеке Астраханского Государственного Университета.
Автореферат разослан «___» сентября 2008г.
Ученый секретарь
диссертационного совета,
доктор биологических наук Федотова А.В.
Общая характеристика работы
Введение. Актуальность проблемы. Одной из центральных задач науки о растениях является исследование гормональной регуляции роста и развития растений. Это объясняется тем, что вся жизнь растения, начиная от оплодотворенной яйцеклетки и заканчивая отмиранием и смертью, происходит под контролем фитогормонов. Также фитогормоны играют важную роль в реакции растений на внешние воздействия. Именно благодаря большим адаптивным возможностям, растения могут вести «сидячий образ жизни», приспосабливаясь к изменяющимся условиям окружающей среды.
Воздействие гормонов на клетки осуществляется через специфические рецепторы. Изучение механизма действия гормонов заключается в исследовании их рецепторов и процессов, приводящих к проявлению специфического гормонального ответа. Кроме того, состав форм гормона и их количественное соотношение, необходимые для проявления того или иного ответа растительным организмом, поддерживаются в клетке белками-транспортерами гормонов и ферментами метаболизма гормона (ферментами синтеза, распада, модификации, которые могут преобразовать активную форму гормона в неактивную).
Существует пять основных групп гормонов растений - это ауксины, цитокинины, гиббереллины, этилен и абсцизовая кислота. Цитокининам принадлежит важная роль в течение всей жизни растений. Они участвуют в регуляции экспрессии цитокинин-чувствительных генов растений, регуляции деления клеток, дифференцировке хлоропластов, индукции стеблевого морфогенеза, осуществлении контроля корневой системы над ростом и развитием надземных органов растения, и др.
Описан мембранный рецептор цитокининов - гистидинкиназа, которая воспринимает внешний по отношению к клетке цитокинин. Кроме того, накапливаются факты, которые говорят о существовании альтернативного пути передачи цитокининового сигнала в растениях. В связи с этим был обнаружен ядерный растворимый цитокинин-связывающий белок 67 кДа (ЦСБ67), который в присутствии цитокинина активирует транскрипцию in vitro. Этот белок является кандидатом на роль внутриклеточного растворимого рецептора цитокинина растений, подобно ядерным рецепторам стероидных гормонов животных.
Обнаружение как мембранного, так и кандидата на внутриклеточный растворимого рецептор цитокинина, говорит о сложности системы восприятия цитокининового сигнала, и ставит вопрос о разделении функций между этими рецепторами. Так как мембранный рецептор цитокинина в основном локализован в корне, возможно, что в надземной части рецепция цитокинина происходит с помощью других белков. Возможно также, что мембранный и растворимый рецепторы цитокинина необходимы одновременно в растительной клетке, как это известно для хорошо изученных рецепторов стероидных гормонов животных. Мембранные рецепторы стероидных гормонов животных индуцируют быстрые ответы (активация сигнальных каскадов), ядерные рецепторы — более медленные ответы (усиление или ослабление транскрипции определенных генов). В некоторых случаях показано взаимодействие между мембранными и ядерными рецепторами. Для растений на настоящий момент такие данные отсутствуют.
Для понимания того, как гормональный цитокининовый сигнал регулирует рост и развитие растительного организма, проводится изучение белков-рецепторов цитокинина, а также цитокинин-связывающих белков с другими функциями. В связи с этим
ЦЕЛЬЮ РАБОТЫ было дать комплексную оценку структурных и функциональных свойств цитокинин-связывающих белков растений Arabidopsis thaliana L., Hordeum vulgare L., Oryza sativa L.
В соответствии с поставленной целью решались следующие задачи:
- Оценить структурное сродство цитокинин-связывающего белка ЦСБ67 Hordeum vulgare L. и мембранного рецептора цитокининов - гистидинкиназы CRE1/WOL/AHK4 Arabidopsis thaliana L..
- Сравнить структурные и функциональные свойства цитокинин-связывающего белка ЦСБ67 Hordeum vulgare L. и ауксин-связывающего белка Джонса АСБ65 Vigna radiata L.
- Оценить функциональную идентичность ЦСБ67 и транскрипционных систем, выделенных из растений, относящихся к разным таксономическим группам: Классу Однодольных (Hordeum vulgare L.) и Классу Двудольных (Arabidopsis thaliana L.).
- Определить структуру новых обнаруженных цитокинин-связывающих белков растений Arabidopsis thaliana L.и Oryza sativa L.
- Сравнить степень сродства цитокинин-связывающего белка аденозинкиназы Hordeum vulgare L. к природному цитокинину транс-зеатину со сродством к природному цитокинину зеатинрибозиду, синтетическому цитокинину 6-БАП, производным аденина и нуклеотидам: аденину, аденозину, АТФ, ГТФ, УТФ.
Научная новизна. Впервые показано, что ЦСБ67 не имеет структурного сродства с мембранным рецептором цитокининов - гистидинкиназой CRE1/WOL/AHK4. Впервые сделано предположение о возможной идентичности цитокинин-связывающего белка ЦСБ67 и ауксин-связывающего белка АСБ65 на основании сходных структурных, иммунохимических и функциональных свойств. Показана высокая консервативность белка ЦСБ67 и транскрипционных систем, выделенных из растений Класса Однодольных (Hordeum vulgare L.) и Класса Двудольных (Arabidopsis thaliana L.). Показано сходство структурных и функциональных свойств двух изоформ аденозинкиназы Arabidopsis thaliana L. (At3g09820 и At5g03300). Изучена степень сродства белков аденозинкиназ Hordeum vulgare L. к различным производным цитокининов и гомологичным им молекулам in vitro. В частности, обнаружено, что аденозинкиназа Hordeum vulgare L. не связывает синтетический цитокинин 6-БАП. Впервые показано, что тиаминаза Arabidopsis thaliana L. связывает цитокинин транс-зеатин in vitro.
Практическое значение работы. Метаболизм фитогормонов и механизм их действия исследуется для понимания того, как реализуется онтогенетическая программа растения и как растение реагирует на внешние воздействия. Эти знания крайне важны для решения практических задач биотехнологии и сельского хозяйства, то есть для получения полезных продуктов растительного происхождения в поле, в лаборатории и в заводских условиях.
В ходе проведения данной работы были разработаны и утверждены методические указания для определения индивидуальной чувствительности к пищевым продуктам (в частности, растительного происхождения) мелких домашних и сельскохозяйственных животных.
Апробация работы. Результаты работы были представлены на V Съезде Общества физиологов растений, Пенза, 15-21 сент. 2003г, на Международной научной конференции «Ломоносов-2008», Москва, 7-11 апр. 2008г, а также на III Всероссийской конференции-школе «Высокореакционные интермедиаты химических реакций и биологических процессов», Астрахань, 14-17 авг. 2008г.
Публикации. По материалам диссертации опубликовано 3 статьи, 3 тезиса докладов, а также 1 методические указания.
Объем и структура диссертации. Диссертация состоит из введения, обзора литературы, описания объектов и методов исследования, результатов и их обсуждения, заключения, выводов, одного приложения и списка литературы.
Работа изложена на 106 страницах машинописного текста и содержит 13 рисунков и 9 таблиц. В списке литературы 179 наименований.
Содержание диссертации
Введение
Содержит краткое обоснование выбора диссертационной темы, в нем сформулирована цель работы, приведены основные положения, отражена научная новизна, представлена структура и общее содержание работы.
Первая глава
В первой главе на основе анализа научной литературы обсуждаются:
- современные представления о роли группы фитогормонов цитокининов в жизнедеятельности растений;
- современные представления о передаче сигнала цитокининов в растении c помощью мембранного рецептора и о структуре двухкомпонентной системы растений;
- другие возможные пути передачи цитокининового сигнала в растении; научные факты, указывающие на существование растворимого рецептора цитокинина у растений;
- свойства растительного цитокинин-связывающего белка ЦСБ67 как возможного кандидата на растворимый рецептор к цитокинину;
- роль ферментов метаболизма цитокининов (синтеза, распада и модификации), в частности аденозинкиназ, в передаче гормонального сигнала и жизнедеятельности растительной клетки;
- цитокинин-связывающие белки растений: их изучение, выделение и функции;
- гормон-связывающие глютатион-трансферазы и их роль в растении.
Вторая глава
Содержит описание объектов и методов исследования:
Объектами исследования были выбраны растения с расшифрованными последовательностями генома: Arabidopsis thaliana L., экотип Colambia (3 и 6-недельные розетки листьев); Oryza sativa L., сорт «Юпитер» (листья 4-х недельных растений). Также в качестве объектов использовались Hordeum vulgare L., сорт «Луч» (закончившие рост 9-10-дневные листья первого яруса); Vigna radiata L. (3-х дневные этиолированные проростки).
Применялось несколько схем выделения белков. Для выделения цитокинин-связывающих белков сначала проводили гель-фильтрацию экстракта из цитозоли или ядер растений на сефадексе G-50 и гидрофобную хроматографию на фенил-сефарозе, затем раствор белков наносили на специально синтезированные аффинные смолы зеатинрибозид-сефарозу или глютатион-сефарозу. Цитокинин-связывающие белки вытесняли с зеатинрибозид-сефарозы неспецифически щелочью или специфически: гормонами и лигандами. в низкой концентрации (0,5-5мМ), чтобы предупредить неспецифическое вытеснение, связанное с увеличением ионной силы раствора. Очищенные таким образом белки тестировались методом твердофазного иммуноферментного анализа на нитроцеллюлозной мембране или полистироловом планшете с помощью антиидиотипических антител к транс-зеатину, антиидиотипических антител к ИУК, антител на пептид N-конца АСБ65 (CASTKRVLV). Антиидиотипические антитела являются вторичными антителами к антителам на гормон и представляют собой антитела к гормон-связывающему участку белка.
Для поиска новых цитокинин-связывающих белков Arabidopsis thaliana L. и Oryza sativa L. проводилось специфическое вытеснение белков этих растений с зеатинрибозид-сефарозы цитокинином транс-зеатином в низкой концентрации (1мМ), электрофорез в денатурирующих условиях полученной цитокинин-связывающей фракции белков. Идентификация белков по результатам MALDI масс-спектрометрии белковых полос осуществлялась с использованием поисковой системы Mascot (www.matrixscience.com) в доступной базе данных NCBInr для Arabidopsis thaliana L. и Oryza sativa L.
Для определения степени сродства белков аденозинкиназ Hordeum vulgare L. к различным производным цитокининов и другим молекулам, проводилась вытеснение этими лигандами в равной концентрации (0,5мМ) белков с аффинной смолы зеатинрибозид-сефарозы.
Третья глава
Содержит результаты проведенных исследований и их обсуждение.
3.1. Взаимодействие ЦСБ67 с антителами к консервативной последовательности гистидинкиназ.
К настоящему времени описано семейство мембранных гибридных гистидинкиназ Arabidopsis thaliana L. (AHK2, AHK3, AHK4), причем одна из них (CRE1/WOL/AHK4) является мембранным рецептором цитокинина. Поликлональные антитела на консервативный пептид гистидинкиназ не взаимодействовали с выделенным ЦСБ67 (см. рис.2, трек 5). Кроме того, в отличие от гистидинкиназ AHK, ЦСБ67 не является мембранным белком. Таким образом, ЦСБ67 не относится к белкам класса гистидинкиназ.
3.2. Изучение свойств цитокинин-связывающего белка ЦСБ67 и ауксин-связывающего белка АСБ65 Джонса.
ЦСБ67 из 10-дневных листьев Hordeum vulgare L., полученный путем неспецифического вытеснения щелочью с зеатинрибозид-сефарозы, взаимодействовал с антителами на пептид АСБ65, а также с антиидиотипическими антителами к ИУК (рис.2). Также был выделен АСБ65 из 3-дневных этиолированных проростков Vigna radiata L. по методу Джонса, с помощью очистки на Q-сефарозе, который взаимодействовал на иммуноблоте с антиидиотипическими антителами к транс-зеатину (рис.1). Таким образом, каждый из белков АСБ65 и ЦСБ67 содержит три идентичные иммунодетерминанты, так как взаимодействует с тремя типами используемых антител: с антиидиотипическими антителами к транс-зеатину, с антиидиотипическими антителами к ИУК и с антителами на пептид АСБ65 (CASTKRVLV). При этом исключена вероятность того, что общие иммунодетерминанты сходны с бычьим сывороточным альбумином, к которому пришивались гормоны и пептид для иммунизации, так как ЦСБ67 не взаимодействует с антителами к пептиду из 19 аминокислот консервативного домена гистидинкиназ (рис.2), которые также были получены иммунизацией кроликов конъюгатом пептида с бычьим сывороточным альбумином.
Так как АСБ65 задерживается глютатион-сефарозой и N-концевая последовательность АСБ65 высоко гомологична некоторым из растительных глютатион-трансфераз, было сделано предположение, что ЦСБ67 также будет связываться с глютатион-сефарозой. С помощью глютатион-сефарозы была получена фракция белков из ядер 10-дневных листьев Hordeum vulgare L., связавшаяся с этой смолой и специфически вытесняемая со смолы восстановленным глютатионом в низкой концентрации (5мМ). Эта фракция использовалась для выделения цитокинин-связывающих белков с помощью аффинной хроматографии на зеатинрибозид-сефарозе с неспецифическим вытеснением щелочью. В результате был получен белок, который определен как ЦСБ67 (рис.3), поскольку он взаимодействовал с антиидиотипическими антителами к транс-зеатину, а также усиливал синтез РНК in vitro до 300% в совокупности с транс-зеатином в транскрипционной системе, содержащей хроматин и связанную с ним РНК-полимеразу I из листьев Hordeum vulgare L. Следовательно, ЦСБ67 является глютатион-связывающим белком.
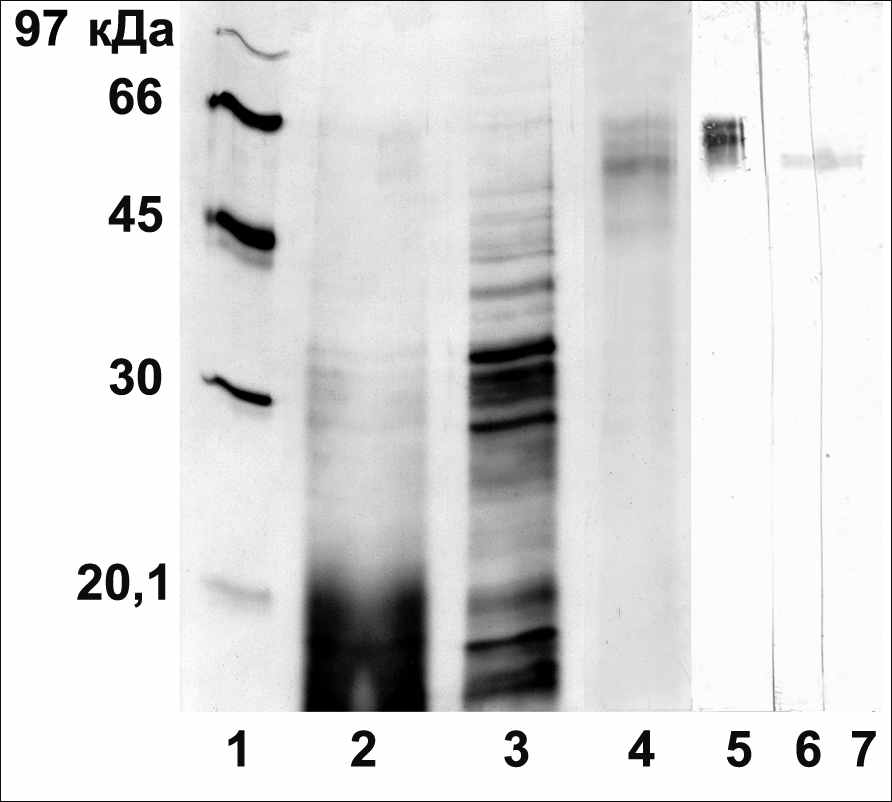
Рис. 1. 1-4: очистка АСБ65 Vigna radiata L., электрофорез в ДДС-Na-ПААГ, окраска серебром; 5-7: иммуноблоты очищенного АСБ65. 1- маркеры; 2 - фракция, осажденная сульфатом аммония; 3 - фракция после очистки на фенил-сефарозе; 4 - фракция после очистки на Q-сефарозе; 5 - антитела к пептиду АСБ65; 6 - антиидиотипические антитела к ИУК; 7 - антиидиотипические антитела к транс-зеатину.
Было проведено определение глютатион-трансферазной активности очищенного ядерного и цитозольного ЦСБ67 в реакции с субстратом CDNB in vitro. Ферментативной активности обнаружено не было (табл.1). Для АСБ65 также известно, что он не проявляет глютатион-трансферазной активности с CDNB, однако показывает незначительную активность (120% по сравнению с контролем) с субстратом металохлором. Таким образом, нельзя исключать, что АСБ65 и ЦСБ67 обладают глютатион-трансферазной активностью с другими субстратами. Также вероятно, что они теряют способность проявлять глютатион-трансферазную активность в результате модификации белков при их выделении.

Рис. 2. ЦСБ67 Hordeum vulgare L. 1: электрофорез в ДДС-Na-ПААГ, окраска Кумасси; 2-5: иммуноблоты очищенного ЦСБ67. 1 - очищенный ЦСБ67; 2 - антиидиотипические антитела к транс-зеатину; 3 - антитела к пептиду АСБ65; 4 - антиидиотипические антитела к ИУК; 5 – антитела к консервативной последовательности гистидинкиназ.
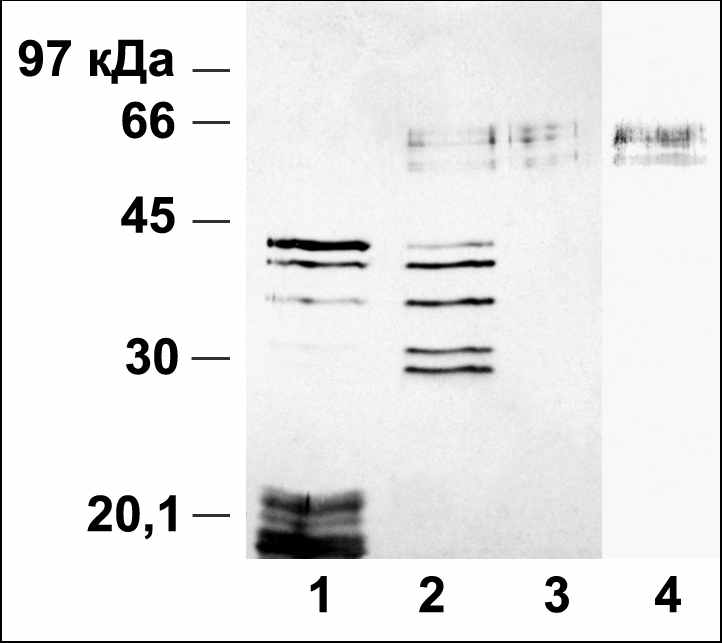
Рис. 3. Очистка ЦСБ67 из ядер Hordeum vulgare L. с помощью глютатион-сефарозы. 1-3: электрофорез в ДДС-Na-ПААГ, окраска серебром, 4: иммуноблот. 1 – белок ядер Hordeum vulgare L., 2 – фракция после очистки на глютатион-сефарозе, 3 – фракция после очистки на зеатинрибозид-сефарозе; 4 – иммуноблот выделенного белка с антиидиотипическими антителами к транс-зеатину.
В результате проведенных исследований было сделано предположение, что АСБ65 и ЦСБ67 принадлежат к одному классу растительных белков, т.к. обладают одинаковыми структурными и функциональными характеристиками и, таким образом, они являются аналогичными белками, выделенными из разных видов растений, Hordeum vulgare L. и Vigna radiata L.
Табл. 1. Глютатион-трансферазная-активность ЦСБ67, выделенного из ядер Hordeum vulgare L. и из цитозоли Hordeum vulgare L., с субстратом CDNB (данные усреднены по 10 повторностям).
-
Контроль
ЦСБ67 из ядер
ЦСБ67 из цитозоли
Оптическая плотность, 340 нм
0,180
0,189
0,182
Значения в %, относительно контроля
100
105
101
На основании того, что ЦСБ67 и АСБ65 имеют одинаковые свойства, также было сделано предположение, что ЦСБ67 связывает не только гормон цитокинин, но и ауксин. Для выяснения того, связываются цитокинин и ауксин одним участком ЦСБ67 или разными, проведилось вытеснение антиидиотипических антител к транс-зеатину с помощью транс-зеатина и ИУК в системе конкурентного твердофазного иммуноферментного анализа на микропланшетах. При увеличении концентрации транс-зеатина уже до 10-8М, он практически полностью вытеснял антиидиотипические антитела к транс-зеатину (рис.4). Тогда как ИУК во всем исследуемом диапазоне концентраций 10-9-10-5М не вытесняла антиидиотипические антитела к транс-зеатину. Следовательно, если ЦСБ67 связывает гормоны транс-зеатин и ИУК, то связывание осуществляется разными участками этого белка.
Антитела на пептид N-конца белка АСБ65 CASTKRVLV не вытеснялись транс-зеатином и ИУК во всем исследуемом диапазоне концентраций гормонов (10-9-10-5М) в системе конкурентного твердофазного ИФА (рис.5). Это говорит о том, что участок ЦСБ67, гомологичный пептиду CASTKRVLV и взаимодействующий с антителами на пептид АСБ65, не участвует в связывании ауксина и цитокинина.
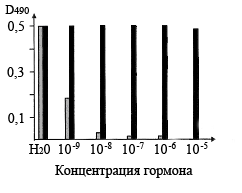
Рис. 4. Вытеснение антиидиотипических антител к транс-зеатину, связанных с ЦСБ67 Hordeum vulgare L., транс-зеатином (серые столбики) и ИУК (черные столбики).

Рис. 5. Вытеснение антител к пептиду АСБ65, связанных с ЦСБ67 Hordeum vulgare L., транс-зеатином (серые столбики) и ИУК (черные столбики).
ЦСБ67 и АСБ65 связывают восстановленный глютатион, гомологичны растительным глютатион-трансферазам класса phi, при этом не обнаружена глютатион-трансферазная активность ЦСБ67 и АСБ65 с субстратом CDNB in vitro. Однако надо отметить, что в отличие от большинства глютатион-трансфераз, для которых характерна молекулярная масса 24-26кДа, АСБ65 и ЦСБ67 имеют молекулярную массу 65-67кДа.
Согласно данным последних лет, глютатион-трансферазы являются не просто участниками в детоксикации ксенобиотиков, а полифункциональными белками с самыми разнообразными функциями. Предполагаются следующие функции связывания гормонов ауксинов и цитокининов растительными глютатион-трансферазами: 1) участие в передаче гормонального сигнала в растении путем гормон-зависимого связывания с протеинкиназами, возможность чего показано на глютатион-трансферазах животных; 2) участие в транспорте гормонов; 3) защита гормонов от метаболизации неспецифическими оксидазами путем его обратимого связывания; 4) регуляция уровня свободного гормона внутри клетки путем его обратимого связывания; 5) модуляция ферментативной активности глютатион-трансфераз гормоном in vivo.
3.3. Изучение активации транскрипции белком ЦСБ67 in vitro.
Ранее было показано, что ЦСБ67 в совокупности с транс-зеатином усиливает синтез РНК in vitro в 2-3 раза в транскрипционной системе, содержащей хроматин и связанную с ним РНК-полимеразу I из листьев Hordeum vulgare L. Согласно результатам данной работы, ЦСБ67 из ядер 6-недельных розеток листьев Arabidopsis thaliana L. усиливает синтез РНК in vitro более чем в 3 раза в совокупности с транс-зеатином в транскрипционной системе, содержащей хроматин и связанную с ним РНК-полимеразу I из листьев Hordeum vulgare L. (табл.2). Таким образом, цитокинин-связывающие белки ЦСБ67, выделенные из разных системных групп растений (Hordeum vulgare L. – Класс Однодольные; Arabidopsis thaliana L.– Класс Двудольные) являются консервативными, а также консервативны транскрипционные системы, выделенные из этих объектов.
Выделенный с помощью глютатион-сефарозы и зеатинрибозид-сефарозы из ядер 10-дневных листьев Hordeum vulgare L., ЦСБ67 усиливал синтез РНК in vitro до 300% в совокупности с транс-зеатином в транскрипционной системе, содержащей хроматин и связанную с ним РНК-полимеразу I из листьев Hordeum vulgare L.
АСБ65, выделенный с помощью преципитации сульфатом аммония, фенил-сефарозы, Q-сефарозы, не усиливал синтез РНК in vitro в совокупности с транс-зеатином в транскрипционной системе, содержащей хроматин и связанную с ним РНК-полимеразу I из листьев Hordeum vulgare L. Предполагается, что полученный таким образом белок не был активен, так как в схеме его очистки применялось осаждение сульфатом аммония.
После предобработки ЦСБ67 в эквимолярном количестве реактивом Эллмана, блокирующим свободные SH-группы и добавлении его в систему транскрипции in vitro, усиления транскрипции не наблюдалось (табл.2). Сделано предположение, что для проявления активности ЦСБ67, необходимы его свободные SH-группы.
Таблица 2. Влияние ЦСБ67 из ядер 6-недельных розеток листьев Arabidopsis thaliana L. на синтез РНК in vitro в транскрипционной системе, содержащей хроматин и связанную с ним РНК-полимеразу I из листьев Hordeum vulgare L.
| ЦСБ67, нг | транс-зеатин, 10-7М | Включение [Н3] УМФ | |
| Имп/мин на 10 мкг ДНК | % | ||
| - | - | 26784 | 10 |
| - | + | 25844 | 97 |
| 20 | - | 30773 | 115 |
| 20 | + | 97891 | 319 |
| 40 | + | 79338 | 297 |
| 20 (предобработан реактивом Эллмана) | - | 19980±486 | 75 |
| 20 (предобработан реактивом Эллмана) | + | 18962±531 | 71 |
3.4. Поиск и идентификация новых цитокинин-связывающих белков Arabidopsis thaliana L. и Oryza sativa L.
Была проведена очистка белков, специфически связывающих транс-зеатин, из растений с расшифрованной последовательностью генома: 4-недельных листьев Oryza sativa L. и 3-недельных розеток листьев Arabidopsis thaliana L. В отличие от схемы очистки для ЦСБ67, где белки с аффинной смолы зеатинрибозид-сефарозы неспецифически вытеснялись щелочью, в данном случае проводилась специфическое вытеснение — раствором транс-зеатина в низкой концентрации (1мМ). Таким образом, можно однозначно заключить, что полученные белки являются цитокинин-связывающими in vitro.
С помощью масс спектрометрии белковых полос цитокинин-связывающей фракции, для Arabidopsis thaliana L. в полосах 150, 80, 45, 42кДа (рис.6) была идентифицирована смесь двух изоформ белков аденозинкиназ: АДК1 (ген At3g09820) и АДК2 (At5g03300). При этом для АДК1 и АДК2 в этих полосах счёт составлял от 82 до 182 (при достоверно значимом счёте более 60), за исключением полосы 80кДа, где счет был 42 для АДК2 и 40 для АДК1, и другие белки для этой полосы также не были достоверно определены. Белки АДК1 и АДК2 во всех полосах, где были идентифицированы, присутствовали в смеси. Об этом говорит тот факт, что среди определенных пептидов, были как общие для родственных белков АДК1 и АДК2, так и специфические только для АДК1 или АДК2. Так, например, в полосе для Arabidopsis thaliana L. 42кДа было определено 10 пептидов, общих для АДК1 и АДК2; 7 пептидов, специфических только для АДК2; 6 пептидов, специфических только для АДК1. Таким образом, в полосах 150, 80, 45, 42кДа белки АДК1 и АДК2 присутствуют в смеси, т.е. оба этих белка имеют сходные структурные свойства и являются цитокинин-связывающими in vitro.
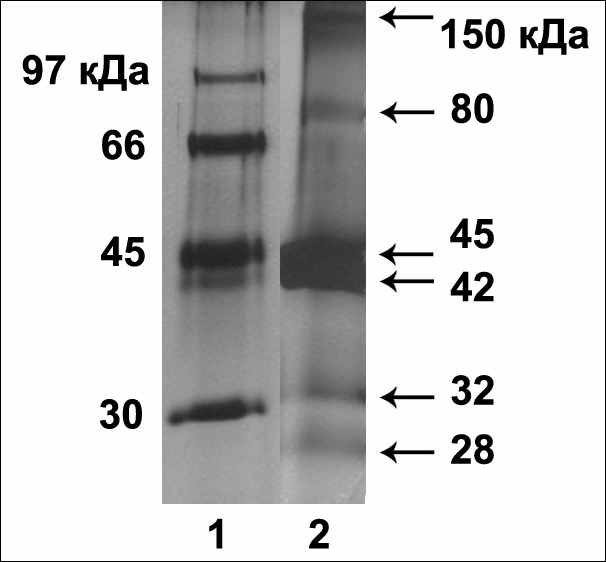
Рис. 6. Выделение цитокинин-связывающих белков из 3-недельных розеток листьев Arabidopsis thaliana L.. Электрофорез в ДДС-Na-ПААГ, окраска серебром. 1 – маркеры; 2 – фракция, вытесненная с зеатинрибозид-сефарозы транс-зеатином 1мМ.
Для Oryza sativa L. был выявлен и достоверно определен белок аденозинкиназа с молекулярной массой 42кДа (Os02g0625500) (рис.7). Тогда как для Arabidopsis thaliana L. с помощью аффинной смолы зеатинрибозид-сефарозы очищались белки АДК1 и АДК2 в смеси, то для Oryza sativa L. с помощью метода фингерпринта была определена только одна из двух аденозинкиназ, чьи гены присутствуют в геноме. Можно предположить, что ген второй аденозинкиназы Oryza sativa L. (Os04g0518000) не экспрессируется в растении, или его продукт не выделятся с помощью используемой для очистки схемы, так как его структурные и функциональные свойства значительно отличаются от продукта гена Os02g0625500.
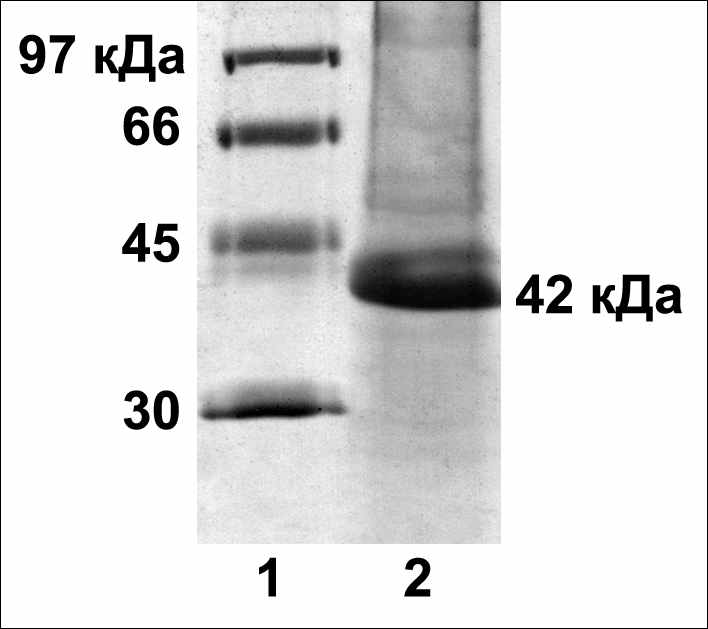
Рис. 7. Выделение цитокинин-связывающих белков из 30-дневных листьев Oryza sativa L. Электрофорез в ДДС-Na-ПААГ, окраска серебром. 1 – маркеры; 2 – фракция, вытесненная с зеатинрибозид-сефарозы транс-зеатином 1мМ.
Ранее было показано, что аденозинкиназы связываются с зеатин-сефарозой и вытесняются с нее транс-зеатином, фосфорилируют аденозин, дигидрозеатин, изопентениладенин, зеатинрибозид in vitro. Роль связывания ферментами аденозинкиназами цитокининов может заключаться: в преобразовании рибозидов и оснований цитокининов в соответствующие нуклеотиды, что происходит, например, при добавлении экзогенных цитокининов; в поддерживании оптимального уровня активных форм цитокининов в клетке; в обеспечении регуляции метаболизма цитокининов, связанного с клеточным циклом растительных клеток. Белки аденозинкиназы являются белками «домашнего хозяйства», их гены экспрессируются конститутивно, белки присутствуют в клетках в значительном количестве и являются абсолютно необходимыми для обеспечения жизнедеятельности клетки.
Белок полосы 32кДа Arabidopsis thaliana L. предположительно определен как протеинкиназа НТ1 (ген At1g62400).
Белок полосы 28кДа Arabidopsis thaliana L. достоверно определен как тиаминаза (ген At3g16990). Ген At3g16990 соответствует гибридному эукариотическому белку ThiD-TenA, который содержит на С-конце фрагмент, схожий с бактериальным активатором транскрипции (TenA), и на N-конце фрагмент, родственный HMP-P киназам, вовлеченным в биосинтез тиамина/витамина В1 (ThiD). Тиаминазы растений не изучены, известна третичная структура тиаминазы, в результате определения которой исследователями была обнаружена плотность в структуре белка, которая вставлена между двумя ароматическими кольцами и имеет размер и форму пурина или индола. Было сделано предположение, что плотность может образовывать молекула растительного гормона – цитокинина или ауксина, что согласуется с полученными нами данными о связывании тиаминазой гормона транс-зеатина in vitro. Физиологический смысл этого связывания остается неизвестным.
3.5. Вытеснение белка аденозинкиназы Hordeum vulgare L. с зеатинрибозид-сефарозы различными производными цитокининов и гомологичными им молекулами.
Фракция гидрофобных белков из 10-дневных листьев Hordeum vulgare L. наносилась зеатинрибозид-сефарозу. Специфическое вытеснение аденозинкиназы проводилась в промывочном растворе с добавлением лиганда в концентрации 0,5-1мМ.
На рис.8 и рис.9 видно, что транс-зеатин и АТФ вытесняли сходное количество белка аденозинкиназы с зеатинрибозид-сефарозы. Может существовать два объяснения этому факту: АТФ и транс-зеатин связываются в одном месте аденозинкиназы, и добавление свободного АТФ в вытесняющий раствор вытесняет транс-зеатин из места связывания, освобождая белок. Также возможно, что связывание АТФ и транс-зеатина осуществляется в разных местах, и вытеснение с помощью АТФ происходит в результате изменения конформации белка при связывании АТФ с АТФ-связывающим участком. Количество вытесненного со смолы белка прямо пропорционально количеству добавленного в вытесняющий раствор лиганда, причем степень точности достаточно высока (см. рис.8, 9). Таким образом, количество белка аденозинкиназы, вытесненного со смолы лигандом, пропорционально двум факторам: количеству добавленного в вытесняющий раствор лиганда, а также степени сродства лиганда к белку.
Было проведено вытеснение белков аденозинкиназ Hordeum vulgare L. с зеатинрибозид-сефарозы с помощью различных производных цитокининов и гомологичных им молекул в концентрации 0,5мМ (см. рис.10, 11). Количество белка аденозинкиназы, вытесненного транс-зеатином было принято за 100%. Данные обработаны с помощью программы 1DScan EX.
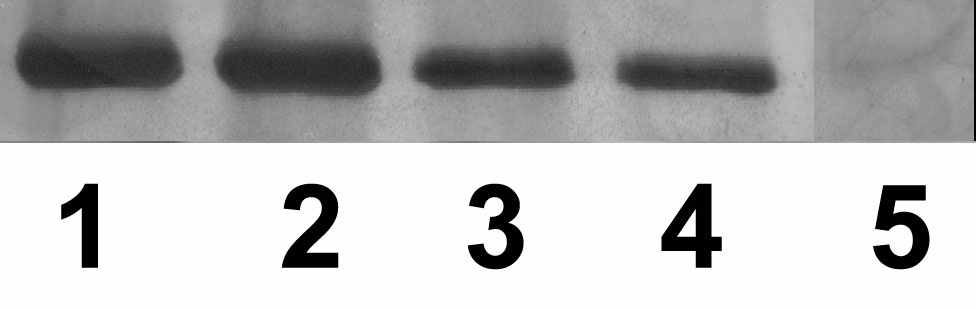
Рисунок 8. Вытеснение аденозинкиназы Hordeum vulgare L. с зеатинрибозид-сефарозы добавлением транс-зеатина и АТФ в разных концентрациях: 1 - транс-зеатин 1мМ; 2 - АТФ 1мМ; 3 - транс-зеатин 0,5мМ; 4 - АТФ 0,5мМ; 5 - контроль (промывочный раствор). Электрофорез в ДДС-Na-ПААГ, окраска серебром.

Рисунок 9. Относительное количество вытесненного белка аденозинкиназы Hordeum vulgare L. (по данным рис.9). Количество белка, вытесненного транс-зеатином 1мМ, принято за 100%. 1 - транс-зеатин 1мМ; 2 - АТФ 1мМ; 3 - транс-зеатин 0,5мМ; 4 - АТФ 0,5мМ; 5 - контроль.
Согласно полученным результатам, аденозинкиназа Hordeum vulgare L. имеет сходную степень сродства к транс-зеатину и зеатинрибозиду, а также к аденину и аденозину, т.е. появление рибозной группы в молекуле пурина не влияет на степень сродства белка с гормоном, что согласуется с функцией аденозинкиназы - фосфорилированием рибозидов с использованием АТФ в качестве донора фосфорила, и свободных оснований производных аденина с использованием фосфорибозила. Таким образом, наличие или отсутствие рибозного остатка в молекуле пурина не изменяет значимо степень сродства белка к лиганду.

Рисунок 10. Вытеснение аденозинкиназы Hordeum vulgare L., связанной с зеатинрибозид-сефарозой, различными лигандами (0,5мМ): 1 - зеатинрибозид; 2 - аденозин; 3 - АТФ; 4 - транс-зеатин; 5 - аденин; 6 - 6-БАП; 7 -ГТФ; 8 -УТФ; 9 - контроль (промывочный раствор). Электрофорез в ДДС-Na-ПААГ, окраска серебром.
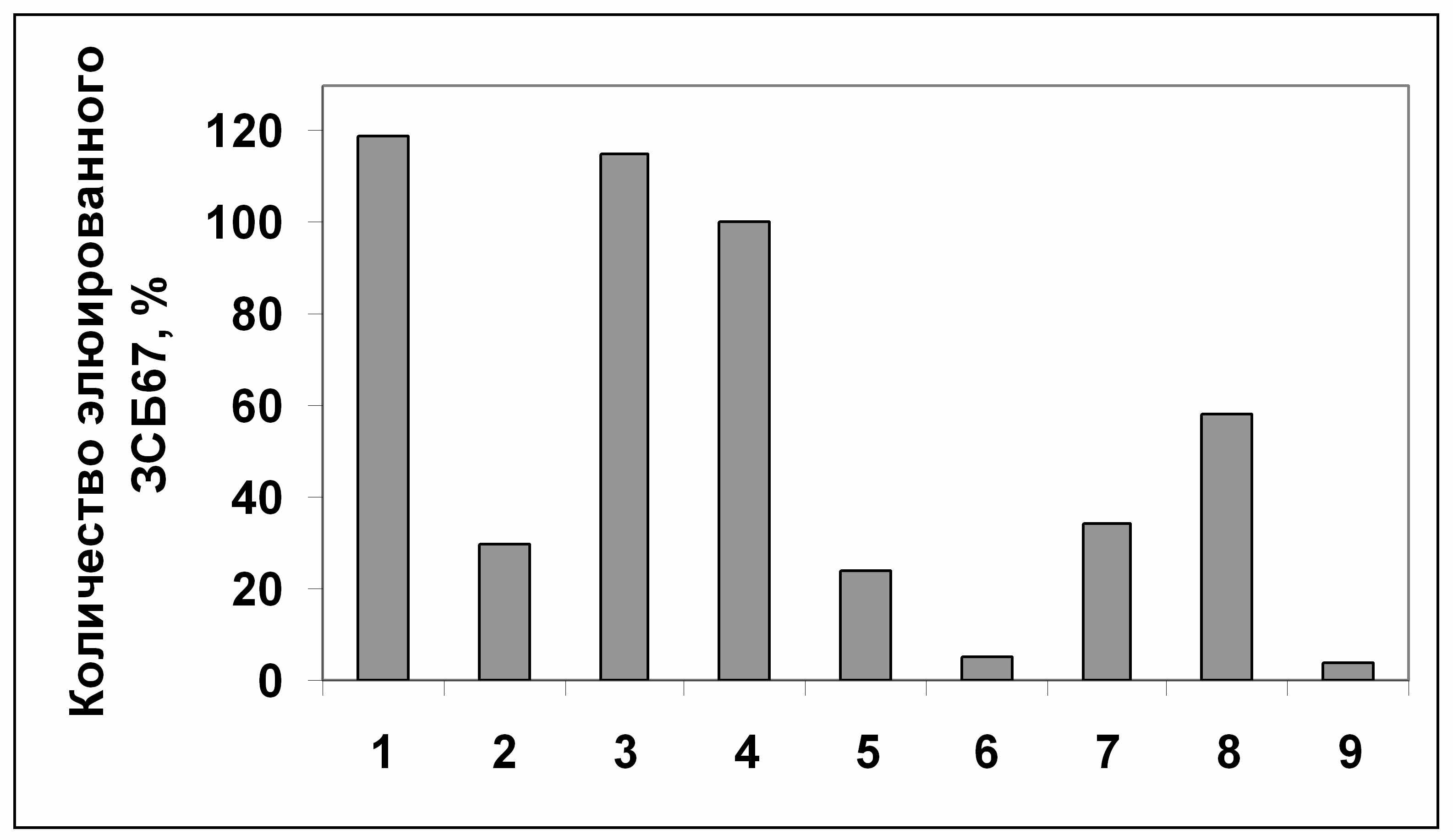
Рисунок 11. Относительное количество вытесненного белка аденозинкиназы Hordeum vulgare L. (по данным рис.10). Количество белка, вытесненного транс-зеатином 0,5 мМ, принято за 100%. 1 - зеатинрибозид; 2 - аденозин; 3 - АТФ; 4 - транс-зеатин; 5 - аденин; 6 - 6-БАП; 7 -ГТФ; 8 -УТФ; 9 - контроль.
Аденин и аденозин, которые считаются классическим субстратом аденозинкиназы, снимают примерно в 4 раза меньше белка, чем транс-зеатин и его производные. Известно, что субстратом аденозинкиназы in vitro являются аденозин и некоторые производные цитокининов (дигидрозеатин, изопентениладенин, зеатинрибозид), но активность фермента с использованием в качестве субстратов цитокининов, ниже, чем с использованием аденозина. Согласно полученным нами результатам, аденозинкиназа связывает транс-зеатин с большей степенью сродства, чем аденозин.
Синтетический цитокинин 6-БАП не вытесняет белок аденозинкиназу с зеатинрибозид-сефарозы. Следовательно, в результате замены боковой группы транс-зеатина на бензольное кольцо, нарушается связывание белка с лигандом, при этом отсутствие радикала в этом положении (как у аденина) уменьшает сродство белка к лиганду примерно в 4 раза, но не полностью. Это согласуется с тем, что искусственный цитокинин 6-БАП вызывает физиологический эффект в растении (вероятно, путем взаимодействия с цитокининовыми рецепторами), однако в отличие от натуральных цитокининов, 6-БАП является высоко стабильным в растении. Можно предположить, что такая особенность объясняется тем, что 6-БАП не используется в качестве субстрата ферментами метаболизма цитокининов, в частности, не фосфорилируется аденозинкиназой.
ГТФ вытесняет со смолы примерно в 3 раза и УТФ в 2 раза меньше аденозинкиназы, чем АТФ. Т.е., сродство белка к другим нуклеотидам значительно ниже по сравнению со сродством к АТФ.
Выводы
- Установлено, что ЦСБ67 Hordeum vulgare L. не имеет структурного сродства с мембранным рецептором цитокининов гистидинкиназой CRE1/WOL/AHK4 Arabidopsis thaliana L..
- Установлено, что цитокинин-связывающий белок ЦСБ67 Hordeum vulgare L. и ауксин-связывающий белок Джонса Vigna radiata L. имеют сходные структурные и функциональные свойства, а именно: молекулярную массу, три общие иммунодетерминанты, связывание глютатиона, отсутствие глютатион-трансферазной активности.
- Обнаружено сродство и возможная идентичность ЦСБ67 Hordeum vulgare L. и АСБ65 Vigna radiata L., а также способность ЦСБ67 связывать гормон ауксин.
- Установлена функциональная идентичность ЦСБ67 и транскрипционных систем, выделенных из растений, относящихся к разным таксономическим группам: Классу Однодольных (Hordeum vulgare L.) и Классу Двудольных (Arabidopsis thaliana L.).
- Определена первичная структура цитокинин-связывающих белков Arabidopsis thaliana L.: АДК1 (At3g09820), АДК2 (At5g03300), тиаминазы (At3g16990) и предположительно протеинкиназы НТ1 (At1g62400); а также цитокинин-связывающего белка Oryza sativa L.: АДК (Os02g0625500).
- Определена степень сродства цитокинин-связывающего белка аденозинкиназы Hordeum vulgare L. к природному цитокинину: зеатинрибозиду, синтетическому цитокинину: 6-БАП, а также к производным аденина и нуклеотидам: аденину, аденозину, АТФ, ГТФ; УТФ, по сравнению со сродством к природному транс-зеатину.
Публикации по материалам диссертационной работы
- Кулаева О.Н., Прокопцева О.С. Новейшие достижения в изучении механизма действия фитогормонов // Биохимия. 2004. Т.69. №3. C. 293-311.
- Мейчик Н.Р., Ермаков И.П., Прокопцева О.С. Диффузия органического катиона в клеточных стенках корня // Биохимия. 2003. Т. 68. №7. C. 926-940.
- Selivankina S.Yu., Karavaiko N.N., Maslova G.G., Zubkova N.K., Prokoptseva O.S., Smith A.R., Hall M.A., Kulaeva O.N. (2004) Cytokinin-binding protein from Arabidopsis thaliana leaves participating in transcription regulation // Plant Growth Regulation. V. 43. pp. 15-26.
- Прокопцева О.С., Каравайко Н.Н., Селиванкина С.Ю., Зубкова Н.К., Кулаева О.Н. Биохимическая характеристика ядерного цитокинин-связывающего белка (67КДА) // Сборник трудов V Съезда Общества физиологов растений. C. 470. Пенза, 15-21 сент. 2003г.
- Прокопцева О.С., Епинетов М.А., Кондаков С.Э. Очистка зеатин-связывающих белков и идентификация их генов // Сборник трудов Международной научной конференции «Ломоносов-2008». C. 292. Москва, 7-11 апр. 2008.
- Прокопцева О.С., Епинетов М.А., Кондаков С.Э. Изучение сродства белков аденозинкиназ ячменя к производным растительных гормонов цитокининов и гомологичным им молекулам // Тез. докл. III Всероссийской конференции — школы «Высокореакционные интермедиаты химических реакций и биологических процессов». — Астрахань – Москва. C. 20.
- Кузьмин В.А., Святковский А.В., Прокопцева О.С., Кондаков С.Э., Короткина С.А. (2007) Метод определения индивидуальной чувствительности к пищевым продуктам и коррекции патологических состояний мелких домашних и сельскохозяйственных животных // Методические указания для ветеринарных врачей. Министерство сельского хозяйства РФ, Санкт-Петербург.
