Структурно-функциональные особенности запасных и защитных белков растений и их использование в генетических исследованиях
| Вид материала | Автореферат |
- Структурные и функциональные свойства цитокинин-связывающих белков растений Arabidopsis, 249.12kb.
- Педагогическая пресса в россии во второй половине XIX в.: Генезис, предметно-тематические, 302.96kb.
- Рабочая учебная программа по нормальной физиологии Электив «Структурно-функциональные, 112.81kb.
- Нп «сибирская ассоциация консультантов», 169.41kb.
- Календарно-тематический план практических занятий по биологии для студентов медико-биологического, 71.39kb.
- Названия экзотических растений в английском и русском языках (структурно-словообразовательный, 378.31kb.
- Программа 9 16 ноября 2010 г г. Москва Место проведения конференции: Учреждение Российской, 265.18kb.
- Добриева Зейнаб Израиловна структурно-семантические и функциональные особенности приставочных, 2630.63kb.
- Структурно-семантические и функциональные характеристики английского лингвокультурного, 562.68kb.
- Программа для поступающих в нввкус по специальности «Психология», 284.28kb.
2. Обнаружение PR-белков в листьях томатов при инфекции ВТМ и перекрестной защите
Для выяснения механизмов устойчивости к вирусному заражению изучали PR-белки, которые появляются после заражения в растениях с разными генами устойчивости к ВТМ: геном толерантности Tm-I и генами сверхчувствительности Tm-2 и Tm-22. Хотя гены устойчивости у томатов известны давно, индуцируемые ими защитные реакции практически не изучены. Исследования проводили как на томатах-дифференциаторах, так и на изогенных линиях, различающихся только по генам устойчивости.
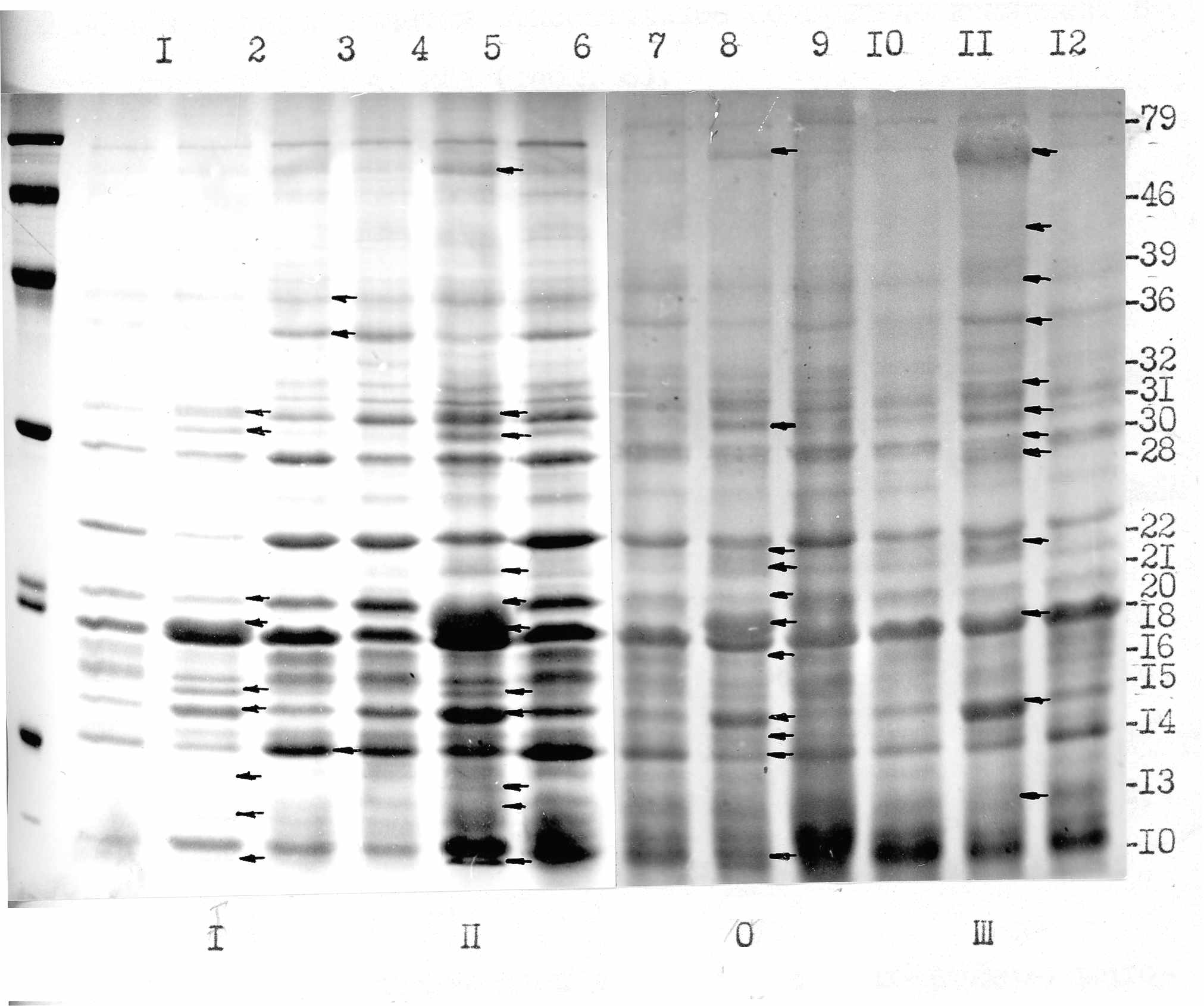
В спектрах кислоторастворимых белков, выделенных из ткани зараженных растений после инфицирования соответствующими штаммами ВТМ, обнаружено 4 типа изменений по сравнению с контролем: (1) накопление отдельных полипептидов, (2) уменьшение относительного содержания некоторых полипептидов, (3) появление новых полипептидов, (4) исчезновение определенных полипептидов. Во всех случаях в зараженных ВТМ растениях в листьях с явными симптомами заболевания появляется вирус-специфический белок – белок оболочки вируса с молекулярной массой 17,4 кДа. На рис. 15 представлены результаты электрофоретического разделения белков листьев растений томатов I группы, содержащих ген толерантности Tm-I, при заражении разными штаммами ВТМ.
 Исследования спектров PR-белков показали, что заражение разными штаммами ВТМ как в томатах-дифференциаторах, так и в изогенных линиях томатов приводит к изменениям белкового состава листьев, причем наибольшие изменения наблюдаются через 2 недели после заражения и лишь в растениях с явными симптомами заболевания. Они могут быть связаны, с одной стороны, с развитием патофизиологического процесса, в пользу чего свидетельствует корреляции между изменениями в белках и тяжестью заболевания, а с другой, следствием развития приобретенной устойчивости.
Исследования спектров PR-белков показали, что заражение разными штаммами ВТМ как в томатах-дифференциаторах, так и в изогенных линиях томатов приводит к изменениям белкового состава листьев, причем наибольшие изменения наблюдаются через 2 недели после заражения и лишь в растениях с явными симптомами заболевания. Они могут быть связаны, с одной стороны, с развитием патофизиологического процесса, в пользу чего свидетельствует корреляции между изменениями в белках и тяжестью заболевания, а с другой, следствием развития приобретенной устойчивости.Рис. 15. Электрофореграммы кислоторастворимых белков листьев томатов при инфекции ВТМ (13%-ный ПААГ, 0,1% ДДС-Na). I, II, 0, III – группы томатов, М – белки-маркеры, 1, 4, 7, 10 – здоровые растения томатов: 2 – I/I, 3 – I/0, 5 – II/2, 6 – II/I, 8 – 0/0, 9 – 0/V-69, II – III/N22, 12 – III/2 (первая цифра – группа томатов, вторая – группа штаммов ВТМ).
Отсутствие каких-либо видимых изменений в спектре кислоторастворимых белков в устойчивых растениях при заражении их непробивающими устойчивость штаммами ВТМ, на наш взгляд, связано с тем, что блокировка инфекции происходит в относительно небольшом числе первично инфицированных клеток. Изменений в спектре белков не было обнаружено не только в случае наличия в генотипе одного из генов устойчивости, но и в линиях, содержащих одновременно оба гена: толерантности (Tm-1) и сверхчувствительности (Tm-22).
Наиболее характерной особенностью развития инфекционного процесса в растениях томатов всех генотипов, зараженных пробивающими данный тип устойчивости штаммами ВТМ и при перекрестной защите, является появление в спектрах кислоторастворимых белков нового полипептида с молекулярной массой 15 кДа и названного Р15. Поскольку белок Р15 был обнаружен в томатах всех исследованных генотипов, его образование, по-видимому, не связано с генами устойчивости. При развитии мозаичного заболевания у томатов всех генотипов, помимо белка Р15, было отмечено увеличение синтеза двух других PR-белков- Р79 и Р31. Как и в случае белка Р15, синтез этих полипептидов, по всей видимости, не связан с генами устойчивости. Вероятно, белок Р79 является щелочной эндопротеиназой, идентифицированной в томатах (Vera, Conejero, 1988), а белок Р31 - хитиназой (Joosten, de Wit, 1989).
Помимо белков, которые появляются в растениях томатов различного генотипа в ответ на инфицирование, нами выявлены и специфические белки, индукция которых связана с генами устойчивости и отражает различия в механизмах устойчивости. Эти белки могут быть использованы в качестве маркеров в генетических исследованиях и селекционном процессе.
Были также исследованы изменения в спектре кислоторастворимых белков при перекрестной защите, заключающейся в том, что заражение растений апатогенным штаммом вируса предохраняет растение от последующей инфекции родственным штаммом того же вируса.
Поскольку одна из гипотез предполагала участие PR-белков в возникновении приобретенной устойчивости, были исследованы спектры кислоторастворимых белков при перекрестной защите. Анализировали кислоторастворимые белки растений 0 группы томатов, которые сначала заражали аттенуированным штаммом ВТМ V-69, а через 3 недели - резким штаммом R, который вызывает у растений зеленую мозаику. В качестве контролей использовали растения, зараженные отдельно штаммом V-69 и R штаммом ВТМ, соответственно, а также здоровые растения того же возраста.
При последовательном заражении томатов двумя штаммами ВТМ-аттенуированным V-69 и резким R - симптомы заболевания не развивались. При этом концентрация ВТМ в обоих случаях была сходной: 2,20 мкг/г в варианте 0/V-69 и 2,50 мкг/г в варианте 0/R. Таким образом, при перекрестной защите подавлено развитие симптомов заболевания. Это коррелирует с изменением содержания ряда белков: увеличивается содержание полипептидов с молекулярными массами 15 кДа (Р15) и 31 кДа (Р31), в то время как относительное содержание других белков с молекулярными массами 14, 14,5, 16,5, 17, 22, 23, 30, 36, 43 кДа уменьшается. Полученные нами данные позволяют предположить, что белки Р15 и Р31 участвуют в механизмах приобретенной устойчивости, а снижение экспрессии ряда белков приводит к подавлению развития симптомов мозаичного заболевания.
Поскольку во всех случаях заражения пробивающими устойчивость штаммами ВТМ в томатах разных генотипов появлялся белок с молекулярной массой 15 кДа, обозначенный Р15, этот белок был выделен и определен его аминокислотный состав. Полученные результаты свидетельствовали о том, что выделенный нами белок Р15 соответствует белку Р14, описанному Камачо и Сэнгером в восприимчивых растениях томатов при вирусной, грибной и вироидной инфекциях (Camacho, Sänger, 1982, 1984).
- Структурно-функциональное исследование хлоропластов томатов с различными генами устойчивости к ВТМ при заражении разными штаммами вируса
Исследование структурно-функциональных характеристик хлоропластов растений томатов, несущих различные гены устойчивости к ВТМ, при вирусной инфекции показало, что в мозаичных растениях существенно подавлена активность фотосистемы II и транскрипционная активность хлоропластов. Подавление транскрипции хлоропластных генов при заражении резкими штаммами ВТМ происходит независимо от генотипа, однако оно выражено слабее в генотипах с генами устойчивости. В случае системного некроза функционирование хлоропластов нарушено в меньшей степени: активность фотосистемы II уменьшается на ~10%, а транскрипционная активность хлоропластов - на 20%. Одновременно с этим в растворимой фракции обнаружен ряд новых белков. При заражении аттенуированным штаммом V-69, хотя симптомы заболевания не развиваются, в хлоропластах происходят определенные структурно-функциональные изменения, однако, они проявляются слабее, чем при заражении резкими штаммами ВТМ.
4. Обнаружение интерфероноподобных белков в листьях томатов
Изучив PR-белки, синтезирующиеся в растениях в ответ на вирусную инфекцию и представляющие собой важнейшие компоненты защитной системы растений, представляло интерес выяснить, существует ли в растениях система защиты, связанная с синтезом интерфероноподобных белков, поскольку этот механизм защиты широко распространен у животных. В связи с этим, был проведен поиск интерфероноподобных белков в растениях томатов с различными генами устойчивости к ВТМ с использованием иммуноблоттинга с антителами к β-интерферону человека.
Полученные результаты свидетельствуют о том, что среди кислоторастворимых белков листьев томатов различного генотипа выявляются три белка в низкомолекулярной области спектра, иммунологически сходных с β-интерфероном человека. Один из них практически совпадает по электрофоретической подвижности с β-интерфероном человека, два других обладают несколько большей молекулярной массой. Заметное увеличение содержания интерфероноподобных белков наблюдалось в томатах с геном сверхчувствительности Tm-22 при инфицировании растений штаммом N22, вызывающим системный некроз. У растений с геном толерантности Tm-1 не происходит индукции интерфероноподобного механизма противовирусной защиты. Результаты настоящей работы свидетельствуют о том, что одним из сходных защитных механизмов растений и животных является индуцированное вирусной инфекцией образование антивирусных интерфероноподобных веществ.
5. Исследование трансгенных растений табака, экспрессирующих двунитевую РНК
Помимо PR-белков – компонентов врожденной иммунной системы растений, нами были исследованы белки растений при индуцированной устойчивости – в трансгенных растениях табака, экспрессирующих двунитевую РНК (днРНК).
В качестве объекта исследования были использованы трансгенные растения табака, стабильно сохраняющие в течение 3-х поколений конструкцию, несущую экспрессируемую последовательность бактериального происхождения (фрагмент гена устойчивости к тетрациклину) в виде протяженного инвертированного повтора. Данная конструкция обеспечивает синтез в трансгенных растениях РНК, имеющую шпилечную, двунитевую структуру (Смирнов и др., 1993).
Была исследована устойчивость трансгенных растений табака поколения Т2, устойчивых к канамицину, к штаммам ВТМ, различающимся по степени патогенности. Было установлено, что хотя здоровые трансгенные и нетрансгенные растения табака не различаются фенотипически, у трансгенных зараженных растений наблюдались задержка в сроках развития симптомов, а также изменения в характере симптомов. Степень развития мозаичных симптомов у трансгенных растений табака была слабее, чем у нетрансгенных растений. Полученные результаты свидетельствовали об увеличении устойчивости к заражению ВТМ у трансгенных растений табака, экспрессирующих двунитевую РНК. При этом реакция на разные штаммы была различной.
Электрофоретический анализ белков листьев здоровых нетрансгенных и трансгенных растений в денатурирующих условиях не выявил различий в электрофоретических спектрах. В трансгенных зараженных растениях было снижено содержание белка оболочки вируса (17,6 кДа) по сравнению с нетрансгенными растениями, что свидетельствовало о меньшем накоплении вируса и коррелировало с повышением устойчивости к ВТМ. Одновременно при заражении трансгенных растений штаммом N22, было обнаружено два новых белка, молекулярные массы которых составили 25 и 30 кДа, обозначенные Р25 и Р30. Структурный анализ белка Р30 выявил гомологию с ксилоглюкан-эндо-1,4-β-D-глюканазой томата и с глюкан-эндо-1,3-β-глюкозидазой сои. Белки, обладавшие гомологией с исследованными полипептидами, относятся к одному функциональному семейству растительных β-эндоглюканаз. Эти ферменты связаны с метаболизмом углеводных компонентов клеточной стенки: гидролизом О-гликозидной связи в различных полисахаридах, что приводит к расщеплению сложных полимеров на фрагменты и образованию различных олигосахаридов.
Полученные данные позволяют предположить, что индуцированный инфекцией в трансгенных растениях белок с молекулярной массой 30 кДа является новым представителем семейства β-эндоглюканаз, в регуляции экспрессии которого участвует днРНК. По всей видимости, активация синтеза этого белка зависит не только от присутствия днРНК, но требует дополнительно некоторого вирусного фактора. Это говорит в пользу участия этого белка в защите или патогенезе.
6. Исследование антимикробных пептидов пшеницы Triticum kiharae Dorof. et Migusch.
Важнейшей группой защитных полипептидов, относящихся к группе PR-белков, являются антимикробные пептиды. Хотя к началу настоящего исследования они были выделены из ряда растений, многие аспекты, касающиеся их молекулярного полиморфизма у отдельных видов растений, специфичности в отношении отдельных групп патогенов, механизма действия, структуры генов и регуляции их экспрессии оставались мало изученными. В связи с этим был проведен систематический анализ катионных АМП зерновок пшеницы вида Triticum kiharae Dorof. et Migusch., которая представляет собой синтетический аллополиплоид, полученный от скрещивания Triticum timopheevii с Aegilops tauschii, обладающий повышенной устойчивостью к патогенам. К началу наших исследований сведения об АМП пшеницы этого вида отсутствовали.
6.1. Выделение и характеристика антимикробных пептидов вида T. kiharae
Была разработана методика выделения АМП из этого вида растения, сочетающая в себе различные виды ВЭЖХ (аффинную, эксклюзионную и обращенно-фазовую) с масс-спектрометрией, секвенированием аминокислотных последовательностей и испытаниями биологической активности. В результате из пшеницы Т. kiharae было выделено 24 новых пептида. На основе гомологии аминокислотных последовательностей и цистеинового мотива, характерного для каждого семейства растительных АМП, все полученные пептиды были отнесены к известным семействам: дефензинов, тионинов, гевеиноподобных пептидов, ноттиноподобных пептидов и липид-переносящих белков. Кроме того, нами впервые было обнаружено новое семейство глицин-богатых пептидов, а также семейство 4-Cys пептидов, гомологов 4Cys-пептида кукурузы MBP-1 (Duvick et al., 1992). Обнаружены также новые структурные типы дефензинов и гевеиноподобных пептидов.
На рис. 16 приведены различные стадии очистки АМП семян пшеницы T. kiharae. .Выделенные пептиды были охарактеризованы по молекулярным массам, аминокислотным последовательностям и биологической активности в отношении важнейших фитопатогенных грибов и бактерий.
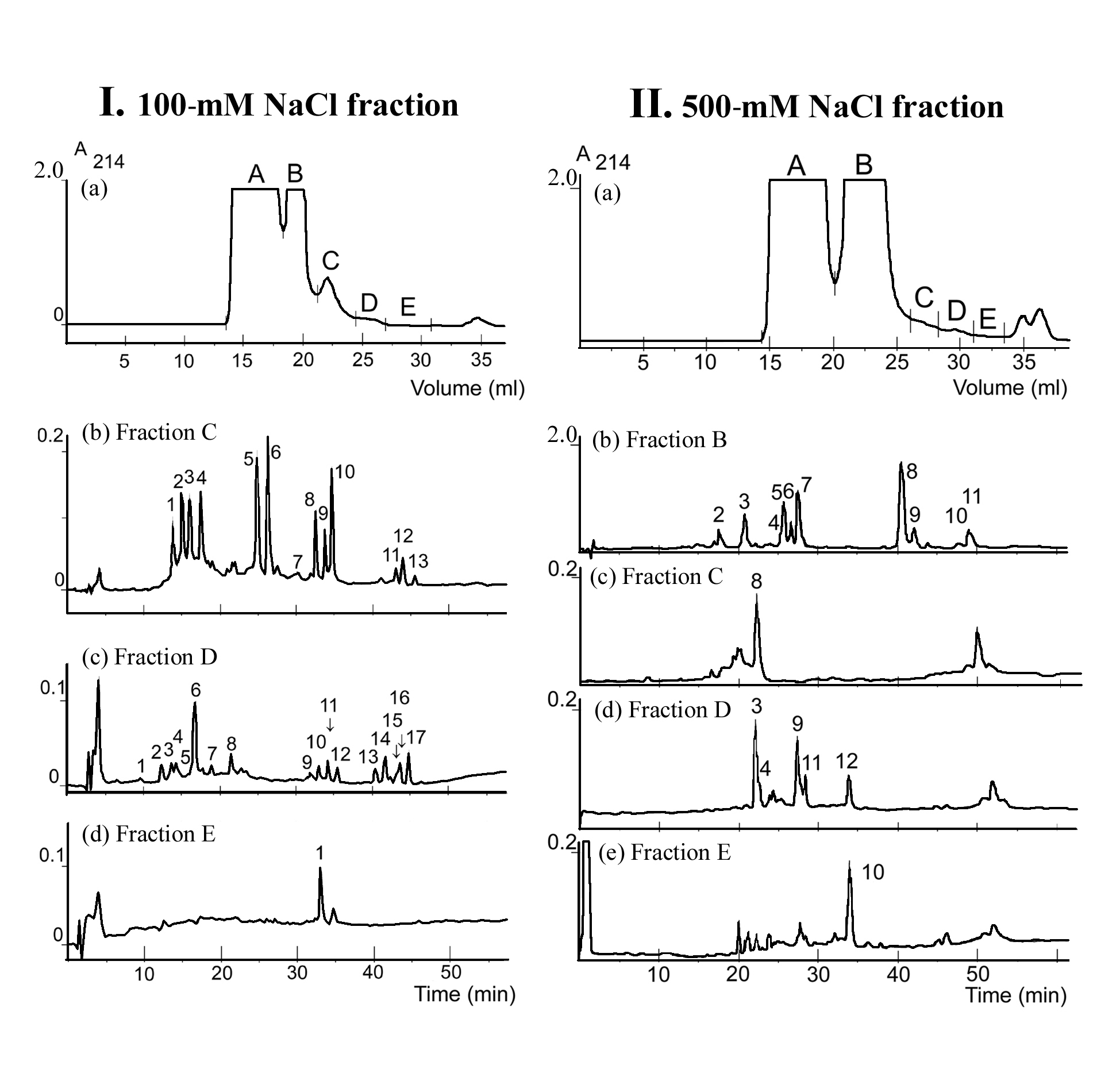
Рис. 16. Выделение АМП из семян Т. kiharae . I. 100-мМ фракция; II. 500-мМ фракция; (а) эксклюзионная ВЭЖХ на колонке Superdex HR 10/30, отмечены границы объединения фракций А-Е. ОФ-ВЭЖХ фракций С (b), D (c) и E (d).
6.2. Глицин-богатые пептиды
Новые глицин-богатые пептиды, выделенные из семян пшеницы, приведены в табл. 6.
Таблица 6.
Глицин-богатые пептиды пшеницы T. kiharae*
| Пептид | N-концевая аминокислотная последовательность | Мол. масса, Да |
| Tk-AMP-G1 | GGGGGGGGYHGGGGGGYPGH20 | 4294 |
| Tk-AMP-G2 | GGGGAGGGYPGHGGGGYPGHGGGGGGGGYPGHGGGGGGGGGGGGGGGGGG50 | 4375 |
| Tk-AMP-G3 | GGYPGGGGGG10 | 4668 |
| Tk-AMP-G4 | GGYPGGGGAG10 | 4750 |
| Tk-AMP-G5 | GGGGGXGY8 | 4844 4917 |
| Tk-AMP-G6 Tk-AMP-G7 | HHGGGDQAHGDR HHGGGGHGHGDR | 4360 4603 |
| Tk-AMP-G8 | XGXGGGGRGGGYPGRG16 | 4285 |
*Повторяющиеся аминокислотные мотивы выделены жирным шрифтом.
Для большинства из них показано отсутствие остатков цистеина в молекуле. Для этих пептидов, помимо высокого содержания глицина, характерно наличие повторяющихся олигопептидных мотивов, наличие которых отражает происхождение кодирующих их генов путем многократных дупликаций предкового гена.
6.3. Дефензины T. kiharae
В семенах T. kiharae нами были частично охарактеризованы 11 дефензинов, которые по гомологии N-концевых последовательностей были подразделены на 3 структурные группы: Tk-AMP-D (группа I), Tk-AMP-γ1, Tk-AMP-γ2, Tk-AMP-γ3 (группа II), Tk-AMP-ω2 и Tk-AMP-ω3 (группа III). Большинство из них (пептиды Tk-AMP-D) являются новыми, ранее не описанными, и представляют собой новый подкласс дефензинов пшеницы - дефензины группы I. Были установлены полные аминокислотные последовательности D дефензинов T. kiharae, а также родственных пшенице видов родов Triticum и Aegilops, которые рассматриваются как доноры геномов полиплоидных пшениц (табл. 7).
Таблица 7.
Аминокислотные последовательности дефензинов T. kiharae и T. monococcum
| Пептид | Аминокислотная последовательностьa |
| Tk-AMP-D1 | RTCQSQSHKFKGACFSDTNCDSVCRTENFPRGQCNQHHVERKCYCERDC |
| Tm-AMP-D1.2 | RTCQSQSHKFKGACFSDTNCASVCRTENFPRGQCNQHHVERKCYCERDC |
| Tk-AMP-D2 | RTCESQSHKFKGPCFSDSNCATVCRTENFPRGQCNQHHVERKCYCERSC |
| Tk-AMP-D1.1 | RDCESDSHKFHGACFSDTNCANVCQTEGFTAGKCVG--VQRHCHCTKDC |
| Tk-AMP-D5 | RECRSESKKFVGLCVSDTNCASVCLTERFPGGKCDG--Y-RRCFCTKDC |
| Tk-AMP-D6 | RDCRSQSKTFVGLCVSDTNCASVCLTEHFPGGKCDG--Y-RRCFCTKDC |
| Tk-AMP-D6.1 | RECRSQSKQFVGLCVSDTNCASVCLTEHFPGGKCDG--Y-RRCFCTKDC |
| Tk-AMP-D3 | RDCKSDSHKFHGACFSDTNCANVCQTEGFTRGKCDG--I--HCHCIKDC |
| Tk-AMP-D4 | RDCTSQSHKFVGLCLSDRNCASVCLTEYFTGGKCD-H---RRCVCTKGC |
| Консенсусная последовательность | R-C-S-Sb-F-GhChSD-NC--VC-TE-F--G-C-------bChC-b-C |
В табл. 7 аминокислотные остатки, различающиеся у всех или некоторых последовательностей, выделены, соответственно, светло- и темносерым цветом. В нижней строке приведена консенсусная последовательность, в которой консервативные остатки цистеина и некоторых других аминокислот выделены жирным шрифтом. “h” и “b” обозначают гидрофобные и основные аминокислоты, соответственно.
Cравнение аминокислотных последовательностей D дефензинов с дефензинами других злаков по программе Clustal W (рис. 17) выявило наибольшую гомологию с TAD1, дефензиноподобным пептидом, экспрессирующимся в пшенице при холодовой адаптации (Koeke et al., 2002).
Растение Дефензин Аминокислотная последовательность
Triticum kiharae Tk-AMP-D1 RTCQSQSHKFKGACFSDTNCDSVCRT-E--NFPRGQCNQHHVERKCYCERDC- 49
Triticum kiharae Tk-AMP-D1.2 RTCQSQSHKFKGACFSDTNCASVCRT-E--NFPRGQCNQHHVERKCYCERDC- 49
Triticum kiharae Tk-AMP-D2 RTCESQSHKFKGPCFSDSNCATVCRT-E--NFPRGQCNQHHVERKCYCERSC- 49
Triticum aestivum† TAD1 RTCLSQSHKFKGTCLSNSNCAAVCRT-E--NFPDGECNTHLVERKCYCKRTC- 49
Triticum kiharae Tk-AMP-D3 RDCKSDSHKFHGACFSDTNCANVCQT-E--GFTRGKCDG--I--HCHCIKDC- 45
Triticum kiharae Tk-AMP-D1.1 RDCESDSHKFHGACFSDTNCANVCQT-E--GFTAGKCVGVQ--RHCHCTKDC- 47
Triticum kiharae Tk-AMP-D6 RDCRSQSKTFVGLCVSDTNCASVCLT-E--HFPGGKCDG--Y-RRCFCTKDC- 46
Triticum kiharae Tk-AMP-D6.1 RECRSQSKQFVGLCVSDTNCASVCLT-E--HFPGGKCDG--Y-RRCFCTKDC- 46
Triticum kiharae Tk-AMP-D5 RECRSESKKFVGLCVSDTNCASVCLT-E--RFPGGKCDG--Y-RRCFCTKDC- 46
Triticum kiharae Tk-AMP-D4 RDCTSQSHKFVGLCLSDRNCASVCLT-E--YFTGGKCD-H---RRCVCTKGC- 45
Zea mays γ1-Z RVCRRRSAGFKGVCMSDHNCAQVCLQ-E--GYGGGNCDG-IM-RQCKCIRQC- 47
Sorghum bicolor SI-1 RVCMGKSQHHSFPCISDRLCSNECVKEE-GGWTAGYCHLR-Y---CRCQKAC- 47
Sorghum bicolor SI-3 RVCRRRSAGFKGLCMSDHNCAQVCLQ-E--GWGGGNCDG-VI-RQCKCIRQC- 47
Sorghum bicolor SI-2 RVCMGKSAGFKGLCMRDQNCAQVCLQ-E—-GWGGGNCDG-VM-RQCKCIRQCW 48
Hordeum vulgare γ1-H RICRRRSAGFKGPCVSNKNCAQVCMQ-E--GWGGGNCDGP-L-RRCKCMRRC- 47
Triticum turgidum γ1-P KICRRRSAGFKGPCMSNKNCAQVCQQ-E--GWGGGNCDGP-F-RRCKCIRQC- 47
Triticum turgidum γ2-P KVCRQRSAGFKGPCVSDKNCAQVCLQ-E--GWGGGNCDGP-F-RRCKCIRQC- 47
Zea mays γ2-Z RVCMGKSQHHSFPCISDRLCSNECVK-EDGGWTAGYCHLR-Y---CRCQKAC- 47
Raphanus sativum Rs-AFP2 QKLCQRPSGTWSGVCGNNNACKNQCIRLEK--ARHGSCNYVFPAHKCICYFPC- 51
