Выделение и идентификация нетуберкулезных микобактерий у пациентов фтизиатрических учреждений 03. 00. 07 Микробиология
| Вид материала | Автореферат |
- Бактериологическая диагностика туберкулеза внелегочных локализаций с исследованием, 271.98kb.
- Идентификация и внутривидовое типирование возбудителей сапа и мелиоидоза 03. 00., 750.11kb.
- Омелотерапия в онкологии с точки зрения доказательной медицины, 135.77kb.
- Цивилизации древнего востока, 288.82kb.
- Примерная программа дисциплины микробиология, вирусология, микробиология полости рта, 447.35kb.
- «Микробиология», 161.59kb.
- Контрольная работа по дисциплине Микробиология По теме Общая и специальная микробиология, 208.97kb.
- Резолюция второго всероссийского конгресса пациентов город Самара 03 ноября 2011, 206.55kb.
- Вопросы к экзамену по дисциплине «Микробиология, физиология питания, санитария», 45.83kb.
- Рабочей программы учебной дисциплины (модуля) микробиология, 48.16kb.
Рис. 4. Дендрограмма последовательности гена gyrB для некоторых видов
микобактерий, построенная на основании программы Vector NTI 10
(Invitrogen, США) и алгоритма Clustal W
На рисунке 5 представлена картина гибридизации видоспецифических олигонуклеотидных зондов, иммобилизированных на биологическом микрочипе «IMS», с меченными флуоресцентной меткой комплементарными последовательностями ДНК ампликонов, полученных после проведения двухстадийной ПЦР, где в качестве матрицы использовали ДНК, выделенную из исследуемых культур микобактерий. Оценку результатов осуществляли с помощью программного обеспечения.
При использовании предпоследнего варианта экспериментальной версии биочипов «IMS» изучено 187 культур микобактерий, выделенных из клинических образцов в жидкой и на плотной питательных средах. Получен высокий процент совпадений полученных результатов (92,6%) с данными микробиологических исследований (табл. 10.).
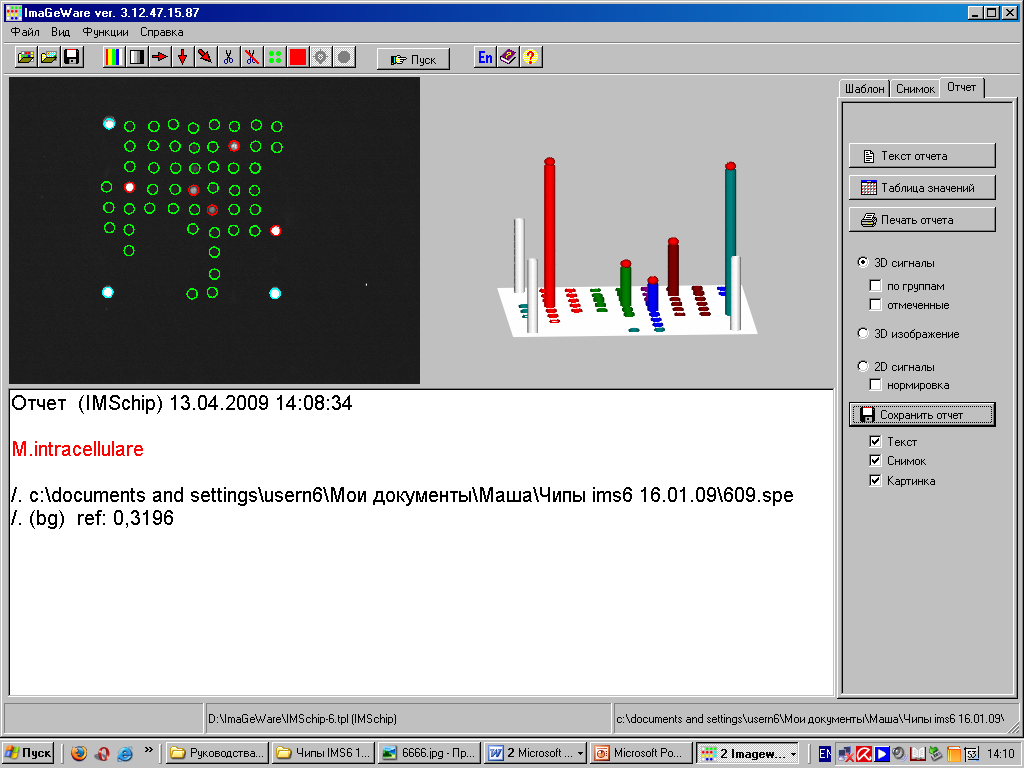

Рис. 5. Анализ гибридизационной картины биочипа «IMS» с помощью программного
обеспечения (гибридизационная картина, характерная для M. intracellulare)
Таблица 10.
Видовая идентификация микобактерий с помощью
экспериментальной версии биологических микрочипов «IMS»
и микробиологическими методами
| № п/п | Вид микобактерий | Микробиологическая идентификация | Биочип | Число совпадений результатов (%) | |
| 1. | M. tuberculosis | M. tuberculosis | 24 | 23 | 96,0 |
| M. bovis | 1 | 1 | |||
| 2. | MAC | М. avium | 64 | 58 | 95,3 |
| M. intracellulare | 3 | ||||
| 3. | M. kansasii | 20 | 18 | 90,0 | |
| 4. | M. fortuitum | 18 | 16 | 88,9 | |
| 6. | M. gordonae | 16 | 14 | 87,5 | |
| 7. | M. scrofulaceum | 3 | 2 | 66,7 | |
| 8. | M. chelonae | 1 | 1 | 100,0 | |
| 9. | M. marinum | 1 | 1 | 100,0 | |
| ИТОГО | 148 | 137 | 92,6 | ||
В таблице не представлены результаты идентификации 39 культур НТМ, принадлежащих к видам и подвидам для определения которых данная версия биочипов «IMS» не предназначена. Отрицательный результат их идентификации подтвердил специфичность методики (статистически достоверные различия результатов, полученных при использовании двух методов, отсутствовали). Но это было существенным недостатком данной версии биологических микрочипов, так как одним из видов, который невозможно было идентифицировать, оказались часто выделяемые из биологического материала больных с подозрением на микобактериальную инфекцию M. xenopi. В связи с этим на гелевую микроматрицу биочипа внесли олигонуклеотидные зонды, специфичные в отношении данного вида микобактерий. Для проверки их специфичности для детекции M. xenopi, из собранной коллекции были выбраны ДНК культур, идентифицированных микробиологическими методами и ВЭЖХ как M. xenopi, а методом ПДРФ гена hsp65 как M. xenopi/M. gordonae и показавшие отрицательный результат гибридизации на этой версии биочипов. После проведения идентификации 32 культур на новой версии биочипов, специфичных в отношении M. xenopi, было получено совпадение результатов в 100% случаев (в сравнительных исследованиях – их данные приведены в разделе 3.3. представлены результаты использования последней версии биочипа с помощью которого возможно идентифицировать и M. xenopi).
3.2. Видовая идентификация микобактерий с помощью ПДРФ
Изучена также эффективность использования для идентификации НТМ метода оценки полиморфизма длин рестрикционных фрагментов (ПДРФ) в модификации, ранее разработанной в МНПЦБТ (Краснова М.А., Макарова М.В. и др., 2006). Это необходимо для последующего сравнения результатов, полученных с помощью биологических микрочипов и ПДРФ (исследование проведено на значительно большем материале, чем это было сделано ранее).
Данная тест-система основана на ПДРФ гена hsp65 и предназначена для идентификации следующих видов микобактерий: M. avium, M. intracellulare, M. scrofulaceum, M. kansasii, M. fortuitum/M. chelonae, M. xenopi/M. gordonae, M. marinum, и их дифференциации от M. tuberculosis complex.
С использованием метода оценки ПДРФ исследованы 342 культуры микобактерий, выделенных на плотной (Л-Й) и в модифицированной жидкой (7H9) питательных средах.
Таблица 11.
Видовая идентификация микобактерий с помощью
определения ПДРФ в сравнении с микробиологическими методами
| № | Вид микобактерий | Микробиологическая идентификация | ПДРФ гена hsp65 | Число совпадений результатов (%) | |
| 1. | M. tuberculosis | 41 | 39 | 95,1 | |
| 2. | МАС | M. avium | 106 | 91 | 97,2 |
| M. intracellulare | 12 | ||||
| 3. | M. kansasii | 57 | 57 | 100,0 | |
| 4. | M. xenopi/ M. gordonae | M. xenopi | 42 | 48 | 92,3 |
| M. gordonae | 10 | ||||
| 5. | M. marinum | 5 | 3 | 60,0 | |
| 6. | M. scrofulaceum | 2 | 2 | 100,0 | |
| 7. | M. fortuitum/ M. chelonae | M. fortuitum | 69 | 74 | 93,7 |
| M. chelonae | 10 | ||||
| ВСЕГО | 342 | 326 | 95,3 | ||
Полученные данные свидетельствовали о том, что распределение по частоте выявления видов НТМ при использовании микробиологических методов и ПДРФ, в основном совпадало (в 95,3% случаев в целом) (табл. 11.), статистически достоверные различия результатов, полученных при использовании двух методов, отсутствовали.
3.3. Сравнение результатов использования биочипов и других методов идентификации НТМ
Представляло интерес оценить эффективность разработанного последнего варианта биологических микрочипов (возможность идентификации M. xenopi) для идентификации микобактерий в сравнении с данными, полученными с помощью ПДРФ и ВЭЖХ. Количество положительных результатов оценивали по отношению к данным идентификации НТМ микробиологическими методами (табл. 12).
Таблица 12.
Сопоставление результатов идентификации НТМ, полученных с помощью биологических микрочипов, ПДРФ и ВЭЖХ, с данными
микробиологических исследований (%)
| Группа НТМ | Вид | Методы и процент совпадений | |||||
| Биочип | ПДРФ | ВЭЖХ | |||||
| абс. | % | абс. | % | абс. | % | ||
| Медленнорастущие | МАС (56) | 53 | 94,6 | 52 | 92,9 | 52 | 92,9 |
| M. kansasii (34) | 31 | 91,2 | 33 | 97,1 | 32 | 94,1 | |
| M. xenopi (22) | 21 | 95,5 | 31 | 93,9 | 21 | 95,5 | |
| M. gordonae (11) | 10 | 90,9 | 10 | 90,9 | |||
| M. marinum (3) | 3 | | 2 | | 3 | | |
| M. scrofulaceum (3) | 2 | | 3 | | 3 | | |
| Всего (129) | 120 | 93,0 | 121 | 94,0 | 121 | 94,0 | |
| Быстрорастущие | M. fortuitum (42) | 40 | 95,2 | 45 | 93,8 | 39 | 92,8 |
| M. chelonae (6) | 5 | | 5 | | |||
| Всего (48) | 45 | 93,8 | 45 | 93,8 | 44 | 91,7 | |
| Всего НТМ (177) | 165 | 93,2 | 166 | 93,8 | 165 | 93,2 | |
Полученные тремя вышеуказанными методами данные при идентификации как медленнорастущих (биочип – 93,0% совпадений с результатами микрокробиологических исследований, ПДРФ – 94,0%, ВЭЖХ – 94,0%), так и быстрорастущих (93,8%, 93,8%, 91,7% – соответственно) НТМ вполне сопоставимы (статистически достоверные различия отсутствовали).
Основными причинами частичного несовпадения результатов идентификации НТМ методом ВЭЖХ, молекулярно-генетическими и микробиологическим методами, являлись с одной стороны – вариабельность бактериологических и биохимических свойств разных штаммов внутри одного вида микобактерий, а с другой – схожесть этих свойств у некоторых представителей разных видов, большое сродство геномов разных видов микобактерий, а также «относительный» субъективизмом в интерпретации результатов проводимых микробиологических тестов и полученных хроматографических профилей.
Таким образом, молекулярно-генетические методы (биочип «IMS», ПДРФ) и ВЭЖХ показали высокую информативность при идентификации нетуберкулезных микобактерий – имел место высокий процент совпадения их результатов с данными микробиологических методов. При этом необходимо подчеркнуть, что наиболее перспективным для идентификации НТМ в практических микробиологических лабораториях может быть использование биологических микрочипов, поскольку этот метод прост в исполнении, стандартизирован и автоматизирован. Перспективным, на наш взгляд, является продолжение исследований с целью увеличения спектра видов НТМ, идентифицируемых этим методом.
4. Виды НТМ в городе Москве и характеристика их лекарственной чувствительности
Данные литературы свидетельствуют о том, что в разных регионах земного шара имеются различия как в частоте обнаружения разных видов НТМ, так и в их чувствительности к противотуберкулезным (ПТП) и другим антибактериальным препаратам [Оттен Т.Ф., Васильев А.В., 2005; Литвинов В.И. и др.,2008; Adle-Biassette H., et al, 2003; Heifets L., 2004; Kathoch V., 2004] .
В связи с вышеизложенным проанализирована частота обнаружения НТМ в городе Москве с помощью разработанного оптимизированного комплекса исследований и определен спектр их чувствительности к антибактериальным препаратам.
Учитывая, что материал для исследования поступал из большинства противотуберкулезных диспансеров города Москвы, под наблюдением которых состоят больные туберкулезом и лица из групп риска заболевания туберкулезом из двух третей населения города, можно считать, что полученные результаты дают достоверное представление о видовом составе НТМ в городе Москве.
4.1. Характеристика видов НТМ в городе Москве
Установлено (рис. 6), что чаще всего среди НТМ обнаружены MAC (203 культуры – 33,3%), M. fortuitum (169 культур – 27,8 %), M. xenopi (83 культуры – 13,6%), M. kansasii (78 культур – 12,8%), реже М. gordonaе (25 культур – 4,1%), M. chelonae (18 культур – 3,0%), M. flavescens (15 культур – 2,5%), ещё реже M. marinum (6 культур – 1,0%), M. scrofulaceum (5 культур – 0,8%), M. simiae (2 культуры – 0,3%) и по одной культуре M. gastri, M. szulgai, M. terrae, M. malmoense, M. smegmatis.

Рис. 6. Виды нетуберкулезных микобактерий, выделенных от больных туберкулезом и лиц с подозрением на туберкулез
Полученные данные отличаются от таковых, в других регионах мира, в частности, из медленнорастущих НТМ M. xenopi в ряде стран находятся на втором месте по частоте обнаружения (после МАС). В Москве M. kansasii и M. xenopi встречаются практически с одинаковой частотой; среди быстрорастущих НТМ в некоторых регионах мира наиболее часто обнаруживаются M. chelonae, в Москве – M. fortuitum [Katoch V., Kumar M., 2001; Murras T., Daley C., 2002].
4.2. Чувствительность НТМ к антибактериальным препаратам
Проведено изучение чувствительности выделенных в городе Москве нетуберкулезных микобактерий к противотуберкулезным и ряду других антибактериальных препаратов: стрептомицину, изониазиду, рифампицину, этамбутолу, канамицину, этионамиду, циклосерину, ПАСК, капреомицину, офлоксацину, левофлоксацину, ципрофлоксацину, моксифлоксацину. При ее оценке учитывали также частоту множественной лекарственной устойчивости (по критериям ВОЗ – к изониазиду и рифампицину), устойчивости ко всем препаратам основного ряда, XDR (по критериям ВОЗ – к рифампицину + изониазиду + к одному из фторхинолонов + капреомицину/канамицину), устойчивости к одному фторхинолону или любому химиопрепарату.
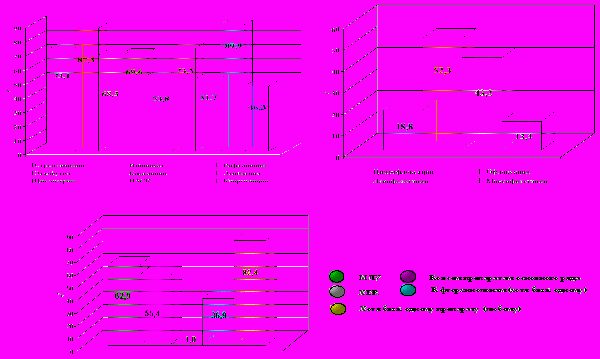
Рис. 7. Частота устойчивости нетуберкулезных микобактерий к антибактериальным препаратам
Установлено (рис. 7), что выделенные культуры MAC в большинстве случаев устойчивы к стрептомицину, изониазиду, рифампицину, этамбутолу, этионамиду, ПАСК, капреомицину, офлоксацину, левофлоксацину, в половине случаев – к канамицину, циклосерину и, как правило, чувствительны к ципрофлоксацину, моксифлоксацину. Устойчивость МАС ко всем противотуберкулезным препаратам основного ряда выявили в 66,7% случаев, к одному фторхинолону– в 54,3% случаев, а хотя бы к одному антибактериальному препарату – в 86,4% случаев. Множественной лекарственной устойчивостью обладали 79,2% выделенных изолятов МАС, XDR среди них обнаружено не было.
M. kansasii в большинстве случаев проявляли резистентность к изониазиду и ПАСК, а в половине случаев оказались чувствительны к основным и резервным противотуберкулезным препаратам. Устойчивость M. kansasii ко всем препаратам основного ряда определили в 21,6% случаев, МЛУ – в 32,4%, XDR – не было, устойчивость к одному фторхинолону выявлена в 16,2% случаев, а к одному антибактериальному препарату – в 73, 0% случаев.
У M. xenopi в 2/3 случаев обнаружена устойчивость к рифампицину, этамбутолу и ПАСК, в половине – к изониазиду, офлоксацину, этамбутолу, в 1/3 случаев – к стрептомицину, этионамиду. К остальным антибактериальным препаратам этот вид НТМ был чаще чувствителен. МЛУ у M. xenopi выявили в 33,3 % случаев, устойчивость ко всем противотуберкулезным препаратам основного ряда в 27,8% случаев, XDR у М. xenopi не обнаружена. К одному фторхинолону этот вид НТМ был устойчив в 29,4% случаев, а к одному антибактериальному препарату – в 52,9% случаев.
M. fortuitum в 100% случаев проявляли устойчивость к стрептомицину и изониазду, почти в 100% – к рифампицину, этамбутолу, этионамиду, канамицину, циклосерину, ПАСК и капреомицину, в половине случаев – к офлоксацину, левофлоксацину, и в 1/3 случаев к ципрофлоксацину и моксифлоксацину. МЛУ определяли в 94,6% случаев, устойчивость ко всем противотуберкулезным препаратам основного ряда – в 92,7%, XDR – в 3,8% случаев, устойчивость к одному фторхинолону обнаружена в 37,8% и к одному антибактериальному препарату – в 96,4% случаев.
О чувствительности к антибактериальным препаратам других выделенных видов НТМ, делать выводы пока сложно из-за малого числа наблюдений.
Всего к стрептомицину оказались резистентными 63,9% медленнорастущих и 94,1% быстрорастущих НТМ, что в целом составило 73,1%, изониазиду 82,7%, 98,5% и 87,5%, соответственно; рифампицину – 59,6%, 88,2% и 68,3%, соответственно; этамбутолу – 62,2%, 86,8% и 69,6%, соответственно; канамицину – 39,5%, 81,8% и 53,6%, соответственно; этионамиду – 61,0%, 97,7% и 73,5%, соответственно; циклосерину – 33,3%, 87,7% и 57,7%, соответственно; ПАСК – 88,6%, 92,5% и 89,9, соответственно; капреомицину – 31,0%, 83,3% и 46,3%, соответственно.
Что касается фторхинолонов, то к офлоксацину были устойчивы 51,7% медленнорастущих и 53,4% быстрорастущих НТМ (в целом 52,3%), к лево-флоксацину – 40,3 %, 48,8% и 43,2%, соответственно; к ципрофлоксацину – 16,7%, 25,0% и 18,8%, соответственно; к моксифлоксацину – 8,5%, 26,1% и 13,4%, соответственно.
Множественная лекарственная устойчивость обнаружена в 52,6% случаев у медленнорастущих НТМ и в 86,8% случаев у быстрорастущих (62,9% в целом), устойчивость ко всем ПТП первого ряда в 42,9%, 83,6% и 55,4% соответственно. XDR у медленнорастущих НТМ отсутствовала, а у быстрорастущих выявлена в 3,1% случаев. Устойчивость к одному фторхинолону имела место в 36,0% 38,6% и 36,9% соответственно, а к одному антибактериальному препарату – в 75,0%, 96,7% и 82,4%, соответственно.
Представленные данные свидетельствуют о том, что в городе Москве имеются определенные особенности чувствительности НТМ к основным и резервным ПТП и другим антибактериальным препаратам. При этом можно выделить два «положительных» момента – преимущественное сохранение чувствительности к таким фторхинолонам как ципрофлоксацин и моксифлоксацин у ряда НТМ и трем резервным ПТП (канамицину,капреомицину и циклосерину).
Суммируя результаты проведенных исследований, следует обратить внимание на то, что впервые было проведено сравнительное изучение наиболее эффективных современных методов выделения и идентификации НТМ (микро-биологических, молекулярно-генетических, ВЭЖХ), в результате чего предложен их оптимальный комплекс. Также охарактеризованы особенности распространения разных видов НТМ в городе Москве (включая данные об их лекарственной чувствительности), что чрезвычайно важно для практического здравоохранения.
